Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.2 Bogotá July/Dec. 2012
Selección de hongos entomopatógenos para controlar salivazos (Hemiptera: Cercopidae) de la caña de azúcar en Colombia
Selection of entomopathogenic fungi to control spittlebugs (Hemiptera: Cercopidae) of sugar cane in Colombia
ANAMARÍA GARCÍA D.1, ALEX ENRIQUE BUSTILLO P.2, ULISES CASTRO V.3 y YOLIMA ARENAS B.4
1 Microbióloga, Centro de Investigación de la Caña de Azúcar de Colombia, Cenicaña - Pontificia Universidad Javeriana, Joven Investigadora, agarciad@javeriana.edu.co
2 Ph. D. Centro de Investigación de la Caña de Azúcar de Colombia, Cenicaña, Florida, Valle del Cauca, Colombia. Entomólogo I, alexe.bustillo@gmail.com, autor para correspondencia.
3 M. Sc. Centro de Investigación de la Caña de Azúcar de Colombia, Cenicaña, Florida, Valle del Cauca, Colombia. Entomólogo II, ucastro@cenicana.org
4 Bióloga, Centro de Investigación de la Caña de Azúcar de Colombia, Cenicaña - Universidad del Valle, Joven Investigadora, yarenas0527@hotmail.com
Recibido: 5-abr-2011 - Aceptado: 25-oct-2012
Resumen: Los salivazos (Hemiptera: Cercopidae) amenazan con convertirse en plagas de la caña de azúcar en Colombia. Desde el 2007, se detectó Aeneolamia varia en la zona central del Valle del Cauca, lo cual motivó a los productores de caña de azúcar a tomar medidas de emergencia para controlar estas infestaciones. Otra especie Zulia carbonaria también se registra atacando caña de azúcar y se usó en este estudio debido a restricciones cuarentenarias impuestas a A. varia. Se usaron larvas de Galleria mellonella como trampa en el suelo, para obtener los hongos entomopatógenos. Los aislamientos se reactivaron sobre Z. carbonaria y se caracterizaron en relación con su tasa de crecimiento, esporulación, germinación y patogenicidad. Se obtuvieron 26 hongos entomopatógenos (15 aislamientos de Metarhizium anisopliae y 11 de Paecilomyces lilacinus). Solo ocho aislamientos de M. anisopliae y seis de P. lilacinus resultaron patogénicos al salivazo. Las cepas de M. anisopliae CCMa0907 y de P. lilacinus: CCPL0801, CCPL0904, CCPL0802 y CCPL0805, presentaron características ideales de esporulación, tasa de crecimiento y porcentaje de germinación. Finalmente, se desarrolló el protocolo para realizar bioensayos en invernadero, para evaluar el potencial patogénico de hongos para el control de salivazos de la caña de azúcar.
Palabras clave: Zulia carbonaria. Aeneolamia varia. Metarhizium anisopliae. Paecilomyces lilacinus.
Abstract: Spittlebugs (Hemiptera: Cercopidae) can become into a menace to the sugar cane pest in Colombia. Aeneolamia varia was detected in 2007 in the central area of Cauca Valley, which made sugar cane producers to take emergency measures to control this pest. Another species Zulia carbonaria is also present infesting sugar cane, but due to A. varia quarantine restrictions, Z. carbonaria was used in this research. Galleria mellonella larvae were used as a bait to obtain entomopathogenic fungi from soil samples. Fungi isolates were reactivated using adults of Z. carbonaria and characterized by measuring the speed of development, sporulation, viability and pathogenicity. Twenty-six entomopathogenic fungi were obtained 15 strains of Metarhizium anisopliae and 11 strains of Paecilomyces lilacinus, but only eight strains of M. anisopliae and six of P. lilacinus, were pathogenic to adults of Z. carbonaria. The isolates of M. anisopliae: CCMa0907 and P. lilacinus: CCPL0801, CCPL0904, CCPL0802, CCPL0805, had the best characteristics of growth, viability and sporulation. Finally, a protocol to conduct a bioassay was developed, under greenhouse conditions, to test strains of pathogenic fungi to control sugarcane spittlebugs.
Key words: Zulia carbonaria. Aeneolamia varia. Metarhizium anisopliae. Paecilomyces lilacinus.
Introducción
Los insectos conocidos como salivazos (Hemiptera: Cercopidae), son una plaga muy seria de la caña de azúcar en muchos países. A nivel mundial se han registrado cerca de 31 especies y en el continente americano existen 24 especies de importancia económica en la caña de azúcar (Fewkes 1969). En 2002, en el municipio de Guática (Risaralda, Colombia), se encontró Mahanarva bipars (Walker, 1858) sobre caña de azúcar sembrada para la producción de panela, que causó daño en los lotes afectados (Gómez et al. 2007). En 2007, se detectó Aeneolamia varia (Fabricius, 1787) en el Valle del Cauca, Colombia (Gómez 2007), una especie presente en Venezuela en donde causa daños de importancia económica a la industria azucarera. Sin embargo, existen registros de la presencia de A. varia de hace más de 40 años, como plaga en pastos en los Llanos Orientales de Colombia (ICA 1973). La especie A. varia se encuentra entre Buga y Tuluá (Valle del Cauca, Colombia) y abarca unas 20.000 ha de caña de azúcar por lo cual fue declarada zona en cuarentena por la amenaza económica para el resto del área plantada (Gómez 2007).
Especies de salivazos son frecuentes en varios países y causan cuantiosas pérdidas económicas en caña de azúcar. En Ecuador Mahanarva andigena (Jacobi, 1908), ocasiona pérdidas hasta del 34% en sacarosa (Mendoza 2001) y en Brasil, pueden llegar hasta el 60% debidas a Mahanarva fimbriolata (Stål, 1854) y Mahanarva posticata (Stål, 1855) (Mendonça 2001). Otras especies registradas como plagas potenciales en caña de azúcar para el Valle del Cauca son Zulia carbonaria (Lallemand), Aeneolamia lepidior (Fowler, 1897) y Prosapia simulans (Walker, 1858) y como exóticas, M. andigena, M. bipars y Aeneolamia reducta (Lallemand, 1924)(Peck et al. 2004; Castro et al. 2009).
El adulto del salivazo es una plaga que succiona la savia del xilema y excreta una sustancia tóxica que causa una quemazón en el follaje de la planta, reduciendo así su actividad fotosintética. El estado de la ninfa se adhiere a las raíces superficiales y se alimenta de la savia, cubriéndose con una espuma que excreta por su ano y dentro de la cual completa su desarrollo, por lo cual ocasiona una reducción en la producción de biomasa (Castillo 2006).
Entre los enemigos naturales estudiados en otros países para el control de salivazos que atacan la caña de azúcar, se destaca el hongo Metarhizium anisopliae (Metsch.) Sorokin (Alves 1986). Es así como en México, Guatemala, Costa Rica, Panamá, Venezuela, Ecuador y Brasil se han seleccionado cepas y preparado formulaciones de M. anisopliae para llevar a cabo programas de aspersiones rutinarias para el control de especies como: Aeneolamia albofasciata Lallemand, 1939, A. jugata (Fowler) (Carvalho y Webb 2005), Aeneolamia postica (Walker) (Carvalho y Webb 2005), A. varia, M. posticata, M. andigena y M. fimbriolata (Cenicaña 1999; Mendonça 2001; Mendoza 2001; Torres de la Cruz et al. 2006; Alves y Lopes 2008).
En Colombia, el CIAT (Centro Internacional de Agricultura Tropical) ha hecho evaluaciones en pasturas para el control de A. varia, A. reducta, Z. carbonaria y Z. pubescens (F.), usando cepas de M. anisopliae con resultados de eficacia variables de acuerdo a la especie estudiada (Morales et al. 2001). En relación con la caña de azúcar en Colombia, se desconoce la eficacia del control de estos hongos. Es por esta razón que este estudio tuvo como objetivo establecer un bioensayo para evaluar y seleccionar aislamientos de hongos entomopatógenos, para el control de salivazos de importancia económica como A. varia y M. bipars y otros potenciales como P. simulans y Z. carbonaria, que pueden afectar la caña en zonas azucareras y paneleras de Colombia.
Materiales y Métodos
El presente estudio se realizó en el laboratorio de Entomología de la Estación Experimental del Centro de Investigación de la Caña de Azúcar de Colombia, ubicado en el corregimiento de San Antonio de los Caballeros del municipio de Florida, Valle del Cauca, Colombia. Se utilizó la especie Z. carbonaria como modelo, debido a las imposiciones cuarentenarias para criar la especie A. varia en las instalaciones de Cenicaña.
Colección y aislamiento de hongos entomopatógenos. Los hongos entomopatógenos se obtuvieron mediante muestras de suelo colectadas en los municipios de Guática (Risaralda), Oiba, (Santander), Anapoima (Cundinamarca), Riofrío, Buga, Tuluá (Valle del Cauca) y sobre adultos de A. varia y Z. carbonaria, provenientes del campo con signos de la infección. Se visitaron dos fincas por localidad y se georeferenciaron. Los lotes del predio de interés se muestrearon aleatoriamente, obteniendo, con ayuda de una pala, 20 muestras de 1 kg cada una por finca. La pala se desinfectó al cabo de cada muestra con alcohol al 95%, para evitar contaminación cruzada de las muestras. En total se obtuvieron 40 muestras por localidad.
Aislamiento. El suelo de cada muestra se procesó por duplicado y cada submuestra de 300 g se depositó en una tarrina plástica transparente y se homogenizó con ayuda de un tamiz N° 10, que tiene una apertura de 2,0 mm. Luego se humedeció hasta alcanzar la capacidad de campo y se depositaron en la superficie cinco larvas de Galleria mellonella (L.) de IV estadio. El recipiente se tapó y se giró 180° diariamente para que las larvas se desplazaran a la superficie a través del suelo y entraran en contacto con las esporas de los hongos que pudieran estar presentes (Chandler et al. 1997). A los ocho días se revisaron las tarrinas y se retiraron las larvas muertas y vivas y, posteriormente, se desinfestaron con hipoclorito de sodio al 1%, durante 3 min. El exceso de hipoclorito se eliminó con un lavado triple en agua destilada estéril y para evitar el exceso de humedad se colocaron las larvas sobre papel toalla estéril. Luego, cada larva fue depositada en cámara húmeda (90% HR) a 26 °C, durante ocho días. Finalmente, cuando se observó algún crecimiento de hongos sobre el cuerpo del insecto, éste se aisló sembrándolo en un medio de PDA modificado (39 g/l de PDA, 4,5 g/l de extracto de levadura, 4,5 g/l de peptona y ácido láctico al 25% adicionando el 1% del volumen a preparar). El aislamiento se incubó durante ocho días a 26 °C, para permitir su desarrollo e identificar el microorganismo obtenido (Chandler et al. 1997).
Los salivazos infectados colectados en el campo, se colocaron en un vial estéril con papel filtro, y se llevaron al laboratorio. Los insectos se desinfestaron superficialmente en la misma forma descrita con anterioridad para G. mellonella,para aislar el patógeno.Conservación e identificación de los hongos entomopatógenos. Una vez se obtuvo crecimiento de los hongos en los medios de cultivo, se hizo un raspado de conidias para preparar una suspensión en 5 ml de solución de NaCl (0,85%). Con esta suspensión se inoculó una caja Petri con medio PDA modificado, cubierta con trozos de papel filtro de 1 x 1 cm y se incubó a 26 °C durante ocho días (Fig.1). Luego, se retiraron los cuadrantes y se dejaron secar en una caja Petri estéril a la misma temperatura de incubación durante un mes para, finalmente, almacenarlos en un sobre de papel glicina a -41 °C (CIAT 2001).
Para caracterizar e identificar los hongos, se tomaron muestras preservadas en papel filtro y se depositaron en una caja Petri con 20 ml de medio de cultivo PDA modificado. El hongo se incubó durante siete días a 26 °C y se registraron las características de crecimiento, aspecto de la colonia, pigmentación y morfología de las conidias (Vélez et al. 1999, 2001; Bustillo y Marín 2002).Desinfestación de los adultos. Previo a la aplicación de la suspensión de las conidias sobre los adultos de Z. carbonaria, se realizó un ensayo para determinar la mejor concentración y tiempo de exposición con hipoclorito de sodio (NaOCl) para desinfestar los adultos sin causarles mortalidad (Marín y Bustillo 2002). Se usaron las concentraciones: 0, 0,5 y 1,0% de NaOCl durante tres tiempos de exposición: 3, 5 y 10 min. El experimento se organizó bajo un diseño factorial 3 x 3 con cuatro repeticiones. El testigo fue la concentración 0 para la cual se usó agua estéril. Después de la exposición al hipoclorito, los insectos se lavaron tres veces con agua destilada estéril. La unidad experimental se conformó por cuatro adultos de Z. carbonaria. Se registró diariamente la mortalidad. Los datos se analizaron a través de un análisis de varianza.
Reactivación de los aislamientos. Para evitar la atenuación de la virulencia de los hongos entomopatógenos, cultivados sucesivamente en medios sintéticos, se hizo necesario proceder a reactivarlos sobre adultos de Z. carbonaria (Bustillo 1993; Bustillo y Marín 2002; González et al. 1993) procedentes de una cría mantenida bajo invernadero. Una vez esporulado el hongo sobre el medio de cultivo PDA modificado, se le adicionaron 10 ml de tween 80 estéril al 0,1%, para desprender las conidias con ayuda de un asa, obteniendo una suspensión madre de conidias, la cual se ajustó a una concentración de 1 x 107 conidias/ml (Narváez et al. 1997; Vélez et al. 1997; Ezzati et al. 2009).
Posteriormente, cada aislamiento del hongo se reactivó infectando tres adultos de cuatro días de edad, colocando 1 ml de la suspensión madre en la superficie del insecto, con ayuda de una micropipeta. Los insectos se individualizaron en una caja Petri, previamente desinfectada con alcohol al 90%. Dentro de la caja, un vial con agua y una porción de hoja de caña proporcionaron alimento a los salivazos.
Durante 10-15 días, se hicieron observaciones sobre mortalidad y la aparición de micelio de los hongos sobre el cuerpo de los salivazos. De estas muestras reactivadas, se hicieron aislamientos en PDA modificado y se incubaron a 26 °C durante siete días, para luego almacenarlas mediante la técnica del papel filtro (CIAT 2001; Marín y Bustillo 2002; Gidin et al. 2009). Los aislamientos de los hongos entomopatógenos, se caracterizaron evaluando la tasa de crecimiento, y en estos cultivos se estimó la producción de conidias, pureza y viabilidad al cabo de 20 días de incubación (Narváez et al. 1997; Vélez et al. 1997, 1999; Marín y Bustillo 2002).Tasa de crecimiento. Se sembraron 10 µl de una suspensión (1x106 conidias/ml) de cada aislamiento de los hongos, en un disco de papel filtro de 0,5 cm de diámetro, el cual se ubicó en el centro de una caja Petri que contenía 20 ml de PDA modificado. La unidad experimental fue la caja Petri y se tuvieron cuatro repeticiones. El medio se incubó a 26 °C y al cabo de 1, 5, 10, 15 y 20 días después de la inoculación, se midió el radio de la colonia (Vélez et al. 1997; Parker et al. 2003). Los datos se analizaron a través de un análisis de varianza y los promedios de los tratamientos se compararon mediante la prueba de Duncan (P = 0,05).
Producción de conidias. Con la ayuda de una pipeta Pasteur de vidrio, se extrajeron del cultivo cuatro discos de agar de 0,5 cm de diámetro, se mezclaron en 10 ml de tween 80 (0,1%) estéril y se homogenizaron con la ayuda de un vortex durante 1 min. De esta suspensión madre se realizaron diluciones seriadas en base 10, hasta 10-2, y se contaron las conidias con ayuda de la cámara Neubauer, para establecer su concentración (Narváez et al. 1997; Parker et al. 2003). Ésta se llevó a cabo registrando el número de esporas presentes en el cuadrante central, contando 5 de los 25 cuadrantes en el que se divide, y aplicando posteriormente la fórmula:
Los datos se sometieron a un análisis de varianza y los promedios de los tratamientos se compararon mediante la prueba de Duncan (P = 0,05).
Pureza. Se realizaron diluciones seriadas en base 10 de la suspensión madre de conidias hasta la dilución 10-4. Se sembraron y homogenizaron por duplicado 100 µl de la suspensión en PDA modificado (Vélez et al. 1997; Marín y Bustillo 2002). Dichas siembras, se incubaron a 26 °C durante siete días, al cabo del cual se estimaron las unidades formadoras de colonia (UFC), estimando el número total, el número de UFC correspondiente al entomopatógeno de interés y el número de UFC perteneciente a otros microorganismos, considerado contaminantes, como bacterias, hongos y levaduras. El porcentaje de pureza se estimó relacionando las UFC del hongo con el total de UFC. Los datos se sometieron a un análisis de varianza y los promedios de los tratamientos se compararon mediante la prueba de Duncan (P = 0,05).
Viabilidad. La suspensión madre de conidias se diluyó hasta 10-3, de la cual se sembraron 5 µl sobre agar agua al 1,5% sin acidificar, en cinco puntos previamente señalados en la base de la caja Petri (Vélez et al. 1997; Marín y Bustillo 2002). Estas siembras se incubaron a 25 ± 2 °C y al cabo de 24 h, se adicionó a cada punto una gota de azul de lactofenol, se cortó la muestra y se puso sobre una lámina cubierta con una laminilla para observar al microscopio. En esta muestra se contó un mínimo de 100 conidias y se cuantificó la germinación y se expresó el resultado en porcentaje de germinación. Los datos se sometieron a un análisis de varianza y los promedios de los tratamientos se compararon mediante la prueba de Duncan (P = 0,05).
Selección de materiales para el bioensayo de virulencia. Para poder evaluar los hongos sobre adultos de Z. carbonaria, primero se determinaron las características del recipiente en cuanto a la humedad relativa y temperaturas apropiadas para la supervivencia de adultos sin infección, bajo condiciones de invernadero. Se evaluaron cilindros de acetato transparente con un diámetro de 23 cm y 53 cm de altura, colocados individualmente sobre una base de espuma de poliuretano (Fig. 1A) o en un soporte plástico con orificios, cubierto con una malla de muselina (Fig. 1B). Cada juego de cilindro y base se colocó en una bandeja de acetato (26,5 cm de ancho, 33 cm de largo y 10 cm de profundidad) y dentro de esta se le adicionaron 700 y 850 ml de agua, respectivamente, para suministrar humedad al sistema. En la parte superior, el cilindro se recubrió con una muselina ajustada con un resorte, para permitir la aireación al sistema. En el interior se colocó una plántula de caña de la variedad CC 85 - 92 de cuatro meses de edad, que proporcionó alimento al adulto del salivazo para asegurar su sobrevivencia. El experimento consistió en dos tratamientos (cilindro con la base de espuma y cilindro con la base o soporte plástico con orificios, cubierto con malla de muselina), con cinco repeticiones en un diseño completamente aleatorio. Diariamente, durante 5 días y cada 2 h, se midió la humedad relativa y la temperatura, dentro de cada uno de los cilindros con la ayuda de un higrotermógrafo digital. Los datos se sometieron a un análisis de varianza y los promedios de los tratamientos se compararon mediante la prueba de Duncan (P = 0,05).
Supervivencia de adultos de Zulia carbonaria. La supervivencia promedio de adultos de Z. carbonaria, se evaluó usando 50 unidades experimentales (cilindro más la base más adecuada, seleccionada en el ensayo arriba mencionado), en donde se colocaron, individualmente, 25 machos y 25 hembras de Z. carbonaria recién emergidos. Las unidades experimentales se distribuyeron aleatoriamente en el invernadero, evaluando diariamente su mortalidad para estimar el promedio de duración bajo estas condiciones. Aplicando el teorema de Chebyshev se estableció el número de insectos óptimo para los bioensayos de virulencia de las cepas de interés.
Resultados y Discusión
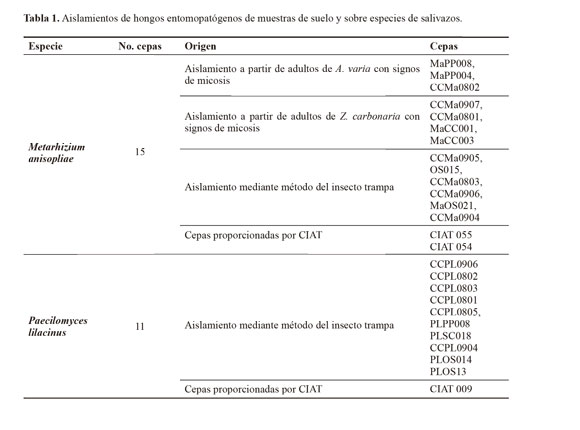
Durante la época seca y de lluvias se visitaron 11 sitios (cultivos de caña y pastos afectados por salivazos), de donde se obtuvieron 23 cepas de hongos potencialmente patógenos a los salivazos, A. varia y Z. carbonaria. Fue posible aislar, a partir de suelo e insectos con signos de micosis, los hongos Metarhizium anisopliae y Paecilomyces lilacinus (Tabla 1). La identificación de estos hongos se llevó a cabo mediante caracterización morfológica en donde las cepas de M. anisopliae, generaron colonias con pigmentación verde-amarillosa y al microscopio se observaron esporas típicamente de morfología bacilar (Santos et al. 2010) mientras que las cepas de P. lilacinus, poseen una típica morfología de colonia aterciopelada, de crecimiento concéntrico y al microscopio se observan conidióforos divergentes en forma de botella y sus conidias dispuestas en forma basipétala (Barnett y Hunter 1998).
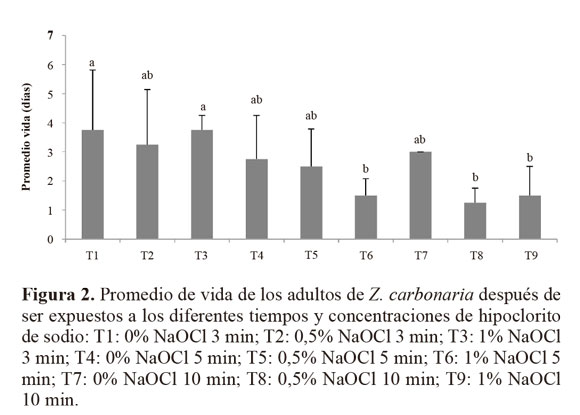
Muchos hongos entomopatógenos habitan el suelo y se constituyen en un componente de muchos ecosistemas terrestres, desempeñando un papel importante en la regulación de poblaciones de insectos. Entre los géneros más comunes se destacan Beauveria, Metarhizium, Conidiobolus y Paecilomyces (Faria y Wraight 2001; Quesada et al. 2007), sin embargo son las cepas de M. anisopliae las que se han estudiado en diversas regiones del mundo, demostrando su eficacia en el control de salivazos en caña de azúcar, como Mahanarva fimbriolata en Brasil (Vieira et al. 2011).Desinfestación de los adultos. El promedio de vida de los adultos de Z. carbonaria sometidos a diferentes tiempos de exposición al NaOCl fue variable y, en general, no se encontraron diferencias significativas entre los tratamientos (Fig. 2). Esto pudo deberse a la poca longevidad de los adultos de Z. carbonaria durante el experimento como se muestra con el testigo tratado solo con agua. No obstante, se observó que al aumentar la concentración del hipoclorito de sodio, la vida media del insecto disminuye, debido a que el hipoclorito de sodio al ejercer su acción, tiene la capacidad de reaccionar fácilmente con las proteínas y nucleótidos del insecto, para producir una variedad de compuestos orgánicos clorados, mediante reacciones de oxidación y sustitución, los cuales son altamente lipofílicos, persistentes y tóxicos (Emmanuel et al. 2004).
Reactivación de los aislamientos. Seis cepas de P. lilacinus (CCPL0803, CCPL0805, CCPL0801, CCPL0802, CCPL0904, CCPL0906) y ocho cepas de M. anisopliae (CIAT 054, CCMa0801, CCMa0906, CCMa0803, CCMa0904, CCMa0907, CCMa0802, CCMa0905) fueron patógenas a adultos de Z. carbonaria. La infección de los hongos en estos insectos, pasa por varias fases: adhesión y germinación, penetración y desarrollo y colonización. Algunas cepas que no muestran la patogenicidad hacia un insecto se debe a que fallan en penetrar y colonizar el insecto probablemente debido a que las baterías enzimáticas que poseen no son suficientes o a que el insecto se sobrepone a estos ataques a través de sus mecanismos de defensa (Alean 2003; González et al. 1993).
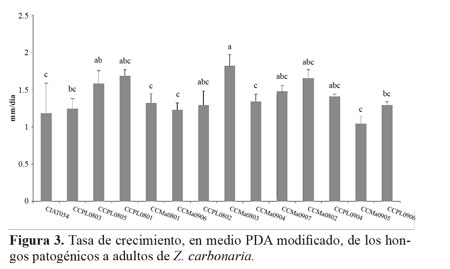
Tasa de crecimiento. Se encontró que al evaluar el crecimiento en medio de cultivo (Fig. 3), las cepas de P. lilacinus: CCPL0805, CCPL0801, CCPL0802, CCPL0904 y las de M. anisopliae: CCMa0803, CCMa0907 y CCMa0802, presentaron una mayor tasa de crecimiento significativamente superior (P < 0,0001) a las demás cepas evaluadas. Esto indica que son cepas que bajo sistemas de producción masiva, tienen ventajas en comparación con las otras. Ruiz et al. (2011), demostraron que el crecimiento radial en cepas de M. anisopliae varió entre 3,1 y 3,7 mm/día, valores superiores a los registrados en el presente estudio.
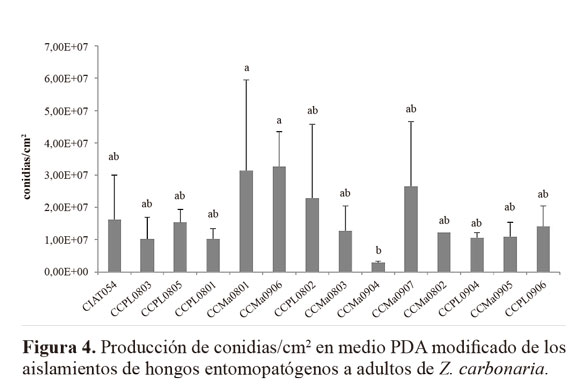
Producción de conidias. Las estimaciones sobre producción de conidias de las diferentes cepas (Fig. 4), fue muy variable y, por lo tanto, no se presentaron diferencias estadísticas entre los hongos evaluados, con excepción de CCMa0904 que presentó la menor producción con 2,88 x 106 conidias/cm2. Este parámetro es muy importante cuando se trata de usar comercialmente una cepa de un hongo, ya que una alta producción de esporas hace más viable su comercialización y reduce los costos de su implementación en el campo. Por otra parte, una cepa de alta esporulación sobre un insecto permite una mayor diseminación del hongo con la consecuente infección en otros individuos de la población (Thomas y Jenkins 1997; Narváez et al. 1997).
Pureza. Todos los cultivos de las cepas patogénicas a Z. carbonaria, al momento de la evaluación, mostraron tener más del 95% de pureza. La pureza de los aislamientos de hongos es un factor muy importante en el control de su calidad, ya que se trata de certificar que el producto solo contiene el organismo deseado y que no está contaminado con otros organismos que puedan ser deletéreos o contaminantes en el ambiente en el cual se depositan (Vélez et al. 1997).
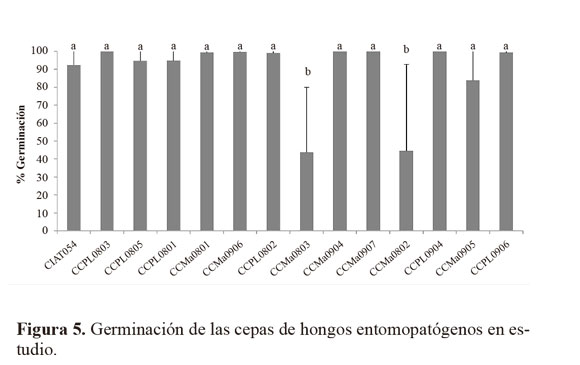
Viabilidad. Al evaluar la viabilidad a través de la germinación (Fig. 5), se encontró que con excepción de las cepas CCMa0803 y CCMa0802 que presentaron baja germinación (P < 0,0001) a las 24 h, todas las demás tuvieron una germinación superior al 90%. Estas dos cepas no se consideraron apropiadas debido a su baja viabilidad. En otros estudios con cepas de M. anisopliae,Ruiz et al. (2011) encontraron germinación del 100% a las seis horas de incubación; sin embargo, Hernández et al. (2007) y Khaskaveh et al. (2008) registraron porcentajes de germinación más bajos a las 24 h de incubación, que oscilaron entre 90 y 94%, muy similares a lo encontrado en el presente estudio.
Selección de materiales para el bioensayo de virulencia. No se encontraron diferencias estadísticamente significativas en cuanto a la temperatura en los dos tipos de sistemas evaluados. La temperatura en el interior de los dos sistemas fue superior a la registrada en el invernadero, en donde el promedio fue de 27,4 ± 2,8 °C, en los días en que se llevó a cabo la evaluación. En relación con la humedad relativa, tampoco hubo diferencias significativas y estuvo alrededor de 88%, muy apropiada para este tipo de bioensayos y fue superior a la humedad promedia ambiental del invernadero (68,4%). Con base en estos resultados cualquiera de los dos sistemas es apropiado, pero se escogió el sistema cilindro - soporte plástico, que lleva una base plástica con malla de muselina debido a que es más sencilla su instalación y se mantiene libre de contaminantes.
Supervivencia de adultos de Zulia carbonaria. Bajo el sistema cilindro - soporte plástico con orificios cubierto con malla de muselina, el tiempo de vida para las hembras (10,7 ± 2,0 días) y para los machos (10,6 ± 1,7 días) es igual bajo las condiciones del invernadero, por lo tanto, las cepas de los hongos se pueden evaluar sobre los adultos del salivazo en los bioensayos, sin tener en cuenta el sexo.
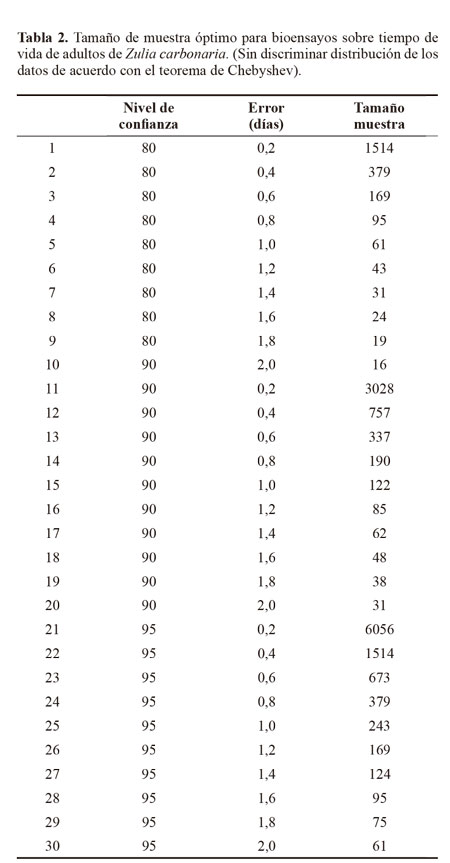
Al realizar el análisis de la supervivencia de los adultos mediante la prueba de desigualdad de Chebyshev, se pudo establecer el tamaño de muestra de insectos a utilizar en bioensayos de virulencia de los aislamientos de los hongos, teniendo en cuenta un nivel de confianza determinado y un error preestablecido (Tabla 2). En este caso, a un nivel de confianza de 95% y 1,2 días de error, por ejemplo, se aconseja que se utilicen 169 insectos por cepa a evaluar, con el fin de asegurar que la vida media de los insectos va a ser de aproximadamente 10 días y una reducción en este valor será asociado a la acción del patógeno.Agradecimientos
Los autores expresan su agradecimiento al Ministerio de Agricultura y Desarrollo Rural de Colombia, por la cofinanciación de esta investigación a través del proyecto 141-2008P4896-4070. Al Dr. Carlos Moreno de Cenicaña, por su asesoría estadística en el análisis de la información.
Literatura citada
ALEAN, I. 2003. Evaluación de la patogenicidad de diferentes hongos entomopatógenos para el control de la mosca blanca de la yuca Aleurotrachelus socialis Bondar (Homoptera: Aleyrodidae) bajo condiciones de invernadero. Trabajo de grado. Pontificia Universidad Javeriana. Facultad de Ciencias. Microbiología Agrícola y Veterinaria. Bogotá, Colombia, 72 p. [ Links ]
ALVES, S. B. 1986. Fungos entomopatogénicos. pp. 73-126. In: Alves, S. B. (Ed.). Controle microbiano de insetos. São Paulo, Editora Manole Ltda. [ Links ]
ALVES, S. B.; LOPES R. B. 2008. Controle microbiano de pragas na America Latina. Piracicaba: FEALQ, 414 p. [ Links ]
BARNETT, H.; HUNTER, B. B. 1998. Illustrated genera of imperfect fungi. Fourth edition. APS Press. The American Phytopathological Society. St. Paul. Minnesota, EEUU. 280 p. [ Links ]
BUSTILLO, A. E. 1993. Pérdida de virulencia del hongo Beauveria bassiana cultivado sucesivamente en sustrato de arroz. Centro Nacional de Investigaciones de Café - Cenicafé, Brocarta No. 14, noviembre 1 de 1993. 2 p. [ Links ]
BUSTILLO, A. E.; MARÍN, P. 2002. ¿Cómo reactivar la virulencia de Beauveria bassiana para el control de la broca del café? Hoja Técnica No. 40. Catie. Revista Manejo Integrado de Plagas 63: 1-4. [ Links ]
CARVALHO, G.; WEBB, M. 2005.Cercopid spittle bugs of the New World (Hemiptera, Auchenorrhyncha, Cercopidae). Sofia, Moscú: Pensoft. 271 p. [ Links ]
CASTILLO, S. 2006. Uso de Metarhizium anisopliae para el control biológico del salivazo (Aeneolamia spp. y Prosapia spp.) en pastizales de Brachiaria decumbens en el Petén, Guatemala. Magister Scientiae en agricultura Ecológica. Centro Agronómico Tropical de Investigación y Enseñanza. Turrialba, Costa Rica, 66 p. [ Links ]
CASTRO, U.; GÓMEZ, L. A.; GUTIÉRREZ, Y.; ANDRADE, L. P.; VILLEGAS, A.; BERNAL, N. 2009. Distribución y especies de salivazo (Hemiptera: Cercopidae) asociados con la caña de azúcar (Saccharum officinarum L.) en el Valle del Cauca y Colombia. pp. 144-151. Memorias Tecnicaña VIII, Congreso, Cali, Colombia. [ Links ]
CENICAÑA. 1999. Manejo integral de plagas. En: Informe anual Cengicaña, 1998-1999, Guatemala, p. 25-32. [ Links ]
CHANDLER, D.; HAY, D.; REID, A. 1997. Sampling and occurrence of entomopathogenic fungi and nematodes in UK soils. Applied Soil Ecology 5: 133-141. [ Links ]
CIAT. Centro Internacional de Agricultura Tropical. 2001. Maintenance of a ceparium for fungal entomopathogens of major forage grass and cassava pest. pp. 35-37. En: Research group on the Comparative Bioecology and IPM of grassland spittlebugs. [ Links ]
EMMANUEL, E.; KECK, G.; BLANCHAR, J.; VERMANDE, P.; PERRONDI, Y. 2004. Toxicological effects of disinfections using sodium hypochlorite on aquatic organisms and its contribution to AOX formation in hospital wastewater. Environment International 30: 891-900. [ Links ]
EZZATI, R.; TALAEI, R.; REZA, H. 2009. Effect of formulating of Beauveria bassiana conidia on their viability and pathogenicity to the onion thrips, Thrips tabaci Lind (Thysanoptera: Thripidae). Journal of Plant Protection Research 49 (1): 97-103. [ Links ]
FARIA, M. Y.; WRAIGHT, S. 2001. Biological control of Bemisia tabaci with fungi. Crop Protection20: 767-778. [ Links ]
FEWKES, D. W. 1969. The biology of sugar cane froghoppers. pp. 283-307. In: Williams, J. R.; Metcalfe, J. R.; Montgomery, R. W.; Mathes, R. (Eds.). Pests of sugar cane. Amsterdam, Elsevier Publishing Co., 568 p. [ Links ]
GIDIN, G.; GLAZER, I.; MISHOUTCHENKO, A. 2009. Entomopathogenic fungi as a potential control agent against the lesser mealworm, Alphitobius diaperinus in broiler houses. Biocontrol 54: 549-558. [ Links ]
GÓMEZ, L. A. 2007. Manejo del salivazo Aeneolamia varia en cultivos de caña de azúcar en el valle del río Cauca. Cenicaña (Colombia). Carta Trimestral 29 (2-3): 10-17. [ Links ]
GÓMEZ, L. A.; HINCAPIÉ, L. A.; MARÍN, M. E. 2007. El salivazo de la caña de azúcar Mahanarva bipars. Cali, Cenicaña (Colombia), Serie Divulgativa No. 10, 4 p. [ Links ]
GONZÁLEZ, M. T.; POSADA, F. J.; BUSTILLO, A. E. 1993. Desarrollo de un bioensayo para evaluar la patogenicidad de Beauveria bassiana sobre Hypothenemus hampei. Revista Cenicafé (Colombia) 44 (3): 93-102. [ Links ]
HERNÁNDEZ, R; PÉREZ, B.; VENTURA, L.; REAL, T.; GARCÍA, J. 2007. Efecto del coadyuvante Break-Thru sobre Metarhizium anisopliae (Ascomycota: Hypocreales) y salivazo Aeneolamia postica (Hemiptera: Cercopidae) en México. pp. 489-492. XXX Congreso Nacional de Control Biológico Simposio del IOBC, Mérida, Yucatán, México. [ Links ]
ICA. 1973. Notas y noticias entomológicas. Mión de los pastos en los Llanos Orientales. Programa de Entomología, ICA, Bogotá, 35 p. [ Links ]
KHASHAVEH, A.; SAFARAIZADE, A.; GHOSTA, Y. 2008 Iranian isolates of the fungus, Metarhizium anisopliae (Metsch.) Sorokin (Deuteromycotina: Hyphomycetes) against granary weevil, Sitophilus granarium L. (Coleoptera: Curculionidae). Journal of Biological Science8: 804-808. [ Links ]
MARÍN, P.; BUSTILLO, A. E. 2002. Pruebas microbiológicas y físico - químicas para el control de calidad de hongos entomopatógenos. pp. 72 - 116. In: Memorias Curso Internacional Teórico-Práctico. Sección I. Entomopatógenos de la broca del café. Cenicafé, Chinchiná, marzo 11 al 15 del 2002. [ Links ]
MENDONÇA, A. F. 2001. Manejo integrado del salivazo de la raíz de la caña de azúcar. Mahanarva fimbriolata en Brasil. pp. 48-55. Memorias del I Taller Latino Americano sobre plagas de la Caña de Azúcar. Guayaquil, Nov. 28-30. Aeta-Atalac. [ Links ]
MENDOZA, J. R. 2001. Bioecología del salivazo de la caña de azúcar, Mahanarva andigena (Hom: Cercopidae) en el Ecuador. pp. 40-47. Memorias del I Taller Latino Americano sobre plagas de la Caña de Azúcar. Guayaquil, Nov. 28-30. Aeta-Atalac. [ Links ]
MORALES, A.; TOBÓN, R.; YELA, O.; PECK, D. 2001. Characterization and formulation of select fungal entomopathogen isolates for field evaluation. pp. 38-39. Research group on the comparative bioecology and IPM of grassland spittlebugs. Summary of Activities, CIAT. Cali-Colombia. [ Links ]
NARVÁEZ, M.; GONZÁLEZ, M. T.; BUSTILLO, A. E.; CHAVES, B.; MONTOYA, E. C. 1997. Producción de esporas de aislamientos de Beauveria bassiana y Metarhizium anisopliae en diferentes sustratos. Revista Colombiana de Entomología 23 (3-4): 125-132. [ Links ]
PARKER, B.; SKINNER, M.; COSTA, S.; GOULI, S.; REID, W.; BOUHSSINI, M. 2003. Entomopathogenic fungi of Eurygaster integriceps Puton (Hemiptera: Scutelleridae): collection and characterization for development. Biological Control 27: 260-272. [ Links ]
PECK, D. C.; RODRÍGUEZ, J.; GÓMEZ, L. A. 2004. Identity and first record of the spittlebug Mahanarva bipars (Hemiptera: Auchenorrhyncha: Cercopidae) on sugarcane in Colombia. Florida Entomologist 82 (1): 82-84. [ Links ]
QUESADA, E.; NAVAS, J.; MARANHAO, E.; ORTIZ, A.; SANTIAGO, C. 2007. Factors affecting the occurrence and distribution of entomopathogenic fungi in natural and cultivated soils. Mycological Research 3: 947-966. [ Links ]
RUIZ-SÁNCHEZ, E.; CHAN-CUPUL, W.; PÉREZ GUTIÉRREZ, A.; CRISTÓBAL-ALEJO, J.; UCH-VAZQUEZ, B.; TUN- SUÁREZ, J. M.; MUNGUÍA-ROSALES, R. 2011. Crecimiento, esporulación y germinación in vitro de cinco cepas de Metarhizium y su virulencia en huevos y ninfas de Bemisia tabaci. Revista Mexicana de Micologia 33: 9-15. [ Links ]
SANTOS, S.; LEAL, C.; CARNEIRO, F.; ASSUNÇÃO, R; DUTRA, N.; FREIRE, F.; KAMIMURA, M.; MAGALHÃES, D.; LUNA, E.; GADELHA, M. 2010. The effects of the fungus Metarhizium anisopliae var. acridum ondifferent stages of Lutzomyia longipalpis (Diptera: Psychodidae). Acta Tropica 113 (3): 214-220. [ Links ]
THOMAS, M. B.; JENKINS, N. E. 1997. Effects of temperature on growth of Metarhizium flavoviride and virulence to the variegated grasshopper, Zonocerus variegatus. Mycological Research 101 (2): 1469-1474. [ Links ]
TORRES DE LA CRUZ, M.; MADRIGAL, H.; ORTIZ, C. F.; LAGUNAS, L.; DÍAZ, G. 2006. Selección de aislamientos de Metarhizium anisopliae para el manejo de Aeneolamia postica en caña de azúcar de Tabasco, México. pp. 22. Memorias Congreso Internacional de Control Biológico. Mayo 31 - junio2, 2006. Palmira, Colombia. [ Links ]
VÉLEZ, P. E.; POSADA, F. J.; MARÍN, P.; GONZÁLEZ, M. T.; OSORIO, E.; BUSTILLO, A. E. 1997. Técnicas para el control de calidad de formulaciones de hongos entomopatógenos. Boletín Técnico No. 17, Cenicafé, Colombia, 37 p. [ Links ]
VÉLEZ, P. E.; GONZÁLEZ, M. T.; RIVERA, A.; BUSTILLO, A. E.; ESTRADA, M. N.; MONTOYA, E. C.1999. Caracterización de aislamientos de Beauveria bassiana y Metarhizium anisopliae de la colección de Cenicafé. Revista Colombiana de Entomología 25 (3-4): 191-207. [ Links ]
VÉLEZ, P. E.; ESTRADA, M. N; GONZÁLEZ, M. T.; VALDERRAMA, A. M.; BUSTILLO, A. E. 2001. Caracterización de aislamientos de Beauveria bassiana para el control de la broca del café. Manejo Integrado de Plagas (Costa Rica) 62: 38-53. [ Links ]
VIEIRA, P. DE LIMA, H., BORSATO, J. TINTI, N; ALVES, E. 2011. Differential pathogenicity of Metarhizium anisopliae and the control of the sugarcane root spittlebug Mahanarva fimbriolata. Brazilian Archives of Biology and Technology 54 (3): 15- 21. [ Links ]