Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.2 Bogotá July/Dec. 2012
Eficacia de entomonematodos para controlar estados de Aeneolamia varia
(Hemiptera: Cercopidae) bajo condiciones de invernadero
Efficiency of entomonematodes for controlling Aeneolamia varia (Hemiptera: Cercopidae)
stages under controlled conditions
MIRIAM ROSERO-GUERRERO1, ALEX ENRIQUE BUSTILLO-PARDEY2, JUAN CARLOS LÓPEZ-NÚÑEZ3, ULISES CASTRO-VALDERRAMA4 y EYDER DANIEL GÓMEZ-LÓPEZ5
1 Ing. Agr., candidato, M. Sc. Universidad Nacional de Colombia, Sede Palmira, mrossgu@gmail.com
2 Ing. Agr., Ph. D. Entomólogo I. Centro de Investigación de la Caña de Azúcar, Cenicaña, alexe.bustillo@gmail.com
3 Microbiólogo, Investigador Científico I. Centro Nacional de Investigaciones de Café, Cenicafé, juancarlos.lopez@cafedecolombia.com
4 Ing. Agr., M. Sc. Entomólogo II. Centro de Investigación de la Caña de Azúcar (Cenicaña), ucastro@cenicana.org
5 Ing. Agr., Ph. D. Profesor Asociado. Universidad Nacional de Colombia, Sede Palmira, edgomezl@unal.edu.co
Recibido: 24-feb-2012 - Aceptado: 15-nov-2012
Resumen: Aeneolamia varia se registró en cultivos de caña en el Valle del Cauca entre 2007 y 2008 y sus infestaciones se extendieron a 25.000 ha, amenazando así la industria azucarera y panelera. Debido a esta situación, se inició una investigación con nematodos entomopatógenos, para evaluarlos en el control de esta plaga. Se evaluaron las especies Steinernema colombiense, Steinernema websteri, Steinernema sp.1, Steinernema sp.2, Heterorhabditis bacteriophora yuna especie de Steinernema codificada como O1R1, en dosis de 100 y 1.500 juveniles infectivos (JI)/cm2 de área asperjada, sobre estadios ninfales de A. varia en plántulas de caña de azúcar en invernadero. El estado adulto se evaluó bajo condiciones de laboratorio empleando 100 JI/cm2 y los sistemas de bioensayo en cajas Petri y cilindros. El tercer estadio ninfal fue el menos susceptible y el cuarto fue el más susceptible a H. bacteriophora, presentando mortalidad de 89,1% con 100 JI/cm2. El estado adulto tuvo una mortalidad de 100% con todas las especies de nematodos evaluadas en el bioensayo en cajas Petri, mientras que en los cilindros la mortalidad varió entre 40 y 54%. El experimento para evaluar la habilidad de las especies de nematodos, para buscar el hospedero A. varia, reveló que todas son capaces de encontrar sus ninfas, pero H. bacteriophora y Steinernema sp.1 fueron las más eficaces causando mortalidades del 46% y 30%, respectivamente.
Palabras clave: Caña de azúcar. Control biológico. Heterorhabditis. Steinernema.
Abstract: Aeneolamia varia was reported in sugar cane crops in the Cauca Valley between 2007 and 2008 and its infestations extended to 25,000 ha, thereby threatening the sugar and “panela” industries. Given this situation, research was initiated on entomopathogenic nematodes in order to evaluate them for control of this pest. We evaluated the species Steinernema colombiense, Steinernema websteri, Steinernema sp.1, Steinernema sp.2, Heterorhabditis bacteriophora and a species of Steinernema coded as O1R1 in doses of 100 and 1,500 infective juveniles (IJ)/cm2 of spray area on the nymphal instars of A. varia in sugar cane seedlings under greenhouse conditions. The adult stage was evaluated under laboratory conditions using 100 IJ/cm2 and bioassay systems in Petri dishes and cylinders. The third nymphal instar was the least susceptible and the fourth instar was the most susceptible to H. bacteriophora, presenting a mortality of 89.1% with 100 IJ/cm2. The adult stage had 100% mortality with all nematode species tested under bioassay conditions with Petri dishes, while in cylinders the mortality varied between 40 and 54%. The experiment to demonstrate the ability of the nematode species to search for the host A. varia, revealed that all are capable of finding their nymphs, but H. bacteriophora and Steinernema sp.1 were the most efficient causing mortalities of 46% and 30%, respectively.
Key words: Sugar cane. Biological control. Heterorhabditis. Steinernema.
Introducción
El salivazo de la caña de azúcar, Aeneolamia varia (Fabricius, 1787) (Hemiptera: Cercopidae), se registró atacando caña en el Valle del Cauca, Colombia, a principios de junio de 2007. Este hallazgo se constituyó en una alerta sanitaria debido a que en países vecinos como Venezuela es una plaga de importancia económica ocasionando pérdidas hasta del 25% en producción (Salazar y Proaño 1989).
Los salivazos se caracterizan porque las ninfas se recubren de una sustancia espumosa y viscosa con apariencia de saliva que sirve de defensa de enemigos naturales y como protección de condiciones climáticas adversas (Thompson y González 2005). La producción de espuma la llevan a cabo una vez que inician su alimentación en los tejidos del xilema principalmente en la raíz o en la parte basal de los tallos. Los adultos introducen su estilete en las hojas hasta alcanzar el xilema e inyectan una toxina que produce necrosis del tejido foliar causando un secamiento de la hoja (Gómez 2007). El ciclo de vida de A. varia sobre caña de azúcar, bajo condiciones de invernadero, es en promedio de 62 días; los huevos eclosionan luego de 15 días pasando por cinco estadios ninfales que se desarrollan en 40,5 días y la longevidad de los adultos es de cinco días (Sendoya et al. 2011).
Para el control del salivazo de la caña de azúcar, A. varia se recomiendan prácticas de manejo basados en experiencias con otros salivazos en las cuales se contemplan prácticas culturales, control biológico con Metarhizium anisopliae (Metschnikoff, 1879) Sorokin, 1883, e insecticidas químicos como emergencia en situaciones de infestaciones altas (Salazar y Proaño 1989; Leite et al. 2005; Bustillo y Castro 2011). Debido a que las ninfas del salivazo se encuentran en las raíces de las gramíneas en el suelo, los nematodos entomopatógenos se consideran promisorios para su control. Los nematodos tienen características importantes, como son la capacidad de desplazarse, buscar, encontrar e infectar insectos, además presentan inocuidad al medio ambiente, a mamíferos y compatibilidad con otros entomopatógenos (Kaya 1990; Rovesti y Deseo 1990; Lewis y Gaugler 1994; Glazer 1996; Kaya y Koppenhöfer 1996; Akhurst y Smith 2002).
Especies de los géneros Steinernema y Heterorhabditis se han evaluado para el control del salivazo de la caña de azúcar desde hace varios años. Estudios realizados en varias partes para el control de especies de salivazos como Mahanarva fimbriolata (Stål, 1854), M. spectabilis (Distant, 1909), A. varia, Aeneolamia sp.,con diferentes especies de nematodos han demostrado que pueden causar mortalidades altas al estado ninfal de los salivazos que se localizan en el suelo (Leite et al. 2002, 2005; Ferrer et al. 2004; Quintero et al. 2007; Batista y Machado 2010).
Teniendo en cuenta las consideraciones anteriores, el objetivo de este trabajo fue establecer la virulencia de varias especies de nematodos entomopatógenos sobre ninfas y adultos de A. varia.
Materiales y Métodos
Este trabajo se realizó bajo condiciones de laboratorio (24 ± 0,7 °C y 70 ± 3% HR) e invernadero (26,6 ± 0,85 °C y 70,7 ± 4,3% HR) en las instalaciones del Centro Agropecuario del Sena en Buga, Valle del Cauca, ubicado a 3°54’07”N y 76°18’ 4”O y 969 msnm, donde se encuentra establecida una cría masiva de A. varia.
Las especies de nematodos evaluadas fueron Steinernema colombiense López-Núñez et al., 2008, Steinernema websteri Cutler y Stock, 2003, Steinernema sp.1, Steinernema sp.2 y Heterorhabditis bacteriophora (Poinar, 1976)suministradas por Cenicafé (aisladas a partir de muestras de suelo de los municipios Fresno, Tolima y Montenegro, Quindío), y Steinernema O1R1 (aislado de Oiba-Santander). Estos nematodos se multiplicaron en larvas de último estadio de Galleria mellonella (L.) (Lepidoptera: Pyralidae) siguiendo procesos establecidos por Realpe et al. (2007) y López (2008) y utilizados inmediatamente después de ser cosechados. Los adultos y ninfas de A. varia se obtuvieron de la colonia establecida en el SENA de Buga, bajo condiciones de invernadero (Sendoya et al. 2011).
Bioensayos de virulencia sobre ninfas de A. varia. Estudios previos sobre ninfas en condiciones de laboratorio (datos no publicados) mostraron una mortalidad natural alta por falta de raíces secundarias en las plantas para la alimentación del insecto por lo cual fue necesario realizar los ensayos directamente en invernadero.
Las unidades experimentales se conformaron con plántulas de caña de azúcar variedad CC 85-92 sembradas en recipientes de PVC de 6 cm de diámetro y 7 cm de alto. Estos recipientes contenían suelo estéril (suelo + arena 3:1). Ocho días después de la infestación de las plántulas con huevos de A. varia se aplicaron los nematodos entomopatógenos en 10 ml de una solución de agua estéril y un dispersante al 0,1% (Carrier®, ingrediente activo: ácidos carboxílicos insaturados y glicéridos saturados: 862 g/L), aplicado con una pipeta directamente a las ninfas de I estadio. Para efectuar los bioensayos con ninfas de II, III, IV y V estadio, se infestaron las plántulas con huevos de A. varia y se esperó hasta que el salivazo llegó a cada estado ninfal preestablecido. Los nematodos suspendidos en 10 ml de una solución de agua estéril y un dispersante se aplicaron a las ninfas empleando un atomizador manual plástico, con capacidad de 500 ml. Se evaluaron dos dosis de juveniles infectivos (JI´s) (d1: 100 y d2: 1500 JI´s/cm2) y las evaluaciones se llevaron a cabo diariamente hasta que moría el insecto o se transformaba a adulto. Se estimó la mortalidad de las ninfas y ésta se corrigió teniendo en cuenta la mortalidad natural que ocurrió en el testigo (Schneider-Orelli 1947). Además, se realizaron observaciones sobre la reproducción de los nematodos en el 50% de los individuos muertos colocándolos en cámara “White” modificada (Kaya y Stock 1997) (Fig. 1). El 50% restante se diseccionó para estimar el número de nematodos que lograron parasitar cada insecto. Lo anterior se realizó si la mortalidad fue mayor al 20%, de lo contrario se diseccionaron, en su totalidad, los insectos muertos.
Se utilizó un diseño completamente aleatorio con 12 tratamientos y un testigo (seis especies de nematodos, en dos dosis), cada tratamiento constó de diez repeticiones y cada una estuvo conformada por cinco ninfas. Para establecer las diferencias entre tratamientos se realizó un análisis de varianza al 95% de confiabilidad y para establecer diferencias entre tratamientos se realizo la prueba de comparación de medias de Duncan (SAS 2005). El análisis estadístico se realizó para cada estadio.
Bioensayos de virulencia sobre adultos de A. varia. Se confinaron tres adultos tenerales de A. varia (adultos de menos de 24 horas de edad) en una caja Petri de 14 cm de diámetro, con papel toalla en cuyo interior se encontraba un estolón de pasto braquiaria (Brachiaria ruziziensis R. Germ. & C. M. Evrard, 1953), mantenido en solución nutritiva (Murashige y Skoog 1962), que sirvió de alimento al insecto. Los adultos se colocaron en contacto con 15400 JI por caja Petri (equivalente a 100 JI/cm2) aplicados por aspersión en 6 ml de agua estéril. A los insectos del tratamiento testigo se aplicó solo agua estéril. Las cajas Petri con los insectos infectados se mantuvieron en laboratorio a temperatura ambiente (25 °C ± 2) y el alimento se cambió cada dos días. Las evaluaciones de la mortalidad de A. varia se realizaron diariamente y durante cinco días consecutivos.
Además, se realizaron observaciones sobre la producción de los nematodos en el 50% de los individuos muertos colocándolos en cámara “White” modificada (Kaya y Stock 1997). El 50% restante de los individuos se diseccionaron, determinando el número de nematodos que lograron parasitar cada insecto. Se realizó un segundo bioensayo donde plántulas de caña de azúcar y tres tenerales se introdujeron en un cilindro de acetato transparente cubierto en la parte superior e inferior con tela de tul y a las cuales se asperjó 100 JI/cm2, tanto en suelo como en el follaje determinando el porcentaje de mortalidad de los adultos. Las evaluaciones de la mortalidad de A. varia se realizaron diariamente y durante cinco días consecutivos.
Los bioensayos se organizaron bajo un diseño completamente aleatorio con seis tratamientos y un testigo (seis especies de nematodos aplicados en una dosis). Cada tratamiento constó de diez repeticiones y cada una estuvo conformada por tres adultos. La información se analizó a través de un análisis de varianza al 95% de confiabilidad y para establecer diferencias entre tratamientos se realizó la prueba de comparación de medias de Duncan (SAS 2005).
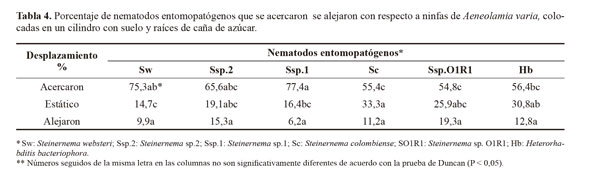
Capacidad de búsqueda de los nematodos. Se utilizó un sistema de bioensayo para desplazamiento horizontal, que consistió de tubos de polivinil cloruro (PVC) de 7 cm de diámetro por 7 cm de largo. Tres de estas secciones se unieron para formar un fragmento de desplazamiento de 21 cm de largo. Estas secciones fueron denominadas como atracción (sección de desplazamiento de los JI´s hacia el insecto), estático (sección del punto de liberación de los JI´s) y repulsión (sección comprendida entre el punto de liberación y la opuesta a la presencia del insecto). Estos recipientes contenían suelo estéril (suelo + arena 3:1) a capacidad de campo y en un extremo se encontraba una plántula de caña de azúcar infestada con cinco ninfas de A. varia de IV estadio. Mil juveniles infectivos se aplicaron en 1 ml de agua estéril en la mitad del fragmento de desplazamiento (10,5 cm). Al tratamiento testigo se le aplicó solo agua estéril.
Cinco días después de aplicados los nematodos se extrajo y se estimó el número de JI´s presentes en cada sección del suelo, mediante conteos de JI´s utilizando el método de tamizado y decantación de Cobb (1918) modificado para la recuperación de los nematodos. Para cada sección se realizaron 10 conteos. Además, se determinó el número de ninfas muertas y el de nematodos que lograron parasitar cada insecto.
El diseño experimental para este ensayo fue completamente aleatorio con seis tratamientos y un testigo (seis especies de nematodos, una dosis). Cada tratamiento tuvo 10 repeticiones y cada una se conformó por cinco ninfas, para un total de 50 individuos por tratamiento. Se realizó un análisis de varianza al 95% de confiabilidad y las diferencias entre tratamientos se establecieron mediante una prueba de comparación de medias de Duncan (SAS 2005).
Resultados y Discusión
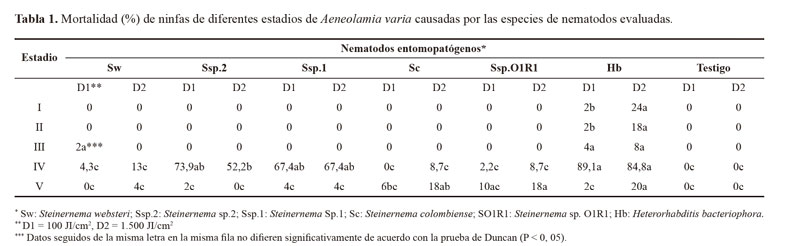
Bioensayos de virulencia sobre ninfas de A. varia. En la evaluación de la virulencia de nematodos entomopatógenos (NEPs) sobre ninfas de I estadio se presentó mortalidad solo con la especie H. bacteriophora (Tabla 1), registrándose este efecto hasta cuando las ninfas se encontraban en III estadio con mortalidades adicionales de 18 y 4% con d1 y d2 (dosis), respectivamente. En la evaluación de la virulencia de NEPs sobre ninfas de II estadio, la especie H. bacteriophora causó una mortalidad de 2 y 18% con d1 y d2, respectivamente (Tabla 1). Cuando el insecto se encontraba en III estadio la mortalidad fue de 16% con d2. No se presentó mortalidad en las otras especies de nematodos evaluadas ni en el testigo. En la evaluación de la virulencia de NEPs sobre ninfas de III estadio, solo dos especies de nematodos fueron capaces de parasitar este estado (Tabla 1). El testigo, no presentó mortalidad durante el tiempo que tomó la evaluación. La menor susceptibilidad se presentó en este estadio de desarrollo.
En la evaluación de la virulencia de NEPs sobre ninfas de IV estadio, hubo diferencias estadísticas significativas (F = 0; g.l. = 1; P = 0,0001) en cuanto a la mortalidad entre las especies de nematodos, sin embargo, no hubo diferencias significativas entre dosis evaluadas para cada especie (F = 0; g.l = 1; P = 0,9849) (Tabla 1). El estadio IV fue el más susceptible a la infección por nematodos con mortalidades hasta de 89,1%. La mayor virulencia la presentó H. bacteriophora, Steinernema sp.2 y Steinernema sp.1, con mortalidades corregidas (Schneider-Orelli 1947) de 89,1, 73,9 y 67,4 %, respectivamente con 100 JI´s/cm2 (Tabla 1).
En la evaluación sobre ninfas de V estadio, las diferencias en la mortalidad entre especies de nematodos fueron significativas (F = 0,24; g.l = 1; P = 0,0059) así como en las dosis (F = 6,8; g.l = 1; P = 0,0089). Los mayores porcentajes de mortalidad se obtuvieron con la dosis más alta (1.500 JI/cm2), destacándose H. bacteriophora (Tabla 1). Las ninfas que sobrevivieron continuaron su desarrollo hasta adultos. Al cabo de 1 a 3 días después de su transformación a adulto se observó una mortalidad del 100%.
Las mortalidades al terminar el estadio ninfal V fueron bajas, pero cuando se continuó la observación sobre las ninfas que sobrevivieron hasta el estado adulto, se encontró que todos murieron por infección de los nematodos. Esto indica que aplicaciones de los nematodos cuando el insecto está en V estadio, pueden reducir la población por que estos nematodos pueden actuar en el estado adulto. Sin embargo, se debe tener en cuenta que los adultos permanecieron confinados sin oportunidad de continuar su hábito alimenticio en las hojas y de esta manera se obligaron a estar en contacto con los nematodos.
Las evaluaciones sobre los diferentes estados ninfales de A. varia bajo condiciones de invernadero revelaron que los NEPs son capaces de matar e infectar el estado ninfal de este insecto como lo registrado por Ferrer et al. (2004), con diferentes grados de virulencia dependiendo del estado de desarrollo.
La susceptibilidad asociada a la edad que se observó en las ninfas de A. varia se podría atribuir al tamaño de los orificios naturales que son el punto de entrada de los nematodos entomopatógenos en los insectos (boca, ano y espiráculos) (Tanada y Kaya 1993) y que en las ninfas de I, II y III estadio debido a su pequeño tamaño y además a que poseen un aparato bucal chupador podrían dificultar o impedir la penetración de los nematodos. Existen varios estudios al respecto en otros insectos donde mencionan que el ancho de las aberturas (boca y ano) puede excluir a los juveniles infectivos de algunos insectos con aparato bucal chupador o estadios jóvenes de insectos de hábito masticador (Eidt y Thurston 1995). Jackson y Brooks (1995) mencionan que en larvas de primeros estadios de Diabrotica virgifera virgifera Leconte, 1868 (Coleoptera: Chrysomelidae), la pequeña abertura de los espiráculos, es una barrera que impide la entrada de los JI´s de Steinernema carpocapsae (Weiser, 1955).
Heterorhabditis presenta una ventaja morfológica sobre Steinernema, debido al diente terminal que posee, con el que raspa las áreas intersegmentales de la cutícula del insecto, facilitando la entrada al cuerpo del insecto por más lugares (Ishibashi y Kondo 1990). Esto puede explicar porque H. bacteriophora en este estudiocausó la mayor mortalidad en todos los estados ninfales y fue la única especie que infectó ninfas de los estadios I y II de A. varia (Tabla 1). Por otra parte, la menor producción de CO2 y kairomonas en los estadios iniciales de los insectos, dificulta que los nematodos encuentren su hospedero (Kaya 1985). Al respecto Campbell y Kaya (1999) mencionan que la respuesta al estímulo químico puede variar de una especie de nematodo a otra y en algunos casos, especies emboscadoras no presentan respuesta hacia su hospedante, si no perciben cantidades suficientes el CO2 o el estímulo de atracción.
Una posible explicación sobre la reducción en el parasitismo de A. varia en el V estadio, puede deberse a que la saliva es más densa, lo cual dificulta la entrada de nematodos para llegar a las ninfas, además la frecuente defecación del insecto puede causar repelencia a los nematodos y disminuir así el parasitismo. Stehr (1987) registró que las cigarras como el salivazo expulsan líquidos anales hacia animales que se aproximan cuando se les molesta. En otros insectos como larvas de Popillia japonica (Newman, 1838) (Coleoptera, Scarabaeidae), y Cephalcia lariciphila (Wachtl, 1898) (Hymenoptera: Pamphiliidae) se presenta una situación similar donde la frecuente defecación expulsa los nematodos (Georgis y Hague 1981; Cui et al. 1993). Por otra parte, el grosor de la cutícula y el sistema inmunológico desempeñan un papel importante en la susceptibilidad de los insectos (Jackson y Brooks 1995; Koppenhöfer y Fuzy 2004). En el V estadio, la cutícula de la ninfa es más gruesa y el sistema inmune es más desarrollado, lo que afectaría la infección, reduciendo la mortalidad, como se presentó incluso con H. bacteriophora (20%) en este estudio (Tabla 1). Sin embargo, las aplicaciones de nematodos entomopatógenos realizadas sobre las ninfas, redujeron considerablemente la población, sobre todo si se suma la mortalidad producida cuando llegan a adultos.
Las ninfas de IV estadio, que fueron más susceptibles a la infección por nematodos, se podrían considerar como un estado intermedio en donde los factores como las aberturas naturales, la defecación, el grosor de la cutícula, el sistema inmune, la producción de CO2 y kairomonas, no fueron una limitante para que los nematodos causaran infección. Estos aspectos deben estudiarse para que permitan dilucidar los mecanismos de acción que hacen que ninfas de IV estadio sean más susceptibles y si este comportamiento ocurre para las diferentes especies de salivazos y nematodos entomopatógenos.
Estudios llevados a cabo con otros insectos para determinar el estado de desarrollo más susceptible a nematodos entomopatógenos, muestran resultados disimiles. Koppenhöfer y Fuzy (2004) encontraron que la eficacia de H. bacteriophora disminuyó con el aumento de la edad deAnomala orientalis (Waterhouse, 1875.) (Coleoptera: Scarabaeidae), sin embargo no difirió significativamente entre estadios larvales de P. japonica, por el contrario, Jackson y Brooks (1995) indican que los estadios iniciales de Simulium vittatum (Zetterstedt, 1838) (Diptera: Simuliidae)son menos susceptibles a la infección con S. carpocapsae (58%) que los más desarrollados (97%).
En cuanto a las dosis, se presentaron diferencias significativas en las mortalidades causadas por H. bacteriophora en los estadios I, II y V de A. varia (Tabla 1). En relación con el IV estadio, no se encontraron diferencias significativas entre las especies de nematodos evaluadas (Tabla 1). Resultados similares registran Ferrer et al. (2004) en el control de ninfas de A. varia con H. bacteriophora, quienes al evaluar dosis de 50, 75 y 100 millones de nematodos/ha, no encontraron diferencias significativas en mortalidad. Del mismo modo, Leite et al. (2005) no encontraron diferencias significativas en la mortalidad de ninfas de M. fimbriolata entre dosis de 6,6 x 107 y 3,3 x 109 JI/ha con Heterorhabditis sp., logrando un control de 74% bajo condiciones de campo. También con otras especies de nematodos Steinernema carpocapsae, S. feltiae Filipjev, 1934, S. riobravis Cabanillas, Poinar & Raulston, 1994y Heterorhabditis amazonensis RSC1, Batista y Machado (2010), no encontraron diferencias significativas en la mortalidad de ninfas de M. spectabilis en función de la concentración empleada entre 2000 y 4000 JI/ml.
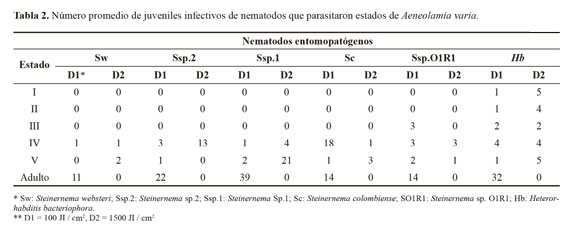
En cuanto a la penetración de los nematodos entomopatógenos y para el caso específico de H. bacteriophora, el cual causó la mayor mortalidad en todos los estados ninfales y fue la única especie que infectó ninfas de los estadios I y II, no se observaron incrementos en los JI a medida que se evaluaron ninfas de mayor edad (Tabla 2).
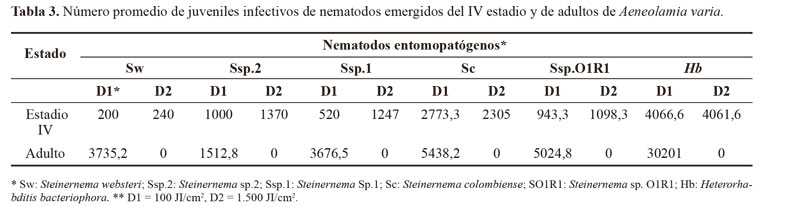
La reproducción de los nematodos solo se registró en ninfas de IV estadio, debido a que fue donde se presentó la mayor mortalidad y, por lo tanto, los insectos muertos permitieron hacer observaciones sobre penetración y reproducción de los nematodos. La mayor producción de nematodos se registró con H. bacteriophora lográndose 4066,6 y 4061,6 JI/ninfa aplicando una dosis de 100 y 1500 JI/cm2, respectivamente (Tabla 3). La mayor producción que se observó con H. bacteriophora, pudo ocurrir debido a la capacidad de reproducirse con tan solo un nematodo que penetre en el cuerpo del insecto, ya que su primera generación es hermafrodita, caso contrario con los Steinernematidae los cuales necesitan aparearse para reproducirse. La sintomatología observada en las ninfas muertas fue flacidez, malformación, detención de la metamorfosis a adulto y coloración rojiza para el caso de H. bacteriophora (Fig. 2).
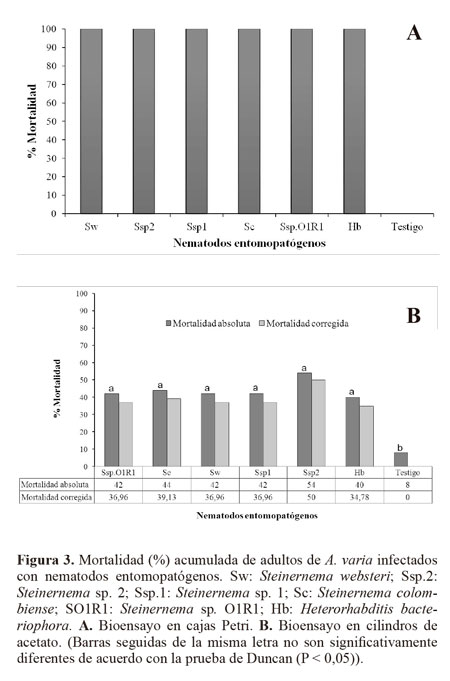
Bioensayos de virulencia sobre adultos de A. varia. El estado adulto de A. varia es susceptible a todas las especies de nematodos evaluadas bajo condiciones de laboratorio. No se encontraron diferencias estadísticas significativas en el porcentaje de mortalidad entre las especies de nematodos (F = 19,4; g.l = 6; P < 0,0001). La mayor mortalidad se presentó cuando los adultos se encontraban en contacto permanente con los nematodos, en los bioensayos en cajas Petri (Fig. 3A). Al respecto, Gaugler et al. (1997) mencionan que en una caja Petri las condiciones físicas son ideales y el contacto huésped-parásito está asegurado, mientras que los nematodos cuando se aplican sobre el follaje son rápidamente inactivados por la desecación, la radiación solar y temperaturas extremas. Para el bioensayo en cilindros de acetato, las condiciones no son apropiadas para el nematodo ya que los adultos de A. varia tienen menor probabilidad de entrar en contacto con los nematodos, ya que estos permanecen alimentándose del follaje y los nematodos se desecan rápidamente y no se movilizan fácilmente como lo harían en el suelo. Esta situación se reflejó con una menor mortalidad que fluctuó entre 40 y 54%, y solo los nematodos pudieron entrar en contacto con los adultos del salivazo cuando se asperjaron y las hembras de A varia se desplazaron a ovipositar al suelo (Fig. 3B).
Los JI´s de todas las especies de nematodos evaluadas se reprodujeron en los adultos de A. varia. La mayor producción de JI se presentó con H. bacteriophora con un promedio de 30.201 JI/adulto (Tabla 3). La mortalidad registrada en este estudio, sugiere que estos nematodos pueden tener potencial en el control de adultos de A. varia, bajo condiciones de campo, cuando estos inician su emergencia y se dirigen al suelo a ovipositar.
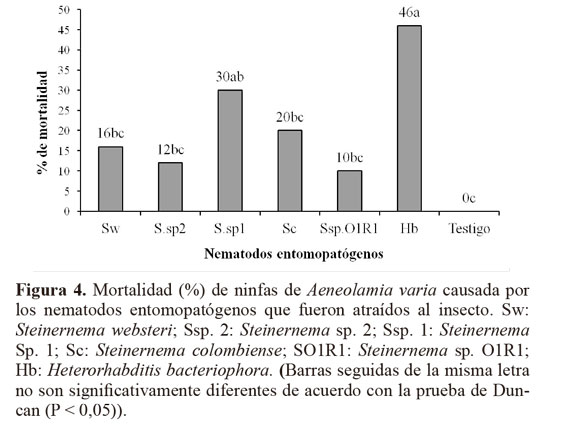
Capacidad de búsqueda. En relación con la prueba de movilidad de los nematodos hacia la zona de presencia de ninfas de A. varia, se encontraron diferencias estadísticas significativas, en las secciones del cilindro más cercanas a las ninfas (desplazamiento positivo) (P = 0,0001) y en la zona donde no se movieron (estático) (P = 0,0002, respectivamente) pero no hubo diferencias en relación con los que se dirigieron en forma contraria a la localización de las ninfas (P = 0,1915) (Tabla 4). Se recuperaron juveniles infectivos en las tres distancias o secciones evaluadas. Todas las especies fueron atraídas y causaron mortalidad a las ninfas de A. varia, destacándose H. bacteriophora y Steinernema sp.1, al causar mortalidades del 46% y 30% (Fig. 4), y desplazamientos de sus poblaciones hacia la ninfas de 56,3% y 77,4%, respectivamente. (Tabla 4). Al diseccionar las ninfas muertas cinco días después de la aplicación se encontraron nematodos en diferentes estados como J4 y adultos de primera generación. El número de JI que lograron penetrar el cuerpo del insecto fluctuó entre 3 y 10 (Tabla 5).
El desplazamiento registrado en este estudio pudo ser influido por la atracción de los nematodos hacia los volátiles presentes en la espuma o saliva que las ninfas expulsan una vez que inician su alimentación. En este sentido, Grewal et al. (1993) investigaron la respuesta de nematodos entomopatógenos a las heces de hospederos naturales y de laboratorio y encontraron que los JI de H. bacteriophora y S. glaseri (Steiner, 1929)respondieron positivamente. Por otra parte, las raíces de las plantas desempeñan un papel importante en la atracción de los nematodos ya sea por el CO2, los compuestos que exudan o por compuestos volátiles emitidos en respuesta al ataque de insectos. Al respecto, Gaugler et al. (1980) señalan que los juveniles infectivos de S. carpocapsae son atraídos por el CO2 liberado tanto de las raíces de las plantas como de los insectos hospedantes que se alimentan de éstas. También fue demostrado por Rasmann et al. (2005) demostraron que en las raíces de variedades europeas de maíz, al ser consumidas por larvas de Diabrotica virgifera virgifera (Coleoptera: Chrysomelidae), emiten el sesquiterpeno (E)-β-cariofileno el cual atrae a H. megidis.
Conclusiones
Los nematodos entomopatógenos evaluados penetraron ninfas y adultos de A. varia, se reprodujeron y causaron mortalidad.La mayor mortalidad se obtuvo con H. bacteriophora siendo el estadio ninfal IV el más susceptible. Todos los JI´s evaluados fueron capaces de encontrar ninfas de A. varia ylograron infectarlas, pero se destacaron H. bacteriophora y Steinernema sp.1, causando las mayores mortalidades. Este estudio muestra la posibilidad de avanzar en el control de A. varia con estas especies de nematodos bajo condiciones de campo.
Agradecimientos
Los autores agradecen a Cenicaña, al Ministerio de Agricultura y Desarrollo Rural y la Universidad Nacional de Colombia - sede Palmira, por contribuir a la realización de esta investigación. A Cenicafé por donar cinco especies de nematodos utilizadas en este estudio. Al Centro Agropecuario SENA - Buga, por facilitar sus instalaciones para la realización de esta investigación y Alberto Palma de Cenicaña, por su asesoría en los análisis estadísticos.
Literatura citada
Akhurst, R.; Smith, K. 2002. Regulation and Safety. pp. 311-326. In: Gaugler, R. (Ed.). Entomopathogenic nematology. CAB International 2002. [ Links ]
Batista, E. S. P.; Machado, A. A. 2010. Application methods of entomopathogenic nematodes for control of Mahanarva spectabilis (Hemiptera: Cercopidae). Biocontrol Science and Technology 20 (10): 1079-1085. [ Links ]
BUSTILLO P., A. E.; CASTRO V., U. 2011. El salivazo de la caña de azúcar Aeneolamia varia (F.) (Hemiptera: Cercopidae). Hábitos, biología y manejo de poblaciones. Cali, Cenicaña. Serie Divulgativa No. 11, 16 p. [ Links ]
COBB, N. A., 1918. Estimating the nematode population of the soil. Agricultural Technology Circular I, Bureau of Plant Industry, USDA 1: 1-48. [ Links ]
Cui, L.; Gaugler, R.; Wang, Y. 1993. Penetration of steinernematid nematodes (Nematoda: Steinernematidae) into Japanese beetle larvae, Popillia japonica (Coleoptera: Scarabaeidae). Journal of Invertebrate Pathology 62 (1): 73-78. [ Links ]
Eidt, D. C.; Thurston, G. S. 1995. Physical deterrents to infection by entomopathogenic nematodes in wireworms (Coleoptera: Elateridae) and other soil insects. Canadian Entomology 127 (3): 423-429. [ Links ]
Ferrer, F; Arias, M; Trelles, A; Palencia, G;Navarro, M. J.; Colmenarez, R. 2004. Posibilidades del uso de nematodos entomopatógenos para el control de Aeneolamia varia en caña de azúcar. Manejo Integrado de Plagas y Agroecología (Costa Rica) 72: 39-43. [ Links ]
GAUGLER, R.; LEBECK, L.; NAKAGAKI, B.; BOUSH, G. M. 1980. Orientation of the entomogenous nematode Neoaplectana carpocapsae to dioxide. Environmental Entomology 9 (5): 649-651. [ Links ]
Gaugler, R.; Lewis, E.E.; Stuart, R. J. 1997. Ecology in the service of biological control: the case of entomopathogenic nematodes. Oecologia 109: 483-489. [ Links ]
Georgis, R.; Hague, N. G. M.1981. A neoaplectanid nematode in the larch sawfly Cephalcia lariciphila (Hymenoptera: Pamphiliidae). Journal of Applied Biology 99 (2): 171-177. [ Links ]
Glazer, I. 1996. Survival mechanisms of entomopathogenic nematodes. Biocontrol Science and Technology 6 (3): 373-378. [ Links ]
Gómez, L. A. 2007. Manejo del salivazo Aeneolamia varia en cultivos de caña de azúcar en el Valle del rio Cauca. En: Carta trimestral. Cenicaña 29 (2 y 3): 10-17. [ Links ]
GREWAL, P. S.; GAUGLER, R.; SELVAN, S. 1993. Host recognition by entomopathogenic nematodes: Behavioral response to contact with host feces. Journal of Chemical Ecology 19 (6): 1219-1231. [ Links ]
Ishibashi, N.; Kondo, E. 1990. Behavior of infective juveniles. pp. 139-150. In: Gaugler R.; Kaya, H. K. (Eds.). Entomopathogenic nematodes in biological control. Boca Raton, CRC Press. [ Links ]
Jackson, J. J.; Brooks, M. A. 1995. Parasitism of western corn rootworm larvae and pupae by Steinernema carpocapsae. Journal of Nematology 27 (1): 15-20. [ Links ]
Kaya, H. K. 1985. Susceptibility of early larval stages of Pseudalletia unipuncia and Spodoptera exigua (Lepidoptera: Noctuidae) to the entomogenous nematode Steinernema feltiae (Rhabditida: Steinernematidae). Journal of Invertebrate Pathology 46 (1): 58-62. [ Links ]
Kaya, H. K. 1990. Soil ecology. pp. 93-115. In: Gaugler R.; Kaya, H. K. (Eds.). Entomopathogenic nematodes in biological control. Boca Raton, CRC Press. [ Links ]
Kaya, H. K.; Koppenhöfer, A. M. 1996. Effects of microbial and other antagonistic organism and competition on entomopathogenic nematodes. Biocontrol Science and Technology 6: 357-371. [ Links ]
Kaya, H. K.; Stock, S. P. 1997. Techniques in insect nematology.pp. 281-324. In: Lawrence L. (Ed.). Manual of techniques in insect pathology. Academic Press, Inc. San Diego. Chapter, 6. [ Links ]
Koppenhöfer, A. M.; Fuzy, E. M. 2004. Effect of white grub developmental stage on susceptibility to entomopathogenic nematodes. Journal of Economic Entomology 97 (6): 1842-1849. [ Links ]
Leite, L. G.; Machado, L. A.; Aguillera, M. M.; RodrÍguez, R. C. D.; Negrisoli A. S. 2002. Patogenicidade de Steinernema e Heterorhabditis (Nematoda: Rhabditida) contra ninfas da cigarrinha-das-raízes da cana-de-açúcar, Mahanarva fimbriolata (Hemiptera: Cercopidae). Revista de Agricultura 78: 139-148. [ Links ]
Leite, L. G.; Machado, L. A.; Goulart, R. M; Tavares, F. M; Batista- Filho, A. 2005. Screening of entomopathogenic nematodes (Nemata: Rhabditida) and the efficiency of Heterorhabditis sp., against the sugar cane root spittlebug Mahanarva fimbriolata (Fabr.) (Hemiptera: Cercopidae). Neotropical Entomology 34 (5): 785-790. [ Links ]
Lewis, E. E; Gaugler, R. 1994. Entomopathogenic nematode (Rhabditida: Steinernematidae) sex ratio relates to foraging strategy. Journal of Invertebrate Pathology 64: 238-242. [ Links ]
LÓPEZ N., J. C. 2008. Nematodos para el control de insectos plagas. Capitulo 10, pp. 150-183. En: Bustillo P., A. E. (Ed.). Los insectos y su manejo en la caficultura colombiana. FNC - Cenicafé, Chinchiná (Colombia). Editorial Blancolor Ltda., Manizales, 466 p. [ Links ]
MURASHIGE, T.; SKOOG, F. 1962. A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiologia Plantarum 15: 473-497. [ Links ]
Quintero, J. C.; López, J. C.; Aristizabal, L. F. 2007. Susceptibilidad del salivazo de los pastos Aeneolamia sp., a nematodos entomopatógenos nativos. Manizales, Colombia. Universidad de Caldas. Fitotecnia No. 125. 2 p. [ Links ]
RASMANN, S.; KÖLLNER, G. T.; DEGENHARDT, J.; HILTPOLD, I.; TOEPFER, S.; KUHLMANN, U.; GERSHENZON, J.; TURLINGS, T. C. J. 2005. Recruitment of entomopathogenic nematodes by insect-damaged maize roots. Nature 434: 732-737. [ Links ]
REALPE A., F. J.; BUSTILLO P., A. E.; LÓPEZ N., J. C. 2007. Optimización de la cría de Galleria mellonella (L.) para la producción de nematodos entomopatógenos parásitos de la broca del café. Revista Cenicafé 58 (2): 142-157. [ Links ]
Rovesti, L.; DESEO, K. V. 1990. Compatibility of chemical pesticides with the entomopathogenic nematodes, Steinernema carpocapsae Weiser and S. feltiae Filipjev (Nematoda: Steinernematidae). Nematologica 36 (9): 237-245. [ Links ]
Salazar, J., Proaño, L. 1989. Pérdidas ocasionadas por la candelilla de la caña de azúcar (Aeneolamia varia) en el área de influencia del central Río Turbio: Estudio comparativo de las zafras 84/85 y 85/86. Revista Caña de azúcar (Venezuela) 7 (2): 49-54. [ Links ]
SAS. 2005. SAS Institute, software package. Cary, North Carolina, EEUU. [ Links ]
SCHNEIDER-ORELLI, O. 1947. Entomologisches praktikum. Einfühung in die land- und forstwirtschaftliche Insektenkunde. Aarau, Sauerländer published. 237 p. Disponible en: http://www.ehabsoft.com/ldpline/HschneiOrli.htm [Fecha revisión: 02 agosto 2001]. [ Links ]
Sendoya, C. A.; RamÍrez, G. D.; Bustillo, A. E.; Castro, U. 2011. Biología de Aeneolamia varia (F.) (Hemiptera: Cercopidae) en caña de azúcar en el Valle del Cauca. En: Resúmenes, Congreso Sociedad Colombiana de Entomología. 38. Manizales, Julio 27-29, 2011. [ Links ]
Stehr, F. W. 1987. Immature insects. Stehr, F. W. (Ed.). Publisher: Kendall / Hunt, volume 1, 754 p. [ Links ]
Tanada, Y.; Kaya, H. K. 1993. Nematodes, nematomorphs, and plathelminthes. pp. 459-491. In: Tanada, Y.; Kaya, H. K. (Eds.). Insect pathology. Chapter 13. Academic Press. San Diego, USA, 666 p. [ Links ]
Thompson, V.; González, R. L. 2005. La identificación y distribución de los salivazos de la caña de azúcar y los pastos (Homoptera: Cercopidae) en Costa Rica. Manejo Integrado de Plagas y Agroecología (Costa Rica) 75: 43-51. [ Links ]