Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.2 Bogotá July/Dec. 2012
Charipinos de Colombia (Hymenoptera: Figitidae),
con la descripción de dos nuevas especies
Charipines from Colombia (Hymenoptera: Figitidae), with the description of two new species
MAR FERRER-SUAY1, JESÚS SELFA2 y JULI PUJADE-VILLAR1
1 Ph. D. and Ph. D. student. Universitat de Barcelona, Facultad de Biología, Departamento de Biología Animal. Avda. Diagonal 645, 08028-Barcelona, España. mar.ferrer.suay@gmail.com, autor para correspondencia; jpujade@ub.edu
2 Ph. D. Universitat de València, Facultat de Ciències Biològiques, Departament de Zoologia. Campus de Burjassot-Paterna, Dr. Moliner 50, E-46100 Burjassot (Valencia), España, jesus.selfa@uv.es
Recibido: 30-ene-2012 - Aceptado: 1-nov-2012
Resumen: Se estudió la fauna de charipinos (Hymenoptera: Figitidae) presentes en Colombia a partir de colectas realizadas en trampa Malaise por el Instituto Humboldt en diversos lugares de Colombia merced al proyecto Biodiversidad Insectos de Colombia durante los años 2000-2004. Se identificaron un total de ocho especies. Seis especies se citan por primera vez para el país: Alloxysta arcuata, A. castanea, A. hansoni, A. obscurata, A. pilipennis y Phaenoglyphis villosa. Se describen dos nuevas especies para la ciencia: Alloxysta medinae n. sp. y Alloxysta torresi n. sp. Se citan por primera vez para la región neotropical: A. obscurata y A. pilipennis; además A. arcuata, A. castanea y A. pilipennis por primera vez en el continente americano. Se incluye una clave para la identificación de las especies presentes en Colombia. Se aumenta la distribución geográfica de algunas especies paleárticas.
Palabras clave: Charipinae. Alloxysta. Phaenoglyphis. Neotropical. Fauna. Insectos.
Abstract: The fauna of Figitidae (Hymenoptera: Figitidae) present in Colombia was studied from collections made with Malaise traps by the Humboldt Institute in several places of Colombia thanks to the project “Biodiversidad Insectos de Colombia” over the years 2000-2004. A total of eight species was identified. Six species were cited for the first time in the country: Alloxysta arcuata, A. castanea, A. hansoni, A. obscurata, A. pilipennis and Phaenoglyphis villosa. Two new species are described: Alloxysta medinae n. sp. and Alloxysta torresi n. sp. Two species are cited for the first time from a neotropical region: Alloxysta obscurata and A. pilipennis; and A. arcuata, A. castanea and A. pilipennis are cited for the first time from the American continent. A key is included for the identification of the species present in Colombia. The geographic distribution of some Palearctic species is broadened.
Key words: Charipinae. Alloxysta. Phaenoglyphis. Neotropical. Fauna. Insects.
Introducción
La taxonomía de los charipinos (Hymenoptera: Figitidae) ha sido desde siempre muy complicada. Por un lado, influyen de manera considerable sus características morfológicas, se trata de individuos de muy pequeño tamaño con un cuerpo prácticamente liso y brillante, lo cual limita el número de caracteres diagnósticos empleados para su identificación. Por otro lado, hay que tener en cuenta el gran número de especies que han sido descritas desde que fue publicada la primera de ellas: Alloxysta victrix (Westwood, 1833). Además, la mayoría son descripciones muy sucintas que hace, que en ocasiones, los límites específicos no estén muy claros. Esto ha llevado a establecer un grupo de estudio desde la Universidad de Barcelona, encargado de examinar todos los tipos de las especies descritas.
Los charipinos se caracterizan biológicamente por ser parasitoides secundarios de pulgones vía Aphidiinae (Hymenoptera: Braconidae) y Aphelininae (Hymenoptera: Aphelinidae) o bien parasitoides secundarios de psílidos vía Encyrtidae (Hymenoptera: Chalcidoidea). Poco se conoce hasta el momento sobre las interacciones tróficas entre los charipinos y sus hospedadores. Como hiperparasitoides pueden alterar el correcto control biológico realizado por los parasitoides primarios siendo capaces de disminuir su abundancia y modificar su comportamiento dando como resultado un aumento significativo de las poblaciones de hospedadores (Müller et al. 1999; van Veen et al. 2001). Sin embargo, en ocasiones pueden actuar de manera reguladora para mantener ambas poblaciones en equilibrio (Bennett 1981; Starý 1970).
La subfamilia Charipinae está ampliamente distribuida por todo el mundo, puesto que han sido citados ejemplares en todos los continentes. Hasta el momento ocho géneros son considerados como válidos: Alloxysta Förster, 1869 (cosmopolita), Phaenoglyphis Förster, 1869 (cosmopolita), Lytoxysta Kieffer, 1909 (región neártica), Lobopterocharips Paretas-Martinez & Pujade-Villar, 2007 (región Oriental), Dilyta Förster, 1869 (cosmopolita), Apocharips Fergusson, 1986 (cosmopolita, no citada de la región australiana), Dilapothor Paretas-Martinez & Pujade-Villar, 2006 (región australiana) y Thoreauana Girault, 1930 (región australiana).
El objetivo de este trabajo es el estudio de las especies de los géneros Alloxysta y Phaenoglyphis presentes en Colombia. Estos géneros son los de mayor riqueza específica y con mayor rango de distribución dentro de la subfamilia.
Materiales y Métodos
El material estudiado (78 ejemplares) fue obtenido quincenalmente entre 2000-2004 con trampas Malaise en el marco del Proyecto Biodiversidad Insectos de Colombia asociado al Instituto Humboldt. El material está depositado en el Instituto Alexander von Humboldt (IAvH, Villa de Leiva, Colombia) y en la colección Pujade-Villar (UB - Universitat de Barcelona, Barcelona, España).
Los especímenes fueron estudiados usando los microscopios estéreo Nikon modelo SMZ-1 y electrónico ambiental de barrido. FEI Quanta 200 ESEM empleado para obtener imágenes de alta resolución a bajo voltaje (12-15 kV) sin cubrimiento de oro de los especímenes.
En la terminología de las estructuras morfológicas se siguió el trabajo de Paretas-Martínez et al. (2007a). Las abreviaciones incluyen F1–F12, primer y siguientes flagelómeros.
Las especies que no constituyen novedad para la ciencia se acompañan de una diagnosis, las nuevas especies de descripciones y figuras que ilustran sus caracteres diagnósticos. En las observaciones se indican los caracteres que diferencian cada especie de otras similares.
Resultados
Seis especies se citan por primera vez para Colombia, de las que cinco pertenecen al género Alloxysta: A. arcuata (Kieffer, 1902), A. castanea (Hartig, 1841), A. hansoni Pujade-Villar, 2011, A. obscurata (Hartig, 1840), A. pilipennis (Hartig, 1840) y solo una al género Phaenoglyphis: P. villosa (Hartig, 1841). Se describen en este trabajo dos nuevas especies para la ciencia: Alloxysta medinae Ferrer-Suay & Pujade-Villar n. sp. y Alloxysta torresi Ferrer-Suay & Pujade-Villar n. sp. Alloxysta fuscicornis (Hartig, 1841) es la única especie de la subfamilia Charipinae previamente citada en este país (Pujade-Villar et al. 2010) por lo que, después de este estudio, un total de 9 especies de charipinos se encuentran en Colombia.
Clave para identificar las nueve especies de Charipinae citadas en Colombia:
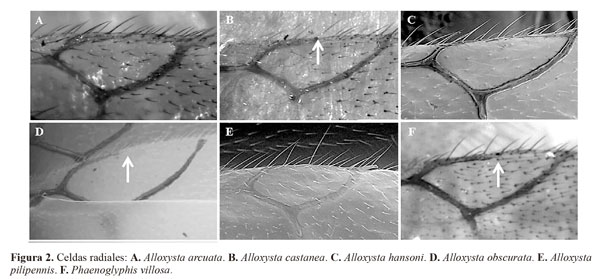
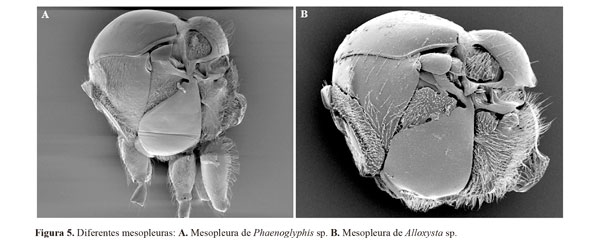
1- Base de la mesopleura con un surco longitudinal (Fig. 5A) .........................................................................Phaenoglyphis
(Una sola especie detectada, P. villosa (Hartig, 1841), caracterizada por ser la única del género con la celda radial parcialmente abierta)
- Mesopleura sin surco longitudinal (Fig 5B).. ................................................................................................... Alloxysta 2
2- Celda radial cerrada (Figs 2A, 2C, 2E).............................3
- Celda radial abierta o parcialmente abierta (Figs. 2B, 2D, 2F). …………………...………....….................................... 7
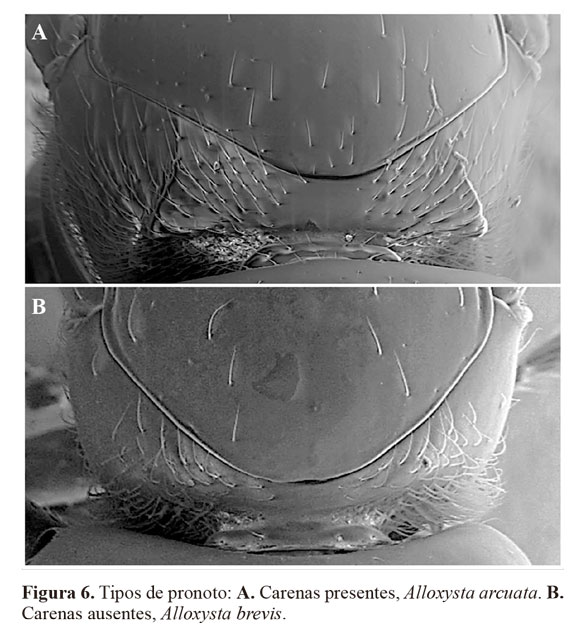
3- Sin carenas en el pronoto (Fig. 6B); celda radial 1,8 veces más larga que ancha (Fig. 4B). Macho desconocido. .............. .............. Alloxysta torresi Ferrer-Suay & Pujade-Villarn. sp.
- Con carenas en el pronoto (Fig. 6A); celda radial mas de 1,8 veces más larga que ancha. …….…...........................… 4
4- Sin carenas en el propodeo; F1-F3 del macho claramente curvados; celda radial 2,7 veces más larga que ancha. ……………….....…….. Alloxysta fuscicornis (Hartig, 1841)
- Con carenas en el propodeo; F1-F3 rectos o ligeramente curvados; celda radial menor que 2,7 veces más larga que ancha. …………….........…………………………….……. 5
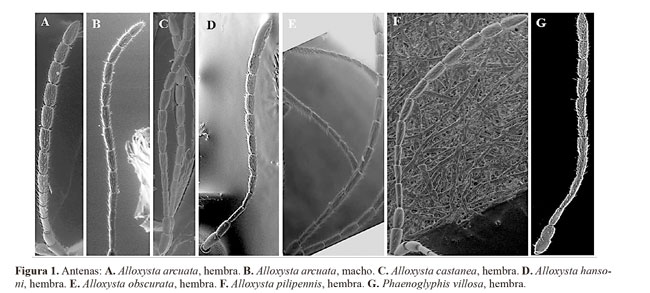
5- Hembra: F1 subigual al pedicelo; F1>F2=F3<F4 (Fig. 1A). Macho: F1 mayor que el pedicelo y F1=F2<F3<F4; F2 ligeramente curvado (Fig. 1B); celda radial 2,2 veces más larga que ancha tanto en el macho como en la hembra (Fig. 2A). ………………………..…. Alloxysta arcuata (Kieffer, 1902)
- F1 mayor que el pedicelo tanto en el macho como en la hembra; flagelómeros con las proporciones anteriores distintas; celda radial mayor que 2,2 veces más larga que ancha. …………..........................................................……...…..... 6
6- Hembra: sensilias y clava inconspicua a partir de F3; F2-F4 subiguales en longitud (Fig. 1F); celda radial 2,5 veces más larga que ancha (Fig. 2E). Carenas en el ápice del escutelo ausentes. Macho desconocido........................................................... ........................................ Alloxysta pilipennis (Hartig, 1840)
- Hembra: sensilias y clava inconspicua a partir de F4 (Fig. 1D); F2<F3<F4; celda radial 2,6 veces más larga que ancha (Fig. 2C). Macho: sensilias y clava inconspicua a partir de F2; F2=F3<F4; celda radial 2,4 veces más larga que ancha. Carena en el ápice del escutelo presentes. ………………...…… ...................................... Alloxysta hansoni Pujade-Villar, 2011
7- Carenas en el pronoto ausentes (Fig. 3E); celda radial completamente abierta (Figs. 3A, 3B). ………..............................
…..… Alloxysta medinae Ferrer-Suay & Pujade-Villarn. sp.
- Carenas en el pronoto presentes; celda radial parcialmente abierta. …………………..…….............................…….…. 8
8- Macho y hembra: sensilias y clava inconspicua a partir de F4; F2=F3<F4 (Fig. 1C); ningún flagelómero curvado en el macho; celda radial 2,4 veces más larga que ancha (Fig. 2B). …………....................….. Alloxysta castanea (Hartig, 1841)
- Hembra: sensilias y clava inconspicua a partir de F3; F2=F3<F4 (Fig. 1E). Macho: sensilias y clava inconspicua a partir de F2>F3>F4; F2 ligeramente curvado. Celda radial 2,7 veces más larga que ancha tanto en el macho como en la hembra (Fig.2D).......................................................... ................................................. Alloxysta obscurata (Hartig, 1840)
Alloxysta arcuata (Kieffer, 1902)
Especie erróneamente sinonimizada con A. brevis por Fergusson (1986) como se ha comprobado después de examinar el material tipo (Ferrer-Suay et al. en prensa).
Descripción breve. Cabeza castaño claro (un poco más amarillenta en el macho), mesosoma y metasoma castaño oscuro; escapo, pedicelo, F1 y F2 de color amarillo fuerte y el resto de flagelómeros de color castaño claro; patas amarillas y venación castaño claro amarillento. Antenas de la hembra con trece segmentos; F1 y F2 lisos, más delgados que el resto, sensilias y clava inconspicua a partir de F3, más evidentes a partir de F4; F1 subigual al pedicelo, F1 > F2, F2 subigual a F3, F3 < F4 (Fig. 1A). Antenas del macho con catorce segmentos; F1 liso y más delgado que el resto de flagelómeros, sensilias y clava inconspicua a partir de F2; F1 recto, mayor que el pedicelo, subigual a F2; F2 ligeramente curvado, menor que F3, F3 < F4 (Fig. 1B). Carenas presentes en el pronoto, claramente visibles debajo de la pubescencia. Propodeo con abundante pubescencia; las dos carenas del propodeo forman una placa separada por unas pocas setas en la parte superior, los bordes de la placa están claramente curvados. Alas anteriores sobrepasan el extremo distal del metasoma; celda radial cerrada, 2,2 veces más larga que ancha tanto en el macho como en la hembra (Fig. 2A).
Material examinado: (3♂ & 6♀).COLOMBIA. Magdalena. PNN Sierra Nevada de Santa Marta, El Ramo, 10º48’N 73º39’O, 2500 m, Malaise: 29.i.2001, 15.ii.2001, J. Cantillo Leg. M1283: 1♂ & 1♀ [IAvH]; 15.ii2001, 27.ii.2001, M1284: 1♂ & 1♀ [IAvH); 14.iii.2001, 31.iii.2001, M 1467: 1♂ & 1♀ [UB); 30.iii.2001, 05.v.2001, M.1749: 1♀ [IAvH). Norte de Santander, PNN Tamá, Mun. Toledo. Vda. La Camacha. Pozo Negro, 7º21’N 72º28’O, 2213m, Malaise: 02-14.xi.2003, C. Leal Leg. M 4050: 1♀ [IAvH); 02-05.xi.2003, M 4031: 1♀ [IAvH).
Diagnosis. Alloxysta arcuata se caracteriza principalmente por poseer una celda radial cerrada, carenas en el pronoto, carenas en el propodeo formando una placa y F1 subigual al pedicelo. Esta especie es similar a A. hansoni, A. pilipennis y A. torresi Ferrer-Suay & Pujade-Villar n. sp. todas ellas presentan la celda radial cerrada. Las hembras de Alloxysta arcuata se diferencia fácilmente de A. torresi por el tamaño de la celda radial y la presencia de carenas en el pronoto: la celda radial de A. arcuata es 2,2 veces más larga que ancha (Fig. 2A) y la de A. torresi es 1,8 veces más larga que ancha (Fig. 4B); las carenas del pronoto se encuentran presentes en A. arcuata y ausentes en A. torresi. Las hembras de Alloxysta arcuata se diferencia de las de A. hansoni y A. pilipennis en la longitud relativa de F1 y pedicelo y en el tamaño de la celda radial: F1 es subigual al pedicelo en A. arcuata (Fig. 1A) pero 1.2 veces mayor que el pedicelo en A. hansoni y 1.6 veces más largo en A. pilipennis (Figs 1D, 1F); la celda radial de A. arcuata (Fig. 2A) es 1.1 veces menor que la de A. hansoni y A. pilipennis (Figs 2C, 2E). Los machos de A. arcuata se diferencian de los de A. hansoni en la proporción de los flagelómeros: F1 es subigual a F2 y F2 menor que F3 en A. arcuata (Fig. 1B) en A. hansoni F1 es 1.2 veces mayor que F2 y F2 es subigual a F3.
Distribución. Regiones paleartica y neotropical. Primer registro para Colombia y para el continente americano.
Alloxysta castanea (Hartig, 1841)
Descripción breve. Cabeza amarillenta, mesosoma de color castaño claro y metasoma castaño oscuro; antenas amarillas oscureciéndose gradualmente hacia el extremos; patas y venación amarillo claro. Antenas de la hembra con trece segmentos; F1-F3 lisos y más delgados que el resto de flagelómeros, sensilias y clava inconspicua presentes a partir de F4; F1 > pedicelo y F2; F2 subigual a F3; F3 < F4 (Fig. 1C). Antenas del macho con catorce segmentos, similares a las de la hembra con todos los flagelómeros rectos. Pronoto cubierto por setas, escasas en los márgenes distolaterales y con dos carenas claramente visibles. Propodeo cubierto por gran cantidad de setas y con dos carenas unidas formando una placa, unas pocas setas en la parte superior de la placa y los márgenes de ésta ligeramente curvados. Alas anteriores sobrepasan el extremo distal del metasoma; celda radial parcialmente abierta, 2,4 veces más larga que ancha (Fig. 2B).
Material examinado: (1♀).COLOMBIA. Boyacá, SFF Iguaque, Lagunillas, 5º25’N 73º27’O, 3380m, Malaise, 16.iv.02.ii.2001, P. Reina Leg. M1738: 1♀ [IAvH].
Diagnosis. Alloxysta castanea se caracteriza principalmente por poseer una celda radial parcialmente abierta, carenas en el pronoto, carenas en el propodeo formando una placa, F1 mayor que el pedicelo y F2, F2 subigual a F3. Esta especie es similar a A. obscurata también presente en Colombia por su celda radial parcialmente abierta, las hembras de A. castanea se diferencian de las de A. obscurata por la presencia de sensilias a partir de F4 (Fig. 1C) y de F3 en A. obscurata (Fig. 1E); la celda radial de A. castanea es 2,4 veces más larga que ancha (Fig. 2B) la de A. obscurata es 2,7 veces más larga que ancha (Fig. 2D). Los machos de ambas especies se diferencian principalmente en la proporción entre flagelómeros: en A. castanea F2 es subigual a F3 y F3 menor que F4 pero en A. obscurata F2 es mayor que F3 y F3 es mayor que F4.
Distribución. Regiones paleártica y neotropical. Primer registro para Colombia y para el continente americano.
Alloxysta hansoni Pujade-Villar, 2011
Descripción breve. Cabeza de color castaño claro, mesosoma y metasoma castaño oscuro; escapo, pedicelo y F1-F2 de color amarillo oscuro, F3-F11 castaños; patas amarillo oscuro y venación de color castaño. Antenas de la hembra con trece segmentos; F1-F3 lisos y más delgados que el resto de flagelómeros, sensilias y clava inconspicua presentes a partir de F4; F1 > pedicelo y F2; F2 < F3 y F3 < F4 (Fig. 1D). Antenas del macho con catorce segmentos; F1 liso y más delgado que el resto, sensilias y clava inconspicua presentes a partir de F2; F1 > pedicelo y F2; F2 subigual a F3 y F3 < F4. Pronoto densamente cubierto por largas setas, se encuentran en menor cantidad en los márgenes distolaterales; con dos gruesas y largas carenas presentes. Propodeo con abundante pubescencia; con dos carenas separadas en los dos tercios superiores por bastantes setas y formando una placa en el tercio inferior, con los bordes curvados. Ala más larga que el cuerpo; celda radial cerrada; 2,6 veces más larga que ancha en la hembra (Fig. 2C) y 2,4 en el macho.
Material examinado: (6♂ & 32♀).COLOMBA. Boyacá, SFF Iguaque, Cabaña Mamarramos, 5º25’N 73º27’O, 2855m, Malaise, 08-25.vi.2000, P. Reina Leg. M184: 1♀ [UB]. Cauca, PNN Munchique, Sector La Romelia, Zona abierta, 2º38’N 76º54’O, 2640m, Malaise, 09/04/2004, 25/04/2004, H. Pino Leg. M4536: 1♀ [UB]. Magdalena, PNN Sierra Nevada de Santa Marta, El Ramo, 10º48’N 73º39’O, 2500m, Malaise, 27.ii.14.iii.2001, J. Cantillo, Leg. M1471: 2♂ & 3♀ [IAvH]; 29.i.2001, 15.ii.2001, J. Cantillo Leg. M1283: 7♀ [UB]; 15.ii.2001, 27.ii.2001, J. Cantillo Leg. M1284: 3♂ & 7♀ [IAvH]; 14.iii.2001, 31.iii.2001, J. Cantillo Leg. M 1467: 1♀ [IAvH]; 30/03/2001, 05/05/2001, J. Cantillo Leg. M.1749: 11♀ [IAvH]. Norte de Santander, PNN Tamá, Mun. Toledo. Vda. La Camacha. Pozo Negro, 7º21’N 72º28’O, 2213m, Malaise, 02-14.xi.2003, C. Leal Leg. M 4050: 1♂ & 1♀ [UB]; 02-05.xi.2003, C. Leal Leg. M4031: 1♀ [IAvH].
Diagnosis. Alloxysta hansoni se caracteriza principalmente por poseer celda radial cerrada, carneas en el pronoto, carenas en el propodeo formando una placa y F1 mayor que el pedicelo y F2. Esta especie es similar a A. arcuata, A. pilipennis y A. torresi por presentar la celda radial cerrada. Las hembras de A. hansoni se diferencian de las de A. torresi en el tamaño de la celda radial y en la presencia de carenas en el pronoto: la celda radial de A. hansoni es 2,6 veces más larga que ancha (Fig. 2C) mientras que la de A. torresi es 1,8 veces más larga que ancha (Fig. 4B); A. hansoni presenta carenas en el pronoto claramente visibles pero A. torresi no presenta. Las hembras de A. hansoni se diferencian de las de A. arcuata en el tamaño de la celda radial y la relación entre F1 y el pedicelo: la celda radial de A. hansoni es 2,6 veces más larga que ancha (Fig. 2C) y la de A. arcuata es 2,2 veces más larga que ancha (Fig. 2A); A. hansoni posee el F1 mayor que el pedicelo (Fig. 1D) pero en A. arcuata el F1 es subigual al pedicelo (Fig. 1A). Los machos de A. hansoni se diferencian de los de A. arcuata en la proporción de los flagelómeros: F1 es mayor que F2 y F2 es subigual a F3 en A. hansoni mientras que F1 es subigual a F2 y F2 menor que F3 en A. arcuata (Fig. 1B). Alloxysta hansoni se diferencia de A. pilipennis en la parte del flagelo antenal donde comienza a diferenciarse la clava y por la presencia de sensilias a partir de F4 en A. hansoni (Fig. 1D) y a partir de F3 en A. pilipennis (Fig. 1F); F3 es menor que F4 en A. hansoni (Fig. 1D) pero son subiguales en A. pilipennis (Fig. 1F).
Distribución. Región neotropical. Primer registro para Colombia.
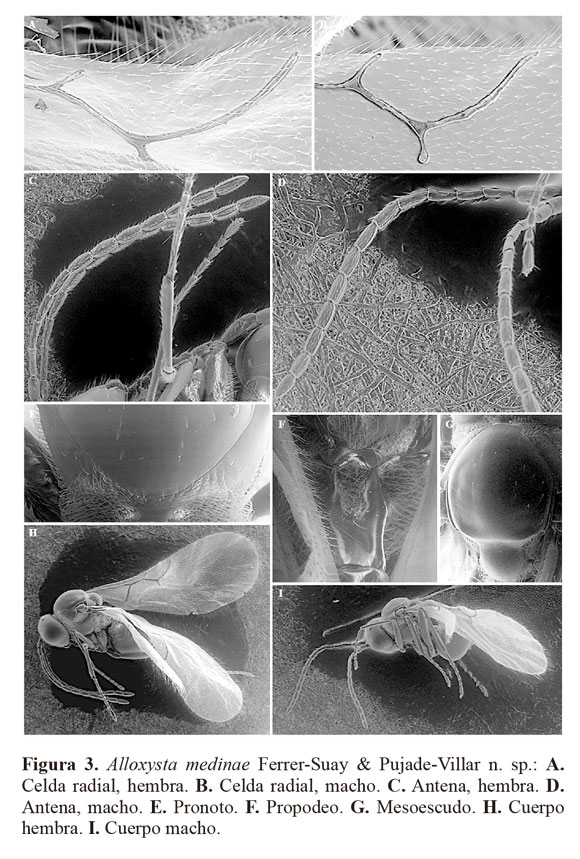
Alloxysta medinae Ferrer-Suay & Pujade-Villarn. sp.
(Fig. 3)
Diagnosis. La celda radial la diferencia de todas las otras especies conocidas presentes en Colombia por ser completamente abierta, las venas R1 y Rs no alcanzan el margen del ala (Figs 3A, 3B).
Descripción
Longitud. Hembra. 1,1-1,4 mm. Macho 0,7-1,1 mm.
Coloración. Cabeza, mesosoma y metasoma de color castaño oscuro. Escapo castaño claro, pedicelo-F2 de color amarillo fuerte y F3-F12 castaño claro. Patas amarillo fuerte y venación de color castaño claro.
Cabeza. Transversalmente ovalada, lisa y brillante, un poco más ancha que larga en visión frontal. Setas presentes por debajo y entre los toruli, sin setas sobre ellos. Pocas o ninguna seta en el vértex y abundantes setas en la cara. Línea transfacial 1,1 veces la altura del ojo compuesto. Espacio malar 0,5 veces la altura del ojo compuesto.
Antenas. Hembra. Trece segmentos, filiforme. Antenómeros cubiertos por abundantes setas. F1-F2 lisos y más delgados que el resto de flagelómeros; presencia de sensilias y placa inconspicua a partir de F3 (en ocasiones clava más evidente a partir de F4). Pedicelo 2,2 veces más largo que ancho; F1 5,0 veces más largo que ancho; F2 3,6 veces más largo que ancho; F3 3,1 veces más largo que ancho; F4 2,6 veces más largo que ancho. F1 1,4 veces más largo que el pedicelo; F1 1,2 veces más largo que F2; F2 subigual a F3; F4 1,2 veces más largo que F3 (Fig. 3C). Macho. Catorce segmentos, filiforme. Antenómeros cubiertos por abundantes setas. F2 y F3 ligeramente curvados. F1-F2 lisos y más delgados que el resto de flagelómeros; presencia de sensilias y placa inconspicua a partir de F3. Pedicelo 1,7 veces más largo que ancho; F1 3,9 veces más largo que ancho; F2 3,1 veces más largo que ancho; F3 3,1 veces más largo que ancho; F4 2,8 veces más largo que ancho. F1 1,3 veces más largo que el pedicelo; F1 1,2 veces más largo que F2; F2 subigual a F3; F4 1,1 veces más largo que F3 (Fig. 3D).
Mesosoma. Pronoto enteramente cubierto por gran cantidad de setas, siendo éstas más abundantes en la zona anterior, no se observan carenas (Fig. 3E). Mesoescudo liso y brillante, redondeado en vista dorsal con setas dispersas. Escutelo también liso y brillante con abundantes setas en el ápex (Fig. 3G). Altura del triángulo mesopleural a lo largo del margen anterior 1,5 veces la altura del mesopleuron. Propodeo con abundante pubescencia, con dos carenas presentes bien definidas y separadas por bastantes setas en el tercio superior y unidas formando una placa con unas pocas carenas en los dos últimos tercios (Fig. 3F).
Ala. Sobrepasa el extremo distal del metasoma; 1,6 veces más larga que el mesosoma y metasoma juntos en la hembra, 1,8 veces en el macho. Cubierta por abundante pubescencia y con setas marginales presentes. Celda radial completamente abierta, 2,5 veces más larga que ancha en la hembra (Fig. 3A) y 2,3 en el macho. R1 pequeña y ligeramente curvada sin alcanzar el margen del ala; Rs mucho más larga y también curvada sin alcanzar el margen del ala (Fig. 3B).
Metasoma. Parte proximal con un anillo incompleto de setas, faltan en una pequeña zona de la parte dorsal y son abundantes en los laterales. Resto del metasoma liso y brillante, con los terguitos claramente visibles.
Material tipo (4♂ & 19♀). HOLOTIPO ♀ (depositado en IAvH):COLOMBIA. Boyacá, SFF Iguaque, Lagunillas, 5º25’N 73º27’O, 3380m, Malaise, 16.iv.02.ii.2001, P. Reina Leg. M1738. PARATIPOS: (4♂ & 18♀).COLOMBIA. Boyacá, SFF Iguaque, Lagunillas, 5º25’N 73º27’O, 3380m, Malaise, 16.iv.02.ii.2001, P. Reina Leg. M1738: 1♀ [IAvH]. Boyacá, SFF Iguaque, La Planada, 5º25’N 73º27’O, 2850m, Malaise: 21.i.07.ii.2001, P. Reina Leg. M1249: 1♀, 01.xi.2000, 13/11/2000, P. Reina Leg. M827: 2♀ [IAvH]. Boyacá, SFF Iguaque, Cabaña Mamarramos, 5º25’N 73º27’O, 2855m, Malaise: 21.xii.2000, 07.i.2001, P. Reina Leg. M1072: 1♀ [IAvH]; 07-21.i.2001, P. Reina Leg. M1252: 4♀ [IAvH]; 08-25.vi.2000, P. Reina Leg. M184: 2♀ [IAvH]. Cauca, PNN Munchique, Sector La Romelia, Zona abierta, 2º38’N 76º54’O, 2640m, Malaise, 09/05/2004, 24/05/2004, H. Pino Leg. M4593: 1♂ [IAvH]. Cauca, PNN Gorgona, El Roble, 2º58’N 78º11’O, 130m, Malaise, 12.vi.2001, 27.vi.2001, H. Torres Leg. M1996: 1♂ [IAvH]. Cundinamarca, PNN Chingaza, Charrascales, 4º31’N 73º45’O, 2990m, Malaise, 15-28.xi.2001, L. Cifuentes Leg. M2550: 1♀ [IAvH]. Magdalena, PNN Tayrona, Cañaveral, 11º20’N 74º2’O, 30m, Malaise, 28.vi.17.vii.2000, R. Henriquez, Leg. M302: 1♀ [IAvH]. Magdalena, PNN Sierra Nevada de Santa Marta, El Ramo, 10º48’N 73º39’O, 2500m, Malaise: 29.i.2001, 15.ii.2001, J. Cantillo Leg. M1283: 1♀ [UB]; 14.iii.2001, 31.iii.2001, J. Cantillo Leg. M1467: 2♀ [UB]; 27.ii.14.iii.2001, J. Cantillo, Leg. M1471: 1♀ [UB]. Boyacá, SFF Iguaque, Lagunillas, 5º25’N 73º27’O, 3380m, Malaise: 09-28.iii.2001, P. Reina Leg. M1511: 1♀ [UB]; 28.iii.16.iv.2001, P. Reina Leg. M1515: 1♂ [UB]. Norte de Santander, Mun. Cucutilla Vda. Carrizal, Cuenca Qda. Poveda, 7º29’N 72º51’O, 2100m, Malaise, 18.iii.03.iv.2002, A. Santamaría Leg. M3106: 1♂ [UB].
Distribución. Neotrópico: Colombia.
Etimología. El nombre de esta especie está dedicado a nuestra amiga Claudia A. Medina Uribe, Investigadora Senior del IAvH e Investigadora Adjunta de colecciones, como agradecimiento por el envío del material y atención prestada durante muestra estancia en Villa de Leiva.
Alloxysta obscurata (Hartig, 1840)
Descripción breve. Cabeza, mesosoma y metasoma castaño oscuro; escapo, pedicelo, F1 y F2 de color amarillo oscuro, el resto de flagelómeros de color castaño claro; patas amarillo tostado y venación castaña. Antenas de la hembra con trece segmentos; F1 y F2 lisos y más delgados que el resto, sensilias y clava inconspicua presentes a partir de F3; F1 > pedicelo, F1 > F2, F2 subigual a F3 y F3 < F4 (Fig. 1E). Antenas del macho con catorce segmentos; F1-F3 lisos y más delgados que el resto, sensilias y clava inconspicua presentes a partir de F4; F2 ligeramente curvado; F1 > pedicelo y F2, F2 > F3 y F3 > F4. Pronoto densamente cubierto por largas setas, con dos carenas largas y gruesas claramente visibles. Propodeo con abundante pubescencia sin carenas presentes. Alas anteriores sobrepasan el extremos distal del metasoma; celda radial parcialmente abierta, 2,7 veces más larga que ancha (Fig. 2D).
Material examinado: (1♀).COLOMBIA. Boyacá, SFF Iguaque, Lagunillas, 5º25’N 73º27’O, 3380m, Malaise, 28.iii.16.iv.2001, P. Reina Leg. M1515 [IAvH].
Diagnosis. Alloxysta obscurata se caracteriza principalmente por poseer una celda radial parcialmente abierta, carenas en el pronoto, ausencia de carenas en el propodeo, F1 mayor que el pedicelo y F2 subigual a F3. Esta especie es similar a A. castanea porque ambas presentan la celda radial parcialmente abierta, pero las hembras de A. obscurata se diferencian de las de A. castanea en el lugar donde empieza la clava inconspicua y las sensilías, a partir de F3 en A. obscurata (Fig. 1E) y de F4 en A. castanea (Fig. 1C); la celda radial de A. obscurata es 2,7 veces más larga que ancha (Fig. 2D) mientras que la de A. castanea es 2,4 veces más larga que ancha (Fig. 2B). Los machos de ambas especies se diferencian principalmente en la proporción entre flagelómeros, en A. obscurata F2 es mayor que F3 y F3 es mayor que F4 pero en A. castanea F2 es subigual a F3 y F3 menor que F4.
Distribución. Regiones holártica y neotropical. Primer registro para Colombia y para la región neotropical.
Alloxysta pilipennis (Hartig, 1840)
Descripción breve. Cabeza de color amarillo oscuro, mesosoma castaño claro amarillento y metasoma castaño (con la parte distal castaño oscuro casi negro); antenas de color amarillo oscureciéndose gradualmente hacia el extremo; patas amarillo claro y venación castaña clara. Antenas de la hembra con trece segmentos; F1 y F2 lisos y más delgados que el resto, sensilias y clava inconspicua presentes a partir de F3; F1 > pedicelo y F2, F2-F4 subiguales en longitud (Fig. 1F). Antenas del macho con catorce segmentos, similares a las de la hembra, flagelómeros rectos. Pronoto enteramente cubierto por gran cantidad de setas, con dos carenas presentes en ocasiones difíciles de ver bajo la pubescencia. Propodeo cubierto por setas, con dos carenas presentes formando una placa con los bordes curvados. Ala más larga que el cuerpo; celda radial cerrada, 2,5 veces más larga que ancha (Fig. 2E).
Material examinado: (1♂ & 2♀).COLOMBIA. Magdalena, PNN Sierra Nevada de Santa Marta, El Ramo, 10º48’N 73º39’O, 2500m, Malaise, 30.iii.2001, 05.v.2001, J. Cantillo Leg. M.1749: 2♀ [1♀ IAvH, 1♀ UB]; 14.iii.2001, 31.iii.2001, J. Cantillo Leg. M 1467: 1♂ [IAvH].
Diagnosis. Alloxysta pilipennis se caracteriza principalmente por poseer una celda radial cerrada, carenas en el pronoto, carenas en el propodeo formando una placa y F1 mayor que el pedicelo. Esta especies es similar a A. arcuata, A. hansoni y A. torresi porque presentan la celda radial cerrada. Las hembras de A. pilipennis se diferencian de las de A. torresi en el tamaño de la celda radial y en la presencia de carenas en el pronoto: la celda radial de A. pilipennis es 2,5 veces más larga que ancha (Fig. 2E) la de A. torresi es 1,8 veces más larga que ancha (Fig. 4B); A. pilipennis presenta carenas en el pronoto, ausentes en A. torresi. Alloxysta pilipennis se diferencian de A. arcuata en el tamaño de la celda radial y la relación entre F1 y el pedicelo: la celda radial de A. pilipennis es 2,5 veces más larga que ancha (Fig. 2E) y la de A. arcuata es 2,2 veces más larga que ancha (Fig. 2A); A. pilipennis posee el F1 mayor que el pedicelo (Fig. 1F) y en A. arcuata el F1 es subigual al pedicelo (Fig. 1A). Alloxysta pilipennis se diferencia de A. hansoni en la primera de ellas las sensilias comienzan en F3 (Fig. 1F) y en F4 en A. hansoni (Fig. 1D); F3 es subigual a F4 en A. pilipennis (Fig. 1F) pero menor que F4 en A. hansoni (Fig. 1D).
Distribución. Paleártico y neotrópico. Primer registro para Colombia, para la región neotropical y el continente americano.
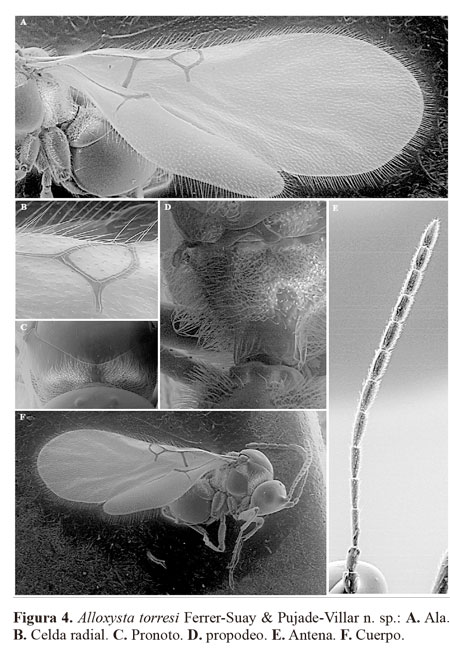
Alloxysta torresi Ferrer-Suay & Pujade-Villarn. sp.
(Fig. 4)
Diagnosis. Alloxysta torresi se caracteriza principalmente por poseer una celda radial cerrada, ausencia de carenas en el pronoto y presencia de carenas formando una placa en el propodeo, F1 mayor que el pedicelo y F2, F2 subigual a F3. Esta especie es similar a A. arcuata, A. hansoni y A. pilipennis porque son las especies presentes en Colombia que poseen la celda radial cerrada, pero se diferencia fácilmente de todas ellas por la ausencia de carenas en el pronoto; mientras que todas poseen carenas en el pronoto claramente visibles en A. torresi éstas están ausentes (Fig. 4C).
Descripción
Longitud. Hembra. 1,3 mm. Macho desconocido.
Coloración. Cabeza, mesosoma y metasoma de color castaño oscuro. Escapo castaño oscuro, pedicelo y flagelómeros de color castaño claro oscureciéndose gradualmente hacia el extremo. Patas amarillas y venación de color castaño claro.
Cabeza. Transversalmente ovalada, lisa y brillante, un poco más ancha que larga en visión frontal. Setas presentes por debajo, entre los toruli, y unas pocas setas sobre ellos. Sin setas en el vértex y abundantes setas en la cara. Línea transfacial 1,1 veces la altura del ojo compuesto. Espacio malar 0,5 veces la altura del ojo compuesto.
Antenas. Hembra. Trece segmentos, filiforme. Antenómeros cubiertos por abundantes setas. F1-F2 lisos y más delgados que el resto de flagelómeros; sensilias y clava inconspicua presentes a partir de F3. Pedicelo 2,3 veces más largo que ancho; F1 5,3 veces más largo que ancho; F2 4,3 veces más largo que ancho; F3 3,8 veces más largo que ancho; F4 3,2 veces más largo que ancho. F1 1,5 veces más largo que el pedicelo; F1 1,2 veces más largo que el F2; F2 subigual a F3; F4 1,2 veces más largo que el F3; F4-F11 subiguales en longitud (Fig. 4E).
Mesosoma. Pronoto cubierto por gran cantidad de setas en el margen anterior y con pocas en el margen posterior; sin carenas presentes (Fig. 4C). Mesoescudo liso y brillante, redondeado en visión dorsal con muy pocas setas dispersas. Escutelo liso y brillante con abundantes setas en el ápex. Altura del triángulo mesopleural a lo largo del margen anterior 1,1 veces la altura del mesopleuron. Propodeo con abundante pubescencia, con dos carenas presentes bien definidas, separadas y parcialmente cubiertas por setas en el tercio superior y unidas formando una placa con unas pocas carenas en los dos últimos tercios (Fig. 4D).
Ala. Más larga que el cuerpo; 1,7 veces más larga que el mesosoma y metasoma juntos. Cubierta por abundante pubescencia y con setas marginales presentes (Fig. 4A). Celda radial cerrada, 1,8 veces más larga que ancha. R1 pequeña y ligeramente curvada; Rs mucho más larga y muy curvada (Fig. 4B).
Metasoma. Parte proximal con un anillo incompleto de setas, faltan en una pequeña zona de la parte dorsal y son abundantes en los laterales. Resto del metasoma liso y brillante, con los terguitos claramente visibles.
Material tipo (1♀). HOLOTIPO. ♀ (depositado en IAvH):COLOMBIA. Boyacá. SFF Iguaque, Cabaña Mamarramos, 5º25’N 73º27’O, 2855m, Malaise: 21.xii.2000, 07.i.2001, P. Reina Leg. M1072 [IAvH].
Distribución. Región Neotropical: Colombia.
Etimología. El nombre de esta especie está dedicado a Miguel Ángel Torres, auxiliar de investigación del IAvH, por todas las facilidades prestadas durante nuestra estancia en Villa de Leiva.
Phaenoglyphis villosa (Hartig, 1841)
Descripción breve. Cabeza, mesosoma y metasoma de color castaño; escapo, pedicelo, F1 y F2 de color amarillo, el resto de flagelómeros de color castaño; patas amarillas y venación castaña clara. Antenas de la hembra con trece segmentos; F1 y F2 lisos y más delgados que el resto, sensilias y clava inconspicua presentes a partir de F3; F1 subigual al pedicelo y F2; F2 < F3; F3 < F4 (Fig. 1G). Antenas del macho con catorce segmentos; F1 y F2 lisos y más delgados que el resto de flagelómeros, sensilias y clava inconspicua presentes a partir de F3; F1 ligeramente curvado y mayor pedicelo; F1 subigual a F2; F2 < F3; F3 subigual a F4. Pronoto cubierto por setas, con dos largas carenas presentes. Mesoescudo sin notaulos. Escutelo con dos fosetas ovaladas, separadas por una carena estrecha o fusionadas. Propodeo cubierto por bastantes setas, con dos finas carenas, rectas y paralelas. Ala más larga que el cuerpo; celda radial parcialmente abierta, 2,1-2,7 veces más larga que ancha (Fig. 2F).
Material examinado: (1♀).COLOMBIA. Boyacá, SFF Iguaque, Cabaña Mamarramos, m4, 5º25’N 73º27’O, 2855m, Malaise, 19.iv.06.v.2000, P. Reina, Leg. M55 [IAvH].
Diagnosis. Esta especie es fácilmente distinguible del resto de las especies de charipinos presentes en Colombia por la presencia del surco mesopleural, es también la única especie conocida del género Phaenoglyphis que posee la celda radial parcialmente abierta (Fig. 2F).
Distribución. Cosmopolita. Primer registro para Colombia.
Discusión
Son pocos los estudios realizados en la región neotropical que se han centrado en la subfamilia Charipinae. La mayoría de las especies conocidas de esta subfamilia están basadas en ejemplares de la región holártica. Actualmente se conocen un total de 276 especies, de las cuales solo siete han sido previamente citadas en el neotrópico: Alloxysta desantisi Pujade-Villar & Díaz, 2002; A. fuscicornis (Hartig, 1841); A. nothofagi Andrews, 1976; A. victrix (Westwood, 1833); Phaenoglyphis villosa (Hartig, 1841); Apocharips angelicae Pujade-Villar & Evenhuis, 2002; y Apocharips hansoni Menke, 1993. Con respecto a Colombia únicamente A. fuscicornis (Hartig, 1841) había sido previamente citada (Pujade-Villar et al. 2010). Recientemente, tan solo han sido publicados los charipinos de Costa Rica (Ferrer-Suay et al. 2011), en el cual se describen cuatro especies nuevas, se cita por primera vez para este país a Alloxysta halli Andrews, 1978 y se completa la descripción de Apocharips hansoni Menke, 1993. Los charipinos de México también han sido abordados; los resultados de este estudio serán publicados en breve. Tras el estudio de los charipinos presentes en Colombia se establece que este país es el segundo en riqueza de especies dentro de la región neotropical, después de México.
Los estudios basados en la fauna de charipinos del neotrópico constituyen un aumento considerable de la distribución de algunas especies conocidas previamente solo en el paleártico. Estos estudios demuestran la amplitud de los rangos de distribución de algunas de las especies de Charipinae. Por otro lado, estos estudios permiten detectar la presencia de especies endémicas hasta el momento y nuevas para la ciencia, lo que supone un aumento del conocimiento de la biodiversidad de la subfamilia Charipinae.
Los dos géneros detectados en Colombia, Alloxysta y Phaenoglyphis, son fácilmente distinguibles atendiendo a la morfología de la mesopleura, por ejemplo, Phaenoglyphis presenta surco mesopleural, notaulos y fosetas escutelares; mientras que en Alloxysta dichos caracteres están ausentes. Un total de ocho especies de Alloxysta están presentes en Colombia (A. arcuata, A. castanea, A. colombiensis, A. fuscicornis, A. hansoni, A. obscurata, A. pilipennis y A. torresi) y una de Phaenoglyphis (P. villosa).
Agradecimientos
Claudia A. Medina Uribe y Miguel Ángel Torres del IAvH por habernos enviado el material que se menciona en este estudio y por todas las atenciones recibidas durante muestra estancia en Villa de Leiva. Esta investigación ha sido apoyada por el proyecto: CGL2008-00180 y CGL2011-22889 del Ministerio de Ciencia e Innovación, y la beca FPU AP2009-4833 del Ministerio de Educación.
Literatura citada
ANDREWS, F. G. 1976. A new species of Alloxysta hyperparasitic on aphids associated with South American Nothofagus forest. Pan Pacific Entomologist 52 (4): 256-257. [ Links ]
ANDREWS, F. G. 1978. Taxonomy and host specificity of Nearctic Alloxystinae with a catalogue of the world species (Hymenoptera: Cynipidae). Occasional Papers in Entomology 25: 1-128. [ Links ]
BENNETT, F. D. 1981. Hyperparasitism in the practice of biological control pp. 43-49. En: Rosen, D. (ed.) The Role of Hyperparasitism in Biological Control: A Symposium. Publication 4103. Division of Agricultural Sciences. University of California. [ Links ]
FERGUSSON, N. D. M. 1986. Charipidae, Ibaliidae and Figitidae (Hymenoptera: Cynipoidea). Handbook of Identification British Insects 8 (1c): 1-55. [ Links ]
FÖRSTER, A. 1869. Ueber die Gallwespen. Verhandlungen der Zoologisch-Botanischen Gesellschaft in Wien 19: 327-370. [ Links ]
FERRER-SUAY, M.; SELFA, J.; PUJADE-VILLAR, J. 2011. First record of Alloxysta Förster (Hymenoptera: Figitidae: Charipinae) from Costa Rica, with description of four new species. Neotropical Entomology 40 (6): 689-697. [ Links ]
GIRAULT, A. A. 1930. New pests from Australia,VIII. Privately published. Brisbane, Australia. 6 p. [ Links ]
HARTIG, T. 1840. Ueber die Familie der Gallwespen. Zeitschrift für Entomologie (Germar) 2: 176-210. [ Links ]
HARTIG, T. 1841. Erster nachtrag zur naturgeschichte der Gallwespen. Zeitschrift für Entomologie (Germar) 3: 322-358. [ Links ]
KIEFFER, J. J. 1902. Description de quelques Cynipides nouveaux ou peu connus et de deux de leurs parasites (Hymenopteres). Bulletin de la Société d'Histoire Naturelle de Metz 10: 1-18. [ Links ]
KIEFFER, J. J. 1909. Beschreibung neuer in Blattlausen schmartozender Cynipiden. Naturwissenschaftliche Zeitschrift für Forsten und Landwirtschaft Stuttgart 7: 479-482. [ Links ]
MENKE, A. S. 1993. A new species of Apocharips from Costa Rica (Hymenoptera: Cynipoidea, Charipidae). Journal of Hymenoptera Research 2 (1): 97-100. [ Links ]
MÜLLER, C. B.; ADRIAANSE, I. C. T.; BELSHAW, R.; GODFRAY, H., C., J. 1999. The structure of an aphid-parasitoid community. Journal of Animal Ecology 68: 346-370. [ Links ]
PARETAS-MARTÍNEZ, J.; PUJADE-VILLAR, J. 2006. Two genera of Charipinae (Hymenoptera: Figitidae) from Australia: revision of the genus Thoreauana Girault, 1930 and description of Dilapothor n. gen. Australian Journal of Entomology 45: 219-226. [ Links ]
PARETAS-MARTÍNEZ, J.; ARNEDO, M. A.; MELIKA, G.; SELFA, J.; SECO-FERNÁNDEZ, M. V.; FÜLOP, D.; PUJADE-VILLAR, J. 2007a. Phylogeny of the parasitic wasp subfamily Charipinae (Hymenoptera, Cynipoidea, Figitidae). Zoologica Scripta 36: 153-172. [ Links ]
PARETAS-MARTÍNEZ, J.; MELIKA, G.; PUJADE-VILLAR, J. 2007b. Description of Lobopterocharips arreplegata gen.n. & sp.n. (Hymenoptera: Figitidae: Charipinae) from Nepal, with notes on its phylogenetic position. Insect Systematics & Evolution 38: 473-479. [ Links ]
PUJADE-VILLAR, J.; DÍAZ, N.; EVENHUIS, H. H.; ROS-FARRÉ, P. 2002. South American Charipinae: Review and description of two new species (Hymenoptera: Cynipoidea: Figitidae). Annals of the Entomological Society of America 95 (5): 541-546. [ Links ]
PUJADE-VILLAR, J.; FERRER-SUAY, M. M.; SELFA, J.; CAICEDO-RAMÍREZ, G. 2010. Primera cita de Charinae (Hym., Figitidae) para Colombia. Boletín del Museo de Entomología de la Universidad del Valle 11 (2): 28-32. [ Links ]
STARÝ, P. 1970. Biology of aphid parasites (Hymenoptera: Aphidiidae) with respect to integrated control. Dr. W. Junk, b. v. La Haya. [ Links ]
VAN VEEN, F. J. F.; RAJKUMAR, A.; MÜLLER, C. B.; GODFRAY, H. C. J. 2001. Increased reproduction by pea aphids in the presence of secondary parasitoids. Ecological Entomology 26: 425-429. [ Links ]
WESTWOOD, J. O. 1833. Notice of the habits of a cynipidous insect parasitic upon the Aphis rosae with descriptions of several other parasitic Hymenoptera. Magazine of Natural History6: 491-497. [ Links ]