Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Entomología
versión impresa ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.2 Bogotá jul./dic. 2012
Estructura de la fauna béntica en corrientes de los Andes colombianos
Benthic fauna structure in streams of Colombian Andes
JESÚS MANUEL VÁSQUEZ-RAMOS1 y GLADYS REINOSO FLÓREZ2
1 Estudiante de Maestría en Ciencias Biológicas, Grupo de Investigación en Zoología, Universidad del Tolima, Colombia, jemavara@hotmail.com, autor para correspondencia.
2 M. Sc. Grupo de Investigación en Zoología, Facultad de Ciencias Básicas, Universidad del Tolima. Altos de Santa Elena, Ibagué-Tolima.
Recibido: 27-ene-2012 - Aceptado: 28-oct-2012
Resumen: Los ríos varían espacial y temporalmente en sus características físicas, comunidades biológicas y procesos, su estudio es complejo dada su heterogeneidad, aspecto que motivó a realizar esta investigación durante 2010, encaminada a determinar la composición y estructura de macroinvertebrados teniendo en cuenta diferentes sustratos en un gradiente altitudinal en corrientes andinas. Se registraron 74 taxones distribuidos en 42 familias y 13 órdenes. Las familias más abundantes fueron Chironomidae (Diptera), Leptohyphidae, Leptophlebiidae, Baetidae (Ephemeroptera), Hydropsychidae y Glossosomatidae (Trichoptera). La densidad media de macroinvertebrados acuáticos no mostró diferencias significativas entre estaciones y entre sustratos (P > 0,05, U de Mann-Whitney). Se evidenciaron diferencias en el ensamblaje de macroinvertebrados de acuerdo con el tipo de sustrato, pero no a nivel de tramos; posteriormente, se revelaron diferencias significativas entre arena - grava/guijarro, y arena - roca (ANOSIM, R = 0.3894, P < 0,01), pero no entre las corrientes evaluadas (ANOSIM, R = 0.95, P > 0,05). La diversidad de Shannon Wiener (H) fue significativamente más baja en el sustrato arena con respecto a los de roca y grava/guijarro (U de Mann-Whitney: Zobs = -2,8 y Zobs = -3,2, respectivamente; P < 0,05), mientras que entre estaciones no se registraron diferencias significativas (U de Mann-Whitney: P > 0,05). A nivel altitudinal los taxones Chironominae, Orthocladiinae, Tanypodinae, Baetodes, Camelobaetidius, Leptohyphes, Thraulodes y Smicridea se registraron en todas las estaciones.
Palabras clave: Macroinvertebrados. Ríos andinos. Sustratos.
Abstract: Rivers change spatially and temporally in their physical properties and processes and biological communities. Their study is complex because of their heterogeneity, aspect that motivated to do this research in 2010, aimed to determine the composition and structure of macroinvertebrates, taking into account different substrates through an altitudinal gradient in Andean streams. There were 74 taxa distributed in 42 families and 13 orders. The most abundant families were Chironomidae (Diptera), Leptohyphidae, Leptophlebiidae, Baetidae (Ephemeroptera), Hydropsychidae and Glossosomatidae (Trichoptera). The average density of aquatic macroinvertebrates showed no significant differences between seasons and between substrates (P > 0.05, Mann-Whitney U). There were differences in the macroinvertebrate assemblages according to the type of substrate, but not at the level of river sections; subsequently revealed significant differences were later shown between Sand-Gravel / Pebble, and Sand - Rock (ANOSIM , R = 0.3894, P < 0.01), but not between streams evaluated (ANOSIM, R = 0.95, P > 0.05). Shannon-Wiener diversity (H) was significantly lower in the sandy substrate with respect to the substrates rock and gravel / pebble (Mann-Whitney U: Zobs = -2.8 and Zobs = -3.2, respectively; P < 0.05), while between stations there was no significant difference (Mann-Whitney U: P > 0.05). Altitudinally Chironominae, Orthocladiinae, Tanypodinae, Baetodes, Camelobaetidius, Leptohyphes, Thraulodes and Smicridea were recorded in all stations.
Key words: Macroinvertebrates. Andean rivers. Substrate.
Introducción
El principal desafío al que se enfrentan los ecólogos acuáticos es la identificación de los factores que influyen en la distribución y abundancia de los organismos, pues los efectos de los impactos que inciden sobre las comunidades acuáticas varían a distinta escala. En la estructuración de éstas comunidades, las variables ambientales locales (profundidad, tamaño y tipo de sustrato, velocidad de la corriente, entre otras), así como los factores que influyen a escala regional y de paisaje (geología, precipitación, etc.), juegan un papel importante (Brown y Brussock 1991; Roy et al. 2003; Allan 2004; Chará et al. 2007; Johnson et al. 2007; Costa y Sanches 2008; Nessimian et al. 2008; Lorion y Kennedy 2009; Mesa 2010).
Los ríos y quebradas son entidades heterogéneas que tienen rasgos estructurales y funcionales (Wiens 2002), donde atributos como la distribución espacial, tamaño, heterogeneidad, conectividad y la dinámica entre los límites de parches discretos, así como las características químicas y físicas (Johnson y Host 2010), los regímenes de flujo hidrológico y patrones de movimiento y ciclo de vida de los organismos (Malard et al. 2002; Malmqvist 2002) tienen gran importancia en la configuración de las comunidades biológicas. Todo esto ha sido el tema central de muchas investigaciones en las últimas décadas (Allan 2004; Johnson y Host 2010; Winemiller et al. 2010).
Las características físicas de las corrientes crean condiciones de hábitat específicas que soportan diferentes tipos de alimento para la biota acuática (Buss et al. 2004; Malmqvist 2002), albergando una composición específica de macroinvertebrados, por tal motivo es importante evaluar la diversidad considerando la heterogeneidad de hábitat (Baptista et al. 2000; Ligeiro et al. 2010). Por ejemplo, la hojarasca es preferida por muchos taxones en corrientes tropicales, dado que brinda refugio y fuentes de alimento (Baptista et al. 2000) que permite soportar ensamblajes más diversos de macroinvertebrados, particularmente especies de Ephemeroptera, Plecoptera y Trichoptera (Buss et al. 2004). En contraste, en regiones templadas se ha evidenciado que los hábitats rocosos contienen un mayor número de individuos, de biomasa y riqueza de bentos (Brown y Brussock 1991; Korte 2010). Con base en lo anterior, el presente estudio está encaminado a determinar y comparar la composición y estructura de la fauna de macroinvertebrados acuáticos en diferentes sustratos (arena, grava/guijarro, hojarasca, roca) en corrientes andinas a diferentes niveles altitudinales.
Materiales y Métodos
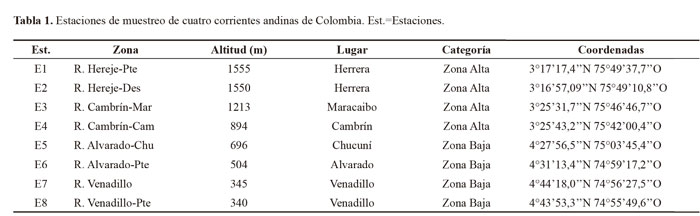
Área de estudio. Los ríos Hereje y Cambrín, están ubicados en la zona alta de los Andes (Fig. 1; Tabla 1), son afluentes de la cuenca del río Saldaña que tiene una superficie de 987.817 ha y se localiza en la parte suroccidental del departamento del Tolima (Colombia), en el flanco oriental de la cordillera Central. El río Hereje nace en la Laguna del Meridiano en estribaciones del Páramo del Meridiano, cuenta con un área total de 19.480 ha, una longitud de 46 km y una pendiente media de 6,21% (CORTOLIMA 1998). El río Cambrín cuenta con una superficie de 64.573 ha, una longitud de 45,6 km y una pendiente media de 6,58% (Díaz y Riveros 1987).
De otra parte, las cuencas de los ríos Alvarado y Venadillo corresponden a la zona baja de los Andes (Fig. 1; Tabla 1). La cuenca de drenaje del río Venadillo con 1.220 tributarios tiene un área de 188,4 km2 y un cauce principal que recorre 44,9 km, con una pendiente media de 4,5%; se origina a 2.250 m de altitud en el sitio conocido como “alto de la Palma”, y desemboca en el río Magdalena a 210 m (Andrade y Lozano 1986). La cuenca hidrográfica del río Alvarado se presenta una orientación nororiental y hace parte de la comúnmente denominada terraza de Ibagué y tiene una superficie de 2128,80 ha; geológicamente la mayor parte de la cuenca está compuesta por materiales sedimentarios procedentes de la cordillera Central y en menor cantidad por rocas ígneas y metamórficas (Reinoso 2001).
Colecta de los especímenes. En faenas de campo realizadas en el periodo de baja precipitación, durante el año 2010, se tomó en cada tramo (100 m) ubicado en cada una de las estaciones (Tabla 1) una muestra con una red Surber (área 900 cm2, 250 μm) en los sustratos roca, arena, grava/guijarro y hojarasca (este último se registró únicamente en dos estaciones de zona baja). Los muestreos realizados en las cuatro corrientes correspondieron a épocas de baja precipitación únicamente. Los especímenes fueron fijados en campo con formol al 10%; en laboratorio se preservaron en etanol (70%) y algunos grupos se determinaron taxonómicamente hasta género (otros: Chironomidae, Acari, Collembola y Oligochaeta a nivel de familia y subfamilia) con las claves y descripciones de Roldán (1996), Epler (2001), Posada y Roldán (2003), Domínguez et al. (2006), Machado (1989), Silva-Passos et al. (2007) y Merritt et al. (2008).
Análisis de datos. Se determinó espacialmente la abundancia para cada taxón utilizando matrices de densidad y se calcularon los índices de diversidad de Shannon-Wiener, (H’) y Dominancia de Simpson (λ) con el paquete estadístico PAST 1.78 (Hammer et al. 2001). Para explorar las relaciones entre sitios y el ensamblaje de macroinvertebrados en los sustratos (arena, grava/guijarro, roca, hojarasca) se realizó un análisis de agrupamiento con la prueba de similitud no paramétrica ANOSIM, y para determinar diferencias en la composición de macroinvertebrados entre sitios y sustratos se realizó la prueba de ordenación NMDS; ambas pruebas se hicieron teniendo como criterio de separación la distancia Bray-Curtis empleando el programa PAST 1.78 (Hammer et al. 2001) y PRIMER 6 (PRIMER-E 2006), respectivamente. Además, para analizar cambios en la abundancia, diversidad y riqueza de macroinvertebrados en sitios y sustratos, se hicieron pruebas de U de Mann-Whitney, dado que los datos no se ajustaron a una distribución normal.
Resultados
Composición y estructura. Se registraron 4.376 organismos correspondientes a 74 taxones distribuidos en 42 familias y 13 órdenes. Las familias más abundantes fueron Chironomidae, Leptohyphidae, Leptophlebiidae, Baetidae, Hydropsychidae y Glossosomatidae, mientras que las demás registraron una abundancia < 1%. Con respecto a los taxones, los más abundantes fueron Chironominae (25,41%), Haplotaxidae (15,11%), Leptohyphes (9,69%), Orthocladiinae (5,28%), Thraulodes (5,14%) y Traverella (5,05%). Los demás presentaron una abundancia inferior al 5% (Tabla 2).
Respecto a la frecuencia de hallazgo de los distintos taxones en los diferentes sustratos evaluados, se encontró que Cylloepus, Heterelmis, Chironominae, Orthocladiinae, Tanypodinae, Baetodes, Paracloeodes, Leptohyphes, Tricorythodes y Haplotaxidae, colonizan o frecuentan los cuatro tipos de sustratos (arena, grava/guijarro, hojarasca y roca), siendo los demás taxones (48) poco abundantes (<5 organismos) y frecuentes en estos sustratos (Tabla 2).
En relación con el gradiente altitudinal, se evidenció que los taxones Chironominae, Orthocladiinae, Tanypodinae, Baetodes, Camelobaetidius, Leptohyphes, Thraulodes y Smicridea se registraron en todas las estaciones evaluadas, mientras que Culoptila, Anacroneuria, Chelifera, Helicopsyche y Atopsyche se colectaron en zonas altas, y Protoptila, Alluaudomyia, Neotrichia, Tricorythodes, Traveryphes, Chimarra y Planariidaeen zonas bajas (Tabla 2).
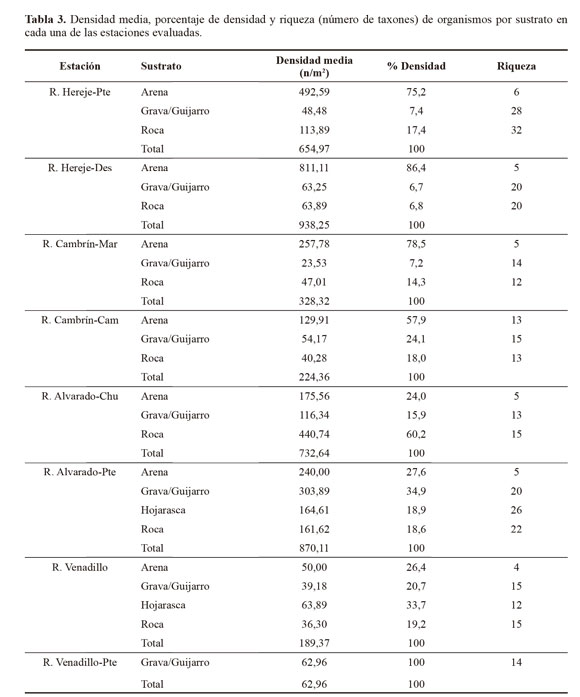
La densidad media de macroinvertebrados acuáticos no mostró diferencias significativas entre estaciones y entre sustratos (P > 0,05, U de Mann-Whitney). Es importante aclarar que se evidenció, de manera general, una abundancia considerablemente menor en las estaciones del río Cambrin y Venadillo. Así mismo, el sustrato que mostró mayor densidad de organismos fue arena en los ríos Hereje y Cambrín, mientras que roca y grava/guijarro lo fueron para los ríos Venadillo y Alvarado. Es de relevar que a pesar de la gran densidad de organismos aportada por el sustrato arena su aporte con respecto a la riqueza (número de taxones) fue bajo en todas las corrientes evaluadas (Tabla 3).
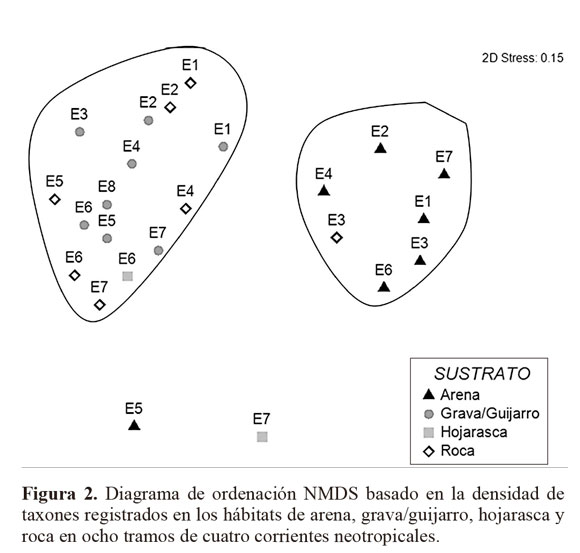
El análisis de ordenación NMDS permitió visualizar diferencias en la comunidad de macroinvertebrados de acuerdo al tipo de hábitat (los hábitats roca, grava/guijarro y hojarasca se diferenciaron completamente del hábitat arena); mientras que no se evidenciaron diferencias en el ensamblaje de la comunidad bentónica respecto a los diferentes tramos evaluados (Fig. 2). De manera general se puede mencionar que la composición de macroinvertebrados acuáticos no mostró diferencias estadísticamente significativas entre las corrientes evaluadas (ANOSIM, R = 0,95; P > 0,05), mientras que entre sustratos reveló diferencias significativas entre arena - grava/guijarro, y arena - roca (ANOSIM, R = 0,3894; P < 0,01). Es importante señalar que los sustratos arena, grava/guijarro y roca fueron frecuentes en todas las estaciones, mientras que el sustrato hojarasca fue restringido a dos tramos de zona baja, y además una de las estaciones solo ofertó el sustrato grava/guijarro (Tabla 3).
Diversidad y riqueza. Respecto a la diversidad, se encontró que los valores más altos se registraron en los sustratos grava/guijarro y roca, en las estaciones E1 (R. Hereje-Pte; H = 2,52) y E6 (R. Alvarado-Pte; H’ = 2,42) respectivamente, mientras que los mayores valores de dominancia de Simpson (D) se registraron en el sustrato arena en las estaciones E1 (R. Hereje-Pte; D = 0,73) y E5 (R. Alvarado-Chu; D = 0,71). A nivel general se encontraron diferencias significativas a nivel de sustratos; la diversidad de Shannon Wiener (H) fue significativamente más baja en el sustrato arena con respecto a los sustratos roca y grava/guijarro (U de Mann-Whitney: Zobs = -2,8 y Zobs = -3,2, respectivamente; P < 0,05), mientras que entre estaciones no se registró diferencias significativas (U de Mann-Whitney: P > 0,05).
Respecto a la riqueza no hubo diferencia significativa entre estaciones (P > 0,05, U de Mann-Whitney), pero sí entre sustratos, donde roca y grava/guijarro registraron los valores más altos, mientras que arena registró los más bajos (U de Mann-Whitney: Zobs = -2,9 y Zobs = -3, respectivamente; P < 0,05). Los valores más altos de riqueza se registraron en los sustratos grava/guijarro y roca de la estación E1, con 28 y 32 taxones respectivamente; mientras que los más bajos fueron los del sustrato arena en todas las estaciones (< 6 taxones) (Tabla 3).
Discusión
Estructura y composición de macroinvertebrados. Los resultados encontrados en el presente estudio a nivel de composición de la fauna de macroinvertebrados concuerdan con los obtenidos por Buss et al. (2004) y Silveira et al. (2006), quienes hallaron que Chironomidae era el taxón dominante en diversos sustratos, relevando lo expuesto por Marques (1999) quien manifestó que todos los géneros de Chironomidae son tolerantes a un amplio arreglo de condiciones ambientales. De otra parte estos resultados contrastan con los obtenidos por Kikuchi y Uieda (1998), quienes registraron que Hydropsychidae, Chironomidae y Oligochaeta fueron los macroinvertebrados más frecuentes en una corriente lótica de Brasil, no reportando grupos tales como Ephemeroptera que en este estudio fue el orden más abundante. Es posible que el gran caudal de las corrientes evaluadas tenga influencia importante sobre la biota acuática, pues el efecto abrasivo del agua limita la disponibilidad y estabilidad de hábitats, generando una baja abundancia y diversidad de grupos como Trichoptera y Coleoptera, y posibilitando que grupos como Ephemeroptera registren la mayor densidad y riqueza taxonómica (Buss et al. 2002; Silveira et al. 2006; Poff y Zimmerman 2010).
La gran abundancia de familias del orden Ephemeroptera (Leptohyphidae, Leptophlebiidae, Baetidae) podría ser efecto de la mayor ocurrencia del sustrato grava/guijarro y roca en las corrientes evaluadas, pues los efemerópteros se hayan con mayor frecuencia en sustratos que se encuentran en el flujo rápido de la corriente (Baptista et al. 2000), y además el comportamiento de este grupo de organismos está muy relacionado con la velocidad del flujo, ya que aguas rápidas deberían ser más ricas en nutrientes, lo que permitiría la presencia de especies filtradoras (Dodds 2002). Otro aspecto que fundamenta esta gran abundancia de efemerópteros está relacionado con las características propias de historia de vida de estos organismos, pues éstos constituyen la mayor parte de la biomasa y producción de macroinvertebrados en hábitats acuáticos, siendo las cantidades de detritus y arena en los sustratos físicos los principales factores que influyen en su microdistribución y abundancia (Brittain y Sartori 2009).
Son muchos los factores que pueden influir significativamente en la densidad de macroinvertebrados en los ecosistemas lóticos, siendo relevante la cobertura de la vegetación ribereña sobre la corriente. Es de resaltar que el número de invertebrados es más alto en áreas más abiertas, debido posiblemente al mayor crecimiento de perifiton en sitios expuestos al sol, posibilitando la presencia de muchos taxones (Baetidae, Elmidae, entre otros) (Boyero y Bosch 2004), o que por el contrario haya una alta diferencia en la composición taxonómica en corrientes con o sin cobertura (Zimmermann y Death 2002). Otro factor relevante es el caudal de las corrientes ya que origina un efecto abrasivo del agua que limita la disponibilidad y estabilidad de hábitats para la colonización por la fauna acuática, haciendo que grupos como Trichoptera y Coleoptera, que son generalmente abundantes en las corrientes, estén limitados en abundancia y diversidad pero posibilitando que otros grupos adaptados a estas condiciones registren la mayor densidad y riqueza taxonómica.
La variabilidad del sustrato influye en el ensamblaje de macroinvertebrados en corrientes tropicales, donde la más alta densidad y riqueza de estos organismos está relacionada con el flujo rápido superficial sobre tramos rápidos y rocosos (Boyero y Bosch 2004), así mismo los patrones más consistentes de riqueza están relacionados con el tamaño del sustrato, régimen de disturbio, predacion, rango de temperatura anual, intermitencia del flujo y tipo de bioma (Vinson y Hawkins 1998). La abundancia de macroinvertebrados acuáticos en los sustratos de grava/guijarro y roca encontrada en nuestro estudio podría deberse a que estos sustratos se encontraron en todas las estaciones evaluadas y que su tamaño fue variado. Brown y Brussock (1991) determinaron que el sustrato de grava soportaba el ensamblaje de especies bénticas más diverso y más abundante, a diferencia de otros sustratos en hábitats de remansos.
En general los sustratos presentes en las corrientes son usados por distintos ensamblajes de macroinvertebrados, en especial aquellos que le brinden a la fauna una condición de hábitat particular como calidad y cantidad de materia orgánica, estabilidad física, etc. (Buss et al. 2004; Brown y Brussock 1991). Los diferentes tipos de sustrato soportan diferente número de taxones, aquellos físicamente complejos (hojarasca, grava, macrofitas, troncos, entre otros) generalmente soportan más taxones que sustratos estructuralmente simples como arena y fondo de roca (Roy et al. 2003;Silveira et al. 2006). En este estudio, como en el de Buss et al. (2004), el sustrato arena presentó la menor riqueza de taxones, resultado que podría explicarse, en parte, porque en áreas rocosas el control de la comunidad béntica es biológico, mientras que es físico en las áreas arenosas (Kikuchi y Uieda 1998). Así mismo cuando la disponibilidad de hábitat rocoso disminuye, en consecuencia la densidad béntica, aunque no exista un gran cambio en la estructura de la comunidad; pero bajo condiciones de flujo bajo, las áreas arenosas se estabilizan y pueden soportar grandes cantidades de ciertos taxones (Lenat 1981). El sustrato hojarasca es preferido por muchos taxones, debido a que ofrece las mejores condiciones de refugio y alimentación dada la alta heterogeneidad de hábitat y a una alta riqueza de flora perifítica, mientras que la inestabilidad del sustrato arenoso y la baja disponibilidad de materia orgánica que éste alberga, conlleva a una baja diversidad y riqueza (Baptista et al. 2000).
La composición de macroinvertebrados acuáticos en corrientes de zona alta y zona baja no mostró diferencias significativas, sin embargo al comparar los diferentes sustratos se encontró que existen diferencias, lo cual concuerda con Buss et al. (2004) quienes encontraron que los macroinvertebrados están influenciados principalmente por el tipo de sustrato.
Medidas de diversidad. La alta diversidad de la fauna de macroinvertebrados puede deberse tanto al sustrato como a la velocidad de la corriente (Minshall et al. 1985). Se ha evidenciado que disturbios periódicos fuertes en remansos y la resultante falta de sustrato disponible parece evitar el desarrollo de extensas comunidades bénticas en estos hábitats al eliminar parcialmente el refugio para evadir a los depredadores (Brown y Brussock 1991); la riqueza de invertebrados en las corrientes es estructurada puntualmente por eventos históricos y por las condiciones físicas y químicas únicas de cada lugar (Vinson y Hawkins 1998).
Los resultados del presente estudio muestran la mayor diversidad en la parte alta y media y la menor en los tramos bajos de los ríos evaluados. En estudios realizados en Brasil se ha encontrado situaciones similares, la más alta diversidad biológica se halla en los tramos medios y altos de los ríos (Baptista et al. 2000; Buckup et al. 2007), mientras que los tramos bajos albergan una menor diversidad y riqueza de taxones, donde quizás las condiciones abióticas como temperatura, pendiente, geología y suelo, así como los procesos de intervención antrópica (uso de agua para riego, extracción de material, estrés ambiental por aguas residuales, entre otros), podrían influir en la colonización de la fauna béntica en tramos bajos de los ríos (Arias et al. 2007; Crespo et al. 2011; Miserendino et al. 2011 ). Buss et al. (2004) mencionan que las comunidades de macroinvertebrados están estructuradas principalmente por el tipo de sustrato más que por la degradación ambiental, la calidad del agua o la época climática.
Conclusiones
Nuestros resultados indican que la estructuración de la fauna de macroinvertebrados acuáticos está principalmente influenciada por factores físicos como el tipo de sustrato, más que por patrones de distribución altitudinal; sin embargo, así como lo han considerado algunos autores (Brown y Brussock 1991; Buss et al. 2004; Silveira et al. 2006), en la región neotropical es necesario recopilar información taxonómica generada por muestras de múltiples hábitats para determinar posibles patrones de distribución de la fauna de macroinvertebrados acuáticos; de la misma manera, trabajos de experimentación bajo condiciones de laboratorio son necesarios para evaluar la importancia de factores bióticos y abióticos de dichos patrones de distribución (Brown y Brussock 1991; Callisto et al. 2001; Silveira et al. 2006, Egler et al. 2012), los cuales brindarían una herramienta útil para la evaluación y conservación de los ecosistemas acuáticos.
Agradecimientos
Los autores agradecen el apoyo logístico y financiero de la Corporación Autónoma Regional del Tolima (CORTOLIMA), de la Universidad del Tolima y del Grupo de Investigación en Zoología de la Universidad del Tolima. A Carolina Gutiérrez, investigadora del Grupo de Investigación en Zoología, estudiante de doctorado Universidad de Colorado, EE.UU., por su apoyo en la parte taxonómica. El primer autor agradece a COLCIENCIAS por la beca 496-2009 del programa “Jóvenes Investigadores e Innovadores Virginia Gutiérrez de Pineda”. Igualmente se agradece a los evaluadores por sus observaciones, las cuales ayudaron a mejorar el manuscrito.
Literatura citada
ALLAN, D. 2004. Landscapes and riverscapes: the influence of land use on stream ecosystems. Annual Review of Ecology, Evolution, and Systematics 35: 257-284. [ Links ]
ANDRADE, T. E.; LOZANO, P. 1986. Sectorización hidrográfica del departamento del Tolima sector norte, Escala 1:25000. Universidad del Tolima. [ Links ]
ARIAS, A. R.; BUSS, D. F.; ALBUQUERQUE, C. DE; INÁCIO, A. F.; FREIRE, M. M.; EGLER, M.; MUGNAI, R.; BAPTISTA, D. F. 2007. Use of bioindicators for assessing and monitoring pesticides contamination in streams and rivers. Ciência & Saúde 12 (1), 61-72. [ Links ]
BAPTISTA, D. F.; BUSS, D.; DORVILLÉ L.; NESSIMIAN, J. 2000. Diversity and habitat preference of aquatic insects along the longitudinal gradient of the Macaé river basin, Rio de Janeiro, Brazil. Revista Brasileira de Biologia 61 (2): 295-304. [ Links ]
BOYERO, L.; BOSCH, J. 2004. The effect of riffle-scale environmental variability on macroinvertebrate asemblages in a tropical stream. Hydrobiologia 524: 125-132. [ Links ]
BRITTAIN, J.; SARTORI, M. 2009. Ephemeroptera: (Mayflies). pp. 328-333. En: Resh, V.; Cardé, R. (Eds.). Encyclopedia of insects. Editor Elsevier, Inc. Oxford. Inglaterra. 1266 p. [ Links ]
BROWN, A.; BRUSSOCK, P. 1991. Comparisons of benthic invertebrates between rifles and pools. Hydrobiologia 220: 99-108. [ Links ]
BUCKUP, L.; BUENO, A.; BOND-BUCKUP, G; CASAGRANDE, M.; MAJOLO, F. 2007. The benthic macroinvertebrate fauna of highland streams in southern Brazil: composition, diversity and structure. Revista Brasileira de Zoologia 24 (2): 294-301. [ Links ]
BUSS, D. F.; BAPTISTA D. F.; SILVEIRA, M. P.; NESSIMIAN J. L.; DORVILLÉ, L. F. M. 2002. Influence of water chemistry and environmental degradation on macroinvertebrate assemblages in a river basin in south-east Brazil. Hydrobiologia 481: 125-136. [ Links ]
BUSS, D.; BAPTISTA, D.; NESSIMIAN, J.; EGLER, M. 2004. Substrate specificity, environmental degradation and disturbance structuring macroinvertebrate assemblages in neotropical streams. Hydrobiologia 518: 179-188. [ Links ]
CALLISTO, M.; MORENO, P.; BARBOSA, F. 2001. Habitat diversity and benthic functional trophic groups at Serra do Cipó, Southeast Brazil. Revista Brasileira de Biología 61 (2): 259-266. [ Links ]
CHARÁ, J.; PEDRAZA, G.; GIRALDO, L.; HINCAPIÉ, D. 2007. Efecto de los corredores ribereños sobre el estado de quebradas en la zona ganadera del río La Vieja, Colombia. Agroforestería en las Américas 45: 72-78. [ Links ]
CORTOLIMA. Corporación Autónoma Regional Del Tolima. 1998. Plan de Gestión Ambiental para el departamento del Tolima 1998-2002. CORTOLIMA, Ibagué [ Links ].
COSTA, S.; SANCHES, A. 2008. Beta diversity in stream macroinvertebrate assemblages: among-site and among-microhabitat components. Hydrobiologia 598: 131-138. [ Links ]
CRESPO, R. DE J.; RAMÍREZ, A. 2011. Effects of urbanization on stream physicochemistry and macroinvertebrate assemblages in a tropical urban watershed in Puerto Rico. Journal of the North American Benthological Society 30 (3): 739-750. [ Links ]
DÍAZ, O.; RIVEROS, E. 1987. Análisis estadístico de algunos parámetros morfométricos de las cuencas hidrográficas del departamento del Tolima. Trabajo de Grado (Ingeniero Forestal). Universidad del Tolima, Facultad de Ingeniería Forestal, Ibagué [ Links ].
DODDS, W. 2002. Freshwater Ecology. Academic Press, San Diego, California. 569 p. [ Links ]
DOMÍNGUEZ, E.; MOLINERI, C.; PESCADOR, M. L.; HUBBARD, M. D.; NIETO, C. 2006. Ephemeroptera of South America. Pensoft, Publishers, Bulgaria. 646 p. [ Links ]
EGLER, M.; BUSS, D.; MOREIRA, J.; BAPTISTA, D. 2012. Influence of agricultural land-use and pesticides on benthic macroinvertebrate assemblages in an agricultural river basin in southeast Brazil. Brazilian Journal of Biology 72 (3): 437-443. [ Links ]
EPLER, J. 2001. Identification manual for the larval Chironomidae (Diptera) of North and South Carolina. North Carolina Department of Environment and Natural Resources, Raleigh, NC, and St. Johns River Water Management District, Palatka, Florida. 526 p. [ Links ]
HAMMER Ø.; HARPER D. A. T.; RYAN P. D. 2001. PAST: Paleontological Statistics software package for education and data analysis. Palaeontologia Electronica 4 (1): 1-9. [ Links ]
JOHNSON, L.; HOST, G. 2010. Recent developments in landscape approaches for the study of aquatic ecosystems. Journal of the North American Benthological Society 29 (1): 41-66. [ Links ]
JOHNSON, T.; MCNAIR, J.; SRIVASTAVA, P.; HART, D. 2007. Stream ecosystem responses to spatially variable land cover: an empirically based model for developing riparian restoration strategies. Freshwater Biology 52: 680-695. [ Links ]
KIKUCHI, R.; UIEDA, V. 1998. Composição da comunidade de invertebrados de um ambiente lótico tropical e sua variação espacial e temporal. Oecologia Brasiliensis 5 (1): 157-174. [ Links ]
LENAT, D.; PENROSE, D.; EAGLESON, K. 1981. Variable effects of sediment addition on stream benthos. Hydrobiologia 79: 187-194. [ Links ]
KORTE, T. 2010. Current and substrate preferences of benthic invertebrates in the rivers of the Hindu Kush-Himalayan region as indicators of hydromorphological degradation. Hydrobiologia 651 (1): 77-91. [ Links ]
LIGEIRO, R.; MELO, A. S.; CALLISTO, M. 2010. Spatial scale and the diversity of macroinvertebrates in a Neotropical catchment. Freshwater Biology 55: 424-435. [ Links ]
LORION, C.; KENNEDY, B. 2009. Relationships between deforestation, riparian forest buffers and benthic macroinvertebrates in neotropical headwater streams. Freshwater biology 54: 165-180. [ Links ]
MACHADO, T. A. 1989. Distribución ecológica e identificación de los coleópteros acuáticos en diferentes pisos altitudinales del departamento de Antioquia. Tesis biólogo. Universidad de Antioquia, Departamento de Biología. [ Links ]
MALARD, F.; TOCKNER, K.; DOLE-OLIVIER, M.; WARD, J. 2002. A landscape perspective of surface-subsurface hydrological exchanges in river corridors. Freshwater Biology 47: 621-640. [ Links ]
MALMQVIST, B. 2002. Aquatic invertebrates in riverine landscapes. Freshwater Biology 47 (4): 679-694. [ Links ]
MARQUES, M.; BARBOSA, F.; CALLISTO, M. 1999. Distribution and abundance of Chironomidae (Diptera, Insecta) in an impacted watershed in south-east Brazil. Revista Brasileira de Biologia 59 (4): 553-561. [ Links ]
MESA, L. 2010. Effect of spates and land use on macroinvertebrate community in Neotropical Andean streams. Hydrobiologia 641: 85-95. [ Links ]
MERRITT, R. W.; CUMMINS, K.W.; BERG, M. B. (Eds.). 2008. An introduction to the aquatic insects of North America. Kendall Hunt Publishing Company, United States of America. 1158 p. [ Links ]
MINSHALL, G.; CUMMINS, K.; PETERSEN, R.; CUSHING, C.; BRUNS, D.; SEDELL J.; VANNOTE, R. 1985. Developments in stream ecosystem theory. Canadian Journal of Fisheries and Aquatic Sciences 42: 1045-1055. [ Links ]
MISERENDINO, M. L.; CASAUX, R.; ARCHANGELSKY, M.; DI PRINZIO, C. Y.; BRAND, C.; KUTSCHKER, A. M. 2011. Assessing land-use effects on water quality, in-stream habitat, riparian ecosystems and biodiversity in Patagonian northwest streams. Science of the Total Environment 409 (3): 612-624. [ Links ]
NESSIMIAN, J.; VENTICINQUE, E.; ZUANON, J.; DE MARCO, P.; GORDO, M.; FIDELIS, L.; BATISTA, J.; JUEN, L. 2008. Land use, habitat integrity, and aquatic insect assemblages in Central Amazonian streams. Hydrobiologia 614: 117-131. [ Links ]
POFF, N. L.; ZIMMERMAN, J. K. H. 2010. Ecological responses to altered flow regimes: a literature review to inform the science and management of environmental flows. Freshwater Biology 55(1): 194-205. [ Links ]
POSADA, J.; ROLDÁN, G. 2003. Clave ilustrada y diversidad de las larvas de Trichoptera en el Nor-Occidente de Colombia. Caldasia 25: 169-192. [ Links ]
PRIMER-E, L. 2006. PRIMER 6. Plymouth: PRIMER-E Ltd. [ Links ]
REINOSO, G. 2001. Estudio bioecológico de los tricópteros del río Alvarado en el trayecto comprendido entre El Salado y Alvarado Tolima. Universidad del Tolima, Facultad de Ciencias, Departamento de Biología. 79 p. [ Links ]
ROLDÁN, G. 1996. Guía para el estudio de los macroinvertebrados acuáticos del Departamento de Antioquia. Impreades Presencia S.A. Bogotá, Colombia. 217 p. [ Links ]
ROY, A.; ROSEMOND, A.; LEIGH, D.; PAUL M.; WALLACE, B. 2003. Habitat-specific responses of stream insects to land cover disturbance: biological consequences and monitoring implications. Journal North American Benthological Society 22: 292-307. [ Links ]
SILVA-PASSOS, M. I.; NESSIMIAN, J. L.; FERREIRA, N. 2007. Chaves para identificação dos gêneros de Elmidae (Coleoptera) ocorrentes no Estado do Rio de Janeiro, Brasil. Revista Brasileira de Entomologia 51 (1): 42-53. [ Links ]
SILVEIRA, M. P.; BUSS, D. F.; NESSIMIAN, J. L.; BAPTISTA, D. F. 2006. Spatial and temporal distribution of benthic macroinvertebrates in a Southeastern Brazilian river. Brazilian Journal of Biology 66 (2B): 623-632. [ Links ]
VINSON, M.; HAWKINS, C. 1998. Biodiversity of stream insects: variation at local, basin, and regional scales. Annual Review of Entomolology 43: 271-293. [ Links ]
WIENS, J. 2002. Riverine landscapes: taking landscape ecology into the water. Freshwater Biology 47: 501-515. [ Links ]
WINEMILLER, K.; FLECKER, S.; HOEINGHAUS, D. 2010. Patch dynamics and environmental heterogeneity in lotic ecosystems. Journal North American Benthological Society 29 (1): 84-99. [ Links ]
ZIMMERMANN, E.; DEATH, R. 2002. Effect of substrate stability and canopy cover on stream invertebrate communities. New Zealand Journal of Marine and Freshwater Research 36: 537-545. [ Links ]