Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.39 no.1 Bogotá Jan./June 2013
Caracterización de aislamientos nativos de Metarhizium anisopliaey su patogenicidad hacia Aeneolamia postica, en Tabasco, México
Characterization of native isolates of Metarhizium anisopliae and its pathogenicity to Aeneolamia postica in Tabasco, Mexico
Magdiel Torres de la C.1,2, Hipólito Cortez M.3, Carlos F. Ortiz G.4, Silvia Cappello G.1,5 y Aracely de la Cruz P.1,6
1 División Académica de Ciencias Biológicas. Universidad Juárez Autónoma de Tabasco, Carretera Villahermosa-Cárdenas Km. 0.5. C.P. 86039.
2 Profesor Investigador. Ph. D. magtorre@colpos.mx. Autor para correspondencia.
3 Profesor Investigador. Ph. D. Instituto Politécnico Nacional. Justo Sierra No. 28, Jiquilpan, Michoacán, México. C.P. 59510. hcortezm@ipn.mx.
4 Profesor Investigador. Ph. D. Colegio de Postgraduados, Campus Tabasco. Km. 3.5 Carretera Cárdenas-Huimanguillo, H. Cárdenas, Tabasco, México. CP 86500. cfortizg@gmail.com.
5 cappellogs@hotmail.com.
6 arace_lycp@hotmail.com.
Recibido: 22-nov-2012 - Aceptado: 4-jun-2013
Resumen: Con la finalidad de contar en Tabasco, México, con aislamientos nativos de Metarhizium anisopliae con potencial de control del salivazo de la caña de azúcar (Aeneolamia postica), cuatro aislamientos poliespóricos, 12 monospóricos y una cepa comercial se caracterizaron según variables fisiológicas y patogénicas. El desarrollo micelial, la velocidad de germinación y la producción conidial fueron las variables fisiológicas consideradas; las dos primeras se evaluaron a: 25, 30 y 35 oC. La temperatura favorable para el desarrollo micelial de las cepas nativas fue de 25-30 °C. El tiempo requerido para la germinación del 50% de los conidios (TG50) varió desde 6,3 h hasta 13.2 h donde los menores y mayores TG50se registraron a 30 y 35 oC, respectivamente. Los aislamientos nativos fueron menos sensibles a las temperaturas evaluadas que la cepa comercial. Respecto a producción conidial, los aislamientos poliespóricos superaron a los aislamientos monospóricos. La efectividad patogénica de M. anisopliae sobre A. postica varió de 31,9 a 53,6%. Las características fisiológicas y patogénicas con fines de selección de micoinsecticidas fueron superiores en los cultivos monospóricos. Los aislamientos con mayor potencial de biocontrol sobre A. postica fueron los monospóricos MaA3(1), MaA3(2), MaA2(7), MaA2(1), y la cepa poliespórica MaA4.
Palabras clave: Control biológico. Hongos entomopatógenos. Caña de azúcar.
Abstract: In order to obtain native isolates of Metarhizium anisopliae with potential to control Aeneolamia postica, four polysporic strains, 12 monosporic and a commercial strain were characterized according to physiological and pathogenic variables. The mycelial development, germination rate and conidia production were considered physiological variables; the first two were evaluated at three temperatures: 25, 30 and 35 °C. The best temperature for mycelial growth of native strains ranged between 25 and 30 °C. The time required to 50% of conidial germination (TG50) ranged from 6.3 to 13.2 h, where the lowest and highest TG50were 30 °C and 35 °C, respectively. Native strains were less sensitive than the commercial strain at all temperatures tested. Regarding to conidial production, polysporic strains outperformed to the monosporic isolates. The pathogenic effectiveness of M. anisopliae to A. postica ranged from 31.9 to 53.6%. The physiological and pathogenic characteristics to select the best biocontrol strains were higher in monosporic strains. The strains with greatest potential for biocontrol of A. postica, were the monosporic MaA3 (1), MaA3 (2), MaA2 (7), MaA2 (1), and the polysporic MaA4 strain.
Key words: Biological control. Entomopathogenic fungi. Sugar cane.
Introducción
La caña de azúcar (Saccharum officinarum L., 1753)es uno de los principales recursos agrícolas en Tabasco, México. Se cultiva en 29,460 ha que contribuyen con el 4% de la producción nacional de azúcar y ocupa el sexto lugar en superficie cultivada (UNC 2010). Al igual que otros cultivos, es afectada por varias especies de insectos plaga, entre las que destaca el "salivazo" o "mosca pinta" (Aeneolamia postica Walk. 1858) que se alimenta de las láminas foliares y provoca una fitotoxemia llamada "quema de las hojas" con la consecuente disminución de la capacidad fotosintética (Fewkes 1969; Badilla 2002) y pérdidas de hasta 6 ton de caña por ha. Los primeros registros de A. postica en las regiones cañeras del sureste de México datan de 1949 (Flores 1994) y, actualmente, la plaga constituye uno de los factores limitantes de la productividad cañera.
Como una estrategia de manejo integrado de la mosca pinta en Tabasco, se ha incrementado el uso del hongo entomopatógeno Metarhizium anisopliae (Metschnikoff, 1879; Sorokin 1883), debido al bajo impacto que produce sobre el ambiente y la fauna benéfica (Burges y Hussey 1971). Las características patogénicas de M. anisopliae contra A. postica, su factibilidad de reproducción de manera artificial, así como la rentabilidad de su uso, hacen de él una alternativa viable de control del salivazo en Tabasco; sin embargo, las cepas utilizadas son exóticas y, consecuentemente, pueden tener diferente comportamiento en esta región de México.
De acuerdo con De Bach (1968), una de las estrategias básicas en control biológico es la exploración inicial de los enemigos naturales nativos a nivel regional antes de introducir cepas exóticas. En este caso, el clima cálido-húmedo de Tabasco y su diversidad de ecosistemas, sugiere la existencia de una amplia diversidad de organismos nativos con potencial de control biológico (Cortez et al. 2003a); sin embargo, aislamientos nativos de M. anisopliae no han sido estudiados en la entidad. La variabilidad intraespecífica que ocurre en los hongos entomopatógenos en cuanto a rango de hospederos, velocidad de germinación, producción de conidios, crecimiento micelial, respuesta a diferentes temperaturas y virulencia (Drumond y Heale 1988; Ayala et al. 2005) hace necesario caracterizar y seleccionar las mejores cepas para el desarrollo de bioinsecticidas (Díaz et al. 2009) donde los cultivos monospóricos representan una alternativa que permite seleccionar las mejores características de los aislamientos silvestres (Soper y Ward 1980; Cortez et al. 2003a, 2003b). En el presente estudio se caracterizaron aislamientos nativos, poliespóricos y monosporicos, del hongo M. anisopliae, con el objetivo de seleccionar los de mejores características fisiológicas y patogénicas para el desarrollo de micoinsecticidas para el manejo de A. postica.
Materiales y métodos
Obtención de aislamientos. Para aislar hongos hifomicetos a partir de muestras de suelo, se utilizaron larvas de Galleria mellonella Linnaeus, 1756, como insectos trampa de acuerdo con Goettel e Inglis (1997). Las muestras de suelo fueron obtenidas de áreas cultivadas con caña de azúcar del Campo Experimental del Colegio de Postgraduados, Campus Tabasco (17°59’33"N 93°35’33"O). Cada muestra se tamizó en malla de 2 mm de abertura y 300 g de ese suelo humedecido, fue colocado dentro vasos de plástico de 1.000 ml, junto con cinco larvas de G. mellonella. El vaso con suelo y larvas se tapó e invirtió, de modo que las larvas estuviesen en contacto con el suelo (Doberski y Tribe 1980) y las muestras se incubaron por siete días a 25 ± 1 ºC. Las larvas se recuperaron del suelo, se desinfestaron con hipoclorito de sodio al 1%, durante tres minutos), e incubaron en cámara húmeda a 25 ± 1 °C durante siete días para favorecer el desarrollo del hongo (Hatting et al. 1999).
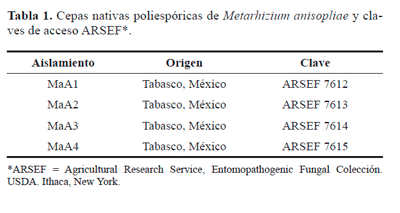
Los hongos que se desarrollaron sobre la superficie de las larvas se aislaron e identificaron con base a las estructuras reproductivas, según Humber (1997) y Samson (1981). La confirmación de la especie fue hecha por el Dr. Richard A. Humber, y los aislamientos se depositaron en la colección de hongos entomopatógenos del Agricultural Research Service (ARSEF) del USDA, EE. UU., Ithaca, N.Y con las claves que se presentan en el Tabla 1. Duplicados se depositaron en la colección de hongos del Colegio de Postgraduados, Campus Tabasco, Cárdenas, Tabasco, México.
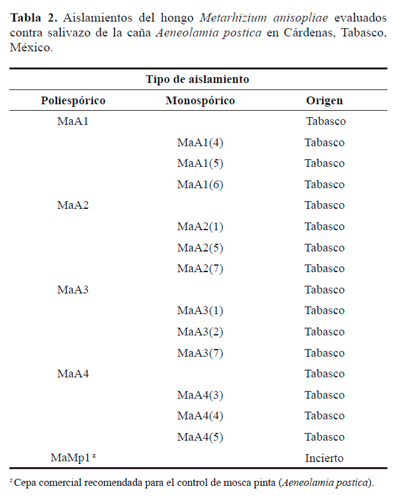
Aislamientos evaluados. Se utilizaron cuatro aislamientos poliespóricos nativos, 12 monospóricos y una cepa comercial de M. anisopliae (Tabla 2). Los aislamientos poliespóricos y monospóricos se obtuvieron de acuerdo con Almeida et al. (1997) y Estrada et al. (1997), respectivamente. Tres aislamientos monospóricos se obtuvieron previamente de cada cultivo poliespórico (cepas "madre") y seleccionados por su patogenicidad hacia G. mellonella. En total se evaluaron 17 aislamientos, y todos se multiplicaron en medio de cultivo agar-dextrosa de sabouraud + 0,1% de extracto de levadura (ADS + EL) (Feng et al. 1990).
Caracterización fisiológica. Desarrollo micelial. A partir de cultivos in vitro de M. anisopliae de cuatro días de edad, se transfirió un círculo de 5 mm de diámetro del borde de la colonia en crecimiento y se colocó en el centro de una caja Petri con medio de cultivo ADS + EL y se incubó en oscuridad a 25, 30 y 35 ± 1 °C. El desarrollo micelial se evaluó de acuerdo con Dimbi et al. (2004), registrándolo cada dos días hasta el día 16 después de la transferencia; los datos del último día se consideraron para el análisis estadístico. Cinco repeticiones por aislamiento y temperatura fueron utilizados. El porcentaje de inhibición e incremento a 30 y 35 °C se obtuvieron con las fórmulas: % Inhibición/incremento = (desarrollo a 30 °C x 100/ desarrollo a 25 °C)-100, y % inhibición/incremento= (desarrollo a 35 °C x 100/ desarrollo a 25 °C)-100.
Producción conidial. A partir de cultivos de 15 días de edad se sembraron 20,000 conidios en cajas Petri con medio ADS + EL y se incubaron a 25 ± 1 °C en oscuridad durante 15 días. Se establecieron tres repeticiones. Los conidios se cosecharon de la superficie del cultivo bajo condiciones asépticas inundando la caja de Petri con agua destilada estéril (ADE) + inex® (0,1%) y raspando la colonia con un bisturí. La suspensión fue filtrada con gasa clínica para separar el micelio. Los conidios se agitaron durante 10 min en un agitador magnético (Thermolyne®, Artur H. Thomas Co., Philadelphia, PA, EUA). El conteo de conidios se realizó en cámara de Neubauer y la concentración ml-1 se estimó mediante la fórmula de Lipa y Slizynski (1973): C = (Cc) (4 x 106) (Fd/80), donde:
C = Número de conidios ml-1; Cc = Número promedio de conidios contados en la cámara de Neubauer y, Fd = Factor de dilución.
Velocidad de germinación. A partir de cultivos de 15 días de edad se obtuvo una suspensión de 5 x 106 conidios ml-1, de donde 30 μl se sembraron en cajas Petri con medio de cultivo ADS + EL y se incubaron a 25, 30 y 35 ± 1 °C. La germinación se evaluó a las 4, 5, 6, 7, 8, 9, y 10 h con lecturas de 100 conidios, hasta que alguno de los aislamientos logró ≥ 90% de germinación. Se consideraron conidios germinados cuando el tubo germinativo alcanzó la longitud de la mitad del conidio (Jackson et al. 1985).
Caracterización patogénica. En macetas de plástico de 10 x 10 cm con suelo pasteurizado se sembró caña de azúcar de la variedad Mex-69-290, la que se utilizó para alimentar los insectos empleados en las pruebas de patogenicidad; para esto, se utilizaron plántulas de 30 días de edad. Cuarenta adultosde A. postica se colectaron en cultivos de caña de azúcar y se colocaron en cada maceta. Las plantas con los insectos se introdujeron en cámaras cilíndricas de plástico transparente de 25 x 15 cm, con dos ventanas laterales opuestas de 12 x 5 cm revestidas de tela organza blanca. Los insectos se asperjaron con una suspensión de 1 x 108 conidios ml-1 mediante un pulverizador manual. El tratamiento control fue asperjado con agua destilada estéril + inex® (0,1%). El ensayo se mantuvo a 25 ± 1 °C con fotoperíodo 12:12; la humedad relativa (HR) fue de 80 ± 10%. La mortalidad se registró diariamente y los "cadáveres" se colocaron en cámara húmeda con el fin de obtener esporulación. La variable respuesta fue el porcentaje de insectos muertos inducido por M. anisopliae. Se establecieron cinco repeticiones por aislamiento fueron establecidos. A partir de los datos de mortalidad final, se obtuvo la efectividad de Abbott (1925) para cada aislamiento. La mortalidad en el testigo forma parte de la fórmula de Abbott .
Análisis estadístico. Los datos del desarrollo micelial (DM), producción conidial (PC) y efectividad de Abbott se analizaron bajo un diseño completamente al azar con 17 tratamientos (cada uno de los aislamientos evaluados) (Tabla 1). Previo al análisis, los datos de DM y PC se transformaron a logaritmo de (x+1), y los porcentajes de efectividad de Abbott se transformaron al arcoseno de la raíz cuadrada de la proporción. Los datos fueron sometidos a un ANOVA y prueba de separación de medias (Tukey, 0.05) mediante SAS® (1998).
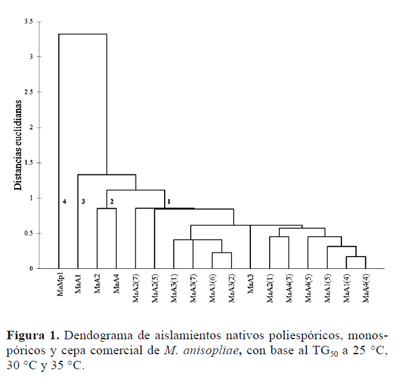
Para la velocidad de germinación, se establecieron tres réplicas por aislamiento y temperatura. Mediante regresión logística y el paquete estadístico SAS® (1998), se estimó el tiempo en que ocurrió el 50% de la germinación de los conidios (TG50) (Samuels 1989). Con los datos del TG50 obtenidos por cepa y temperatura, se efectuó un análisis de conglomerado (STATISTICA, versión 5.1) para generar un dendograma y determinar la mayor diferencia y similitud entre cepas.
Resultados y discusión
Identificación de aislamientos. Los aislamientos mostraron colonias inicialmente blancas que al madurar se tornaron color verde olivo, conidióforos simples o agregados con fiálides en forma de botella. Conidios alargados, ovoides a cilíndricos de 5-9 µm dispuestos en cadenas compactas paralelas, que en masa presentaron color verde olivo. Las características de los cuatro aislamientos poliespóricos coinciden con lo descrito por Humber (1997) y Samson (1981) para M. anisopliae.
Caracterización fisiológica. Efecto de la temperatura sobre el desarrollo micelial. A 25 °C se registraron diferencias significativas (F = 12.66, gl = 16, P < 0.0001) en el desarrollo micelial (DM) entre aislamientos (Tabla 3). Los aislamientos monospóricos tuvieron mayor DM que los aislamientos madre. Resultados similares fueron obtenidos por Cortez et al. (2003a) donde cepas monospóricas de Lecanicillium lecanii (Zimm.) Zare y Gamsregistraron mayor DM que las cepas poliespóricas cuando se expusieron 25 °C. La cepa con el mayor DM fue MaA3(7) con 2,6 ± 0,2 cm. mientras que el aislamiento con el menor DM fue la comercial MaMp1 con 1,8 ± 0,3 cm.
A 30 °C, el análisis manifestó diferencias significativas (F = 10.11, gl = 16, P < 0.0001) (Tabla 3). A esta temperatura el DM mostró menor variación entre aislamientos comparado con la obtenida a 25 °C, similar a lo obtenido por Toriello et al. (2008). Nuevamente los aislamientos monospóricos fueron los de mayor respuesta, similar a lo obtenido por Cortez et al. (2003a) para L. lecanii a 30 °C. El aislamiento monospórico MaA2(7) fue el de mayor desarrollo con 2,4 ± 0,1 cm. A esta temperatura, nueve de los 17 aislamientos mostraron un incremento real en relación con el DM mostrado a 25 °C. El grado de inhibición del DM a esta temperatura fue bajo, pues fluctuó entre 0% y 8,8%, lo que puede ser explicado por el origen tropical de los aislamientos (Tabla 3).
Respecto al DM de los aislamientos cuando se expusieron a 35 °C, el análisis manifestó diferencias significativas (F = 7.76, gl = 16, P < 0.0001) (Tabla 3). A esta temperatura, el DM fue inhibido en todos los aislamientos evaluadas respecto al desarrollo obtenido a 25 °C, similar a lo obtenido por Toriello et al. (2008) con M. anisopliae. La inhibición fluctuó de 74,1% hasta 86,3% (Tabla 3). Al igual que a 30 °C el aislamiento con el mayor DM fue MaA2(7) con 0,6 ± 0,1 cm.
En el presente estudio, la temperatura óptima para el DM de M. anisopliae, aislados en suelos cultivados con caña de azúcar en Tabasco, estuvo en el rango de 25 a 30 °C. Estos resultados concuerdan con Toriello et al. (2008), para aislamientos de M. anisopliae obtenidos en caña de azúcar en Veracruz, México. El DM es una característica importante en la selección y producción de hongos entomopatógenos (Ekesi et al. 1999) y su respuesta a la temperatura está definida por la región de origen del aislamiento y por aspectos genéticos (Vidal et al. 1997; Cortez 2010).
Velocidad de germinación. Con base al tiempo en que germinó el 50% de los conidios (TG50), se observó variabilidad en la velocidad de germinación, la cual fue influenciada por la temperatura y el aislamiento. A 25 °C, dentro de los aislamientos poliespóricos la mayor y menor velocidad de germinación correspondió a las cepas MaA4 y MaA3, con tiempos promedios de 7,4 y 8,2 h, respectivamente. Todos los aislamientos nativos tuvieron mayor velocidad de germinación que la cepa comercial la cual mostró un tiempo promedio de 8,8 h. En cuanto a los aislamientos monospóricos, la mayor velocidad fue para MaA2(5) (Tabla 4).
A 30 °C, la mayor velocidad de germinación para los aislamientos poliespóricos nativos correspondió a MaA2 con 6,3 h (Tabla 4). Nuevamente la cepa comercial mostró el mayor TG50. A esta temperatura todas los aislamientos poliespóricos nativos tendieron a reducir el TG50(incrementaron su velocidad de germinación) respecto al presentado a 25 °C. De los aislamientos monospóricos, la mayor velocidad fue para MaA3(2) (Tabla 4). Los aislamientos monospóricos que superaron a los aislamientos poliespóricos de origen fueron MaA1(6), MaA3(1), MaA3(2), MaA3(7). En general, el TG50de las cepas expuestas a 30 °C fue menor a 9 h, con rangos de 6,2-8,8 h lo cual concuerda con Samuels et al. (1989), quienes reportan cepas de M. anisopliae con TG50menor a 9 h.
A 35 °C, la mayor velocidad de germinación para los aislamientos poliespóricos nativos correspondió a MaA3 con 6,7 (Tabla 4). La mayor sensibilidad a esta temperatura fue registrada en la cepa comercial al presentar el mayor TG50. Para los aislamientos monospóricos la mayor velocidad de germinación fue para MaA2(1), con 6,5 h.
El análisis de conglomerado de los aislamientos poliespóricos nativos, monospóricos y cepa comercial de M. anisopliae con base en el TG50a 25, 30 y 35 °C, mostró la formación de cuatro grupos. En el grupo 1 se incluyeron todos los aislamientos monospóricos (Fig. 1), las cuales fueron los de menor TG50, incluyendo el aislamiento poliespórico nativo MaA3; este grupo fue favorecido por las altas temperaturas al aumentar la velocidad de germinación. En el grupo dos y tres se ubicaron los aislamientos poliesporicos MaA1, MaA2, MaA3, en las cuales su TG50respectivo aumentó conforme incrementó la temperatura (su velocidad de germinación disminuyó). El grupo cuatro fue formado por la cepa comercial (MaMp1), la de mayor TG50en todas las temperaturas evaluadas, lo cual es interesante resaltar debido a que es común utilizar cepas exóticas sin considerar las características básicas del aislamiento (Samuels et al. 1989) (Fig. 1; Tabla 4). La velocidad de germinación es una característica importante en la selección de hongos entomopatógenos porque a mayor velocidad existe una mayor oportunidad del hongo para infectar al insecto hospedero, sobre todo cuando las condiciones ambientales son adversas (Moore y Prior 1993; Cortez et al. 2003b).
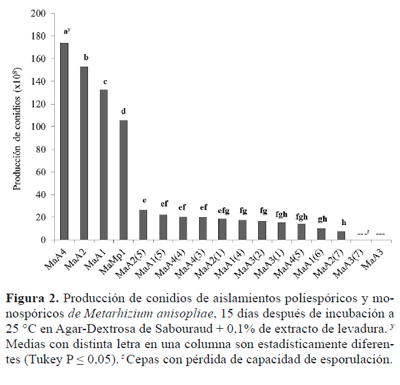
Producción de conidios. El análisis estadístico mostró diferencias significativas (F = 99999.99, gl = 15, P < 0.0001) en la producción de conidios a 25 °C, principalmente entre aislamientos poliespóricos y monospóricos, donde los primeros presentaron mayor producción de conidios que los segundos, excepto la cepa MaA3 que presentó pérdida de capacidad de esporulación en SDA + E.L (Fig. 2). Resultados similares son presentados por Cortéz et al. (2003a) donde aislamientos poliespóricos de L. lecanii mostraron mayor producción de conidios que los monospóricos. El aislamiento con mayor producción conidial fue MaA4, con una producción total de 174 ± 3.8 (x108) conidios. Los aislamientos MaA2 y MaA1 mostraron producción intermedia. La cepa comercial obtuvo el cuarto lugar en cuanto a producción conidial (Fig. 2). De acuerdo con Badilla et al. (1996), la selección de aislamientos con buen potencial genético en cuanto a producción de conidios, es un aspecto básico para la producción a escala comercial de hongos entomopatógenos.
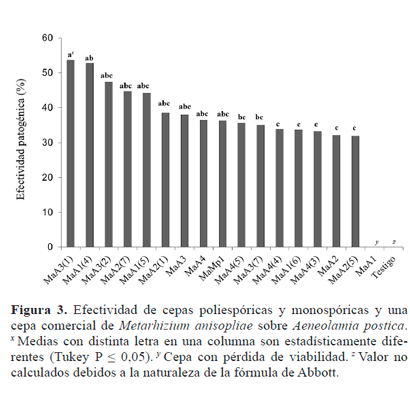
Efectividad patogénica. Diferencias significativas (F = 4.16, gl = 15, P < 0.0001) se encontraron en la efectividad patogénica de los aislamientos de M. anisopliae sobre A. postica. La efectividad fluctuó del 31,9% al 53,6%. Estos resultados son similares a los reportados por Arango et al. (1994) los cuales reportan 46,1% obtenido por M. anisopliae sobre la mosca pinta (Aeneolamia sp.); así también, Badilla et al. (1996) registraron 41,6% de mortalidad sobre A. albofasciata (Lallemand,1939)y Prosapia sp. La cepa monospórica MaA3(1) presentó la mayor efectividad sin diferencias significativas con las cepas monospóricas MaA1(4), MaA3(2), MaA2(7), MaA1(5), MaA2(1), la cepa poliespórica MaA3, y la cepa comercial MaMp1; sin embargo, las cepas que superaron el 50% de efectividad fueron las monoespóricas MaA3(1) y MaA2(7) (Fig. 3). Resultados similares son presentados por Cortéz et al. (2003a) donde cepas monospóricas de L. lecanii mostraron mayor mortalidad sobre Toxoptera aurantii (Boyer de Fonscolombe, 1841). De acuerdo con Tanada y Kaya (1993), la virulencia de cepas de hongos entomopatógenos es una característica relevante en la selección de aislamientos con fines de control biológico, debido a que se presentan diferencias importantes en la virulencia entre aislamientos de una misma especie.
Conclusiones
Los aislamientos de M. anisopliae obtenidos de suelos cultivados con caña de azúcar en Tabasco, México, mostraron variabilidad intraespecífica en cuanto a velocidad de germinación, desarrollo micelial, producción conidial, y patogenicidad. El rango de temperatura favorable para los aislamientos nativos de M. anisopliae fue de 25-30 °C. La cepa comercial fue más sensible que los aislamientos nativos a las temperaturas evaluadas. Se observaron diferencias significativas entre cultivos poliespóricos y sus cultivos monospóricos respectivos. Con excepción de la producción de conidios, las características de interés con fines de selección de micoinsecticidas fueron superiores en los cultivos monospóricos. Con base a las características evaluadas, los aislamientos con mayor potencial de utilización en el manejo de la mosca pinta en Tabasco fueron las cepas monospóricas MaA3(1), MaA3(2), MaA2(7), MaA2(1), y la cepa poliespórica MaA4. La variabilidad en las características evaluadas demuestra la importancia que tiene la caracterización de aislamientos y manifiestan el potencial del hongo estudiado para el desarrollo de bioinsecticidas sobre A. postica. Así también, la obtención de cultivos monospóricos a partir de cepas poliespóricas permite la selección de cepas con características sobresalientes, como se demostró en la presente investigación.
Literatura citada
ABBOTT, W. S. 1925. A method of computing the effectivness of an insecticide. Journal of Economic Entomology 18 (2): 265-267. [ Links ]
ALMEIDA, J. E.; ALVES, M. S. B.; PEREIRA, R. M. 1997. Selection of Beauveria spp. Isolates for control of the termite Heterotermes tenuis (Hagen, 1858). Journal of Applied Entomology 121 (5): 539-543. [ Links ]
ARANGO, G. L.; TORRES, C.; LAPOINTE S. L. 1994. Patogenicidad de tres cepas de Metarhizium anisopliae sobre huevos y ninfas de Aeneolamia varia (Fabricius) (Homoptera: Cercopidae). Revista Colombiana de Entomología20 (1): 43-46. [ Links ]
AYALA Z, M. A.; MIER, T.; ROBLES, S. J.; TORIELLO, C. 2005. Variabilidad intraespecífica del crecimiento de Lecanicillium lecanii (=Verticillium lecanii) por efecto de la temperatura. Revista Mexicana de Micología 20 (1): 93-97. [ Links ]
BADILLA, F. F. 1996. Manejo integrado de jobotos Phyllophaga spp. (Scarabaeidae) en el cultivo de la caña de azúcar en Costa Rica. pp. 104-113. En: Shannon P. J.; Carballo, M. (Eds.). Biología y control de Phyllophaga spp. CATIE Serie Técnica, Informe Técnico no. 277. Turrialba, Costa Rica. 132 p. [ Links ]
BADILLA, F. F. 2002. Un programa exitoso de control biológico de insectos plaga de la caña de azúcar en Costa Rica. Manejo Integrado de Plagas y Agroecología (Costa Rica) 64 (2): 77-87. [ Links ]
BURGES, H. D.; HUSSEY, N. W. 1971. Microbial Control of Insects and Mites. Academic Press Londres. 861 p. [ Links ]
CORTEZ, M. H.; ORTIZ, G. C. F.; ALATORRE, R. R.; BRAVO, M. H.; MORA, A. G.; ACEVES, N. L. A. 2003a. Caracterización cultural de cepas de Lecanicillium (= Verticillium) lecanii (Zimm.) Zare y Gams y su patogenicidad sobre Toxoptera aurantii Boyer. Revista Mexicana de Fitopatología 21 (2): 161-167. [ Links ]
CORTEZ, M. H.; ALATORRE, R. R.; MORA, A. G.; BRAVO, M. H.; ORTIZ, G. C. F.; ACEVES, N. L. A. 2003b. Characterization of multisporic and monosporic isolates of Lecanicillium (=Verticillium) lecanii for the management of Toxoptera aurantii in cocoa. Biocontrol 48 (3): 321-334. [ Links ]
CORTEZ, M. H. 2010. Evaluación de aislamientos de hongos entomopatógenos y su virulencia hacia Bactericera cockerelli, según su origen. Fitopatología Colombiana 34 (1): 17-21. [ Links ]
DE BACH, P. 1968. Control biológico de las plagas de insectos y malas hierbas. Ed. Continental, México. 949 p. [ Links ]
DIAZ, B. M.; OGGERIN, M.; LOPEZ, L. C. C.; RUBIO, V.; FERERES, A. 2009. Characterization and virulence of Lecanicillium lecanii against different aphid species. BioControl 54 (6): 825-835. [ Links ]
DIMBI, S. N.; MANIANIA, N. K.; LUX, S. A.; MUEKE, J. M. 2004. Effect of constant temperaturas on germination, radial growth and virulence of Metarhizium anisopliae to three species of African tephritid fruit flies. BioControl 49 (1): 83-94. [ Links ]
DOBERSKI, J.; TRIBE, H. T. 1980. Isolation of entomopatogenouns fungi from elm bark and soil with reference to ecology of Beauveria bassiana and Metarhizium anisopliae. Transactions of the British Mycological Society 74 (1): 95-100. [ Links ]
DRUMMOND, J.; HEALE, J. B. 1988. Genetic studies on the inheritance of pathogenicity in Vertiicillium lecanii against Trialeurodes vaporarorium. Journal of Invertebrate Pathology 52 (1): 57-65. [ Links ]
EKESI, S.; MANIANIA, N. K.; AMPONG, N. K. 1999. Effect of temperature on germination, radial growth and virulence of Metarhizium anisopliae and Beauveria bassiana on Megalurothrips sjostedti. Biocontrol Science and Technology 9 (2): 177-185. [ Links ]
ESTRADA, V. M. N.; VÉLEZ, A. P. E.; LÓPEZ, N. J. C. 1997. Estandarización de una metodología para obtener cultivos monospóricos del hongo Beauveria bassiana. Cenicafé 48 (1): 59-65. [ Links ]
FENG, M. G.; JOHNSON, J. B.; KISH, L. P. 1990. Virulence of Verticillium lecanii and an aphid-derived isolate of Beauveria bassiana (Fungi: Hyphomycetes) for six species or cereal-infesting aphids (Homoptera: Aphididae). Environmental Entomology 19 (3): 815-820. [ Links ]
FEWKES, D. W. 1969. The biology of sugar cane froghoppers. pp. 283-307. En: Williams, J.R.; Metcalfe, J. R.; Mungomery, R. W.; Mathes, R. (Eds.). Pests of sugar cane. Ed. Elsevier Publishing Company. New York. EEUU. 360 p. [ Links ]
FLORES, C. S. 1994. Las plagas de la caña de azúcar en México. Ed. Silverio Flores Cáceres México. 350 p. [ Links ]
GOETTEL, M.; INGLIS, D. 1997. Fungi: Hyphomycetes. pp. 213-249. En: Lacey, L. A. (Ed.). Manual of techniques in insect pathology. Academic Press. San Diego, EEUU. 409 p. [ Links ]
HATTING, L. J.; HUMBER, R. A; POPRAWSKI, T. J.; MILLER, R. M. 1999. A survey of fungal pathogens of aphids from South Africa, with special reference to cereal aphids. Biological Control 16 (1): 112. [ Links ]
HUMBER, R. A. 1997. Fungi: Identification. pp. 153-185. En: Lacey, L. (Ed.). Manual of techniques in insect pathology. Academic Press. San Diego, EEUU. 409 p. [ Links ]
JACKSON, C. W.; HEALE, J. B.; HALL, R. A. 1985. Traits associated with virulence to the aphid Macrosiphoniella sanborni in eighteen isolates of Verticillium lecanii. Annals of Applied Biology 106 (1): 39-48. [ Links ]
LIPA, J. J.; SLIZYNZKI, K. 1973. Wskazówki metodyczne I terminologia dowyznaczania snedniej dawki swiertelnej (LD50) W Patologii Owadow i toksykologii. Prace Naukowe Instytotu Ochrony Roslin 15 (1): 59-83. [ Links ]
MOORE, D.; PRIOR, C. 1993. The potential of mycoinsecticides. Biocontrol News and Information 14 (1): 31-40. [ Links ]
SAMUELS, K. D. Z.; HEALE, J. V.; LLEWELLYN, M. 1989. Characteristics relating to the pathogenicity of Metharhizium anisopliae toward Nilaparvata lugens. Journal of Invertebrate Pathology 53 (1): 25-31. [ Links ]
SAMSON, R. A. 1981. Identification: Entomopathogenic Deuteromycetes. pp. 93-105. In: Burges, H. D. (Ed.). Microbial control of pests and plant diseases. Ed. Academic press, Londres. 949 p. [ Links ]
SAS INSTITUTE. 1998. SAS User´s guide: Statistics. Release 6.03 Ed. SAS Institute INC. Cary, NC. EEUU. 1028 p. [ Links ]
SOPER, R. S.; WARD, M. G. 1980. Production, formulation and application of fungi for insect control. p. 161-180. En: Papavisas, G. C. (Ed.). Biological control in crop production. Allanhead, Osman and Co. Totowa, New Jersey. 390 p. [ Links ]
TANADA, Y.; KAYA, H. 1993. Insect Pathology. Ed. Academic Press. New York. EEUU. 666 p. [ Links ]
TORIELLO, C.; MONTOYA, S. E.; ZAVALA, R. M.; NAVARRO, B. H.; BASILIO, H. D.; HERNÁNDEZ, V. V.; MIER, T. 2008. Virulencia y termotolerancia de cultivos monospóricos de Metarhizium anisopliae var. anisopliae de la mosca pinta (Hemiptera: Cercopidae). Revista Mexicana de Micología 28 (2): 57-66. [ Links ]
UNC. 2010. Unión Nacional de Cañeros A.C. Disponible en: http://www.cañeros.org.mx. [Fecha revisión: 05 marzo 2011] [ Links ].
VIDAL, C.; FARGUES, J.; LACEY, L. A. 1997. Intraspecific variability of Paecilomyces fumosoroseus: Effect of temperature on vegetative growth. Journal of Invertebrate Pathology70 (1): 18-26. [ Links ]