Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.39 no.1 Bogotá Jan./June 2013
Preferencia alimentaria de Neochetina eichhorniae (Coleoptera: Curculionidae) en plantas acuáticas de diferente valor nutritivo
Food preference Neochetina eichhorniae (Coleoptera: Curculionidae) by aquatic plants of different nutritional value
FEDRA SOLANGE MARTÍNEZ1,2, M. CELESTE FRANCESCHINI1,3 y ALICIA POI1,3
1 Centro de Ecología Aplicada del Litoral, Consejo Nacional de Investigaciones Científicas y Técnicas (CECOAL-CONICET). Ruta 5 km 2,5 3400 Corrientes, Argentina.
2 Becaria Doctoral Consejo Nacional de Investigaciones Científicas y Técnicas. Licenciada en Ciencias Biológicas. fedrasolange@yahoo.com.ar. Autor para correspondencia.
3 Catedra de Limnología. Universidad Nacional del Nordeste. Doctora en Biología. celestefranceschini@yahoo.com.ar, guadalupepoi@gmail.com, respectivamente.
Recibido: 17-abril-2012 - Aceptado: 24-abr-2013
Resumen: Neochetina eichhorniae (Coleoptera: Curculionidae) es un herbívoro asociado a los camalotales de Eichhornia crassipes y E. azurea de áreas nativas. Los objetivos de este trabajo fueron: (1) evaluar la preferencia alimentaria de los adultos de N. eichhorniae bajo condiciones naturales, utilizando especies de macrófitas nativas que coexisten con las dos plantas huéspedes y (2) analizar la preferencia alimentaria en relación con el contenido de nitrógeno, fósforo y lignina, como indicadores del valor nutritivo de las hojas. Las especies de plantas estudiadas fueron: E. crassipes, E. azurea, Oxycaryum cubense, Thalia multiflora, Salvinia biloba, Pistia stratiotes, Ludwigia peploides y Nymphaea prolifera. Se realizaron pruebas de preferencia de opción doble y múltiple, utilizando raciones de las macrófitas, en presencia y ausencia de las plantas huéspedes. Se cuantificó, respectivamente, el área total dañada por macrófita y por curculiónido y se correlacionó con el valor nutritivo de las hojas. Las plantas huéspedes, cuya superficie dañada varió entre 115 y 284,76 mm2, fueron las especies preferidas. La superficie dañada tuvo correlación positiva con el contenido de nitrógeno de las hojas de las distintas especies de plantas. El contenido de fósforo, lignina y el cociente L: N no tuvieron relación con la preferencia. Neochetina eichhorniae tuvo especificidad por ambas plantas huéspedes, cuyas hojas tuvieron alto contenido de nitrógeno. Estos resultados constituyen una contribución preliminar debido a que todavía es poco conocido el efecto del valor nutritivo de las macrófitas sobre la preferencia alimentaria de los invertebrados herbívoros en los sistemas acuáticos subtropicales.
Palabras clave: Herbivoría. Gorgojos. Eichhornia crassipes. Especificidad. Nitrógeno.
Abstract: Neochetina eichhorniae (Coleoptera: Curculionidae) is one herbivore associated to Eichhornia crassipes and E. azurea floating meadows in native areas. The aims of this study were: (1) to evaluate the feeding preference of adults of N. eichhorniae under natural conditions, using native species of macrophytes that coexist with the two host plants, and (2) to assess feeding preference in relation to nitrogen, phosphorous and lignin content as indicators of the nutritive value of the leaves. The plant species included in this study were: E. crassipes, E. azurea, Oxycaryum cubense, Thalia multiflora, Salvinia biloba, Pistia stratiotes, Ludwigia peploides and Nymphaea prolifera. Double and multiple-feeding choice tests were performed under natural conditions, using feeding rations, including and excluding the host plants. Total damaged area per macrophyte and leaf area damaged by weevil were quantified and correlated with the different nutritional values of leaves. The host plants, with damage area varied between 115 and 284.76 mm2, were the most preferred plants. There was a positive correlation between the damage area and the leaf nitrogen content of the plant species. Feeding preference was unrelated to either phosphorous and lignin content or L: N ratio. Neochetina eichhorniae have high specificity for both host plants, which leaves had high nitrogen content. Because the effect of the nutritive value on the feeding preference of invertebrate herbivores from the subtropical aquatic systems remain still unknown, these results are an preliminary contribution.
Key words: Herbivory. Weevil. Eichhornia crassipes. Specificity. Nitrogen.
Introducción
Neochetina eichhorniae (Warner, 1970)(Coleoptera: Curculionidae) tiene su ciclo de vida estrechamente asociado a Eichhornia crassipes (Mart.) (Solms-Laubach, 1883) y también ha sido encontrado en E. azurea (Swartz.) (Kunth, 1843) (Pontederiaceae) (Morrone y O´Brien 1999; Cordo et al. 2004). El área de distribución de este curculiónido abarca desde México hasta el sur de América del Sur (O´Brien 1976) y sus plantas huéspedes son malezas altamente invasivas (DeLoach et al. 1976c; Cordo et al. 1978) caracterizadas por formar extensos camalotales en los lagos de las planicies inundables de los grandes ríos y humedales sudamericanos (Barrett y Forno 1982; Rodríguez 1996; Neiff et al. 2001; Neiff 2003) en especial Eichhornia crassipes, cuya naturaleza invasiva que le ha permitido colonizar numerosos lagos tropicales y subtropicales del mundo (Gopal 1973; Waterhouse y Norris 1987). Los adultos de N. eichhorniae se alimentan de las plantas huéspedes removiendo la capa epidérmica y subepidérmica formando pequeñas máculas en la lámina y parte superior del pecíolo, mientras que las larvas forman galerías a lo largo del pecíolo (DeLoach y Cordo 1976b). Las especies de Neochetina y Cornops aquaticum (Bruner, 1906) (Orthoptera: Acrididae) constituyen las poblaciones más abundantes de invertebrados herbívoros en los camalotales de E. crassipes y E. azurea del nordeste de Argentina (Casco y Poi de Neiff 1998; Poi de Neiff y Casco 2003; Franceschini et al. 2007; Franceschini et al. 2010; Franceschini et al. 2011a, 2011b), su herbivoría alcanza hasta el 19 % de la superficie foliar y consumen hasta el 30% de la biomasa de la lamina de la hoja por m2 (Franceschini et al. 2010; 2011b).
Numerosas especies de curculiónidos asociados a ambientes acuáticos han sido utilizados en pruebas de preferencia alimentaria debido a que las plantas huéspedes son altamente invasivas (DeLoach et al. 1976c; Cordo et al. 1978; Forno et al. 1983; Sheldon y Creed 1995; Sousa 2008). Las pruebas de preferencia muestran en general que los curculiónidos consumen en laboratorio la planta huésped pero pueden también alimentarse de otras plantas, no consumidas en condiciones naturales (Cordo et al. 1981; Cordo y DeLoach 1982a; Cordo y DeLoach 1982b; Buckingham y Bennett 1998). En otros casos, los insectos consumen en pruebas de laboratorio las mismas plantas que en la condición de campo (Cordo et al. 1978; Cordo et al. 1981; Sheldon y Creed 1995; Hill 1998).
La selección de la planta huésped por los insectos herbívoros está relacionada con las propiedades químicas y el valor nutritivo que presentan las plantas, especialmente con el contenido de lignina y nutrientes presentes en los tejidos (Rosenthal y Beranbaum 1992; Bernays y Chapman 1994; Heard y Winterton 2000). El efecto del alto contenido de nitrógeno en los tejidos vegetales ha sido bien documentado por varios autores (Mattson 1980; Room et al. 1989; Center y Wright 1991; Morehouse y Rutowski 2010), tanto en los ambientes terrestres como en los acuáticos.
La alimentación y especificidad del género Neochetina fue estudiada en poblaciones de N. bruchi y N. affinis, criadas en laboratorio (DeLoach 1976; DeLoach y Cordo 1976b; Ding et al. 2002; Chen et al. 2005). En general, se encontró una alta especificidad de las especies de Neochetina hacia E. crassipes. DeLoach y Cordo (1981) registraron que los adultosde N. affinis O´Brien, 1976 durante las pruebas de laboratorio prefirieron a E. azurea y, en menor grado, Pontederia (= Reussia) rotundifolia (L. f., 1783), E. crassipes y P. cordata (L., 1753). La preferencia de N. eichhorniae utilizando a E. crassipes como planta huésped fue estudiada en áreas no nativas, bajo condiciones de laboratorio, incluyendo en las pruebas de alimentación plantas cultivadas y otras macrófitas (Shih et al. 1994).
Por su alta especificidad, N. eichhorniae junto con N. bruchi, están siendo utilizadas como agentes de control biológico de E. crassipes en áreas nativas y no nativas (DeLoach y Cordo 1976a, 1983; Cordo 1999; Center et al. 2002). En este contexto, las pruebas de opción múltiple y doble con diferentes macrófitas, incluyendo y excluyendo a las plantas huéspedes (Sheppard et al. 2005) son de mucha utilidad para realizar predicciones sobre la preferencia y comportamiento de las poblaciones de herbívoros, especialmente cuando la abundancia y cobertura de las plantas huéspedes disminuyen drásticamente por algún factor ambiental. Sumado a esto, en la amplia área nativa de distribución de estos curculiónidos, cada región presenta un ensamble particular de macrófitas que coexisten con las plantas huéspedes, que deben ser incluidas en las pruebas de preferencia. En ecosistemas no nativos donde los herbívoros son introducidos como agentes de control, este ensamble de macrófitas puede resultar aún bastante diferente respecto a las áreas nativas.
El objetivo de este trabajo fue 1) determinar la preferencia alimentaria de los adultos de N. eichhorniae bajo condición de campo, incluyendo plantas acuáticas que coexisten con las plantas huéspedes; 2) analizar la preferencia en relación al contenido de nitrógeno, fósforo y lignina, como indicadores del valor nutritivo de las hojas.
Se plantearon las siguientes hipótesis:
1) Neochetina eichhorniae tiene mayor preferencia por E. crassipes.
2) El consumo es mayor en las hojas de las macrófitas que tienen mayor contenido de nitrógeno y menor contenido de lignina.
Materiales y métodos
Las plantas acuáticas utilizadas en las pruebas de preferencia fueron colectadas en una laguna de la planicie de inundación del río Paraná (Chaco: 27°26’S 58°51’O) y en una laguna no conectada a un sistema fluvial (Corrientes: 27°30’S 58°45’O), donde predominan camalotales de E. crassipes y E. azurea, respectivamente.
Las experiencias se realizaron en el Centro de Ecología Aplicada del Litoral (CECOAL) (26°46’S 58°50’O) durante el verano y bajo la influencia del clima local, pero sin exposición solar directa, debido a que en los meses de verano se registran los picos de abundancia de las poblaciones de herbívoros en los ambientes naturales (Casco y Poi de Neiff 1998; Franceschini et al. 2007, 2011a; Franceschini 2008) y un mayor porcentaje de lámina foliar dañada en las plantas huéspedes (DeLoach y Cordo 1976a; Franceschini et al., 2010, 2011b). El CECOAL está ubicado en las cercanías de los ambientes naturales donde se obtuvieron las plantas y los individuos de Neochetina. La temperatura promedio durante las experiencias varió entre 19,2 y 34,2 ºC.
Para analizar la preferencia se realizaron pruebas de opción múltiple y doble con y sin las plantas huéspedes siguiendo el criterio de Sheppard et al. (2005). Se utilizaron las siguientes especies de macrófitas: E. crassipes y E. azurea (Pontederiaceae), Oxycaryum cubense (Poepp y Kunth, 1908) Palla(Cyperaceae), Thalia multiflora (Horkel ex Körn, 1862) (Marantaceae), Salvinia biloba (Raddi,1825) (Salviniaceae), Pistia stratiotes (L., 1753)(Araceae), Ludwigia peploides (Kunth ) (P. H. Raven, 1963)(Onagraceae), Nymphaea prolifera (Wiersema, 1984) (Nymphaeaceae).
Para armar las raciones se cortaron porciones de 25 cm2 de las hojas de cada especie de planta (Cronin et al. 1998; Dorn et al. 2001), cuidando de no incluir en las mismas algún tipo de daño. Las raciones se distribuyeron en ocho tratamientos (Tabla 1) con seis repeticiones en el tratamiento 5 y cinco repeticiones en los tratamientos restantes.
Las raciones se colocaron en recipientes transparentes de 32 cm longitud, 23 cm de ancho x 11 cm profundidad, con una base de algodón y papel de filtro humedecido y fueron tapados en la parte superior para mantener un microclima con elevada humedad, característico de los camalotales. Los gorgojos utilizados en los ensayos fueron obtenidos de poblaciones naturales con dominancia de N. eichhorniae.
Se colocaron diez curculiónidos por recipiente, alcanzando un N total de 387 individuos al final de la experiencia. Previamente, los curculiónidos fueron sometidos a cuatro horas de ayuno con la intención de descartar los posibles errores metodológicos relacionados con los mecanismos de saciedad (Basset 1994), experiencia y aprendizaje (Bernays 1989; Bernays y Simpson 1990; Bernays y Chapman 1994; Sheppard et al. 2005).
Para analizar la preferencia, las especies de plantas se sometieron al consumo de los adultos durante 24 horas; transcurrido ese tiempo, las plantas ofrecidas se retiraron de los recipientes y la preferencia se evaluó considerando que la planta preferida es la más consumida. El consumo se evaluó contando el número de máculas producidas por los gorgojosen cada especie de planta. Como la superficie promedio de la mácula es de 2,77 mm2 en el haz y 0,87 mm2 en el envés (Franceschini et al. 2010), una vez contado el número de máculas, se calculó la superficie dañada para cada hoja. Se calculó el daño por cada individuo, no considerando aquellos gorgojos que al refugiarse quedaban atrapados en la cama de algodón; este número siempre fue inferior a dos por cada recipiente, sobre un total de diez. Finalizada las experiencias, los gorgojos fueron fijados en alcohol al 70% y se procedió a la identificación taxonómica (DeLoach 1975), que requiere para la separación de las especies de Neochetina una cuidadosa observación bajo microscopio estereoscópico de los caracteres morfológicos. Las repeticiones donde se detectó la presencia de N. bruchi fueron excluidas de este estudio.
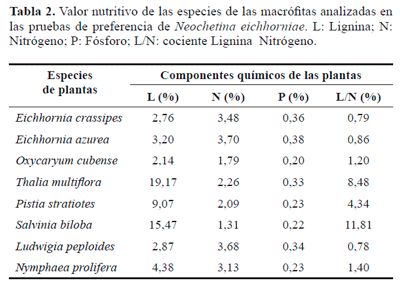
Para analizar el valor nutritivo de las hojas, se tomaron muestras de diez hojas de cada especie de macrófita, las cuales se secaron en estufa a 60 °C para el posterior análisis del contenido de nitrógeno y fósforo (Método de Kjendähl) y lignina (método de análisis de fibra de Ankon) en los tejidos. Los análisis químicos fueron realizados por el Laboratorio de Análisis de la Universidad Católica Argentina (Buenos Aires, Argentina) y el Laboratorio de Química-Física de la Facultad de Ciencias Agrarias Universidad Nacional del Nordeste (Corrientes, Argentina).
Los valores se expresaron como promedio ( ) y desvío estándar. Para analizar las diferencias en el consumo entre especies de plantas y determinar la preferencia se utilizaron los Modelos Lineales Generales y Mixtos (MLG Mixtos), ya que estos contemplan la dependencia existente entre tratamientos y son más potentes que otros modelos (Mangeaud y Videla 2005). Se consideraron significativas las diferencias con un P < 0,05. Se realizaron correlaciones utilizando el coeficiente de Spearman para probar las asociaciones entre los factores químicos indicadores del valor nutritivo de las plantas estudiadas y el consumo total de cada una de ellas. Los análisis estadísticos se realizaron con el Software Infostat (versión 2011).
Resultados
Preferencia alimentaria de N. eichhorniae. Los valores de superficie dañada oscilaron entre 115 y 156 mm2 para E. crassipes y para E azurea entre 113,57 y 284,76 mm2 (Tabla 1). Independiente que estuvieran o no las plantas huéspedes, los valores de consumo para O. cubense, T. multiflora, S. biloba, P. stratiotes, L. peploides, N. prolifera fueron inferiores a 17,7 mm2 (Tabla 1). La superficie dañada por N. eichhorniae varió significativamente entre las especies de plantas utilizadas en los tratamiento 1 (MLG Mixtos F = 41,61; P = < 0,0001) y 2 (MLG Mixtos F = 121,75; P = < 0,0001) resultando E. crassipes y E. azurea las plantas preferidas en cada tratamiento, respectivamente (Tabla 1). En el tratamiento 3 el consumo no varió significativamente entre las especies de plantas analizadas (MLG Mixto F = 1,75; P = 0,1963).
Por lo contrario, en el tratamiento 4 la superficie dañada por los adultos de N. eichhorniae fue significativamente diferente entre las distintas especies de plantas (MLG Mixtos F = 46,15; P = < 0,0001). El post test separó a P. stratiotes, N. prolifera, L. peploides con bajos valores de superficie dañada, de E. crassipes y E. azurea que resultaron las plantas preferidas. En el tratamiento 5 la superficie dañada por los adultos de N. eichhorniae en E. crassipes y E. azurea fue significativamente mayor respecto de T. multiflora y O. cubense (MLG mixtos F = 20,34; P = < 0,0001). La superficie dañada por N. eichhorniae varió significativamente entre E. azurea, O. cubense y T. multiflora en el tratamiento 6 (MLG Mixtos F = 27,51; P = < 0,0001) en el cual E. azurea, resultó la especie preferida.
Cuando no se incluyeron a las plantas huéspedes (tratamiento 7), el consumo no varió significativamente entre O. cubense y T. multiflora (MLG Mixtos F = 0,00; P = > 0,9999). No hubo diferencias significativas entre el daño registrado en E. crassipes y E. azurea (MLG Mixtos F = 2,42; P = 0,1582) en el tratamiento 8, que consideró sólo a las dos plantas huéspedes. Enlas hojas de E. azurea, la superficie dañada registrada en el haz ( = 76,45) no fue significativamente diferente (MLG Mixtos F = 1,49; P = 0,2573) respecto al envés ( = 116,34). En E. crassipes tampoco se observaron diferencias significativas (MLG Mixtos F = 0,73; P = 0,4172) entre el daño producido en el haz ( = 43,77) y el envés ( = 71,47) de la hoja.
Valor nutritivo de las macrófitas y preferencia de N. eichhorniae. Eichhornia azurea fue la macrófita que presentó mayor porcentaje de nitrógeno; estos valores también fueron altos en L. peploides y E. crassipes, mientras que fueron bajos en S. biloba, O. cubense, P. stratiotes y T. multiflora. E. azurea registró también el mayor contenido de fósforo, seguida en orden de importancia por E. crassipes (Tabla 2). En cuanto al contenido de lignina, los porcentajes más altos correspondieron a S. biloba, T. multiflora y los más bajos a E. crassipes y E. azurea. En S. biloba los valores de lignina fueron menores en las hojas (15,47%) que en las lacinias (17,24%). El coeficiente de correlación de Spearman obtenido entre el contenido de nitrógeno y consumo total de cada especie de planta fue de 0,76 (prueba de Spearman p < 0,05). El contenido de lignina, el cociente lignina- nitrógeno y contenido de fósforo no tuvieron correlación con el consumo total de cada especie de planta (prueba de Spearman P = > 0,05).
Discusión
Existen diversos estudios que demuestran la importancia de N. eichhorniae como herbívoro, por el daño que ocasiona a los camalotales de E. crassipes en áreas nativas (Poi de Neiff et al. 1977; Casco y Poi de Neiff 1998; Poi de Neiff y Casco 2003; Franceschini et al. 2010) y no nativas (Julien et al. 2001). Los resultados de este estudio bajo condiciones controladas durante las pruebas de preferencia de opción múltiple, muestran que N. eichhorniae prefiere por igual a las dos plantas huéspedes. Bajo condiciones de laboratorio y utilizando plantas enteras en las pruebas de preferencia, DeLoach (1976) registra un mayor consumo de E. crassipes respecto a E. azurea por estecurculiónido. Similares valores de daño en el haz y envés de las hojas de las plantas huéspedes es coincidente con lo encontrado por DeLoach y Cordo (1976b). En condiciones de campo no hemos observado poblaciones de Neochetina spp. en los camalotales de E. azurea, a diferencia de lo que ocurre en E. crassipes. Si bien en las hojas de ambas plantas huéspedes se ha obtenido similar valor nutritivo y según Sculthorpe (1967) presentan similares características anatómicas, la arquitectura de la planta de E. crassipes, principalmente las hojas envainadas dispuestas en rosetas, proporcionarían refugio para los adultos de Neochetina spp. creando un hábitat propicio (DeLoach y Cordo 1976b).
En experiencias de preferencia realizadas con larvas de Bagous affinis (Hustache, 1926) (Coleoptera: Curculionidae)con tallos y tubérculos de Hydrilla verticilata (L. fils,) (Royle, 1839), los tubérculos, con menor contenido de nitrógeno fueron preferidos sobre los tallos debido a que son más apropiados como hábitat para el crecimiento y desarrollo larval (Wheeler y Center 2007). En Salvinia molesta (D.S. Mitchell, 1972)y S. minima (Baker, 1886) (Salviniaceae)la elección de planta huésped por Cyrtobagous salviniae (Calder y Sands, 1985) (Coleoptera: Curculionidae), se basó en el tamaño de la planta, siendo más preferidas las plantas con rizoma de suficiente diámetro para la actividad minadora de las larvas (Tipping y Center 2005).
DeLoach (1976) encontró que las poblaciones de Neochetina bruchi del centro de Argentina son altamente especificas de E. crassipes y que raras veces se alimentan y oviponen en E. azurea y otras Pontederiaceae. Coincidentemente, en áreas no nativas, N. eichhorniae y N. bruchi muestran también alta preferencia alimentaria por E. crassipes (Shih et al. 1994; Ding et al. 2002; Chen et al. 2005).
Los valores bajos de preferencia registrados en este estudio para P. stratiotes, L. peploides, T. multiflora, O. cubense, N. prolifera y S. biloba indican que estas especies no serían consumidas en condiciones naturales por N. eichhorniae. En el área de estudio, Poi de Neiff y Casco (2003) y Casco y Poi de Neiff (1998) registran otras especies de Curculionidae asociadas a estas macrófitas.
Los resultados en este estudio muestran que los insectos prefirieron en general las plantas con mayor contenido de nitrógeno. Según Bernays y Chapman (1994), este nutriente es requerido para el desarrollo y crecimiento óptimo de los insectos herbívoros. Los valores de proteína bruta registrados en E. crassipes, N. prolifera y P. stratiotes por otros autores (Boyd 1969; Boyd y Blackburn 1970; Linn et al. 1975; Henry-Silva y Camargo 2006) indican que el contenido de nitrógeno obtenido para estas macrófitas en este estudio, está dentro de ese rango de valores.
Las plantas con mayor contenido de lignina fueron en general las menos preferidas. Esto es coincidente con lo mencionado por varios autores que puntualizan que este compuesto actúa como elemento disuasorio de la alimentación, interviniendo en la dureza de los tejidos y reduciendo la palatabilidad (Rosenthal y Beranbaum 1991; Zamora et al. 1999; Elger et al. 2006). Los valores de lignina registrados en S. biloba fueron comparables a los obtenidos para S. molesta (Moozhiyil y Pallauf 1986). Según estos autores, la alta cantidad de lignina de esta especie reduce la aceptación y la digestibilidad y, por lo tanto, el uso de esta macrófita como potencial recurso alimentario para los rumiantes. La concentración de lignina de P. stratiotes registrado en este estudio, es comparable al encontrado por Rodríguez y Palma (2000) quienes mencionan la limitación del uso de esta especie como alimento. El valor de lignina de N. prolifera es similar al registrado para N. tuberosa por Linn et al. (1975). Las plantas más preferidas, E. azurea y E. crassipes, presentaron porcentajes bajos de lignina, coincidiendo con lo obtenido por Poi de Neiff et al. (2006). Sin embargo, nuestros resultados muestran que la alimentación de N. eichhorniae está correlacionada solamente con los niveles de nitrógeno.
En el caso de N. prolifera y L. peploides hay que destacar que, si bien registró un alto contenido de nitrógeno y bajo de lignina, estas especies fueron consumidas en bajas proporciones, por lo que serían otros factores los que limitarían su selección por parte de los curculiónidos. Bolser et al. (1998) señalan que la palatabilidad de las macrófitas está determinada principalmente por la dureza de los tejidos y también por la cantidad de productos químicos disuasivos, mientras que para Newman et al. (1996) la calidad nutritiva de los tejidos puede también influir en la palatabilidad, pero es de importancia secundaria en la preferencia del herbívoro. Según Lodge et al. (1998) para que una macrófita tenga un alto consumo por un invertebrado herbívoro, debe tener una estructura morfológica y consistencia adecuada de los tejidos, ser nutritiva y carecer de sustancias químicas disuasivas.
Los resultados de preferencia obtenidos indican la especificidad de N. eichhorniae hacia las dos plantas huéspedes, por lo tanto se acepta parcialmente la primera hipótesis propuesta. La segunda hipótesis, i.e. que el consumo de N. eichhorniae es mayor en macrófitas que tienen mayor contenido de nitrógeno y menor contenido de lignina, también es aceptada parcialmente, debido a que algunas macrófitas fueron poco consumidas aún cuando presentaron alto contenido de nitrógeno y bajos valores de lignina.
En la mayoría de las macrófitas consideradas en las pruebas de preferencia, el nitrógeno fue un factor determinante en la preferencia de N. eichhorniae. Sin embargo en el caso de N. prolifera y L. peploides se plantea que el valor nutritivo no es el único motivo de selección por parte de los curculiónidos, y que sería aconsejable evaluar factores tales como la presencia de otras sustancias químicas, la consistencia de las hojas, las características morfoanatómicas de las plantas, entre otras.
En síntesis, N. eichhorniae tiene especificidad hacia las plantas huéspedes y los valores de consumo se relacionan con el contenido de nitrógeno de las hojas. Estos resultados constituyen una contribución preliminar debido a que todavía es poco conocido el efecto del valor nutritivo de las macrófitas sobre la preferencia alimentaria de los invertebrados herbívoros en los sistemas acuáticos subtropicales.
Agradecimientos
Este estudio fue financiado por el proyecto PICT 07-12755 y PICT 2011-2160 del FONCYT (Argentina).
Literatura citada
BARRETT, S. C. H.; FORNO, I. W. 1982. Style morph distribution in new world populations of Eichhornia crassipes (Mart.) Solms-Laubach (water hyacinth). Aquatic Botany 13: 299-306. [ Links ]
BASSET, Y. 1994. Palatability of tree foliage to chewing insects: a comparison between a temperate and a tropical site. Acta Oecologica 15 (2): 181-191. [ Links ]
BERNAYS, E. A. 1989. Insect plant interactions. Vol. I. CRC Press. Florida. Estados Unidos. 198 p. [ Links ]
BERNAYS, E. A.; CHAPMAN, R. F. 1994. Host-plant selection by phytophagous insects. Chapman & Hall. New York. Estados Unidos. 312 p. [ Links ]
BERNAYS, E. A.; SIMPSON, S. J. 1990. Nutrition. pp. 105-128. En: Chapman, R. F.; Joern, A. (Eds.). Biology of grasshoppers. John Wiley & Sons. New York. Estados Unidos. 563 p. [ Links ]
BOLSER, R. C.; HAY, M. E.; LINDQUIST, N.; FENICAL, W.; WILSON, D. 1998. Chemical defenses of freshwater macrophytes against crayfish herbivory. Journal of Chemical Ecology 24 (10): 1639-1658. [ Links ]
BOYD, C. E. 1969. The nutritive value of three species of water weed. Economic Botany 23 (2): 123-127. [ Links ]
BOYD, C. E.; BLACKBURN, R. D. 1970. Seasonal changes in the proximate composition of some common aquatic weeds. Hyacinth Control Journal 8 (2): 42-44. [ Links ]
BUCKINGHAM, G. R.; BENNETT, C. A. 1998. Host range studies with Bagous affinis (Coleoptera: Curculionidae), an indian weevil that feeds on Hydrilla tubers. Environmental Entomology 27 (2): 469-470. [ Links ]
CASCO, S. L.; POI DE NEIFF, A. S. 1998. Daño ocasionado por adultos de Neochetina spp.(Coleoptera: Curculionidae) a Eichhornia crassipes en la planicie del río Paraná. FACENA (Argentina) 14: 31-43. [ Links ]
CENTER, T. D.; WRIGHT, A. D. 1991. Age and phytochemical composition of waterhyacinth (Pontederiaceae) leaves determine their acceptability to Neochetina eichhorniae (Coleoptera: Curculionidae). Environmental Entomology 20 (1): 323-334. [ Links ]
CENTER, T. D.; HILL, M. P.; CORDO, H.; JULIEN, M. H. 2002. Waterhyacinth. pp. 41-64. En: Van Driesche, R. G.; Blossey, B.; Hoddle, M.; Lyon, S.; Reardon, R. (Eds.). Biological control of invasive plants in the eastern United States. USDA-Forest Service, Forest Health Technology EnterpriseTeam. Morgantown. West Virginia. Estados Unidos. 413 p. [ Links ]
CHEN, R. X.; YE, G. Y., WANG, Y. J.; GU, B. Q.; ZHANG, C. F.; YING, X. L.; SHEN, J. 2005. The host specificity of water hyacinth weevils and their controlling effects against water hyacint in Ningbo district. Acta Agriculturae Zhejiangensis (China) 17 (2): 74-78. [ Links ]
CORDO, H. A. 1999. New agents for biological control of water hyacinth. pp. 68-74. En: Hill, M. P.; Julien, M. H.; Center, T. D. (Eds.). Proceeding of the first IOBC global working group meeting for the biological and integrated control of water hyacinth. Plant Protection Research Institute. Pretoria. Sudáfrica. 182 p. [ Links ]
CORDO, H. A.; DELOACH, C. J. 1982a. Notes on the weevils Tyloderma, Auleutes, and Onychylis that feed on Ludwigia and other aquatic plants in southern South America. The Coleopterists Bulletin 36 (2): 291-297. [ Links ]
CORDO, H. A.; DELOACH, C. J. 1982b. Weevils Listronotus marginicollis and L. cinnamomeus that feed on Limnobium and Myriophyllum in Argentina. The Coleopterists Bulletin 36 (2): 302-308. [ Links ]
CORDO, H. A.; DELOACH, C. J.; RUNNACLES, J.; FERRER, R. 1978. Argentinorhynchus bruchi, a weevil from Pistia stratiotes in Argentina: biological studies. Environmental Entomology 7 (2): 329-333. [ Links ]
CORDO, H. A.; DELOACH, C. J.; FERRER, R. 1981. Biological studies on two weevils, Ochetina bruchi and Onychylis cretatus, collected from Pistia and other aquatic plants in Argentina. Annals of the Entomological Society of America 74 (4): 363-369. [ Links ]
CORDO, H. A.; LOGARZO, G.; BRAUN, K.; DI IORIO, O. R. 2004. Catálogo de insectos fitófagos de la Argentina y sus plantas asociadas. South American Biological Control Laboratory USDA-ARS y Sociedad Entomológica Argentina. Buenos Aires. Argentina. 734 p. [ Links ]
CRONIN, G.; WISSING, K. D.; LOGDE, D. M. 1998. Comparative feeding selectivity of herbivorous insects on water lilies: aquatic vs. semi- terrestrial insects and submersed vs. floating leaves. Freshwater Biology 39: 243-257. [ Links ]
DELOACH, C. J. 1975. Identification and biological notes on the species of Neochetina that attack Pontederiaceae in Argentina (Coleoptera: Curculionidae: Bagoini). The Coleopterists Bulletin 29 (4): 257-266. [ Links ]
DELOACH, C. J. 1976. Neochetina bruchi, a biological control agent of waterhyacinth: host specificity in Argentina. Annals of the Entomological Society of America 69 (4): 635-642. [ Links ]
DELOACH, C. J.; CORDO, H. A. 1976a. Ecological studies of Neochetina bruchi and N. eichhorniae on waterhyacinth in Argentina. Journal of Aquatic Plant Management 14: 53-59. [ Links ]
DELOACH, C. J.; CORDO, H. A. 1976b. Life cycle and biology of Neochetina bruchi, a weevil attacking waterhyacinth in Argentina, with notes on N. eichhorniae. Annals of the Entomological Society of America 69 (4): 643-652. [ Links ]
DELOACH, C. J.; CORDO, H. A. 1981. Biology and host range of the weevil Neochetina affinis, which feeds on Pontederiaceae in Argentina. Annals of the Entomological Society of America 74 (1): 14-19. [ Links ]
DELOACH, C. J.; CORDO, H. A. 1983. Control of waterhyacinth by Neochetina bruchi (Coleoptera: Curculionidae: Bagoini) in Argentina. Environmental Entomology 12 (1): 19-23. [ Links ]
DELOACH, C. J.; DELOACH, A. D.; CORDO, H. A. 1976c. Neohydronomus pulchellus, a weevil attacking Pistia stratiotes in South America: biology and host specificity. Annals of the Entomological Society of America 69 (5): 830-834. [ Links ]
DING, J.; CHEN, Z.; FU, W.; FAN, Z.; WANG, R. 2002. The biology and host range of water hyacinth weevil, Neochetina eichhorniae, an insect agent for the control of the weed. Chinese Journal of Biological Control 18 (4): 153-157. [ Links ]
DORN, N. J.; CRONIN, G.; LODGE, D. M. 2001. Feeding preferences and performance of an aquatic lepidopteran on macrophytes: plant hosts as food and habitat. Oecologia 128: 406-415. [ Links ]
ELGER, A.; BARRAT-SEGRETAIN, M. H.; WILLBY, N. J. 2006. Seasonal variability in the palatability of freshwater macrophytes: a case study. Hydrobiologia 570: 89-93. [ Links ]
FORNO, I. W.; SANDS, D. P. A.; SEXTON, W. 1983. Distribution, biology and host specifity of Cyrtobagous singularis Hustache (Coleoptera: Curculionidae) for the biological control of Salvinia molesta. Bulletin of Entomological Research 73 (1): 85-95. [ Links ]
FRANCESCHINI, M. C. 2008. Biología y ecología de la tucura semiacuática Cornops aquaticum (Orthoptera: Acrididae: Leptysminae) en relación a dos macrófitas dominantes en humedales del nordeste de Argentina: Eichhornia crassipes y E. azurea (Pontederiaceae).Universidad de la Plata. La Plata. Argentina. 222 p. [ Links ]
FRANCESCHINI, M. C.; ADIS, J.; POI DE NEIFF, A. S.; DE WYSIECKI, M. L. 2007. Fenología de Cornops aquaticum Bruner (Orthoptera: Acrididae: Leptysminae), en un camalotal de Eichhornia azurea (Pontederiaceae) en Argentina. Amazoniana 19: 149-158. [ Links ]
FRANCESCHINI, M. C.; POI DE NEIFF, A.; GALASSI, M. E. 2010. Is the biomass of water hyacinth lost through herbivory in native areas important?. Aquatic Botany 92: 250-256. [ Links ]
FRANCESCHINI, M. C.; DE WYSIECKI, M. L.; POI DE NEIFF, A.; GALASSI, M. E.; MARTÍNEZ, F. S. 2011a. The role of the host-specific grasshopper Cornops aquaticum (Orthoptera: Acrididae) as consumer of native Eichhornia crassipes (Pontederiaceae) floating meadows. Revista de Biología Tropical 59 (3): 1407-1418. [ Links ]
FRANCESCHINI, M. C.; MARTÍNEZ, F. S.; POI, A. S. 2011b. Herbivoría en hojas de Eichhornia azurea y E. crassipes (Pontederiaceae). IX Congreso Venezolano de Ecología. Instituto Nacional de Investigaciones. Venezuela. 335 p. [ Links ]
GOPAL, B. 1973. A survey of the indian studies on ecology and production of wetland and shallow water communities. Polish Archives of Hydrobiology 20 (1): 21-29. [ Links ]
HEARD, T. A.; WINTERTON, S. L. 2000. Interactions between nutrient status and weevil herbivory in the biological control of water hyacinth. The Journal of Applied Ecology 37: 117-127. [ Links ]
HENRY-SILVA, G. G.; CAMARGO, A. F. M. 2006. Composição química de macrófitas aquáticas flutuantes utilizadas no tratamento de efluentes de aqüicultura. Planta Daninha 24 (1): 21-28. [ Links ]
HILL, M. P. 1998. Life history and laboratory host range of Stenopelmus rufinasus, a natural enemy for Azolla filiculoides in South Africa. Biocontrol 43 (2): 215-224. [ Links ]
JULIEN, M. H.; HILL, M. P.; CENTER, T. D.; Ding, J. 2001. Biological and integrated control of water hyacinth, Eichhornia crassipes. Proceedings of the Second Meeting of the Global Working Group for the Biological and Integrated Control of Water Hyacinth, Beijing, China, 9-12 October 2000. Australian Centre for International Agricultural Research Proceedings Nº 102. Canberra. Australia. 152 p. [ Links ]
LINN, J. G.; STABA, E. J.; GOODRICH, R. D.; MEISKE, J. C.; OTTERBY, D. E. 1975. Nutritive value of dried or ensiled aquatic plants. I. Chemical composition. Journal of Animal Science 41 (2): 601-609. [ Links ]
LODGE, D. M.; CRONIN, G.; VAN DONK, E.; FROELICH, A. J. 1998. Impact of herbivory on plant standing crop: comparisons among biomes, between vascular and nonvascular plants, and among freshwater herbivore taxa. pp. 149-174. En: Jeppesen, E.; Søndergaard, M.; Søndergaard, M.; Christoffersen, K. (Eds.). The structuring role of submerged macrophytes in lakes. Springer-Verlag. New York. Estados Unidos. 452 p. [ Links ]
MATTSON, W. J. JR. 1980. Herbivory in relation to plant nitrogen content. Annual Review of Ecology and Systematics 11: 119-161. [ Links ]
MANGEAUD, A.; VIDELA, M. 2005. En busca de la independencia perdida: la utilización de modelos lineales generalizados mixtos en pruebas de preferencia. Ecología Austral 15 (2): 199-206. [ Links ]
MOOZHIYIL, M.; PALLAUF, J. F. 1986. Chemical composition of the water fern, Salvinia molesta, and its potential as feed source for ruminants. Economic Botany 40 (3): 375-383. [ Links ]
MOREHOUSE, N. I.; RUTOWSKI, R. L. 2010. Developmental responses to variable diet composition in the cabbage white butterfly, Pieris rapae: the role of nitrogen, carbohydrates and genotype. Oikos 119: 636-645. [ Links ]
MORRONE, J. J.; O´BRIEN, C. W. 1999. The aquatic and semiaquatic weevils (Coleoptera: Curculionoidea: Curculionidae, Dryophthoridae and Erirhinidae) of Argentina, with indication of their host plants. Physis Sección C 57 (132-133): 25-37. [ Links ]
NEIFF, J. J. 2003. Distribución de la vegetación acuática y palustre del Iberá. pp. 3-15. En: Poi de Neiff, A. (Ed.) Limnología del Iberá. Aspectos físicos, químicos y biológicos de las aguas. Editorial Universitaria de la Universidad Nacional del Nordeste. Corrientes. Argentina. 191 p. [ Links ]
NEIFF, J. J.; NEIFF, A. P.; CASCO, S. A. L. 2001. The effect of prolonged floods on Eichhornia crassipes growth in Paraná river floodplain lakes. Acta Limnologica Brasiliensia 13 (1): 51-60. [ Links ]
NEWMAN, R. M.; KERFOOT, W. C.; HANSCOM III, Z. 1996. Watercress allelochemical defends high-nitrogen foliage against consumption: effects on freshwater invertebrate herbivores. Ecology 77 (8): 2312-2323. [ Links ]
O´BRIEN, C. W. 1976. A taxonomic revision of the New World subaquatic genus Neochetina (Coleoptera: Curculionidae: Bagoini). Annals of the Entomological Society of America 69 (2): 165-174. [ Links ]
POI DE NEIFF, A. S.; CASCO, S. L. 2003. Biological agents that accelerate winter decay of Eichhornia crassipes Mart. Solms. in northeastern Argentina. pp. 127-144. En: Thomaz, S. M.; Bini, L. M. (Eds.). Ecología e manejo de macrófitas aquáticas. Maringá. Brasil. 341 p. [ Links ]
POI DE NEIFF, A.; NEIFF, J. J.; BONETTO, A. 1977. Enemigos naturales de Eichhornia crassipes en el nordeste argentino y posibilidades de su aplicación al control biológico. Ecosur 4 (8): 137-156. [ Links ]
POI DE NEIFF, A.; NEIFF J. J.; CASCO, S. L. 2006. Leaf litter decomposition in three wetland types of the Paraná river floodplain. Wetlands 26 (2): 558-566. [ Links ]
RODRÍGUEZ, R. J. C. 1996. Estudios taxoecológico y de la dinámica poblacional de macrófitas acuáticas flotantes en la Laguna Castillero de Caicara del Orinoco, estado Bolívar. Informe Final, Proyecto CI-2011-00685/94. Universidad de Oriente. Venezuela. 177 p. [ Links ]
RODRÍGUEZ, R. J. C.; PALMA, J. 2000. Valor nutritivo del repollito de agua (Pistia stratiotes L.) y su posible uso en la alimentación animal. Zootecnia Tropical (Venezuela) 18 (2): 213-226. [ Links ]
ROOM, P. M.; JULIEN, M. H.; FORNO, I. W. 1989. Vigorous plants suffer most from herbivores: latitude, nitrogen and biological control of the weed Salvinia molesta. Oikos 54 (1): 92-100. [ Links ]
ROSENTHAL, G. A.; BERENBAUM, M. R. 1991. Herbivores. Their interactions with secondary plant metabolites. Vol I: The Chemical participants. Academic Press INC. New York. Estados Unidos. 468 p. [ Links ]
ROSENTHAL, G. A.; BERENBAUM, M. R. 1992. Herbivores. Their interactions with secondary plant metabolites. Vol. II: Evolutionary and ecological processes. Academic Press INC. New York. Estados Unidos. 493 p. [ Links ]
SCULTHORPE, C. D. 1967. The biology of acuatic vascular plant. Edward Arnold, Ltd. Londres. Inglaterra. 610 p. [ Links ]
SHEPPARD, A. W.; VAN KLINKEN, R. D.; HEARD, T. 2005. Scientific advances in the analysis of direct risks of weed biological control agents to non-target plants. Biological Control 35: 215-226. [ Links ]
SHELDON, S. P.; CREED, R. P. JR. 1995. Use of a native insect as a biological control for an introduced weed.Ecological Applications 5 (4): 1122-1132. [ Links ]
SHIH, C. I. T.; CHEN, H. Y.; WANG, C. J. 1994. Host range and preference of water hyacinth weevils, Neochetina eichhorniae Warner (Coleoptera: Curculionidae). Chinese Journal of Entomology 14: 281-290. [ Links ]
SOUSA, O. W. 2008. Curculionídeos (Insecta, Coleoptera) associados às macrófitas aquáticas no pantanal Mato-Grossense e Amazônia Central: Taxonomia, ecologia, testes alimentar e de mergulho. Universidade Federal do Paraná. Curitiba. Brasil. 179 p. [ Links ]
TIPPING, P. W.; CENTER, T. D. 2005. Influence of plant size and species on preference of Cyrtobagous salviniae adults from two populations. Biological Control 32: 263-268. [ Links ]
WATERHOUSE, D. F.; NORRIS, K. R. 1987. Eichhornia crassipes (Marthius) Solms-Laubach. pp. 332-341. En: Waterhouse, D. F.; Norris, K. R. (Eds.). Biological control pacific prospect. Inkata Press. Melbourne. Australia. 454 p. [ Links ]
WHEELER, G. S.; CENTER, T. D. 2007. Hydrilla stems and tubers as hosts for three Bagous species: two introduced biological control agents (Bagous hydrillae and B. affinis) and one native species (B. restrictus). Environmental Entomology 36 (2): 409-415. [ Links ]
ZAMORA, R. J.; HODAR, A.; GÓMEZ, J. M. 1999. Plant-herbivore interaction beyond a binary vision. pp. 677-718. En: Pugnaire, F.; Valladares, F. (Eds.). Handbook of functional plant ecology. Marcel Dekker. New York. Estados Unidos. 920 p. [ Links ]