Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.39 no.1 Bogotá Jan./June 2013
Estados inmaduros de Iridopsis parrai (Lepidoptera: Geometridae)
Immature stages of Iridopsis parrai (Lepidoptera: Geometridae)
Héctor A. Vargas1 y Luis E. Parra2
1 Dr. Sc. Departamento de Recursos Ambientales, Facultad de Ciencias Agronómicas, Universidad de Tarapacá, Casilla 6-D, Arica, Chile. havargas@uta.cl. Autor para correspondencia.
2 Dr. Sc. Departamento de Zoología, Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción, Casilla 160-C, Concepción, Chile. luparra@udec.cl.
Recibido: 27-dic-2010 - Aceptado: 13-mar-2013
Resumen: Se describe e ilustra el huevo, la larva y la pupa de Iridopsis parrai (Lepidoptera: Geometridae). Se detectó variación en el número de aberturas micropilares y de rosetas micropilares del huevo. La morfología externa es descrita por primera vez para la larva de primer instar de una especie de Iridopsis. Se detectaron dos morfos a partir del tercer instar larval. Los resultados son discutidos en relación con la literatura disponible.
Palabras clave: Boarmiini. Morfología. Neotropical.
Abstract: Egg, larva and pupa of Iridopsis parrai (Lepidoptera: Geometridae) are described and illustrated. The number of micropylar openings and micropylar cells in the egg varied. The external morphology of the first instar larva is described for the first time for the genus Iridopsis. Two forms were detected in the third, fourth and fifth larval instars. Results are discussed in relation to previous studies.
Key words: Boarmiini. Morphology. Neotropical.
Introducción
Con más de 20.000 especies descritas a nivel global, Geometridae es una de las familias más diversas de Lepidoptera (Scoble 1999). Gran parte de esta diversidad se encuentra bien representada en el Neotrópico (Heppner 1991; Brehm et al. 2005). En su estado larvario, la mayoría de las especies son fitófagas, algunas con un estrecho rango de plantas hospederas (Vargas 2011) y otras polífagas (Pinault et al. 2007; Vargas y Parra 2009). Como herbívoros, son importantes consumidores primarios en ecosistemas terrestres (Vargas y Parra 2009; Bodner et al. 2010). Por otra parte, constituyen presas fundamentales para algunos organismos insectívoros (Matthews y González 2004; Méndez-Abarca et al. 2012).
Pese a la enorme importancia que tiene el conocimiento morfológico de estados inmaduros de Lepidoptera, poco ha sido estudiado respecto a la fauna neotropical. Incluso en familias tan diversas y ubicuas como Geometridae son escasos los trabajos en los que se ha descrito la morfología de sus estados inmaduros.
El género Iridopsis Warren, 1894 se encuentra representado en el Neártico y en el Neotrópico por más de 90 especies descritas (Pitkin 2002; Vargas 2007), de las cuales poco se conoce respecto a la biología y morfología de sus estados inmaduros. Según lo indicado por Rindge (1966) las especies neárticas, para las que existen registros de plantas hospederas, tienden a ser generalistas. Recientemente, Pinault et al. (2007) han descrito en detalle la biología de la especie neártica polífaga Iridopsis ephyraria (Walker, 1860), causante de intensas defoliaciones en Tsuga canadensis (L.) Carr. (Pinaceae) en Canadá. En el Neotrópico sólo se conocen algunos aspectos morfológicos y biológicos de los inmaduros de Iridopsis herse (Schaus, 1912), cuyas larvas se asocian a soya, Glycine max Linnaeus (Fabaceae) (Passoa 1983), mientras que Marconato et al. (2008) han indicado a Erythroxylum microphyllum St-Hilaire (Erythroxylaceae) como planta hospedera de Iridopsis fulvitincta (Warren, 1897) e Iridopsis nigraria (Jones, 1921).
En Chile se han descrito sólo dos especies de Iridopsis, ambas del extremo norte de este país, y sólo para una de ellas se conoce la planta hospedera (Vargas 2007). Iridopsis parrai Vargas, 2007 se encuentra restringida a la Pampa del Tamarugal, donde sus larvas folívoras se crían asociadas a tamarugo, Prosopis tamarugo Phil. (Fabaceae), el único vegetal hospedero indicado hasta ahora para esta especie (Vargas 2007). El objetivo del presente trabajo consiste en describir e ilustrar por primera vez la morfología externa de los estados inmaduros de I. parrai.
Materiales y métodos
Se colectaron ejemplares adultos de I. parrai en la Pampa del Tamarugal en octubre de 2008. Las hembras se acondicionaron en bolsas plásticas con folíolos de P. tamarugo para promover la oviposición. Luego de eclosionar, las larvas fueron mantenidas en frascos individuales y alimentadas con folíolos de tamarugo. En todos los casos se determinó el número de mudas. El alimento se renovó periódicamente. Huevos, larvas de todos los instares y pupas se conservaron en alcohol. Las larvas se sacrificaron en agua hirviendo. Al menos cinco de estos ejemplares se observaron con microscopio electrónico de barrido. Observaciones adicionales se efectuaron con una lupa estereoscópica y un microscopio óptico. Las mediciones se hicieron con un ocular graduado, y están basadas en 15 individuos de cada estado e instar. Para confeccionar la quetotaxia y para estudiar piezas de pequeño tamaño, como las estructuras bucales, patas torácicas y espuripedios, las larvas se calentaron en KOH (10%) por 5-10 minutos y posteriormente se disecaron para separar las estructuras de interés, las cuales se montaron en portaobjetos con glicerina o bálsamo de Canadá como medio de montaje.
Al describir las diferentes estructuras se siguió la terminología de Hinton (1946), Salkeld (1983), Stehr (1987), Blaik y Malkiewicz (2003) y Duarte et al. (2005).
Resultados
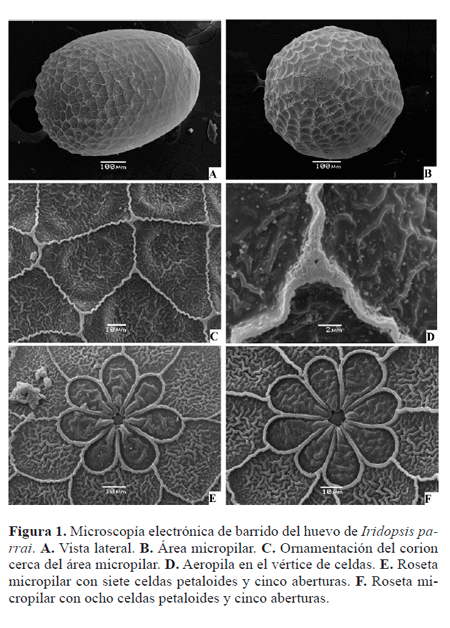
Huevo (Fig. 1). Blanco amarillento cuando recién depositado, verde blanquecino a medida que progresa el desarrollo embrionario, posteriormente rosado. Eje longitudinal paralelo al sustrato. Roseta micropilar con 7 - 10 celdas petaloides elongadas (Figs. 1E-F), distalmente redondeadas, medialmente agudas; 4 - 6 aberturas micropilares. Área cercana a la roseta micropilar ornamentada por celdas poligonales de márgenes sinuosos (Figs. 1A-C). Aeropilas en los vértices de las celdas poligonales (Fig. 1D).
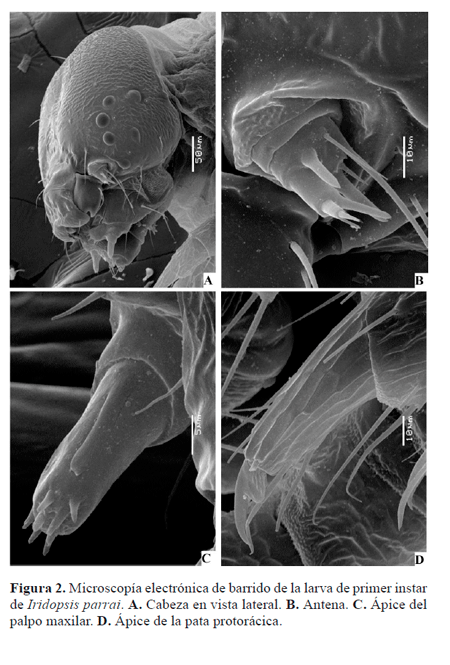
Larva de primer instar (Figs. 2, 5-9). Cabeza parda, tórax y abdomen verde amarillento. Patas torácicas pardas, espuripedios presentes en A6 y A10.
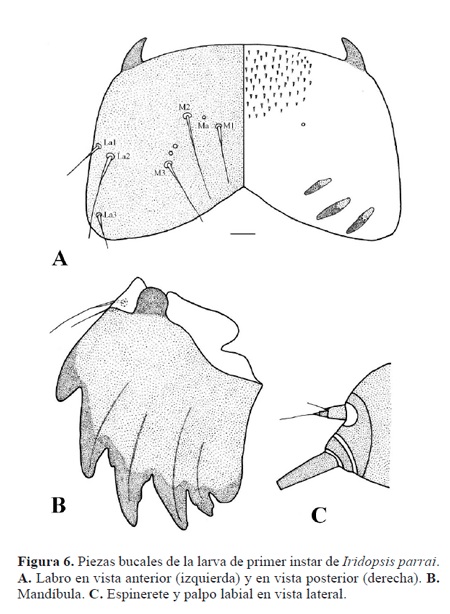
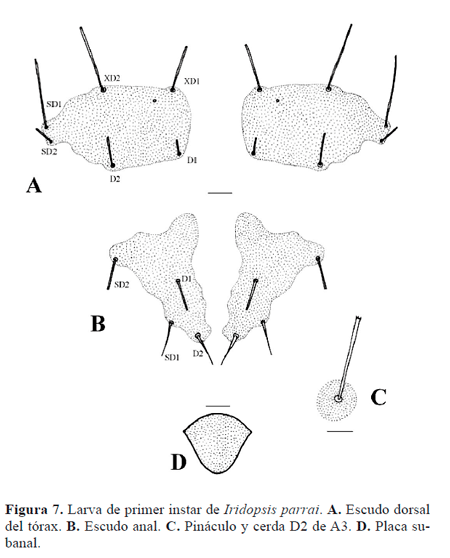
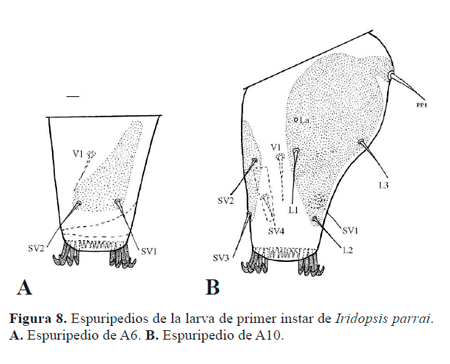
Cabeza (Fig. 2A) bien desarrollada; seis estemas (Fig. 5B) circulares lateroventrales; frontoclípeo triangular; tegumento finamente rugoso; cerdas de ápice agudo. Antena compuesta por tres antenómeros (Fig. 2B.): primero y segundo anulares, tercero cilíndrico. Piezas bucales masticadoras; labro (Fig. 6A) bilobulado, hendido ventralmente, superficie anterior con doce cerdas y seis poros, superficie posterior con seis procesos dentiformes aplanados, dos poros y abundantes espínulas; mandíbula (Fig. 6B) con seis proyecciones dentiformes a lo largo del margen distal, dos cerdas sobre la superficie externa; maxila bien desarrollada, palpo (Fig. 2C) triarticulado; espinerete (Fig. 6C) cilíndrico, corto, posteroventral a los pequeños palpos labiales. Tórax compuesto por tres segmentos, cada uno con un par de patas bien desarrolladas provistas de una garra tarsal levemente curvada (Fig. 2D); tegumento torácico finamente rugoso, cerdas con el ápice agudo o con varias puntas; protórax con el escudo dorsal (Fig. 7A) compuesto por dos amplias placas separadas medialmente por un área membranosa, cada placa con seis cerdas y un poro. Abdomen compuesto por 10 segmentos, tegumento finamente rugoso, cerdas con el ápice agudo o con varias puntas (Figs. 7B-C); espuripedios en segmentos A6 y A10 (Figs. 8A-B), "crochets" biordinales, un grupo anterior y uno posterior de cuatro cada uno, separados por un grupo de ocho pequeños crochets; segmento A10 con escudo anal (Fig. 7B) compuesto por dos placas esclerotinizadas triangulares separadas medialmente por un área membranosa, cada una de las placas esclerotinizadas con cuatro cerdas; placa subanal (Fig. 7D) subtriangular.
Quetotaxia. La quetotaxia más simple la presenta la larva de primer instar. La larva de segundo instar presenta cerdas adicionales en algunos de los segmentos torácicos y abdominales, las cuales se conservan hasta el quinto instar.
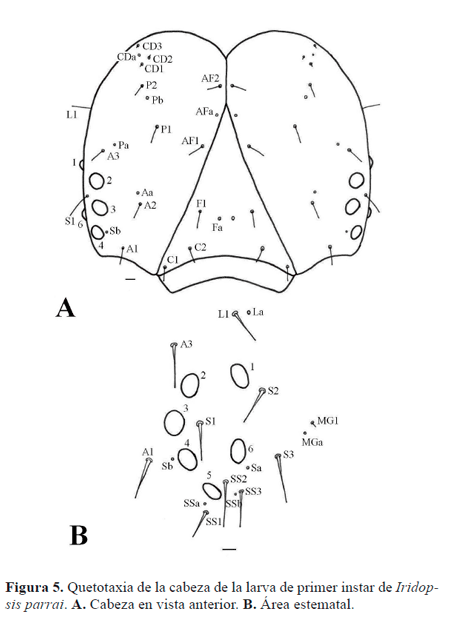
Cabeza (Figs. 5, 6). Grupo adfrontal (AF) bisetoso, AF1 lateral a la sutura adfrontal, AF2 lateral a la sutura epicranial, poro AFa lateral al vértice dorsal del frontoclípeo; grupo anterior (A) bisetoso, A1 entre la sutura adfrontal y el estema 4, A2 entre el estema 3 y la sutura adfrontal, A3 dorsal al estema 2, poro Aa dorsal a A2; grupo céfalodorsal (CD) trisetoso, poro CDa en medio de CD1 y CD3, CD3 desplazado medialmente; grupo clipeal (C) bisetoso, cercano al margen ventral del frontoclípeo, C1 cercana al margen lateral del frontoclípeo, C2 dorsomedial a C1; grupo frontal (F) unisetoso, F1 cercana al margen lateral del frontoclípeo, Fa ventromedial a F1; grupo lateral (L) unisetoso, L1 dorsal al estema 1, poro La posterior a L1; grupo microgenal (MG) unisetoso, MG1 reducida, posterior a estema 3, poro MGa anteroventral a MG1 grupo posterodorsal (P) bisetoso, P1 entre AF1 y L1, P2 laterodorsal a P1, poro Pa entre A3 y P1, poro Pb entre P1 y P2; grupo estematal (S) trisetoso, S1 posterior al estema 3, S2 posterior al estema 1, S3 posterior al estema 6, poro Sb anterior al estema 4; grupo subestematal (SS) trisetoso, SS1 ventral al estema 5, SS2 entre estemas 5 y 6, SS3 posterior al estema 5.
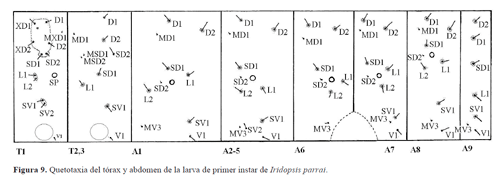
Tórax (Figs. 7, 9). T1. Once pares de cerdas táctiles (D1, D2, XD1, XD2, SD1, SD2, L1, L2, SV1, SV2, V1), un par de microcerdas (MXD1) y un par de poros. Grupos XD, D y SD incluidos en el escudo dorsal; grupo L en pináculo elipsoidal anterior al espiráculo; grupo SV en pináculo elipsoidal dorsal a la pata; grupo V posteroventral a la pata.
T1-2. Siete pares de cerdas táctiles (D1, D2, SD1, SD2, L1, SV1, V1) y tres pares de microcerdas (MD1, MSD1, MSD2). D2, SD1, L1 y SV1 en pináculos circulares; D1, SD2 y V1 no se encuentran sobre pináculos.
Abdomen (Figs. 7-9).A1. Ocho pares de cerdas táctiles (D1, D2, SD1, SD2, L1, L2, SV1, V1), dos pares de microcerdas (MD1, MV3). D1, D2, SD1, L1, L2, SV1 en pináculos circulares; SD2 reducida, similar a una microcerda, anteroventral a SD1, anterior al espiráculo; V1 no está en pináculo. MD1 anteroventral a D1, MV1 anteroventral a SV1, cercana al margen anterior de A1.
A2 - 5. Nueve pares de cerdas táctiles (D1, D2, SD1, SD2, L1, L2, SV1, SV2, V1) y dos pares de microcerdas (MD1, MV1). D1, D2, SD1, L1, L2, SV1 en pináculos circulares; SV2, V1 no están sobre pináculos. SD2 de tamaño similar al que presenta en A1, en línea recta paralela al margen anterior de A2 con D1, SD1, L2, MV1, anterior al espiráculo.
A6. Nueve pares de cerdas táctiles (D1, D2, SD1, SD2, L1, L2, SV1, SV2, V1) y dos pares de cerdas (MD1, MV1). D1, D2, SD1, L1, L2 en pináculos circulares; SD2 similar a los segmentos precedentes, anterior al espiráculo, posteroventral a SD1; SV1, SV2 en la placa triangular lateral del espuripedio; V1 en la superficie medial del espuripedio, no está en pináculo.
A7. Ocho pares de cerdas táctiles (D1, D2, SD1, SD2, L1, L2, SV1, V1) y dos pares de microcerdas (MD1, MV1). D1, D2, SD1, L1, L2, SV1 en pináculos circulares. SD2 similar a los segmentos precedentes, anterior al espiráculo, ventral a SD1; V1 no está en pináculo.
A8. Ocho pares de cerdas táctiles (D1, D2, SD1, SD2, L1, L2, SV1, V1) y dos pares de microcerdas (MD1, MV1). D1, D2, SD1, L1, L2, SV1 en pináculos circulares; V1 no en pináculo. SD1, SD2, L1, L2 y espiráculo en posición más dorsal que en los segmentos precedentes.
A9. Seis pares de cerdas táctiles (D1, D2, SD1, L1, SV1, V1) y un par de microcerdas (MV1). D1, D2, SD1, L1, SV1 en pináculos circulares; V1, no en pináculo. Todas las cerdas táctiles en línea recta; D2 dorsal a D1.
A10. Trece pares de cerdas táctiles (D1, D2, SD1, SD2, L1, L2, L3, SV1, SV2, SV3, SV4, PP1, V1) y un par de poros (La). D1, D2, SD1, SD2, en las placas del escudo anal; L1, L2, L3 en la placa esclerotinizada posterolateral del espuripedio; SV2, SV3 en la placa anterior del espuripedio; SV1, SV4, V1 en el área medial del espuripedio; SV1, SV4 en pináculos; V1 no en pináculo. Poro La dorsal a L1.
Larva de segundo instar. Coloración de cabeza, tórax y abdomen como en el instar precedente. Quetotaxia de la cabeza como en el primer instar. Quetotaxia del tórax y abdomen similar a la del quinto instar (Fig. 10). Se adiciona L2 y L3 en T2-3; L3, SV3 y SV4 en A1; L3, SV2, SV3 y SV4 en A2 - 5; L3, SV3, SV4 y SV5 en A6; L3 y SV3 en A7; L3 en A8; EXL4 en A10.
Larva de tercer instar. Coloración y quetotaxia de cabeza, tórax y abdomen similares a quinto instar.
Larva de cuarto instar. Coloración y quetotaxia de cabeza, tórax y abdomen similares a quinto instar.
Larva de quinto instar (Figs. 3A-C, 10). Quetotaxia de cabeza, tórax y abdomen similar a los instares tercero y cuarto (Fig. 10). En la cabeza aparece la línea ecdisial. Además, la antena de la larva de quinto instar presenta el segundo antenómero notoriamente elongado (Fig. 3A). Pináculos ausentes de la base de todas las cerdas torácicas y abdominales. Se distinguen dos morfos larvales. Uno que se caracteriza por presentar la cabeza parda; tórax y abdomen verdes con tres franjas amarillas longitudinales (una dorsal y una lateral a cada lado) que se extienden desde el protórax hasta el extremo posterior; segmento A8 con dos proyecciones dorsales tuberiformes rojas sobre las cuales se ubica la cerda D1 (Fig. 3C). El otro morfo presenta cabeza parda, mientras que el tórax y el abdomen son pardos con manchas negras y pardas oscuras irregulares; los segmentos abdominales A1 - 7 presentan la cerda D2 sobre una proyección tuberiforme parda (Fig. 3B), mientras que el segmento A8 permanece como en el morfo verde.
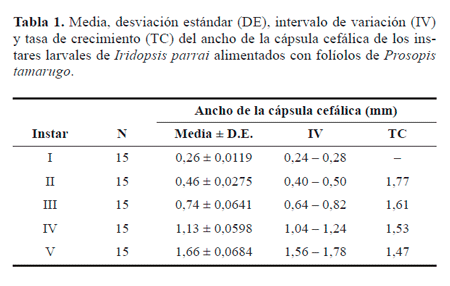
Identificación de los instares larvales. El tamaño de las cápsula cefálica es una herramienta útil para la separación de los diferentes instares larvales de I. parrai, puesto que los rangos registrados para cada instar no se sobreponen (Tabla 1). Al contrario, el color no fue un buen criterio de separación. Las larvas de primer y segundo instares presentan coloración similar, mientras que las de tercer, cuarto y quinto podrían ser confundidas si sólo se considera la coloración y no se tiene en cuenta el tamaño de la cápsula cefálica, puesto que el patrón de coloración es el mismo para los tres último instares. La tasa de crecimiento varió entre 1,468-1,747, mientras que la media para toda la fase larvaria fue de 1,59. Las tasas de crecimiento más altas fueron las de los instares iniciales, mientras que los valores fueron disminuyendo progresivamente hacia los finales (Tabla 1).
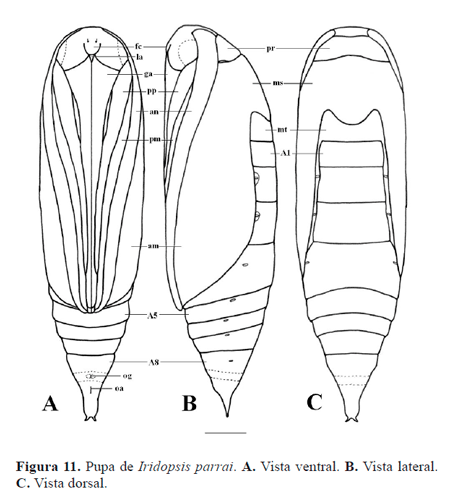
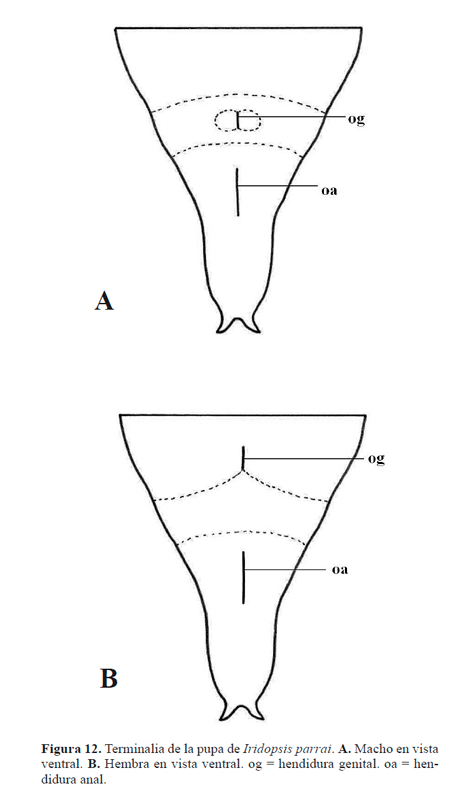
Pupa (Figs. 4, 11-12). Obtecta, pardo rojiza. Cabeza: antenas originadas anterolateralmente, dirigidas hacia la superficie ventral, ápice sobrepasa ligeramente al de las alas mesotorácicas y coincide con el margen posterior de A4; vértex en el área anterior, delimitado lateralmente por la base de las antenas, posterodorsalmente por el protórax, posteroventralmente no separado del frontoclípeo; frontoclípeo en la superficie ventral, en medio de los ojos compuestos, parcialmente separado de éstos, delimitado posteriormente por el labro; ojos compuestos en la superficie ventral, delimitados lateralmente por las antenas y las patas protorácicas, posteriormente por la base de las gáleas; labro triangular, lateralmente delimitado por la base de las gáleas; gáleas bien desarrolladas, se extienden a lo largo del área mediana ventral, en medio de los apéndices torácicos, ápice casi alcanza el de las antenas. Tórax: protórax dorsalmente evidente como una corta franja transversal de lados agudos, entre la cabeza y el mesotórax, lateralmente triangular, pata protorácica se extienden a lo largo de la superficie ventral entre la gálea y la pata mesotorácica por una longitud mayor a tres cuartos la de la gálea; mesotórax dorsalmente evidente como un área amplia, margen anterior recto, margen posterior fuertemente convexo, alas mesotorácicas extendidas a lo largo de la superficie lateral, oculta casi totalmente al ala metatorácica, delimitada ventralmente por la gálea, ápice casi alcanza al margen posterior de A4, pata protorácica extendida entre la pata protorácica y la antena, ápice sobrepasa ligeramente al de la antena; metatórax dorsalmente evidente como una franja con el margen anterior fuertemente cóncavo, margen posterior recto, ala metatorácica poco evidente entre el margen dorsal del ala mesotorácica y los segmentos abdominales, pata metatorácica casi totalmente oculta, ápice sobrepasa posteriormente al de la gálea; espiráculo del tórax poco evidente, situado entre el protórax y el mesotórax. Abdomen compuesto por diez segmentos, los cuatro anteriores parcialmente ocultos por los apéndices torácicos, los tres distales (A8-10) fusionados; segmento A10 con una proyección posterior plana con el ápice bifurcado (Fig. 4B); tegumento ornamentado por pequeñas hendiduras subcirculares y microtriquias (Fig. 4A); hendidura genital del macho medioventralmente en A9, con dos áreas circulares a ambos costados (Fig. 12A); hendidura genital de la hembra medioventralmente en el segmento A8 (Fig. 12B); hendidura anal con forma de una línea longitudinal situada medioventralmente en A10.
Discusión
En el presente trabajo se describen, por primera vez, todos los estados inmaduros de una especie neotropical de Iridopsis. Previamente se conocía la morfología externa de la pupa y la larva de último instar de I. herse (Passoa 1983), cuya distribución geográfica incluye Costa Rica, Honduras y México (Rindge 1966; Passoa 1983).
El cremáster de la pupa de I. herse consiste de dos espinas divergentes formando una letra "V", con cada una de estas espinas bifurcadas en el ápice. Este patrón contrasta notablemente con el de I. parrai, cuyo cremáster es plano y de lados paralelos en la base, con dos espinas cortas y simples en el ápice, las cuales están ampliamente separadas en la base formando una "U".
La variación morfológica detectada entre diferentes instares larvales de I. parrai, asociada a la quetotaxia, a la presencia o ausencia de pináculos y proyecciones tuberiformes en la base de las setas, concuerda con lo detectado para otras especies de Geometridae de diferentes regiones del mundo (McGuffin 1973; Blaik y Malkiewicz 2003; Vargas et al. 2010). Debido a esta variación morfológica ontogénica es importante estudiar la mayor cantidad posible de instares larvales, al menos el primero y uno de los subsecuentes, cuando se intenta caracterizar la morfología larval de Geometridae.
Otro aspecto morfológico larvario interesante detectado en el presente estudio se relaciona con la presencia de dos morfos a partir del tercer instar. Variación intraespecífica en el número de proyecciones tuberiformes en larvas de Geometridae ha sido también indicada por Bocaz et al. (2003) para Syncirsodes primata (Walker, 1862). Sin embargo, Bocaz et al. (2003) asociaron la variación a diferentes plantas hospederas, mientras que en el presente estudio la variación detectada no está asociada a plantas hospederas diferentes. Tampoco se detectó asociación con el sexo, puesto que de ambos morfos larvales se originaron adultos machos y hembras.
Iridopsis parrai es la primera especie de este género para la que se conoce la quetotaxia de la larva de primer instar, por lo que resulta imposible efectuar comparaciones. Por otro lado, esta es la primera vez que se emplea microscopía electrónica de barrido para describir los inmaduros de una especie neotropical de este género. Esta herramienta es particularmente útil para el estudio de la morfología del huevo y de detalles estructurales de la larva y la pupa (Figs. 1-4).
Descripciones de huevos de Iridopsis utilizando microscopio electrónico de barrido fueron efectuadas por Salkeld (1983) para dos especies neárticas: I. ephyraria e I. humaria (Guenée, 1857). Una interesante semejanza entre el huevo de estas dos especies y el de I. parrai es la sinuosidad de los márgenes de las celdas poligonales. Sin embargo, las celdas se encuentran bien marcadas sólo en el área cercana a la roseta micropilar en I. parrai, mientras que son bien marcadas a lo largo de todo el corion en I. ephyraria e I. humaria.
Del mismo modo que acontece para muchos de los géneros neotropicales de Geometridae, la monofilia de Iridopsis aún no está claramente sustentada (Pitkin 2002). Los intentos realizados hasta ahora han estado basados fundamentalmente en caracteres morfológicos del adulto. En el presente estudio se han detectado divergencias morfológicas notables entre los inmaduros de I. parrai y otras especies del género, lo que plantea nuevos interrogantes respecto a la monofilia de este grupo. Futuros estudios morfológicos sobre inmaduros de Iridopsis son necesarios para aportar nuevos antecedentes que permitan efectuar análisis comparativos robustos. Sin embargo, un obstáculo importante para progresar en este sentido es el desconocimiento de las plantas hospederas de muchas de las especies neotropicales de Iridopsis.
Agradecimientos
Los comentarios de dos revisores anónimos permitieron mejorar la versión preliminar de este trabajo. Este estudio fue financiado por el proyecto DIEXA-UTA 9710-08.
Literatura citada
BLAIK, T.; MALKIEWICZ, A. 2003. Morphology of larval and pupal stages of Isturgia roraria (Fabricius, 1777) (Lepidoptera: Geometridae). Annales Zoologici 53: 245-258. [ Links ]
BOCAZ, P.; PARRA, L. E.; VICTORIANO, P. F. 2003. Larval morphological variation and its relation to host plants in Syncirsodes primata (Lepidoptera: Geometridae). Gayana 67: 39-44. [ Links ]
BODNER, F.; BREHM, G.; HOMEIER, J.; STRUTZENBERGER, P.; FIEDLER, K. 2010. Caterpillars and host plant records for 59 species of Geometridae (Lepidoptera) from a montane rainforest in southern Ecuador. Journal of Insect Science 10: 67. [ Links ]
BREHM, G.; PITKIN, L. M.; HILT, N.; FIEDLER, K. 2005. Montane Andean rainforests are a global biodiversity hotspots of geometrid moths. Journal of Biogeography 32: 1621-1627. [ Links ]
DUARTE, M.; ROBBINS, R. K.; MIELKE, O. H. H. 2005. Immature stages of Calycopis caulonia (Hewitson, 1877) (Lepidoptera, Lycaenidae, Thechinae, Eumaeini), with notes on rearing detritivorous hairstreaks on artificial diet. Zootaxa 1063: 1-31. [ Links ]
HEPPNER, J. B. 1991. Faunal regions and the diversity of Lepidoptera. Tropical Lepidoptera 2 (Supplement 1): 1-85. [ Links ]
HINTON, H. E. 1946. On the homology and nomenclature of setae of leidopterous larvae, with some notes on the phylogeny of Lepidoptera. Transactions of the Royal Entomological Society of London 97: 1-37. [ Links ]
MARCONATO, G.; DIAS M. M.; PENTEADO-DIAS, M. A. 2008. Larvas de Geometridae (Lepidoptera) e seus parasitoides, associadas à Erythroxylum microphyllum St.- Hilaire (Erythroxylaceae). Revista Brasileira de Entomologia 52: 296-299. [ Links ]
MATTHEWS, R. W.; GONZÁLEZ, J. M. 2004. Nesting biology of Zeta argillaceum (Hymenoptera: Vespidae: Eumeninae) in southern Florida, U. S. Florida Entomologist 87: 37-40. [ Links ]
MCGUFFIN, W. C. 1973. The Rheumaptera of North America (Lepidoptera: Geometridae). The Canadian Entomologist 105: 383-398. [ Links ]
MENDEZ-ABARCA, F.; MUNDACA, E. A.; VARGAS, H. A. 2012. First remarks on the nesting biology of Hypodynerus andeus (Packard) (Hymenoptera, Vespidae, Eumeninae) in the Azapa valley, northern Chile. Revista Brasileira de Entomologia 56: 240-243. [ Links ]
PASSOA, S. 1983. Immature stages of Anacamptodes herse (Schaus) (Geometridae) on soybean in Honduras. Journal of the Lepidopterists' Society 37: 217-223. [ Links ]
PINAULT, L.; GEORGESON, E.; GUSCOTT, R.; JAMESON, R.; LEBLANC, M.; MCCARTHY, C.; LUCAROTTI, C.; THURSTON, G.; QUIRING, D. 2007. Life history of Iridopsis ephyraria, (Lepidoptera: Geometridae), a defoliator of eastern hemlock in eastern Canada. Journal of the Acadian Society 3: 28-37. [ Links ]
PITKIN, L. M. 2002. Neotropical Ennominae moths: a review of the genera (Lepidoptera: Geometridae). Zoological Journal of the Linnean Society 135: 121-401. [ Links ]
RINDGE, F. H. 1966. A revision of the moth genus Anacamptodes (Lepidoptera, Geometridae). Bulletin of the American Museum of Natural History 132: 175-244. [ Links ]
SALKELD, E. H. 1983. A catalogue of the eggs of some Canadian Geometridae (Lepidoptera), with comments. Memoirs of the Entomological Society of Canada 126: 1-273. [ Links ]
SCOBLE, M. J. (Ed.) 1999. Geometrid moths of the world - a catalogue (Lepidoptera, Geometridae). CSIRO Publishing, Collingwood, Victoria, Australia, 1016 p. [ Links ]
STEHR, F. W. 1987. Order Lepidoptera. p: 288-315. In: Stehr, F. W. (Ed.). Immature insects. Vol. I. Kendall/Hunt Publishing Company. Dubuque, Iowa. [ Links ]
VARGAS, H. A. 2007. Dos nuevas especies de Iridopsis Warren (Lepidoptera, Geometridae) del norte de Chile. Revista Brasileira de Entomologia 51: 138-141. [ Links ]
VARGAS, H. A.; PARRA, L. E. 2009. Prospección de lepidópteros antófagos asociados a Acacia macracantha Willd. (Fabaceae) en el norte de Chile. Revista Brasileira de Entomologia 52: 291-293. [ Links ]
VARGAS, H. A.; MIELKE, O. H. H.; CASAGRANDE, M. M.; PARRA, L. E. 2010. Imaturos de Chrismopteryx undularia (Blanchard) (Lepidoptera, Geometridae). Revista Brasileira de Entomologia 54: 519-528. [ Links ]
VARGAS, H. A. 2011. First host plant record for Pero obtusaria Prout (Lepidoptera: Geometridae). Neotropical Entomology 40: 625-627. [ Links ]