Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.39 no.1 Bogotá Jan./June 2013
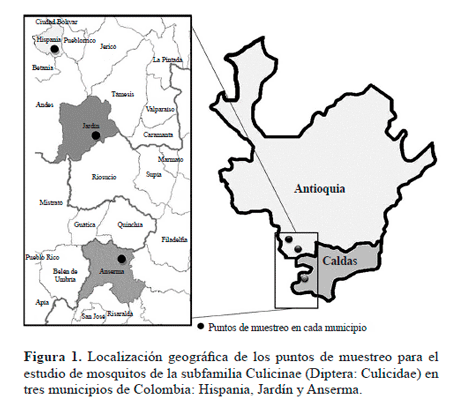
Mosquitos (Diptera: Culicidae) asociados a guadua en los municipios de Anserma, Hispania y Jardín, Colombia
Mosquitoes (Diptera: Culicidae) associated to guadua in municipalities of Anserma, Hispania and Jardín, Colombia
JOVANY BARAJAS G.1, JUAN DAVID SUAZA V.2, CAROLINA TORRES G.3, GUILLERMO LEÓN RÚA4, SANDRA URIBE-SOTO5 y CHARLES H. PORTER6
1 Biólogo-Estudiante de Maestría. Programa de Estudio y Control de Enfermedades Tropicales PECET, Sede de Investigación Universitaria SIU, Universidad de Antioquia. Carrera 53 No. 61-30, Torre 2, Laboratorio 632. j.barajas@pecet-colombia.org. Autor para correspondencia.
2 Ingeniero agrónomo, MSc.-Estudiante de Doctorado convenio PECET-Grupo de Sistemática Molecular GSM (Universidad de Antioquia-Universidad Nacional de Colombia Sede Medellín), Calle 59A No 63-20. Bloque 18-102 Universidad Nacional de Colombia sede Medellín. jdsuaza@unal.edu.co.
3 Bióloga, M. Sc.-Estudiante de Doctorado, Profesora asociada a la Facultad de Medicina. Programa de Estudio y Control de Enfermedades Tropicales PECET, Sede de Investigación Universitaria SIU,
Universidad de Antioquia. Carrera 53 No. 61-30, Torre 2, Laboratorio 632. carolina. torres@siu.udea.edu.co.
4 Biólogo, M. Sc., Ph. D. Profesor asociado a la Facultad de Medicina, Laboratorio de Hemoparasitosis y Entomología Médica. Universidad de Antioquia, Carrera 51d Nº 62-29. Laboratorio383. gl_rua@medicina.udea.edu.co.
5 Ingeniera agrónoma, M. Sc., Ph. D. Profesora asociada a la Facultad de Ciencias, Posgrado de Entomología Universidad Nacional de Colombia, sede Medellín, Calle 59A No 63-20. Bloque 18-102 Medellín, Colombia. suribe@unal.edu.co.
6 Biólogo, M. Sc., Ph. D. Investigador. Centers for Disease Control and Prevention -CDC-, Atlanta, EE.UU. chp1@cdc.gov.
Recibido: 18-jul-2011 - Aceptado: 27-mar-2013
Resumen: El estudio de mosquitos de la subfamilia Culicinae (Diptera: Culicidae) en Colombia, ha sido limitado a pesar de su importancia en salud pública. El presente estudio determinó las especies de esta subfamilia colectadas en Guadua angustifolia en ecosistemas de influencia cafetera. Se resaltan tres tipos de criaderos: tocón, entrenudo perforado y recipiente. Se registraron nueve especies de las cuales dos son nuevos registros para Colombia (Orthopodomyia albicosta y Wyeomyia oblita), cinco son nuevos registros para los departamentos visitados (Culex secundus, Cx. antunesi, Limatus durhami, Trichoprosopon digitatum y Sabethes undosus) y dos (Trichoprosopon sp. del complejo Pallidiventer y Toxorhynchites sp.) se encuentran en proceso de estudio. Se determinó que existe relación entre las especies encontradas y el volumen de agua contenida y la altura sobre el nivel del suelo medida en los criaderos. De las especies reportadas, Tr. digitatum y Li. durhami están registradas en la literatura como posibles vectores de arbovirus. Toxorhynchites se destaca por agrupar especies cuyas larvas son depredadoras. Los resultados realzan la importancia de la guadua como criadero de diferentes mosquitos, incluyendo algunas especies importantes en salud pública.
Palabras clave: Taxonomía. Culicidae. Hábitats larvales. Phytotelmata.
Abstract: The study of culicine mosquitoes (Diptera: Culicidae) in Colombia, has been limited even though this subfamily is important in public health. This study aimed to determine the species of Culicinae breeding in stands of Guadua angustifolia in areas with coffee plantations. Three breeding sites were distinguished: guadua stumps, perforated internodes and containers. Nine mosquito species were identified which two are new records for Colombia (Orthopodomyia albicosta, Wyeomyia oblita), five new records for the departments (Culex secundus, Cx. antunesi, Limatus durhami, Trichoprosopon digitatum and Sabethes undosus). Two others are under current study (Trichoprosopon sp. part of the Pallidiventer complex, and Toxorhynchites sp.). There was a relationship between the species found and the water volume and height above ground, measured for each of the breeding sites. Two of the species, Tr. digitatum and Li. durhami, are reported in literature as potential vectors of arboviral agents; Toxorhynchites is grouped with species whose larvae are predators. The results support an important role for guadua as breeding sites for various mosquitoes, including some species of public health importance.
Key words: Taxonomy. Culicidae. Larval habitats. Phytotelmata.
Introducción
En Colombia la investigación en taxonomía e identificación de mosquitos de la familia Culicidae (Insecta: Diptera) se ha realizado principalmente para los géneros Anopheles Meigen, 1818 y Aedes Meigen, 1818y en particular en relación con las especies transmisoras de malaria y dengue (Suárez y Nelson 1981), respectivamente. Dichos estudios incluyen además de la identificación de especies, la distribución geográfica y otros aspectos relevantes para la implementación de actividades de control (Tinker y Olano 1993; Olano et al. 2001; Suarez 2001; Rodriguez y Hoz 2005). Estudios similares sobre otros géneros de Culicidae son escasos, lo cual probablemente se relaciona con su menor impacto en salud pública y el desconocimiento de la biología y taxonomía de sus especies (Barreto et al. 1996). No obstante, las grandes modificaciones del paisaje y la expansión de la frontera agrícola en el país, así como los cambios relacionados con el clima, los cuales tienen gran incidencia en las dinámicas de las poblaciones de mosquitos y los agentes patógenos que transmiten, hacen necesario avanzar en el estudio y reconocimiento de estas otras especies. En particular esto es válido para las enfermedades conocidas como emergentes y reemergentes, muchas de las cuales se relacionan con arbovirus transmitidos por mosquitos (Gubler 2002).
En este contexto, cobra importancia el estudio de géneros de mosquitos como Culex Linnaeus, 1758, Haemagogus Williston, 1896, Trichoprosopon Theobald, 1901, Wyeomyia Theobald, 1901 y Orthopodomyia Theobald, 1904 en los cuales se incluyen especies transmisoras de arbovirus de la familia Bunyaviridae a animales y humanos, mosquitos que se han registrado en criaderos fitotelmata, unos de los criaderos más antiguos de Culicidae (Forattini 1965a; Cyrino y Lopes 2001; Forattini 2002; Ferro et al. 2003) y que se exploraron en el presente estudio.
El término fitotelmata, como es definido por Fish (1983) y Greeney (2001), hace referencia a pequeños cuerpos de agua que se originan al interior o sobre diferentes estructuras de las plantas (axilas, brácteas, troncos, hojas, frutos, flores, etc.), en donde se desarrolla una o varias comunidades de organismos asociados, en los que se incluyen los mosquitos Culicidae. La abundancia de fitotelmata es reconocida en áreas silvestres, siendo la guadua muy abundante en los bosques andinos y zonas cafeteras, a pesar de esto, su papel como criadero de mosquitos ha sido pobremente explorado en Colombia.
La guadua, pertenece a la subfamilia Bambusoidea, es de gran presencia y abundancia en el trópico y posee características que la convierten en hábitat potencial para el desarrollo de los estados inmaduros de mosquitos (MacDonald y Traub 1960). Se ha postulado que el acceso al interior de los entrenudos de la planta es facilitado por aves e insectos del orden Orthoptera, lo que propicia la disponibilidad de espacios para la oviposición de hembras de mosquitos (Cyrino y Lopes 2001). Muchas de las especies de Culicidae previamente registradas en guadua son consideradas silvestres, pero su importancia aumenta cuando los parches de guadua se ubican en áreas periurbanas y urbanas (Cyrino y Lopes 2001; Forattini 2002).
Entre los trabajos más representativos sobre mosquitos criados en guadua se encuentran los realizados en guaduales naturales y otros utilizando trampas artificiales en Panamá (Galindo et al. 1951), Brasil (Silva et al. 2004), Venezuela (Machado-Allison et al. 1986; Lounibos et al. 1987, Navarro y Machado-Allison 1995; Navarro 1998) y Perú (Lounibos et al. 1987; Yanoviak et al. 2006; Navarro y Machado-Allison 1995; Yanoviak et al. 2006).
En Colombia, la mayoría de los trabajos son antiguos y discontinuos en el tiempo. Rozeboom y Komp (1930) registraron a Cx. (Microculex) elongatus Rozeboom-Komp, 1930 en entrenudos de guadua en el departamento del Meta. Después Roca-García (1944), Arnell (1973), Heinemann y Belkin (1978), Frank y Cutis (1981), Vélez et al. (1998) y Hastriter et al. (1998) registraron Aedes albopictus (Skuse, 1895), Trichoprosopon digitatum (Rondani, 1848), Wyeomyia melanocephala Dyar y Knab, 1906, Haemagogus anastasionis Dyar 1921, Hg. janthinomys Dyar 1921, Hg. equinus Theobald 1903, Hg. celeste Dyar y Nuñez Tovar, 1927, Cx. (Carrollia) bihaicolus Dyar y Nuñez Tovar, 1927 y Toxorhynchites hemorrhoidalis (Fabricius, 1787).
El presente estudio tuvo como objetivo determinar las especies de la subfamilia Culicinae (Diptera: Culicidae) encontradas en guadua en algunos ecosistemas cafeteros de Colombia, explorando la relación posible entre dichos insectos y la planta.
Materiales y métodos
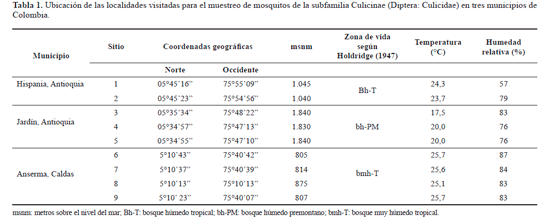
El estudio se llevó a cabo en los municipios de Hispania y Jardín localizados en el suroeste de Antioquia y en el municipio de Anserma al oeste del departamento de Caldas (Tabla 1) (Fig. 1). En total se visitaron nueve sitios de colecta, con presencia de fragmentos de guadua dirigidos a la producción y conservación de esta planta, en áreas aledañas a zonas de actividades agrícolas, ganaderas y turísticas. La selección de los parches de guadua se realizó a partir de imágenes satelitales SPOT, mapas de cobertura vegetal e información extraída de los Planes de Ordenamiento Territorial de los municipios incluidos en el muestreo (Corantioquia 1999, 2002; Corcaldas 2000).
Para el muestreo se siguió la metodología de búsqueda y colecta propuesta por Belkin et al. (1969) y Louton et al. (1996). Los inmaduros se succionaron con una pipeta plástica y se registró el tipo de criadero, el volumen de agua (mL) y la altura sobre el suelo (cm), así como la temperatura y humedad relativa ambiental al momento de la colecta (Tabla 1) (Corantioquia 1999, 2002; Corcaldas 2000; IDEAM 2008). Las colectas se realizaron durante periodos de cuatro días en Hispania en noviembre de 2007 y en Jardín y Anserma en febrero y marzo de 2008. El esfuerzo de muestreo por sitio fue de 5 horas/hombre (2 personas por 4 días) haciendo un recorrido aleatorio en transectos de 200 m x 2 m. Como unidad de muestreo se utilizaron los criaderos positivos correspondientes a recipientes de guadua con presencia de inmaduros de Culicidae. Cada recipiente fue identificado con un código único con el fin de hacer un seguimiento de los mosquitos por criadero. La metodología basada en esfuerzo de muestreo entomológico (horas/hombre) ha sido implementada en diversos trabajos para caracterizar e inventariar insectos en diferentes tipos de hábitat (Arango et al. 2007; Rivera et al. 2008).
Las larvas colectadas se transportaron en bolsas plásticas Whirl-Pak hasta el insectario del Programa de Estudio y Control de Enfermedades Tropicales - PECET- de la Universidad de Antioquia, Medellín, Colombia (27 ± 2 °C; humedad relativa 80 ± 10%; fotoperiodo: 12 horas luz), donde se individualizaron los estadios III y IV y se continuó su cría para la obtención de series entomológicas como colección de referencia.
Los protocolos de montaje de larvas, exuvias y adultos para la identificación de los mosquitos se realizaron de acuerdo a lo sugerido en el documento de la Walter Reed Biosystematics Unit, Division of Entomology, Walter Reed Army Institute of Research (WRBU) (Gaffigan y Pecor 1997). Los montajes se almacenaron en las colecciones entomológicas del PECET y el Museo Entomológico Francisco Luis Gallego (MEFLG) de la Universidad Nacional de Colombia, sede Medellín registradas ante el Instituto Alexander von Humboldt.
La identificación taxonómica se realizó mediante observación de caracteres morfológicos externos de larva, pupa y hembras adultas. La genitalia de machos adultos también fue considerada para la identificación de algunas especies. Se utilizaron claves y revisiones taxonómicas de diferentes autores: Berlin y Belkin (1980), Cova-Garcia et al. (1966), Dyar (1982), Fernández et al. (2006), Forattini (1962; 1965; 2002), González y Carrejo (2007), González y Darsie (1996), Harbach (1994; 2007), Harbach y Kitching (1998), Judd (1996), Lane (1953; 1965), Lane y Cerqueira (1942), Valencia (1973), Zavortink (1968; 1981).
Para el análisis de correlación de las especies de mosquitos encontradas y las variables consideradas se utilizó el programa estadístico "R" (Hornik 2011). Se emplearon tablas de contingencia con la aplicación de la prueba estadística chi-cuadrado con nivel de significancia de 0,05 y el programa Statistical Package for the Social Sciences para Windows, versión 16 (2007) (SPSS Inc., Chicago, IL), con el que se realizó un análisis de correspondencia múltiple para establecer si existía independencia entre las especies y las características de los criaderos.
Resultados
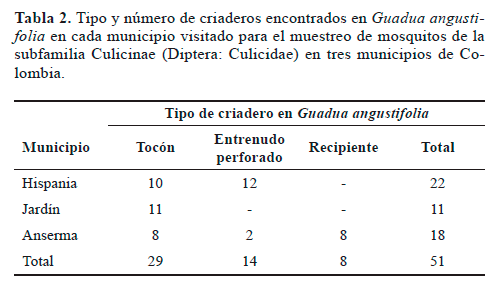
En total se encontraron 51 criaderos en Guadua angustifolia (Tabla 2). Los criaderos correspondieron a tres tipos: (Tabla 2) (Fig. 2) (i) el tipo "tocón" cuyo contenedor se forma al realizar un corte transversal del culmo de la guadua permitiendo la acumulación de agua y materia orgánica en su interior; (ii) el tipo "entrenudo perforado" que se define como un entrenudo de guadua con una abertura lateral, que permite la entrada y almacenamiento de agua y (iii) el tipo "guadua caída", que se refiere a la guadua sobre el suelo en posición horizontal con un corte longitudinal en el culmo que permite que en ciertos segmentos se acumule agua.
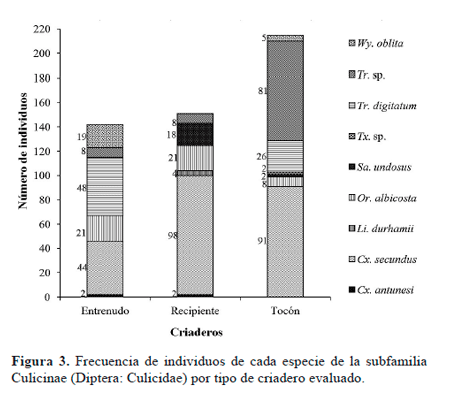
Se determinaron 518 especímenes obtenidos en los criaderos que correspondieron a Culex (Carrollia) antunesi Lane & Whitman, 1943, Cx. (Carrollia) secundus Bonne-Wepter, 1920 (Tribu Culicini); Orthopodomyia albicosta Lutz, 1905 (Tribu Orthopodomyiini); Limatus durhami Theobald, 1901, Trichoprosopon (Trichoprosopon) digitatum, Sabethes (Sabethinus) undosus Coquillett, 1906; Wyeomyia (Wyeomyia) oblita Lutz, 1905 (Tribu Sabethini), Trichoprosopon sp. y Toxorhynchites sp. (Tribu Toxorhynchitini). Las especies presentes y su número según el tipo de criadero se muestran en la figura 3.
En la tabla de contingencia (Tabla 3), se relaciona la frecuencia de individuos de cada especie de mosquitos según la localidad y variables medidas para los criaderos. La prueba de chi-cuadrado evidencia la relación de las especies con cada una de las variables. En Anserma se colectó el mayor número de individuos (269), seguido por Hispania (266), mientras que en Jardín sólo se colectaron individuos de Trichoprosopon sp. (68) (Fig. 4A). En tocón se encontró la mayor cantidad de individuos de Culicidae (256). La especie con mayor número de especímenes fue Culex secundus (241) (Fig. 4B), colectada solamente en los municipios de Hispania y Anserma, en los tres tipos de criadero. Del género Trichoprosopon Theobald, 1901 se colectaron 98 individuos en los tres municipios, encontrados con mayor frecuencia en tocones. En Hispania y Anserma, Tr. digitatum (75) se colectó únicamente en tocones y entrenudos perforados (Fig. 4C) mientras que Orthopodomyia albicosta (50) estuvo en los tres tipos de criaderos (Fig. 4D). Sabethes undosus (20) sólo se registró en Anserma, siendo más frecuente en el criadero tipo guadua caída (Fig. 4E). Wyeomyia oblita (Fig. 4F) (24) se colectó en Hispania y Anserma, mostrando mayor afinidad por los entrenudos perforados.
En la tabla 3 se destaca la frecuencia de Cx. secundus en criaderos con volúmenes de agua menores o iguales a 64 ml, los individuos de Trichoprosopon en volúmenes entre 65-114 ml y Or. albicosta y Sa. undosus en criaderos con volúmenes mayores a o iguales a 176 ml. En los cuatro intervalos establecidos para la variable volumen, la frecuencia de especies fue similar.
Con respecto a la variable altura del criadero desde el suelo, es posible observar cierta selectividad de Cx. secundus y Sa. undosus en alturas menores o iguales a 4 cm, Trichoprosopon sp. entre 5-15 cm, Or. albicosta superiores a 16 cm, Tr. digitatum entre 16 y 109 cm y Wy. oblita en alturas que sobrepasan los 110 cm. En cada uno de los cuatro intervalos de altura de los criaderos evaluados, la frecuencia de individuos fue similar.
Se encontró que todas las especies se relacionan estadísticamente con las variables localidad, tipo de criadero, altura sobre el suelo y volumen de agua et al. (P < 0,0001). Las especies Cx. secundus, Tr. digitatum, Trichoprosopon sp. y Or. albicosta se colectaron en todos los intervalos establecidos para las diferentes variables medidas en los criaderos. Las especies que se colectaron en menor número fueron Cx. (Car.) antunesi (4), Li. durhami (4) y Toxorhyncites sp. (2), provenientes de los parches de guadua localizados en Hispania y Anserma.
De las especies encontradas asociadas a G. angustifolia, Tr. digitatum y Li. durhami se señalan en la literatura como vectores de arbovirus (Hastriter et al. 1998; Natal 1998), la primera relacionada con la transmisión de los virus Bussuquara (Flaviviridae), Wyeomyia (Bunyaviridae), Pixuna (Togaviridae) y Encefalitis de San Luis (Flaviviridae), mientras que Li. durhami con los virus Caraparu (Bunyaviridae) y Wyeomyia (Tabla 4).
Discusión
De las especies encontradas asociadas a guadua se destacan como nuevos registros para Colombia Or. albicosta y Wy. oblita (Barreto-Reyes 1955; Barreto et al. 1996).
La literatura especializada para la subfamilia Culicinae es escasa para Colombia; los manuscritos que existen corresponden a estudios clásicos (Barreto-Reyes 1955; Lane 1965; Hieneman-Belkin 1978 y Valencia 1973), por lo que se recurrió a revisiones y claves taxonómicas elaboradas para especies de mosquitos de Venezuela, Brasil y Perú, que suponen una dificultad adicional, pues esta literatura es susceptible de contener diferencias relevantes con las especies presentes en Colombia. Debido a esto, la identificación taxonómica se confirmó con especialistas de diferentes instituciones internacionales. Para el caso de las dos especies colectadas del género Culex, subgénero Carrollia, el estudio de los caracteres de larvas y genitalia masculina fueron determinantes para su separación ya que guardan gran similitud morfológica (Valencia 1973).
El poco número de inmaduros y un solo adulto de Toxorhynchites Theobald, 1901 supuso la mayor dificultad para su determinación. Las claves taxonómicas disponibles para este género cuentan con información limitada que impide la diferenciación de las especies. Lounibos y Campos (2002) lo señalaron como de difícil manejo taxonómico. Toxorhynchites está conformado por individuos no hematófagos y hembras autógenas, con larvas de hábito depredador que consumen inmaduros de otros mosquitos, por lo que este grupo representa gran interés en estudios de control biológico.
Para estudiar la fauna de culícidos asociada a guadua y, en general, a fitotelmatas es relevante considerar ciertas características ecológicas del hábitat, que indiquen criterios físicos que faciliten o restrinjan la distribución local de las especies. Estas características comprenden desde las zonas de vida hasta otras específicas de los microhábitat, como altura y volumen de agua (Louton et al. 1996; Zequi et al. 2005; Yanoviak et al. 2006). Según Yanoviak et al. (2006), Li. durhami y Tr. digitatum se han colectado en bosques húmedos tropicales de tierras bajas (Perú); de manera similar, existen registros para Cx. secundus, Li. durhami y Tr. digitatum en bosque lluvioso tropical y bosque húmedo tropical en diferentes departamentos de Colombia (Heinemann y Belkin 1978) y el trabajo de Machado-Allison et al. (1986) indica que Sa. undosus, Tr. digitatum y Li. durhami se colectaron en bosque lluvioso tropical (Venezuela). Las localidades muestreadas en este estudio corresponden a guaduales localizados en zonas de bosque húmedo premontano (Hispania y Jardín) y bosque húmedo tropical (Anserma), por lo que las características ambientales en las cuales ocurren las especies de Culicidae corresponden con regiones de altos niveles de humedad y temperatura.
La información disponible sobre intervalos altitudinales de distribución, que podrían explicar la ocurrencia de las especies asociadas a guadua, en diferentes zonas de vida, es limitada. La mayoría de estudios hacen énfasis en registrar especies, sin documentar debidamente los determinantes ecológicos de las mismas. En este estudio se realizaron colectas en un intervalo entre 805 - 1845 m. Para Cx. antunesi Heinemann y Belkin (1978) indican que la especie tiene un intervalo de distribución hasta los 400 m (San Vicente de Chucurí-Santander), en tanto que Valencia (1973) registró colectas de la especie entre los 50 - 500m. El hallazgo de C. antunesi en este estudio fue entre 805 - 1040 m de altitud, por lo que por primera vez se documenta la presencia de esta especie en esta altitud. Para Li. durhami, Cx. secundus, Tr. digitatum y Sa. undosus los registros de distribución altitudinal coinciden con hallazgos previos citados por otros autores (Heinemann y Belkin 1978; Navarro y Machado-Allison 1995; Navarro 1998; Yanoviak et al. 2006).El volumen de agua de los criaderos se consideró una variable determinante en la distribución de las especies, puesto que la disponibilidad de agua genera un microhábitat propicio para que los inmaduros de culícidos culminen su desarrollo. La permanencia de agua en estos criaderos influye sobre las especies, pues los ciclos de vida pueden variar entre diferentes grupos de Culicidae. Louton et al. (1996) mencionan que cuando la procedencia del agua es por efecto de la acción metabólica de la planta, como sucede con frecuencia en guadua, este volumen puede perdurar incluso en épocas de sequía, lo cual es muy favorable para la comunidad de invertebrados acuáticos que allí se desarrolla. Por otro lado, cuando el agua de los criaderos depende de la lluvia, pueden ocurrir grandes fluctuaciones afectando las comunidades de invertebrados que allí habitan (Murillo et al. 1988; Sunahara y Mogi 1997). Es de resaltar que aunque los volúmenes de agua medidos en los criaderos de guadua, en este estudio, no influyeron en la presencia de mosquitos Culicinae, la presencia permanente del líquido en los tres tipos de criaderos representan sitios de cría seguros para su desarrollo, incluso en periodos de sequía.
La altura a la cual se encuentra el criadero a lo largo del culmo de la guadua es otro factor que puede afectar la ocurrencia de diferentes especies de mosquitos. Cyrino y Lopes (2001) señalan que la mayor diversidad de especies se da en los primeros dos metros. Estos autores proponen también que las especies con comportamiento alimenticio similar se disponen en diferentes estratos altitudinales a lo largo de la guadua, de esta forma evitan competencia por alimento, e incluso por el mismo criadero, ya que este tipo de hábitat se considera altamente especializado. Los registros de altura de los criaderos muestreados en el presente estudio guardan relación con los datos de altura de criaderos en guadua encontrados en la literatura. En el caso de Tr. digitatum, Sa. undosus y Toxorhynchites sp. no hubo una agrupación detectable en los intervalos medidos (Tabla 3), mientras que los individuos de Tr. digitatum se registraron en criaderos por encima de 5 cm de altura, las otras dos especies son más frecuentes en criaderos por debajo de esta medida.
Algunas de las especies que son consideradas de amplia distribución por habitar diferentes tipos de criaderos, como Tr. digitatum y Li. durhami (Machado-Allison et al. 1986), muestran poca especificidad por las condiciones medidas en los sitios de cría encontrados en G. angustifolia. El caso contrario se observa en Sa. undosus,ya que sus individuos logran ovipositar en criaderos de bambú cuando poseen perforaciones muy pequeñas en sus entrenudos (Machado-Allison et al. 1986), lo que les facilita la colonización de criaderos de difícil acceso en guadua. Sin embargo, aun cuando la especie Sa. undosus fue encontrada en el presente estudio, el tipo de criadero en donde fue más frecuente corresponde con guadua caída, cuya abertura de acceso es considerablemente grande.
La prueba chi-cuadrado estableció la relevancia de las variables medidas en los criaderos (volumen de agua, altura y tipo del criadero) con la frecuencia de captura de las diferentes especies de Culicinae. Esta información facilita y direcciona futuros muestreos y estudios hacia grupos de mosquitos de interés.
El estudio taxonómico de mosquitos silvestres asociados a la guadua, planta cada vez más explotada en espacios agrícolas, domésticos y urbanos, permite identificar estos escenarios como sitios de posible contacto entre el hombre y especies de mosquitos de importancia médica, por lo que la guadua debe ser considerada de interés epidemiológico.
Agradecimientos
Los autores agradecen a la investigadora Libertad Ochoa (Universidad de Antioquia) y al estudiante Estiben Galeano (Universidad Nacional de Colombia Sede Medellín), quienes apoyaron las actividades de campo y laboratorio del estudio. Al Dr. Iván Darío Vélez Bernal, director del PECET de la Universidad de Antioquia por su constante apoyo. A los especialistas internacionales Thomas Zavortink (Universidad de California - Davies - EE.UU.) y Monique Motta (Fundação Oswaldo Cruz - Fiocruz - Rio de Janeiro, Brasil) por la ayuda en la confirmación de las especies de Culicinae. La investigación se realizó con el apoyo financiero del CODI, Universidad de Antioquia (proyecto aprobado Código: EO1551) y Colciencias (proyecto aprobado No. 111545921858).
Literatura citada
ARANGO, L; MONTES, J. M.; LÓPEZ, D. A.; LÓPEZ, J. O. 2007. Mariposas (Lepidoptera: Papilionoidea, Hesperioidea), escarabajos coprófagos (Coleoptera: Scarabaeidae) y hormigas (Hymenoptera: Formicidae) del ecoparque Alcázares - Arenillo (Manizales, Caldas - Colombia). Boletín Científico. Centro de Museos. Museo de Historia Natural 11: 390-409. [ Links ]
ARNELL, J. H. 1973. A revision of the genus Haemagogus (Mosquito Studies XXXII). Contributions of the American Entomological Institute 10 (2): 120-174. [ Links ]
BARRETO, M.; BURBANO, M. E.; SUÁREZ, M.; BARRETO, P. 1996. Psorophora ciliata y otros mosquitos (Diptera: Culicidae) en Yolombó, Antioquia, Colombia. Colombia Médica 27 (2): 62-65. [ Links ]
BARRETO-REYES, P. 1955. Lista de mosquitos de Colombia. Anales de la Sociedad de Biología 7 (2): 94. [ Links ]
BELKIN, J. N.; SCHICK, R. X.; GALINDO, P.; AITKEN, T. H. G. 1969. Mosquito Studies (Diptera: Culicidae). I. A project for a systematic study of the mosquitoes of Middle America. Contribution of the American Entomological Institute 1 (2): 1-17. [ Links ]
BERLIN, O. G. W.; BELKIN, J. N. 1980. Mosquito studies (Diptera, Culicidae). XXXVI. Subgenera Aedinus, Tinolestes and Anoedioporpa of Culex. Contribution of the American Entomological Institute 17 (2): 1-104. [ Links ]
CORANTIOQUIA. 1999. Esquema de Ordenamiemto Territorial (EOT), fase diagnostico. Documento técnico. Municipio de Jardín. 1. [ Links ]
CORANTIOQUIA. 2002. Plan básico de Ordenamiento Territorial (POT). Municipio de Hispania. 1. [ Links ]
CORCALDAS. 2000. Plan básico de ordenamiento Territorial (POT). Municipio de Anserma. 1. [ Links ]
COVA-GARCIA, P.; SUTIL, E.; RAUSSEO, J. A. 1966. Mosquitos de Venezuela, Tomo 1. Publicaciones del Ministerio de Sanidad y Asistencia Social de Caracas, Venezuela. 1. [ Links ]
CYRINO, J. A.; LOPES, J. 2001. Culicideofauna (Diptera) encontrada em entrenós de taquara de uma mata residual na área urbana de Londrina, Paraná, Brasil. Revista Brasilera de Zoologia 18 (2): 429-438. [ Links ]
DYAR, H. G. 1982. The Mosquitoes of the Americas. The Carnegie Institution of Washington. Publ. No. 387: 1-616. [ Links ]
FERNÁNDEZ, L. D.; HERNÁNDEZ, C. A.; PÉREZ, R. Z.; QUIROGA, V. S. 2006. Contribución al estudio de la familia Culicidae de Guatemala: relación y distribución geográfica de las principales especies de la región norte. Revista Cubana de Medicina Tropical 58 (1): 30-35. [ Links ]
FERRO, C.; BOSHELL, J.; MONCAYO, A. C; GONZALEZ, M.; AHUMADA, M. L; KANG, K.; WEAVER, S. C. 2003. Natural enzootic vectors of Venezuelan Equine Encephalitis Virus in the Magdalena Valley, Colombia. Emerging Infectious Diseases Journal 9 (1): 49-54. [ Links ]
FISH, D. 1983. Phytotelmata: Flora and fauna. pp. 1-27. In: Frank, J. H., Lounibos, L. P. (Eds.). Phytotelmata: Terrestrial plants as hosts for aquatic insect communities. Medford, New Jersey; Plexus, vii + 293 p. [ Links ]
FORATTINI, O. P. 1962. Entomologia medica. Parte geral, Diptera, Anophelini. Vol I, 662 pp., illus. São Paulo. [ Links ]
FORATTINI, O. P. 1965. Entomologia Médica. Culicini: Culex, Aedes e Psorophora. Vol. 2, 506 pp. Universidade de São Paulo, Brasil. [ Links ]
FORATTINI, O. P. 1965. Entomologia Médica. Culicini: Haemagogus, Mansonia, Culiseta, Sabethini, Toxorhynchitini, arboviroses, filariose bancroftiana, genética. São Paulo: Editora da USP. v. 3, 415p. [ Links ]
FORATTINI, O. P. 2002. Culicidologia Médica. São Paulo, Editora da Universidade de São Paulo, 666 p. [ Links ]
FRANK, J. H.; CURTIS, G. 1981. On the bionomics of bromeliad-inhabiting mosquitoes. VI. A review of the bromeliad-inhabiting species. Journal of the Florida Anti-Mosquito Association 52: 4-23. [ Links ]
GAFFIGAN, T.; PECOR, J. 1997. Collecting, rearing, mounting and shipping mosquitoes. Walter Reed Biosystematics Unit, Division of Entomology, Walter Reed Army Institute of Research. [ Links ]
GALINDO, P.; CARPENTER, S. J.; TRAPIDO, H. 1951. Ecological observations on forest mosquitoes of an endemic yellow fever area in Panama. American Journal of Tropical Medicine and Hygiene 31 (1): 98-137. [ Links ]
GONZÁLEZ, R.; CARREJO, N. S. 2007. Introducción al estudio taxonómico de Anopheles de Colombia, claves taxonómicas y notas de distribución. Santiago de Cali. 237 p. [ Links ]
GONZÁLEZ, R.; DARSIE, R. F. 1996. Clave ilustrada para la determinación genérica de larvas de Culicidae de Colombia y el nuevo mundo. Boletin del Museo de Entomología de la Universidad del Valle 4 (1): 21-37. [ Links ]
GREENEY, H. F. 2001. The insects of plant-held waters: a review and bibliography. Journal of Tropical Ecology 17 (1): 241-260. [ Links ]
GUBLER, D. J. 2002. The global emergence/resurgence of arboviral diseases as public health problems. Archives of Medical Research 33: 330-342. [ Links ]
HARBACH, R. E. 1994. The subgenus Sabethinus of Sabethes (Diptera: Culicidae). Systematic Entomology 19 (1): 207-234. [ Links ]
HARBACH, R. E.; KITCHING, I. J. 1998. Phylogeny and classification of the Culicidae (Diptera). Systematic Entomology 23: 327-370. [ Links ]
HARBACH, R. E. 2007. The Culicidae (Diptera): a review of taxonomy, classification and phylogeny. Zootaxa 1668 (1): 591-538. [ Links ]
HASTRITER, M. W.; LAWYER, P. G.;MAUER, D. J.; ROBBINS, R. G.; SCHULTZ, G. W.; STRICKMAN, D. A. 1998. Disease vector profile Colombia. Defense Pest Management Information Analysis Center. Washington, D.C., Armed Forces Pest Management Board. Disponible en: www.afpmb.org. [Fecha revision: 25 mayo 2009] [ Links ].
HEINEMANN, S. J.; BELKIN, J. N. 1978. Collection records of the project "Mosquitoes of Middle America". 12. Colombia (COA, COB, COL, COM). Mosquito Systematics 10 (4): 493-539. [ Links ]
HORNIK, K. 2011. "The R FAQ". Disponible en: http://cran.r-project.org/doc/FAQ/R-FAQ.html. [Fecha revisión: 3 julio 2009] [ Links ].
IDEAM -Instituto de Hidrología, Meteorología y Estudios Ambientales. 2008. Meteorología y estudios ambientales. Mapas de precipitación mensual. En: http://www.ideam.gov.co/sectores/agri/precipit/precipit.htm. Colombia. [Fecha revisión: 31 marzo 2008] [ Links ].
JUDD, D. 1996. Review of the systematics and phylogenetic relationships of the Sabethini (Diptera: Culicidae). Systematic Entomology 21 (1): 129-150. [ Links ]
LANE, J. 1953. Neotropical Culicidae. Tribe Culicini, Deinocerites, Uranotaenia, Mansonia, Orthopodomyia, Aedomyia, Aedes, Psorophora, Haemagogus, Tribe Sabethini, Trichoprosopon, Wyeomyia, Phoniomyia, Limatus, Sabethes. University of São Paulo, Brazil. [ Links ]
LANE, J. 1965. Neotropical Culicidae. Dixinae, Chaoborinae and Culicinae, tribes Anophelini, Toxorhynchitini and Culicini (Genus Culex only). University of São Paulo, Brazil. [ Links ]
LANE, J.; CERQUEIRA, N. L. 1942. Os Sabetíneos da América (Diptera: Culicidae). Arquivos de Zoologia de Sao Paulo vol. III, art. IX, pp. [473]-849: ill.; 27 1/2 cm [ Links ]
LOUNIBOS, L. P.; FRANK, J. H.; MACHADO-ALLISON, C. E.; OCANTO, P.; NAVARRO, J. C. 1987. Survival, development and predatory effects of mosquito larvae in Venezuelan phytotelmata. Journal of Tropical Ecology 3: 221-242. [ Links ]
LOUNIBOS, L. P.; CAMPOS, R. E. 2002. Investigaciones recientes sobre Toxorhynchites rutilus (Diptera: Culicidae) con referencia al control biológico de mosquitos habitantes en recipientes. Entomotropica, antes Boletín de Entomología Venezolana 17 (2): 145-156. [ Links ]
LOUTON, J.; GELHAUS, J.; BOUCHARD, R. 1996. The aquatic macrofauna of water-filled bamboo (Poaceae: Bambusoideae: Guadua) internodes in a Peruvian lowland tropicals forest. Biotropica 28 (2): 228-242. [ Links ]
MacDONALD, W. W.; TRAUB, R. 1960. Malaysian parasites XXXVII. An introduction to the ecology of the mosquitoes of the lowland dipterocarp forest of Selangor, Malaya. Studies from the Institute of Medical Research, Malaya 29: 79-110. [ Links ]
MACHADO-ALLISON, C. E.; BARRERA, R.; DELGADO, L.; GÓMEZ-COVA, C.; NAVARRO, J. C. 1986. Mosquitos (Diptera: Culicidae) de los fitotelmata de panaquire, Venezuela. Acta Biológica de Venezuela 12 (2): 1-12. [ Links ]
MURILLO, C.; ASTAIZA, R.; FAJARDO, P. 1988. Biología de Anopheles (Kerteszia) neivai H., D. & K., 1913 (Diptera: Culicidae) en la costa pacífica de Colombia. Revista de Saúde Pública de São Paulo 22 (2): 94-100. [ Links ]
NATAL, D.; URBINATTI, P.; MARUCC, D. 1998. Arbovirus vector ecology in the Brazilian coastal range system. Universidade de São Paulo, Faculdade de Saúde Pública, Departamento de Epidemiologia, Av. Dr. Amaldo, 715, São Paulo, SP, Brasil. pp. 234-247. En: Travassos Da Rosa, A. P. A; Vasconcelos, P. F.; Travassos da Rosa, J. F. An overview of arbovirology in Brazil and neighbouring countries. Belém, Instituto Evandro Chaga. [ Links ]
NAVARRO, J. C.; MACHADO-ALLISON, C. E. 1995. Aspectos Ecológicos de Sabethes chloropterus Humbold (Diptera: Culicidae) en un bosque húmedo del Edo. Miranda Venezuela. Boletín Entomológico de Venezuela 10 (1): 91-104. [ Links ]
NAVARRO, J. C. 1998. Fauna de mosquitos (Diptera: Culicidae) del Parque Nacional Cerro El Copey y nuevos registros para La Isla de Margarita, Venezuela. Boletín Entomológico de Venezuela 13 (2): 187-194. [ Links ]
OLANO, V. A.; BROCHERO, H. L.; SÁENZ, R.; QUIÑONES, M. L.; MOLINA, J. A. 2001. Mapas preliminares de la distribución de especies vectores de malaria en Colombia. Biomédica 21: 402-408. [ Links ]
RIVERA-USME, J. J.; CAMACHO-PINZÓN, D. L.; BOTERO-BOTERO, A. 2008. Estructura numérica de la entomofauna acuática en 8 quebradas del departamento del Quindío-Colombia. Acta Biológica Colombiana 13 (2): 133-146. [ Links ]
ROCA-GARCIA, M. 1944. Isolation of three neurotropic viruses from forest mosquitoes in eastern Colombia. Journal of Infectious Diseases 75: 160-169. [ Links ]
RODRÍGUEZ, H.; DE LA HOZ, F. 2005. Dengue and dengue and vector behaviour in Cáqueza, Colombia, 2004. Revista de Salud Pública 7: 1-15. [ Links ]
ROZEBOOM, L. E.; KOMP, W. H. W. 1930. A new Microculex elongatus, from Colombia, with notes on the subgenus. Proceedings of the Entomological Society of Washington 52. [ Links ]
SILVA, A. M.; NUNES, V; LOPES, J. 2004. Culicídeos associados a entrenós de bambu e bromélias, com ênfase em Aedes (Stegomyia) albopictus (Diptera, Culicidae) na Mata Atlântica, Paraná, Brasil. Iheringia, Série Zoológica 94 (1): 63-66. [ Links ]
SUÁREZ, M. F.; NELSON, M. 1981. Registro altitudinal de Aedes aegypti en Colombia. Biomédica 1: 225. [ Links ]
SUÁREZ, M. F. 2001. Aedes albopictus (Skuse) (Diptera, culicidae) en Buenaventura Colombia.Informe Quincenal Epidemiológico Nacional 6: 222-223. [ Links ]
SUNAHARA, T.; MOGI, M. 1997. Distributions of larval mosquitoes among bamboo-stump pools which vary in persistence and resource input. Researches on Population Ecology 39 (2): 173-179. [ Links ]
TINKER, M. E.; OLANO, V. A. 1993. Ecología del Aedes aegypti en un pueblo de Colombia, Sur América. Biomédica 13: 5-14. [ Links ]
VALENCIA, J. D. 1973. Mosquito studies (Diptera, Culicidae) XXXI. A revision of the subgenus Carollia of Culex. Contribution of the American Entomological Institute 9 (4): 1-134. [ Links ]
VÉLEZ, I. D.; QUIÑONES, M. L.; SUÁREZ, M.; OLANO, V. A.; MURCIA, L. M.; CORREA, E.; ARÉVALO, C.; PÉREZ, L.; BROCHERO, H.; MORALES, A. 1998. Presencia de Aedes albopictus en Leticia, Amazonas, Colombia. Biomédica 18 (3): 192-198. [ Links ]
YANOVIAK, S. P.; LOUNIBOS, L. P.; WEAVER, S. C. 2006. Land use affects macroinvertebrate community composition in phytotelmata in the Peruvian Amazon. Annals of the Entomological Society of America 99: 1172-1181. [ Links ]
ZAVORTINK, T. J. 1968. Mosquito studies (Diptera: Culicidae). VIII. A prodrome of the genus Orthopodomyia. Contributions of the American Entomological Institute 3 (2): 84-91. [ Links ]
ZAVORTINK, T. J. 1981. Species complexes in the genus Thichoprosopon. Mosquito Systematics 13 (1): 82-85. [ Links ]
ZEQUI, J. A. C.; LOPES, J.; MEDRI, I. M. 2005. Imaturos de Culicidae (Diptera) encontrados em recipientes instalados en mata residual no munícipio de Londrina, Paraná, Brasil. Revista Brasileira de Zoologia 22 (3): 656-661. [ Links ]