Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.39 no.2 Bogotá July/Dec. 2013
Morfología e histología del sistema digestivo del burrito del frambueso Aegorhinus superciliosus (Coleoptera: Curculionidae)
Morphology and histology of the digestive system of raspberry weevil Aegorhinus superciliosus (Coleoptera: Curculionidae)
VIVIAN MEDEL1,2, BENEDICTO MOLINA1,3, JORGE SEGUEL1,4, RAMÓN REBOLLEDO1,5 y ANDRÉS QUIROZ1,6
1 Universidad de La Frontera. Francisco Salazar 01145, Temuco, Chile.
2 Programa de Doctorado en Ciencias de Recursos Naturales. eliettemedel@gmail. com. Autor para correspondencia.
3 M. Sc. Ciencias. benedicto.molina@ufrontera.cl.
4 Técnico Laboratorista, jorge.seguel@ufrontera.cl.
5 Ph. D. Ingeniero Agrónomo. ramon.rebolledo@ufrontera.cl.
6 Ph. D. en Química. andres.quiroz@ufrontera.cl. Autor para correspondencia.
Recibido: 21-nov-2012 - Aceptado: 23-oct-2013
Resumen: Se realizó el estudio morfológico e histológico del sistema digestivo de Aegorhinus superciliosus (Coleoptera: Curculionidae), plaga de importancia económica en el sur de Chile. Esta especie presenta un sistema digestivo característico para la mayoría de los insectos, siendo similar en machos y hembras, pero de mayor longitud en las últimas, llegando a medir el doble del tamaño del insecto. El sistema digestivo es un tubo largo de diámetro variable, dividido en tres regiones: intestino anterior (estomodeo), intestino medio (mesenterón) e intestino posterior (proctodeo). Histológicamente presenta un tejido epitelial similar al descrito para otras especies y externamente un tejido muscular, sin diferencias entre machos y hembras. No obstante, presenta características que difieren en otros curculiónidos y coleópteros tales como: ausencia de buche, ubicación y número de los ciegos gástricos, presencia de membrana peritrófica y ausencia de almohadillas rectales.
Palabras clave: Morfología interna. Plaga del arándano. Chile.
Abstract: A morphological and histological study was performed on the digestive system of Aegorhinus superciliosus (Coleoptera: Curculionidae), an important economic pest in southern Chile. This species has a typical digestive system for most insects, being similar in males and females, but longer in the latter, being twice the length of the insect. The digestive system is a long tube of variable diameter, divided into three regions: foregut, midgut and hindgut. From the histological point of view, it presents epithelium tissue features similar to the one described for other species, and externally it has a muscle tissue with no differences between males and females. Nevertheless, it shows features which differ either in other weevils or in beetles such as: absence of crop, the location and number of gastric caeca, presence of peritrophic membrane, and absence of a rectal pad.
Key words: Internal morphology. Blueberry pest. Chile.
Introducción
El burrito del frambueso Aegorhinus superciliosus (Guérin-Méneville, 1830) (Coleoptera: Curculionidae) es un insecto nativo del cono sur de América (Chile y Argentina), cuya larva posee poderosas mandíbulas con las cuales corta y tritura raíces y raicillas de sus hospederos, horadando finalmente la raíz principal cerca del cuello donde construye una cámara pupal, actividad larvaria que provoca un detrimento en la planta (Kuschel 1951; Carrillo 1993; Elgueta 1993; Cisternas et al. 2000). Los adultos ocasionan daños a brotes, tallos y frutos, que en ataques graves producen la muerte de la planta (Carrillo 1993).
Pese a la importancia que, desde el punto de vista productivo y económico, representa este insecto existe escasa información referente a su biología, la cual se limita principalmente a los aportes de Reyes (1993), Pérez (1994), Aguilera y Rebolledo (2001) y Parra et al. (2009). En general, las investigaciones realizadas han sido enfocadas al manejo y control de esta especie pero no existen antecedentes sobre la morfología del sistema digestivo de este curculiónido. Éste, sin embargo, es un área de contacto entre el insecto y el medio ambiente, y el foco de gran parte de los métodos de control de esta plaga (Chapman 1998).
Específicamente la región del mesenterón, presenta un gran interés, ya que las alteraciones en esa zona pueden afectar el crecimiento, desarrollo y todos los eventos fisiológicos que dependen de una adecuada alimentación, absorción y transformación de nutrientes (Mordue y Blackwell, 1993; Mordue y Nisbet 2000). Debido a que no existen antecedentes sobre morfología e histología de los sistemas vitales de este insecto, se planteó como objetivo de este estudio describir morfológica e histológicamente los órganos que comprenden el sistema digestivo, determinando su forma, tamaño y composición celular. Esta investigación aporta información descriptiva básica sobre A. superciliosus que permitirán establecer futuras estrategias de manejo y control.
Materiales y métodos
Material biológico. Se colectaron manualmente adultos de A. superciliosus entre noviembre 2010 y enero 2011, en una plantación comercial de arándanos orgánicos, ubicada en el Fundo El Roble, sector Martínez de Rozas, Comuna de Freire, Región de La Araucanía, Chile (38°57'12"S 72°37'54"O).
Lugar del estudio. Los insectos fueron transportados juntos en una caja de plástico transparente al laboratorio de Entomología Aplicada de la Universidad de La Frontera, Temuco, Chile, donde se alimentaron con hojas de maitén (Maytenus boaria: Celastraceae) y se mantuvieron bajo condiciones controladas de humedad (53% ± 2,3) y temperatura (26 °C ± 1,1).
Disección. Para el estudio morfológico e histológico, se hicieron disecciones de machos y hembras aletargados en frío (-15 °C), bajo una lupa estereoscópica binocular marca LEICA MZ75. La disección se inició con el desprendimiento de las antenas, patas y cortes dorso laterales de tórax y abdomen, fracturando la cutícula hasta llegar a la cabeza y rostrum. Se retiraron los fragmentos de cutícula y de la membrana interna a la cual se encuentra adherido el segundo par de alas, para facilitar la limpieza. Los órganos internos extraídos fueron colocados sobre placas petri con agua destilada (Hosseini-naveh et al. 2007; 2009), con pinzas y tijeras de punta fina se realizó la extracción del tejido adiposo circundante para continuar separando el sistema digestivo del resto de los sistemas vitales. El sistema digestivo fue dividido en tres partes (anterior, media y posterior) y luego cada parte se midió bajo una lupa equipada con reglilla micrométrica. Los órganos del tracto digestivo fueron fotografiados con una cámara Nikon para determinar su forma y tamaño, siguiendo la metodología propuesta por Rubio y Acuña (2006).
Preparación histológica de las muestras. Cada parte (intestino anterior, medio y posterior) fue fijada en Bouin acuoso (Baker 1969), durante 48 horas, deshidratada en alcohol y, posteriormente, incluida en paraplast con enfriamiento y solidificación a temperatura ambiente. Se obtuvieron cortes seriados de 7 Lim. de espesor en un micrótomo de rotación Microm HM 335 E para luego ser teñidos con hematoxilina eosina (Uría y Mora 1996).
Resultados
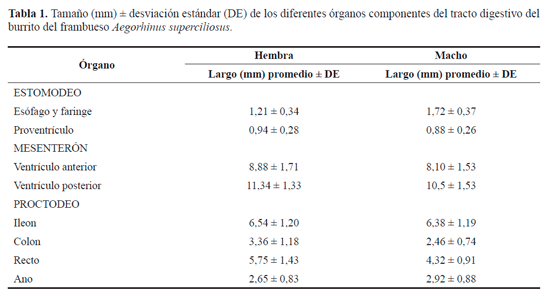
Descripción morfológica. En adultos de A. superciliosus, el sistema digestivo está constituido por un tubo de diámetro variable y longitud mayor al doble del tamaño del insecto, especialmente en las hembras (Tabla 1). Como en la mayoría de los insectos, este se encuentra dividido en tres regiones bien definidas: intestino anterior o estomodeo, intestino medio o mesenterón e intestino posterior o proctodeo. El intestino anterior ocupa en la hembra el 5%, el intestino medio el 50% y el intestino posterior el 45% de la longitud total. En el caso del macho, los respectivos porcentajes fueron 7, 50 y 43% del largo total del tubo digestivo.
Intestino anterior. Es un tubo de poca longitud (2,15 mm en la hembra y 2,6 mm en el macho), que se inicia en la boca y termina en el cardias. Comprende la faringe, el esófago y el proventrículo (Fig. 1A). La faringe es un tubo delgado con múltiples tráqueas, que se encuentra entre la cavidad preoral y el esófago (Fig. 1A). El esófago (Figs. 1A, 1C) es un tubo corto, poco diferenciado que no presenta la zona de ensanchamiento conocida como buche y se une al proventrículo (Figs.1B, 1C). Este último es la zona de mayor diámetro y se presenta como una dilatación definida (órgano esférico), siendo la sección más dura y esclerotizada del canal alimentario que culmina en la válvula "cardíaca" o cardias (Fig. 1B), un área de poca longitud que no permite que los alimentos regresen desde el intestino medio al intestino anterior.
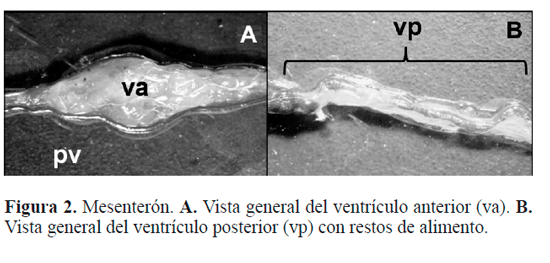
Intestino medio. Posterior al cardias, se encuentra el me-senterón, que comprende dos regiones: ventrículo anterior y posterior. El ventrículo anterior, es una porción que aparece como una diferenciada dilatación en forma de bulbo (Figs.1C, 2A) (8,88 mm en la hembra y 8,10 mm en el macho), a su vez el ventrículo posterior (Fig. 2B) es una región larga y angosta (11,34 mm en la hembra y 10,5 mm en el macho), que se encuentra externamente tapizada por numerosos ciegos gástricos de tamaño uniforme, que culmina en una constricción denominada válvula pilórica o píloro.
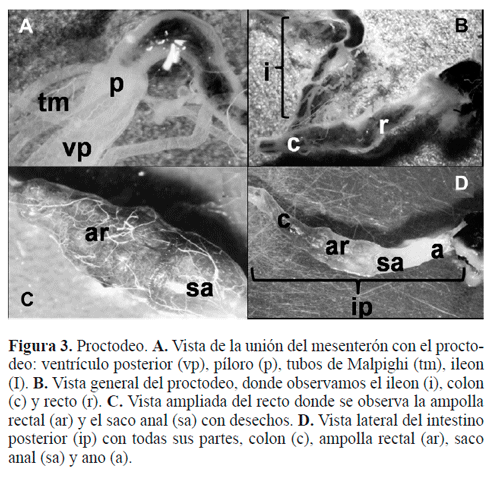
Intestino posterior. Esta porción es un tubo largo (18,30 mm en la hembra y 16,08 mm en el macho), que se inicia con la válvula pilórica de la cual nacen seis tubos de Malpighi (Fig. 3A) de gran longitud, que se encuentran rodeando todo el interior del insecto, especialmente el mesenterón y enlazados con un gran número de tráqueas. Los tubos de Malpighi se agrupan en dos: un grupo que contiene cuatro túbulos y el otro con sólo dos túbulos (Tipo II, según la clasificación de Calder 1989).
A continuación, justo después de la válvula pilórica se encuentra el íleon (Figs. 3A, 3B), que es la porción más larga del proctodeo (6,54 mm en la hembra y 6,38 mm en el macho) y presenta un diámetro uniforme en toda su estructura. Posterior al íleon se encuentra el colon (Figs. 3B, 3D), porción más corta (3,36 mm en la hembra y 2,46 mm en el macho) pero voluminosa. El recto (Figs. 3B-3D), es la última zona y presenta un área de mayor diámetro formando la ampolla rectal (Figs. 3C, 3D), la cual concluye en una pequeña porción denominada saco anal (Figs. 3C, 3D). Por último se encuentra el ano (Fig. 3D), que es la válvula encargada de evacuar los desechos del insecto al exterior y que termina en una zona más estrecha.
Descripción histológica
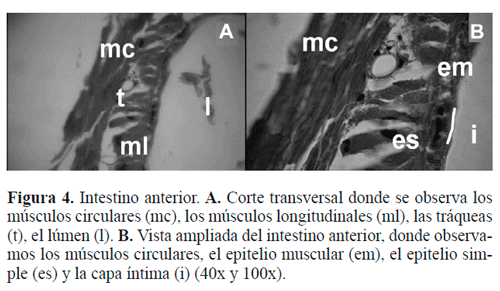
Intestino anterior. Está compuesto, desde el exterior hacia el interior, por una capa de músculos circulares, seguida de una capa relativamente gruesa con músculos longitudinales que se continua en una capa de epitelio simple plano, con la presencia de tráqueas y células con núcleos centrales redondeados, con la cromatina en corpúsculos y un citoplasma acidófi-lo denso y esponjoso (Fig. 4A). Internamente se encuentra un epitelio simple cilíndrico, cuyas células presentan un núcleo ovoide a un mismo nivel en la región basal. Finalmente, en contacto directo con el lumen, se observa la íntima, una capa delgada, densa, amorfa y plegada hacia el interior y el epitelio muscular (Fig. 4B). El proventrículo está formado por músculos circulares que son responsables de la constricción del mismo durante el filtrado de los alimentos.
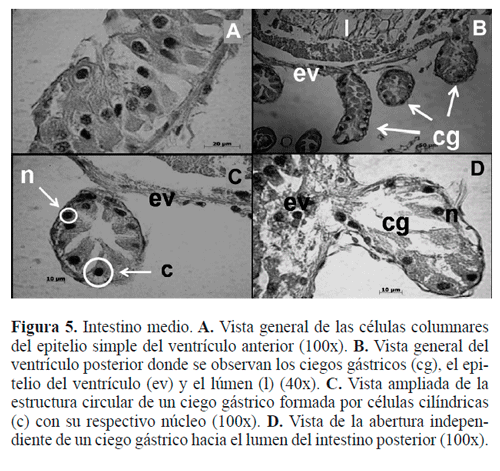
Intestino medio (Fig. 5). Sobre el epitelio se ordenan dos capas musculares: primero externamente una de músculos circulares y otra interna de músculos longitudinales. Entre los haces musculares se acomodan las tráqueas y una membrana de tejido conectivo. Las células más características del epitelio en este insecto, son cilíndricas con microvellosidades, formando un borde estriado que delimita el lumen.
Ventrículo anterior. La pared del mesenterón comprende dos capas de músculos estriados: externa (circular) con fibras continuas e interna (longitudinal), separadas por espacios intersticiales. Luego se continúa en un epitelio simple cilíndrico de células columnares, altas y delgadas y un núcleo
vp B
ovoide, claramente visible (Fig. 5A), que está constituido por células regenerativas, con citoplasma fuertemente acidófilo y un núcleo con cromatina dispersa, cuya función sería la absorción y secreción, que descansa sobre una membrana basal delgada. En estas células epiteliales se puede observar la presencia de leves invaginaciones con microvellosidades en la zona apical. El intestino medio carece de íntima cuticular y la parte más profunda, aquella que rodea el lumen o cavidad por donde circula el alimento digerido, está formada por una delgada capa de células epiteliales denominada membrana peritrófica, altamente permeable, ya que permite el paso de la secreción gástrica que va a penetrar en la masa de los alimentos. Entre el epitelio y la membrana peritrófica encontramos un espacio constituido por tejido conectivo.
Ventrículo posterior. Las células características del epitelio de revestimiento de esta sección, son cilíndricas con micro-vellosidades, formando un borde estriado que delimita el lumen (Fig. 5B). Las microvellosidades también están presentes en el borde interno. El alimento en el interior del lumen está rodeado por la membrana peritrófica.
Ciegos gástricos. El epitelio del ventrículo posterior se caracteriza por la presencia de ciegos gástricos, que se abren en forma independiente hacia el lúmen del intestino y se encuentran distribuidos en forma regular a través del ventrículo posterior (Fig. 5C). Muestran una pared con capas musculares similar a las del canal alimentario; sobre la capa muscular presentan una estructura circular formada por células cilíndricas, con núcleos redondos situados centralmente con el polo distal más angosto bordeando el lumen (Fig. 5D).
Intestino posterior (Fig. 6). En general el intestino posterior está constituido por una pared con abundantes músculos circulares y en la superficie luminal está revestido por la capa íntima que se originaría en la región pilórica.
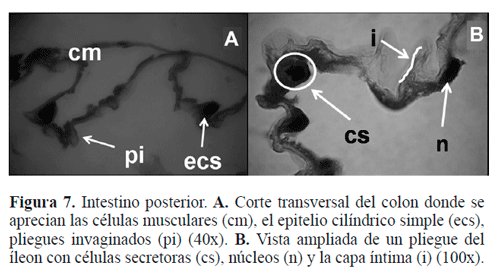
Ileon. Está constituido externamente por una capa cerosa de células epiteliales planas, que protegen la pared intestinal, a continuación presenta una pared externa de músculos circulares y una capa interna de músculos longitudinales (Fig. 6A), además se observa un epitelio de revestimiento simple cilín-drico cuyo citoplasma provoca protrusiones hacia el lumen, lo cual forma vellosidades intestinales (Fig. 6B).
Colon. Porción tubular del proctodeo que está revestido externamente por una pared de células musculares y presenta en su parte interna ondulaciones y pliegues invaginados (Fig. 7A) con presencia de vellosidades que posiblemente estén recubiertas por células secretoras de enzimas. La porción del colon que está próxima al recto no presenta vellosidades. Esto indica que, en general, el proctodeo tiene la misma estructura, con una pared cubierta por músculos, lo cual ayudaría a darle la forma y a realizar la función de esta región. El revestimiento interno de este órgano está formado por tejido epitelial simple cilíndrico (Fig. 7B) ya que las células presentan contornos rectangulares y la altura de estas es mayor que la que presentan las células del epitelio simple cúbico.
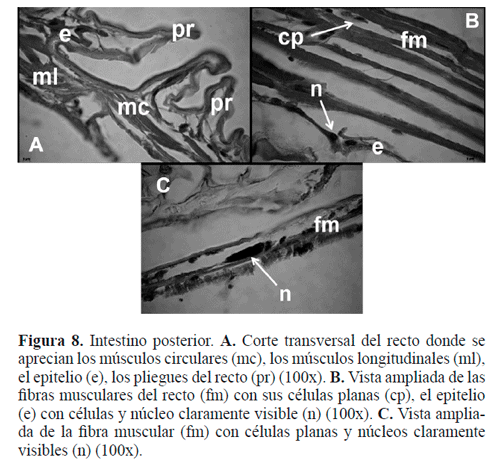
Recto. La pared interna del recto aparece muy plegada y externamente rodeada por una capa desarrollada de músculos circulares y longitudinales que dan forma y ayudan al funcionamiento de esta región (Fig. 8A). Los longitudinales están formados por células planas, delgadas, con núcleo central, alargado, cromatina laxa, con uno o más nucléolos y citoplasma uniforme (Fig. 8B), no se aprecian almohadillas rectales que son comunes en otros insectos. Las células de estos músculos tienen capacidad contráctil, lo que permitiría que los desechos sean expulsados al exterior. Internamente entre las fibras musculares y el detritus presenta un recubrimiento, formado por un epitelio cúbico simple con células esféricas y núcleo ovoide heterocromático y citoplasma basófilo (Fig. 8C).
Discusión
El sistema digestivo de A. superciliosus está constituido por un tubo, por lo general, recto o en espiral que se extiende desde la boca hasta el ano, con tres secciones principales que tienen diferentes orígenes embrionarios: el intestino anterior o estomodeo, el intestino medio o mesenterón y el intestino posterior o proctodeo, lo que concuerda con lo reportado por Borror y DeLong (1969), Belkin (1976), Snodgrass (1993), Chapman (1998) y Terra y Ferreira (2003), y similar a lo observado en otros coleópteros tales como: Dendroctonus spp. (Díaz et al. 2000, 2003; Silva-Olivares 2003), D. parallelo-colli Chapuis, 1869, D. rhizophagus Thomas y Bright, 1970, D. valens Leconte, 1859, (Díaz et al. 1998), Trypodendron lineatum (Olivier, 1795), Gnathotichus retusus (Leconte, 1868), G. sulcatus (Leconte, 1868) (Schneider y Rudinsky 1969), Cosmopolites sordidus (Germar, 1824), Metama-sius hemipterus (Linneaus, 1758), M. hebetatus (Gyllenhal, 1838) (Rubio y Acuña 2006), Ipspini (Say, 1826) (Hall et al. 2002), Scolytus multistriatus (Marsham, 1802) (Baker y Es-trin 1974), Compsus sp. (Rubio y Acuña 2007), Rhynchopho-rus palmarum (Linnaeus, 1758) (Sánchez et al. 2000), Phy-llophaga anxia (Leconte, 1850) (Berberet y Helms 1972), Anthonomus grandi Boheman, 1843 (MacGown y Siko-rowski 1981) e Hyperia postica (Gyllenhal, 1813) (Tombes y Marganian 1967). Estas estructuras también han sido observadas en otros insectos tales como: Anticarsia gemmatalis (Hübner, 1818) (Levy et al. 2004), Apis mellifera Linnaeus, 1758 (Aljedani et al. 2010), Tropidacris collaris (Stoll, 1813) (Wanderley-Teixeira et al. 2006), Nasutitermes takasagoen-sis (Shiraki, 1911) (Tokuda et al. 2001).
Con respecto al intestino anterior, Chapman (1998) y Terra y Ferreira (2003) indican que se encuentra subdividi-do en diversas partes funcionales: faringe, esófago, buche y proventrículo. En A. superciliosus encontramos las mismas partes excepto el buche, lo cual coincide con la descripción de Sánchez et al. (2000) para R. palmarum, pero difiere de lo reportado por Rubio y Acuña (2006) para C. sordidus, M. hemipterus y M. hebetatus, Rubio y Acuña (2007) para Compsus sp. y por Rubio et al. (2008) para Hypothenemus hampei (Ferrari, 1867), debido a que estos insectos presentan un buche fácilmente reconocible. Según Terra (1990), esto se debería a que en la evolución de los coleópteros, se produjo una gran reducción o pérdida del buche. Además Toro et al. (2009) explican que la porción terminal del esófago, fuertemente musculosa, llamada proventrículo no está bien diferenciada en especies de alimentación líquida (pulgas), pero en el caso de A. superciliosus, que tiene un alimento sólido, está claramente definida, lo que muestra la relación del desarrollo del proventrículo con el tipo de alimento ingerido por el insecto.
En el mesenterón de A. superciliosus, se distinguen dos regiones bien definidas: ventrículo anterior y ventrículo posterior, particularidad que está presente en otros coleópteros tal como lo señalan Wigglesworth (1974) y Crowson (1981), quienes indican además que la estructura y función del mesenterón guarda relación con el tipo de alimento ingerido. De acuerdo a lo anterior, Sánchez et al. (2000) indican que el intestino medio de R. palmarum tiene cierta similitud de forma y tamaño con A. grandis, C. sordidus, M. hemipterus y M. hebetatus ya que Macgown y Sikorowski (1981) y Rubio y Acuña (2006), señalan que en estas especies la porción anterior del mesenterón aparece como una diferenciada dilatación en forma de bulbo ovoide y la porción posterior es un tubo delgado, de menor diámetro, lo cual coincide con lo encontrado en A. superciliosus.
El ventrículo anterior presenta un epitelio columnar similar al encontrado en P. anxia (Berberet y Helms 1972), R. palmarum (Sánchez et al. 2000) y T. collaris (Wander-ley-Teixeira et al. 2006). Además presenta un borde interno cubierto por microvellosidades, descritas por Snodgrass (1993) y Chapman (1998) para insectos en general. Ma-cgown y Sikorowski (1981), reportaron que en A. grandis el ventrículo posterior se encuentra revestido externamente por ciegos gástricos, los cuales contienen bacterias y otros microorganismos del tubo digestivo que producen enzimas y vitaminas. En este caso A. superciliosus tiene cierta similitud con A. grandis y Dendroctonus frontalis Zimmerman, 1868 (Díaz et al. 2000), ya que estos autores señalan que varios ciegos gástricos se identificaron en la porción terminal del ventrículo posterior, lo que coincide con nuestros resultados, caso contrario a lo observado en R. palmarum pues según Sánchez et al. (2000) estos serían dos y se encontrarían en el ventrículo anterior. Además Rubio y Acuña (2006) observaron que los ciegos gástricos de C. sordidus, M. hemipterus y M. hebetatus, se encontraban tanto en el ventrículo anterior como posterior lo cual difiere de nuestros resultados y los reportes de otros autores. Internamente los ciegos gástricos presentan una pared con capas musculares similar a las del canal alimentario y poseen una estructura circular, formada por células cilíndricas lo cual concuerda con lo expuesto por Sánchez et al. (2000) para R. palmarum.
Toro et al. (2009) explican que en especies que ingieren tejidos, el epitelio parece estar protegido por una secreción celular que formaría la membrana peritrófica (PM) que reemplazaría de cierto modo la función protectora del mucus secretado en los animales por las células caliciformes. Al respecto Terra et al. (2006) y Bolognesi et al. (2008) explican, que es una estructura anatómica que rodea el bolo alimenticio en coleópteros y en la mayoría de los insectos. En el caso de A. superciliosus, el intestino medio está recubierto por esta membrana, lo cual según Crowson (1981), estaría relacionada con la ingesta de alimentos, ya que sólo los coleópteros que consumen alimentos con alto contenido de sólidos presentarían dicha membrana. Nuestros resultados coinciden con los reportados por Vásquez-Arista et al. (2001) para Prostephanus truncatus (Horn 1878), pero difieren de los reportados por Sánchez et al. (2000) para R. palmarum, Berberet y Helms (1972) para P. anxia, y Chadbourne (1961) para A. grandis ya que en estos insectos no se encuentra presente dicha membrana.
El mesenterón, se encuentra separado del proctodeo por la válvula pilórica o píloro desde la cual nacen seis tubos de Malpighi, largos, uniformes en todo su recorrido y se disponen enlazados sobre el tubo digestivo. Lo anterior coincide con lo informado para R. palmarum (Sánchez et al. 2000), C. sordidus, M. hemipterus y M. hebetatus (Rubio y Acuña, 2006), Compsus sp. (Rubio y Acuña, 2007), H. hampei (Rubio et al. 2008). Además con lo reportado por Wigglesworth (1974), Crowson (1981), Calder (1989) y Snodgrass (1993) quienes han registrado entre cuatro y seis tubos de Malpighi en otros coleópteros.
El proctodeo es un tubo largo, pero de menor diámetro que presenta ondulaciones y pliegues invaginados, constituido por una pared rodeada por una capa de músculos circulares y longitudinales que dan forma y participan en el funcionamiento de esta región. Estas observaciones son similares a las descritas por Berberet y Helms (1972) para P. anxia y Crow-son (1981) para coleópteros en general. Además está formado por el ileon, un tubo largo y delgado, similar al descrito para Dendroctonus adjuntus Blandford, 1897 (Zuñiga et al. 1994), pero diferente al encontrado en otros coleópteros, donde se describe como corto o bien como un órgano indiferenciado (Chapman 1998). El colon, está revestido externamente por una pared de células musculares y presenta en su parte interna ondulaciones y pliegues invaginados con presencia de vellosidades lo cual concuerda con lo reportado para R. palmarum (Sánchez et al. 2000). La porción del colon que está próxima al recto no presenta vellosidades. Esto indica que en general el proctodeo tiene la misma estructura, con una pared cubierta por músculos, lo cual ayudaría a darle la forma y a realizar la función de esta región. El recto es la última sección del intestino posterior y es un saco amplio y de paredes delgadas (ampolla rectal) que tiene un epitelio cilíndrico que está revestido por células musculares con capacidad contráctil, no presentando almohadillas rectales. Snodgrass (1993) explica que en algunos coleópteros estos órganos estarían ausentes, difiriendo de lo reportado por Zuñiga et al. (1994) para D. adjuntus. Finalmente, se encuentra el ano, tubo corto adosado al sistema reproductor, lo cual coincide con lo reportado para otros coleópteros (Wigglesworth 1974; Crowson 1981; Sánchez et al. 2000; Rubio y Acuña 2006).
Conclusión
Se describe por primera vez la morfología e histología del tubo digestivo del burrito del frambueso Aegorhinus superci-liosus. Los resultados indican que presenta la misma división y estructuras típicas descritas para la mayoría de los insectos y para otros coleópteros de la misma familia. Sin embargo existen diferencias como: ausencia de buche, número y posición de los ciegos gástricos, presencia de membrana peri-trófica y ausencia de almohadillas rectales. De acuerdo a los antecedentes presentados y debido a que no existen estudios de la anatomía interna e histología de A. superciliosus, se considera que esta investigación representa un aporte para el conocimiento de aspectos básicos de este insecto en nuestro país y puede establecer futuras estrategias de manejo y control de esta importante plaga del arándano.
Agradecimientos
Al Dr. Ramón Rebolledo, al equipo de trabajo del Laboratorio de Histología de la Facultad de Medicina de la Universidad de La Frontera, al proyecto DI12- 0026 DIUDRO y a CONICYT por la beca de post grado, la cual ha permitido realizar esta maravillosa investigación.
Literatura citada
AGUILERA, A.; REBOLLEDO, R. 2001. Estadios larvarios de Aegorhinus superciliosus (Guérin, 1830) (Coleoptera: Curculionidae). Revista Chilena de Entomología 28: 5-8. [ Links ]
ALJEDANI, D. M.; AL-GHAMDI, A. A.; ALMEHMADI, R. M. 2010. Comparative study in midgut histological structure of queen and worker Yemeni honey bees Apis mellifera jemenatica (Hymenoptera: Apidae) in pupae and adult stages under natural nutrition. Assiut Univesity Bulletin for Environmental Researches 13 (2): 63-76. [ Links ]
BAKER, J. R. 1969. Cytological technique. Methuen, Londres 149 p. [ Links ]
BAKER, W. V.; ESTRIN, C. L. 1974. The alimentary canal of Scolytus multistriatus (Coleoptera: Scolytidae). A histological study. Canadian Entomologist 106 (7): 673-686. [ Links ]
BELKIN, J. N. 1976. Fundamentals of Entomology. Editorial Biological Research Institute, 220 p. [ Links ]
BERBERET, R. C.; HELMS, T. J. 1972. Comparative anatomy and histology of selected systems in larval and adult Phyllophaga anxia (Coleoptera: Scarabaeidae). Annals of the Entomological Society of America 65 (5): 1026-1053. [ Links ]
BOLOGNESI, R.; TERRA, W.; FERREIRA, C. 2008. Peritrophic membrane role in enhancing digestive efficiency theoretical and experimental models. Journal of Insect Physiology 54 (10-11): 1413-1422. [ Links ]
BORROR, D. J.; DELONG, D. M., 1969. Introducción al estudio de los insectos. 1. Ed: Edgard Blücher Ltda. Sao Paulo, pp. 19-22. [ Links ]
CALDER, A. A. 1989. The alimentary canal and nervous system of Curculionoidea (Coleoptera): Gross morphology and systematic significance. Journal of Natural History 23 (6): 1205-1265. [ Links ]
CARRILLO, R. 1993. Plagas insectiles en arbustos frutales menores. pp. 63-86. En: Barriga, P.; Neira, M. (Eds.). Cultivos no tradicionales. Uniprint. Valdivia, Chile. [ Links ]
CISTERNAS, E.; FRANCE, A.; DEVOTTO, L.; GERDING, M. 2000. Insectos, ácaros y enfermedades asociadas a la frambuesa. Instituto de Investigaciones Agropecuarias. Chillán, Chile. 126 p. [ Links ]
CROWSON, R. A. 1981. The biology of the Coleoptera. Academic Press. Londres, Inglaterra. 802 p. [ Links ]
CHADBOURNE, D. S. 1961. Some histological aspect of the boll weevil. Annals of the Entomological Society of America 54 (6): 788-792. [ Links ]
CHAPMAN, R. F. 1998. The insects: structure and function. 4. ed. Cambridge University Press. Cambridge. 770 p. [ Links ]
DÍAZ, E.; CISNEROS, R.; ZUÑIGA, G.; URIA-GALICIA, E. 1998. Comparative anatomical and histological study of the alimentary canal of Dendroctonus parallelocollis, D. rhizophagus, and D. valens (Coleoptera: Scolytidae). Annals of the Entomological Society of America 91 (4): 479-487. [ Links ]
DÍAZ, E.; CISNEROS, R.; ZUÑIGA, G. 2000. Comparative anatomical and histological study of the alimentary canal of Dendroctonus frontalis (Coleoptera: Scolytidae) complex. Annals of the Entomological Society of America 93 (2): 303-311. [ Links ]
DÍAZ, E.; ARCINIEGA, O.; SÁNCHEZ, L.; CISNEROS, R.; ZUÑIGA, G. 2003. Anatomical and histological comparison of the alimentary canal of Dendroctonus micans, D. ponderosae, D. pseudotsugae pseudotsugae, D. rupifenis, and D. terebrans (Coleoptera: Scolytidae). Annals of the Entomological Society of America 96 (2): 144-152. [ Links ]
ELGUETA, M. 1993. Las especies de Curculionoidea (Insecta: Coleoptera) de interés agrícola en Chile. Museo Nacional de Historia Natural. Publicación Ocasional (Santiago) 48 (1): 1-79. [ Links ]
HALL, G. M.; TITTIGER, C.; ANDREWS, G. L.; MASTICK, G. S.; KUENZLI, M.; LUO, X.; SEYBOLD, S. J.; BLOMQUIST.; G. J. 2002. Midgut tissue of male pine engraver, Ips pini, synthesizes monoterpenoid pheromone component ipsdienol de novo. Naturwissenschaften 89 (2): 79-83. [ Links ]
HOSSEININAVEH, V.; BANDANI, A. R.; AZMAYESHFARD, P.; HOSSEINKHANI, S.; KAZZAZI, M. 2007. Digestive proteolytic and amylolytic activities in Trogoderma granarium Everts (Dermestidae: Coleoptera). Journal of Stored Products Research 43 (4): 515-522. [ Links ]
HOSSEININAVEH, V.; BANDANI, A. R.; HOSSEININAVEH, F. 2009. Digestive proteolytic activity in the Sunn pest, Eurygaster integriceps. Journal of Insect Science 9 (70): 1-11. [ Links ]
KUSCHEL, G. 1951. La subfamilia Aterpinae en América. Revista Chilena de Entomología 1 (1): 205-244. [ Links ]
LEVY, S. M.; FALLEIROS, A. M. F.; GREGORIO, E. A.; ARREBOLA, N. R.; TOLEDO, L. A. 2004. The larval midgut of An-ticarsia gemmatalis (Hübner) (Lepidoptera: Noctuidae): light and electron microscopy studies of the epithelial cells. Brazilian Journal of Biology 64 (3B): 633-638. [ Links ]
MACGOWN, M. W.; SIKOROWSKI, P. P. 1981. Digestive anatomy of the adult boll weevil, Anthonomus grandis grandis Boheman (Coleoptera: Curculionidae). Annals of the Entomological Society of America 74 (1): 117-126. [ Links ]
MORDUE, A. J.; BLACKWELL, A. 1993. Azadirachtin: an update. Journal Insect Physiology 39 (11): 903-924. [ Links ]
MORDUE, A. J.; NISBET, A. J. 2000. Azadirachtin from the neem tree Azadirachta indica: its action against insects. Anais da Sociedade Entomológica do Brasil 29 (4): 615-632. [ Links ]
PARRA, L.; MUTIS, A.; AGUILERA, A.; REBOLLEDO, R., QUIROZ, A. 2009. Estado del conocimiento sobre el cabrito del frambueso, Aegorhinus superciliosus (Guérin) (Coleoptera: Curculionidae). Idesia (Chile) 27 (1): 57-65. [ Links ]
PÉREZ, H. 1994. Descripción de aspectos morfológicos, biológicos y de comportamiento de Aegorhinus superciliosus (Coleoptera: Curculionidae). Tesis Ingeniero Agrónomo. Universidad Austral de Chile Valdivia, Chile. 102 p. [ Links ]
REYES, G. 1993. Aspectos morfológicos y biológicos de la especie Aegorhinus superciliosus (Coleoptera: Curculionidae). Tesis de grado de Licenciado en Agronomía, Universidad Austral de Chile, Valdivia. 90 p. [ Links ]
RUBIO, J. D.; ACUÑA, J. R. 2006. Anatomía comparada del tracto digestivo en imagos del complejo picudo (Coleoptera: Curculionidae) asociados al cultivo del plátano. Revista Colombiana de Entomología 32 (1): 67-72. [ Links ]
RUBIO, J. D.; ACUÑA, J. R. 2007. Morfología del tracto digestivo y sistema reproductor femenino de Compsus sp. (Coleoptera: Curculionidae). Revista Colombiana de Entomología 33 (2): 183-187. [ Links ]
RUBIO, J. D.; BUSTILLO, A. E.; VALLEJO, L. F.; ACUÑA, J. R.; BENAVIDES, P. 2008. Alimentary canal and reproductive tract of Hypothenemus hampei (Ferrari) (Coleoptera: Curculionidae, Scolytinae). Neotropical Entomology 37 (2): 143-151. [ Links ]
SÁNCHEZ, P. A.; SÁNCHEZ, F.; CAETANO, F. H.; JAFFÉ, K. 2000. El tubo digestivo en adultos de Rhynchophorus palmarum (L.) (Coleoptera: Curculionidae): Morfología y ultraestructura. Boletín de Entomología Venezolana 15 (2): 195-216. [ Links ]
SILVA-OLIVARES, A.; DÍAZ, E.; SHIBAYAMA, M.; TSUTSU-MI, V.; CISNEROS, R.; ZUÑIGA, G. 2003. Ultrastructural study of the midgut and hindgut in eight species of the genus Dendroctonus Erichson (Coleoptera: Scolytidae). Annals of the Entomological Society of America 96 (6): 883-900. [ Links ]
SCHNEIDER, I.; RUDINSKY, J. A. 1969. Anatomical and histological changes in internal organs of adult Trypodendron lineatum, Gnathotichus retusus and G. sulcatus (Coleoptera: Scolytidae). Annals of the Entomological Society of America 62 (5): 995-1003. [ Links ]
SNODGRASS, R. E. 1993. Principles of insect morphology. Tercera Edición. Mc. Graw-Hill. New York 667 p. [ Links ]
TERRA, W. R. 1990. Evolution of digestive system of insects. Annual Review of Entomology 35: 181-200. [ Links ]
TERRA, W. R.; FERREIRA, C. 2003. Encyclopedia of insects. Digestive system. pp. 313-323. [ Links ]
TERRA, W. R.; COSTA, R. H.; FERREIRA, C. 2006. Plasma membranes from insect midgut cells. Anais da Academia Brasileira de Ciencias 78 (2): 255-269. [ Links ]
TOKUDA, G.; NAKAMURA, T.; MURAKAMI, R.; YAMAOKA, I. 2001. Morphology of the digestive system in the wood-feeding termite Nasutitermes takasagoensis (Shiraki) (Isoptera: Termitidae). Zoological Science 18 (6): 869-877. [ Links ]
TOMBES, S. A.; MARGANIAN, L. 1967. Aestivation (summer diapause) in Hyperia postica (Coleoptera: Curculionidae), II. Morphological and histological studies of the alimentary canal. Annals of the Entomolgical Society of America 60 (1): 1-8. [ Links ]
TORO, H.; CHIAPPA, E.; TOBAR, C. 2009. Biología de insectos. Ediciones Universitarias de Valparaíso. Pontificia Universidad Católica de Valparaiso. pp. 65-70. [ Links ]
URÍA, E.; MORA, C. 1996. Apuntes para el curso teórico práctico de histología animal. ENCB. IPN. México. pp. 29-181. [ Links ]
VÁSQUEZ-ARISTA, M.; BASURTO-CADENA, M.; WALKER, M. 2001. La membrana peritrófica en Prostephanus truncatus (Horn) (Coleoptera: Bostrichidae) ¿Blanco para su control? Acta Universitaria (Universidad de Guanajuato) 11 (2): 21-15. [ Links ]
WANDERLEY-TEIXEIRA, V.; TEIXEIRA, A.; CUNHA, F.; COSTA, M.; VEIGA, A.; OLIVEIRA, J. 2006. Histological description of the midgut and the pyloric valve of Tropidacris collaris (Stoll, 1813) (Orthoptera: Romaleidae). Brazilian Journal of Biology 66 (4): 1045-1049. [ Links ]
WIGGLESWORTH, V. B. 1974. The principles of insect physiology. Chapman and Hall. Londres. 827 p. [ Links ]
ZUNIGA, G.; GONZÁLEZ, M.; FERNÁNDEZ, H.; CISNEROS, R. 1994. Estudio de la anatomía e histología del tubo digestivo de Dendroctonus adjuntus Blandford (Coleoptera: Scolytidae). Acta Zoológica Mexicana (n.s) 62: 23-35. [ Links ]
Citación sugerida:
MEDEL, VIVIAN; BENEDICTO MOLINA; JORGE SEGUEL; RAMÓN REBOLLEDO y ANDRÉS QUIROZ. 2013. Morfología e histología del sistema digestivo del burrito del frambueso Aegorhinus superciliosus (Coleoptera: Curculionidae). Revista Colombiana de Entomología 39 (2): 260-266