Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Entomología
versión impresa ISSN 0120-0488
Rev. Colomb. Entomol. vol.40 no.2 Bogotá jul./dic. 2014
ARTÍCULOS DE INVESTIGACIÓN / RESEARCH PAPERS
Maduración de la ovariola de la grana cochinilla Dactylopius coccus (Hemiptera: Coccoidea: Dactylopiidae)
Ovariole maturation of the cochineal insect Dactylopius coccus (Hemiptera: Coccoidea: Dactylopiidae)
Arturo Ramírez-cruz
Ph. D. Instituto Politécnico Nacional. Centro de Educación Continua, Unidad Morelia. 58190. Morelia, Michoacán. México. aramirezc@ipn.mx
RESUMEN
La maduración de los ovarios en los insectos implica una serie de complicados eventos celulares, los cuales culminan con la formación de ovocitos maduros listos para su fecundación. Dactylopius coccus es un insecto de gran importancia industrial como fuente del colorante natural rojo ácido carmínico. Debido a que no existe información sobre el proceso de maduración de sus ovarios, el objetivo del presente trabajo fue caracterizar las modificaciones morfológicas por las que atraviesan sus ovariolas durante la maduración de los ovarios de las hembras adultas, desde recién emergidas hasta que sus ovarios producen los primeros ovocitos maduros, ello con la finalidad de contribuir al conocimiento de la fisiología reproductiva de esta especie. La previtelogénesis se realizó desde que las hembras emergen como adultos hasta el cuarto día de edad, mientras que la vitelogénesis desde el quinto día postemergencia hasta antes del día 13 de edad. Finalmente, la coriogénesis se presentó a los 13 días de edad de las hembras. En esta última se observan los primeros ovocitos maduros, por lo que los ovarios también adquirieren su madurez; de esta manera, las ovariolas de D. coccus realizan sólo un ciclo gonádico cuya duración es de 13 días.
Palabras clave: Ciclo gonádico; Previtelogénesis; Vitelogénesis; Coriogénesis.
ABSTRACT
Ovarian maturation in insects consists of a series of complicated cellular events that culminates with formation of mature oocytes ready to be fertilized. Dactylopius coccus from which the natural dye carminic acid is obtained, is highly important for industry. Because information on their ovarian maturation is lacking, the aim of this study was to characterize the morphological changes that occurs in their ovarioles during the ovarian maturation of adult females, from newly emerged until their ovaries produced the first mature oocytes, in order to contribute to better understanding of reproductive physiology of this species. The previtellogenesis took place since the newly emerged adult females up to fourth days old. The vitellogenesis takes place from five days old until eleven days old. Finally, the choriogenesis was observed at 13 days old. At this last age the first matured oocytes were observed, thus acquiring the ovaries their maturity; thereby the ovarioles of D. coccus carry out only one gonadic cycle that lasts 13 days.
Key words: Gonadic cycle; Previtellogenesis; Vitellogenesis; Choriogenesis.
Introducción
La maduración de los ovarios en los insectos implica una serie de complejos eventos celulares por los que atraviesan sus ovocitos antes de lograr su madurez, y entre ellos se pueden mencionar la actividad mitótica y meiótica de las células germinales primordiales, la previtelogénesis, la vitelogénesis y finalmente la coriogénesis (King y Büning 1985; Raabe 1986); al término de dichos procesos que engloban a la ovogénesis, los ovarios presentan ovocitos que han alcanzado su madurez fisiológica y están listos para ser fecundados. Una gran cantidad de factores influyen en el proceso de la maduración de los ovocitos y entre los más importantes se mencionan la cópula, la cantidad y calidad del alimento, la temperatura, la humedad, entre otros (Engelman 1970). Los ovarios de Coccoidea presentan ovariolas de tipo telotrófico y en las cuales se pueden distinguir el germario (donde se localizan las células nutricias) y el vitelario (donde el ovocito realiza principalmente la vitelogénesis y la coriogénesis) (Szklarzewicz 1998; Szklarzewicz et al. 2005).
Dactylopius coccus Costa, 1829 es una especie de gran importancia comercial, debido a que de las hembras adultas se obtiene el colorante rojo ácido carmínico, el cual tiene una gran cantidad de aplicaciones en diferentes industrias, principalmente en la de los alimentos, la farmacéutica y la de los cosméticos (Méndez et al. 2003). Con relación a la fisiología ovárica en D. coccus, estudios de cultivo in vitro relacionaron los ovarios con la producción de ácido carmínico (Cortés et al. 2005). Se sabe además que esta especie presenta ovarios de tipo telotrófico, que sus ovariolas tienen un solo ovocito y que maduran asincrónicamente, por lo que se les puede encontrar en muy diferentes grados de madurez (Ramírez-Cruz et al. 2008). Se ha descrito la ultraestructura del germario, en la que se han reportado entre otras cosas, bacterias simbiontes presentes en el citoplasma de las células nutricias (Ramírez-Cruz 2012) e información sobre su fecundidad potencial bajo condiciones controladas (Ramírez-Cruz y Llanderal-Cázares 2013).
Dada la importancia económica que representa D. coccus y a que no existe información sobre el proceso de maduración de sus ovarios, el objetivo del presente trabajo fue caracterizar las modificaciones morfológicas por las que atraviesan sus ovariolas durante su maduración en los ovarios de las hembras adultas, desde recién emergidas hasta que sus ovarios producen los primeros ovocitos maduros, con la finalidad de contribuir al conocimiento sobre la fisiología reproductiva de esta especie.
Materiales y métodos
La cría de las hembras adultas de D. coccus se realizó durante el otoño de 2011, mediante la técnica descrita en Ramírez-Cruz et al. (2008), bajo condiciones de laboratorio a una temperatura promedio de 21 °C y una humedad relativa promedio de 45 %, en el Centro de Educación Continua Unidad Morelia, Michoacán del Instituto Politécnico Nacional, México, localizado a 19º38'N y 101º13'O y una altitud de 1.950 m. Para caracterizar los cambios morfológicos de las ovariolas, se emplearon hembras adultas de las siguientes edades postemergencia: recién emergidas (0), 2, 4, 5, 7, 10 y 13 días. Cada uno de estos grupos de edad contuvo entre cinco y siete hembras, las cuales se disecaron en solución de Ringer para insectos para extraer completos los ovarios y después fijarlos en líquido de Carnoy (Martínez 2002). Posteriormente, para transparentar las ovariolas, los ovarios se sumergieron completamente en una solución de glicerina pura en alcohol de 70 % (1:1) durante al menos 3 días. Después de ello se conservaron en solución recién preparada de glicerina−alcohol 70% hasta el momento de su utilización. En cada uno de los ovarios de las diferentes edades, se midió la longitud de las ovariolas y de su respectivos ovocitos y germarios, considerándose para ello, sólo las ovariolas más desarrolladas en cada edad; se midieron entre seis y 11 ovariolas por ovario. Las ovariolas se midieron colocando los ovarios en un portaobjetos excavado que contenía una pequeña cantidad de solución de glicerina-alcohol de 70 %. Todas las mediciones se realizaron mediante un micrómetro ocular adaptado a un microscopio de campo claro marca Zeiss.
Para microscopía electrónica de barrido, se procesaron uno o dos ovarios de cada una de las edades mencionadas, para lo cual las hembras se disecaron en solución de Ringer para insectos (Martínez 2002) y se procedió a la extracción del sistema reproductor completo. Se fijaron en glutaraldehido al 2,5 % y se postfijaron en tetraóxido de osmio al 1 %; se deshidrataron progresivamente en alcohol, se secaron en CO2 mediante el método de secado por punto crítico y posteriormente se cubrieron con oro (Bozzola 2007); finalmente se observaron en un microscopio electrónico de barrido modelo Jeol JSM-5800LV.
Resultados
Hembras recién emergidas. Los ovarios, ovariolas y sus respectivos ovocitos, fueron muy pequeños y, en consecuencia, completamente inmaduros. Las ovariolas tuvieron una longitud promedio de 137 µm, mientras que sus ovocitos alcanzaron en promedio 56,19 µm (Tabla 1). Las ovariolas fueron aproximadamente piriformes y, aunque ya era posible diferenciar entre el vitelario y el germario, este último aún era poco desarrollado y con una longitud promedio de 76,25 µm (Fig. 1A; Tabla 1). El tamaño pequeño de los ovocitos observado en esta edad, indicó que se encontraban en etapa de previtelogénesis. Aproximadamente la cuarta parte de las ovariolas por ovario en esta edad presentaron estas características, ya que las restantes eran muy pequeñas y esféricas, sin distinción aún entre el germario y el vitelario (Fig. 1A), por lo que no fueron tomadas en cuenta por no corresponder a las ovariolas representativas de esta edad.
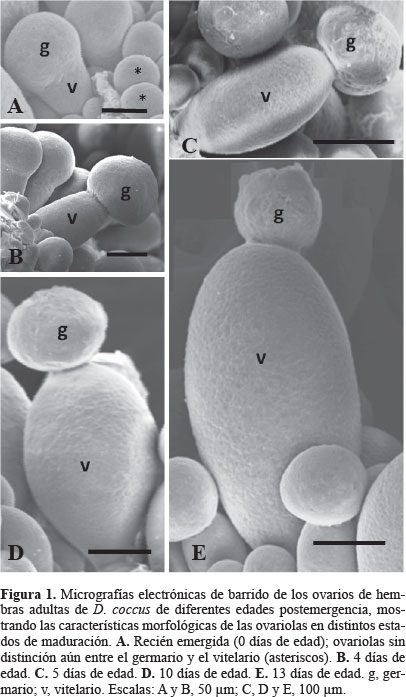
Hembras entre el segundo y cuarto días de edad. Las ovariolas se caracterizaron por mostrar un apreciable crecimiento con relación al observado en hembras recién emergidas, alcanzando en promedio las 187,21 micras (µm) a los cuatro días de edad (Tabla 1; Fig. 1B). El vitelario desde el segundo día ya está claramente diferenciado como consecuencia del lento aumento en la longitud del ovocito mostrado durante estos días, la cual a los cuatro días fue aproximadamente el doble de la registrada a la emergencia (Tabla 1); en contraste, el crecimiento del germario fue moderado comparado con la longitud que tenía a la emergencia (Tabla 1; Fig. 1B). El lento crecimiento de los ovocitos durante estos días indicó que permanecían en previtelogénesis, característica que presentaba aproximadamente la mitad de las ovariolas en cada ovario.
Hembras de 5 días de edad. A partir del quinto día de edad los ovarios presentaron ovariolas que en su conjunto mostraron un marcado aumento en su tamaño (Tabla 1; Fig. 1C) debido principalmente al acelerado aumento en la longitud de los ovocitos los cuales alcanzaron alrededor del doble de la longitud registrada el día anterior (Tabla 1). Del mismo modo, la longitud promedio del germario también se incrementó apreciablemente en comparación al día cuatro de edad, alcanzando en promedio las 128,70 µm (Tabla 1). El rápido crecimiento de los ovocitos al día cinco de edad fue indicativo de que habían iniciado la etapa de la vitelogénesis. Aproximadamente la mitad de las ovariolas por ovario tuvieron estas características.
Hembras entre los 7 y 10 días de edad. Las ovariolas y ovocitos continuaron creciendo aceleradamente hasta alcanzar una longitud promedio de 472,5 µm y de 304,4 µm a los 10 días de edad, respectivamente (Tabla 1; Fig. 1D). El germario por su parte, durante estas edades continuó su crecimiento (aunque menos acentuado en comparación al ovocito) logrando una longitud promedio de 162,5 µm al décimo día (Tabla 1; Fig. 1D), siendo en este caso el incremento en la longitud de la ovariola debido principalmente al crecimiento del ovocito, el cual al seguir aumentando de tamaño, indicó que se hallaba en vitelogénesis activa.
Hembras de 13 días de edad. Tanto las ovariolas como los ovocitos alcanzaron su máxima longitud (Tabla 1; Fig. 1E); fue además posible observar los primeros ovocitos con corion, esto es, que habían concluido la coriogénesis; de esta manera los ovocitos y, en consecuencia los ovarios, habían alcanzado su madurez. El germario por su parte, mostró una clara disminución en su longitud (Tabla 1; Fig. 1E) lo que indicó que había entrado en un proceso de degeneración o de reabsorción. Se observó que aproximadamente dos terceras partes de las ovariolas de esta edad presentaron las características indicadas. Las ovariolas con ovocitos ya maduros no tuvieron un patrón regular de distribución a lo largo de los oviductos laterales, ya que se podían localizar tanto distal como proximalmente sobre éstos, sin mostrar un patrón regular de acomodo (Fig. 1E).
Discusión
Dactylopius coccus presentó a la emergencia ovarios con ovocitos completamente inmaduros, por lo que es una especie sinovigénica. Esta característica se presenta también en otros Coccoidea como Diaspididae (Foldi 1990) y en otros Hemiptera como Podisus maculiventris (Say, 1832) (Pentatomidae), Orius insidiosus (Say, 1832) (Anthocoridae), Geocoris punctipes (Say, 1832) (Geocoridae) (Legaspi y Legaspi Jr. 2008) y Nezara viridula (Linnaeus, 1758) (Pentatomidae) (Fortes et al. 2011). En este aspecto, no existe información precisa sobre el efecto de la cópula sobre la maduración de los ovarios en D. coccus; Peréz-Guerra y Kosztarab (1992) mencionan que después de la cópula la hembra adulta aumenta de tamaño; Llanderal y Nieto (2001) señalan que después de la cópula el volumen corporal de las hembras aumenta considerablemente debido al desarrollo de los huevos. Por otra parte, Marín y Cisneros (1977) indican que las hembras vírgenes aumentan de tamaño, aunque en menor proporción que las hembras copuladas. Esto último, sugiere que en D. coccus la cópula no sería necesaria para la maduración de los ovocitos, tal como ocurre en otros Hemiptera como Triatoma infestans (Klug, 1834) (Triatominae) (Asin y Croco de Ayerbe 1992), Podisus nigrispinus (Dallas, 1851) (Pentatomidae) (Alvarenga Soares et al. 2011) y N. viridula (Fortes et al. 2011) y, aunque la cópula sí podría ser necesaria para aumentar la fecundidad, ambos aspectos tendrían que ser comprobados. La cópula, sin embargo, sí es indispensable para que se realice la oviposición en D. coccus (Marín y Cisneros 1977).
La previtelogénesis en D. coccus se realizó en las hembras adultas desde recién emergidas, hasta los cuatro días de edad. La previtelogénesis en otros hemípteros también llega a ser de corta duración, por ejemplo en Triatoma protracta (Uhler, 1894) (Triatominae) esta fase dura entre uno y dos días (Mundall y Engelmann 1977) y en Pyrrhocoris apterus (Linnaeus, 1758) (Pyrrhocoridae) dura un día (Socha et al. 1991). Esta etapa en D. coccus morfológicamente se caracterizó por el lento crecimiento de sus ovocitos y germarios. En general la previtelogénesis en los insectos es un proceso de crecimiento lento del ovocito, caracterizado en que éste acumula varios tipos de organelos, principalmente ribosomas y mitocondrias (Raabe 1986) que, en Hemiptera, provienen de las células nutricias del germario a través del cordón trófico; dichos organelos son usados en etapas posteriores de la maduración del ovocito (King y Büning 1985). El crecimiento previtelogénico en los insectos representa aproximadamente sólo el 1% del crecimiento total del ovocito (Büning 1994).
La vitelogénesis en D. coccus comenzó desde el quinto día y concluyó antes del día 13 de edad de las hembras, por lo que tuvo una duración aproximada de siete días y se caracterizó por un pronunciado crecimiento del ovocito por la acumulación del vitelo. Aunque no existe información en Coccoidea con referencia a la duración de la vitelogénesis, se puede indicar que su duración es muy variable en Hemiptera; por ejemplo en el caso de Triatominae se sabe que en T. protracta dura entre cinco y seis días (Mundall y Engelmann 1977) y en Triatoma barberi Usinger, 1939 dura alrededor de cinco días (Ramírez-Cruz et al. 2003). En contraste en el hemíptero acuático Aphelocheirus aestivalis (Fabricius, 1794) (Aphelocheiridae) la vitelogénesis es muy prolongada ya que dura entre dos y cuatro semanas (Papácek y Soldán 2008). Diferencias tan grandes en la duración de la vitelogénesis entre los hemípteros (y en general en los insectos) son consecuencia de varios factores tanto internos como externos; Engelman (1970) señala que entre los más importantes están la cantidad y calidad de alimento, la cópula, la temperatura, la humedad y factores hormonales. Se sabe que el cordón trófico en las ovariolas en D. coccus se mantiene durante toda la vitelogénesis (Ramírez-Cruz et al. 2008), lo cual ocurre también en Diaspididae (Coccoidea) (Foldi 1990); esto contrasta con lo observado en otros hemípteros, como por ejemplo en Triatominae, donde el cordón trófico sólo es funcional durante la previtelogénesis, ya que degenera cuando inicia la vitelogénesis (Stoka et al.1987). El germario de las ovariolas de D. coccus creció rápidamente durante la vitelogénesis, lo cual indica que el germario en esta especie no sólo es activo durante la previtelogénesis sino se mantiene activo incluso durante la vitelogénesis. El hecho de que el germario y el cordón trófico de D. coccus degeneren sólo hasta el final de la vitelogénesis, sugiere que sus células nutricias, además de enviar ribosomas y mitocondrias a los ovocitos (Ramírez-Cruz 2012), pudieran proporcionar además por ejemplo lípidos, tal como sucede en Lygus lineolaris (Palisot de Beauvois, 1818) (Hemiptera:Miridae) (Ma y Ramaswamy 1987) o proteínas como en el caso de Dysdercus intermedius Distant, 1902 (Hemiptera:Pyrrhocoridae) (Biczkowski y Dittman 1995). A diferencia de la variación en el tamaño del germario detectada en D. coccus en este trabajo durante el ciclo gonádico, el germario en L. lineolaris permanece del mismo tamaño durante dicho ciclo (Ma y Ramaswamy 1987).
La coriogénesis, es decir la presencia de los primeros ovocitos maduros, en D. coccus se detectó a los 13 días de edad de las hembras. En este sentido, según Vogelgesang y Szklarzewicz (2001) en el coccoideo Orthezia urticae (Linnaeus, 1758) la coriogénesis da inicio al mismo tiempo que la vitelogénesis; sería necesario profundizar en este sentido para determinar si pudiera suceder lo mismo en D. coccus. El germario en las ovariolas de D. coccus a los 13 días de edad de las hembras dio claras muestras de degeneración o reabsorción por la disminución de su tamaño. Los materiales producto de la degradación del germario en D. coccus muy posiblemente se incorporan al ovocito en crecimiento y sirvan a éste como fuente adicional de proteínas y ARN, tal como Engelman (1970) indica que sucede durante la degeneración del germario en los ovarios politróficos.
En D. coccus se realiza un solo ciclo gonádico, ya que sólo se presenta un ovocito por ovariola (Ramírez-Cruz et al. 2008). Este ciclo en D. coccus duró 13 días en completarse, lo que indica que la madurez fisiológica del ovocito (y en consecuencia de los ovarios) se adquiere cuando la hembra llega a esta edad. Este ciclo se puede considerar de muy larga duración si se compara con otros Hemiptera, tal es el caso de Trioza erytreae (Del Gercio, 1918) (Psyllidae) donde tarda sólo tres días (Blowers y Moran 1967), en T. protracta alrededor de ocho días (Mundall y Engelmann 1977), en L. lineolaris siete días (Ma y Ramaswamy 1987) y en T. barberi (Triatominae) entre cinco y siete días (Ramírez-Cruz et al. 2003). Las ovariolas con ovocitos con corion en D. coccus, se ubicaron sobre los oviductos laterales tanto apical como basalmente; esta disposición también se ha observado en los Coccidae (Coccoidea) (Foldi 1997), sin embargo, en Diaspididae (Coccoidea) las ovariolas con ovocitos maduros comienzan a presentarse en la parte apical de los oviductos laterales (Foldi 1990, 1997).
Conclusiones
En D. coccus la previtelogénesis se realizó desde que las hembras emergen como adultas y hasta el cuarto día de edad; la vitelogénesis se realizó desde el quinto día postemergencia y hasta antes del día 13 de edad; por su parte la coriogénesis se presentó a los 13 días. Es a esta última edad cuando se observan los primeros ovocitos maduros, por lo que los ovarios también adquirieren su madurez; de esta manera, las ovariolas de D. coccus realizan sólo un ciclo gonádico cuya duración es de 13 días.
Agradecimientos
A la Dra. Celina Llanderal del Colegio de Postgraduados, Montecillo, México, por proporcionar las hembras de D. coccus usadas como pie de cría y por sus comentarios sobre el escrito original. A la M. en C. Ma. Esther Sánchez E., de la Central de Microscopía ENCB (IPN), México, por su asistencia técnica en la parte correspondiente a la microscopía electrónica de barrido. A los revisores anónimos por sus comentarios.
Literatura citada
ALVARENGA SOARES, M.; DARC BATISTA, J.; COLA ZANUNCIO, J.; LINO-NETO, J.; SERRAO, J. E. 2011. Ovary development, egg production and oviposition for mated and virgin females of the predator Podisus nigrispinus (Heteroptera: Pentatomidae). Acta Scientiarum. Agronomy 33 (4): 597-602. [ Links ]
ASIN, S.; CROCCO DE AYERBE, L. 1992. Influence of mating on ovarian follicle development in Triatoma infestans (Klug, 1834). Memórias do Instituto Oswaldo Cruz 87 (3): 369-374. [ Links ]
BICZKOWSKI, M.; DITTMANN, F. 1995. Translation of maternal mRNA during early oogenesis in a telotrophic-meroistic insect (Dysdercus intermedius). Journal of Insect Physiology 41 (12): 1133-1139. [ Links ]
BOZZOLA, J. J. 2007. Conventional specimen preparation techniques for scanning electron microscopy of biological specimens. pp. 449-466. In: Kuo, J. (Ed.). Electron microscopy: Methods and protocols. 2nd edition. Human Press Inc. New Jersey. 608 p. [ Links ]
BLOWERS, J. R.; MORAN, V. C. 1967. Notes on the female reproductive system of the South African citrus psylla, Trioza erytreae (Del Guercio) (Homoptera: Psyllidae). Journal of the Entomological Society of Southern Africa 30 (1): 75-81. [ Links ]
BÜNING, J.1994. The insect ovary. Utrastructure, previtellogenic growth and evolution. Chapman and Hall. Londres. 400 p. [ Links ]
CORTÉS, D.; VIGUERAS, A. L.; PORTILLO, L. 2005. Relación del aparato reproductor femenino de Dactylopius coccus Costa (Hemiptera: Dactylopiidae) en la síntesis del ácido carmínico. Scientia-CUCBA 7: 131-138. [ Links ]
ENGELMANN, F. 1970. The Physiology of Insect Reproduction. Pergamon Press. Oxford. 307 p. [ Links ]
FOLDI, I. 1990. Gametogenesis. Oocytes and spermatozoa formation. pp. 199-204. In: Rosen, D. (Ed.). Armored Scale Insects. Their biology, natural enemies and control. Vol. 4A. Elsevier Science Publishers B.V. Netherlands. 384 p. [ Links ]
FOLDI, I, 1997. Internal anatomy of the adult female. pp. 73-89. In: Ben-Dov, Y.; Hodgson, C. J. (Eds.). Soft scale insects. Their biology, natural enemies and control. Vol. 7A. Elsevier Science Publishers B.V. Netherlands. 442 p. [ Links ]
FORTES, P.; SALVADOR, G.; CONSOLI, F. L. 2011. Ovary development and maturation in Nezara viridula (L.) (Hemiptera: Pentatomidae). Neotropical Entomology 40 (1): 89-96. [ Links ]
KING, R. C.; BÜNING, J. 1985. The origin and functioning of insect oocytes and nurse cells. pp. 37-82. In: Kerkut, G. A.; Gilbert, L. I. (Eds.). Comprensive Insect Physiology, Biochemistry and Pharmacology. Vol. 1. Pergamon Press. New York. 487 p. [ Links ]
LEGASPI, J. C.; LEGASPI, B. C. Jr. 2008. Ovigeny in selected generalist predators. Florida Entomologist 91 (1): 133-135. [ Links ]
LLANDERAL, C.; NIETO, H. R. 2001. Características biológicas de la grana cochinilla del nopal Dactylopius coccus Costa. pp. 23-30. En: Llanderal, C.; Nieto, H. R. (Eds.). Producción de grana cochinilla. Instituto de Fitosanidad, Colegio de Postgraduados. Texcoco, Edo. de México. 140 p. [ Links ]
MA, W. K.; RAMASWAMY, S. B. 1987. Histological changes during ovarian maturation in the tarnished plant bug Lygus lineolaris (Palisot de Beauvois) (Hemiptera: Miridae). International Journal of Insect Morphology and Embryology 15: 309-322. [ Links ]
MARÍN L., R.; CISNEROS V., F. 1977. Biología y morfología de la cochinilla de carmín, Dactylopius coccus Costa (Homopt.: Dactylopiidae). Revista Peruana de Entomología 20 (1): 115-120. [ Links ]
MARTÍNEZ M., I. 2002. Técnicas básicas de anatomía microscópica y de morfometría para estudiar los insectos. Boletín de la Sociedad Entomológica Aragonesa 30: 187-195. [ Links ]
MÉNDEZ-GALLEGOS, S. de J.; PANZAVOLTA, T.; TIBERI, R. 2003. Carmine cochineal Dactylopius coccus Costa (Rhynchota: Dactylopiidae): Significance, production and use. Advances in Horticultural Science 17 (3): 165-171. [ Links ]
MUNDALL, E.; ENGELMANN, F. 1977. Endocrine control of vitellogenin synthesis and vitellogenesis in Triatoma protracta. Journal of Insect Physiology 23: 825-836. [ Links ]
PAPÁCEK, M.; SOLDÁN, T. 2008. Structure and development of the reproductive system in Aphelocheirus aestivalis (Hemiptera: Heteroptera: Nepomorpha: Aphelocheiridae). Acta Entomologica Musei Nationalis Pragae 48 (2): 299-318. [ Links ]
PÉREZ-GUERRA, G.; KOSZTARAB, M. 1992. Biosistematics of the family Dactylopiidae (Homoptera: Coccinea) with emphasis on the life cycle of Dactylopius coccus Costa. Bulletin No. 92-1.Virginia Agricultural Experiment Station. 90 p. [ Links ]
RAABE, M. 1986. Insect reproduction: regulation of successive steps. Advances in Insect Physiology 19: 29-154. [ Links ]
RAMÍREZ-CRUZ, A.; NOGUEDA T., B.; MARTÍNEZ M., I. 2003. Maduración ovárica en Triatoma barberi Usinger, 1939 (Hemiptera: Triatominae) bajo condiciones de laboratorio. Folia Entomológica Mexicana 42 (1): 21-26. [ Links ]
RAMÍREZ-CRUZ, A.; LLANDERAL-CÁZARES, C.; RACOTTA, R. 2008. Ovariole structure of cochineal scale insect, Dactylopius coccus. Journal of Insect Science 8 (20): 1-5. [ Links ]
RAMÍREZ-CRUZ, A. 2012. Ultraestructura del germario de Dactylopius coccus Costa, 1829 (Hemiptera: Coccoidea: Dactylopiidae). Acta Zoológica Mexicana (n.s) 2 8(3): 586-593. [ Links ]
RAMÍREZ-CRUZ, A.; LLANDERAL-CÁZARES, C. 2013. Fecundidad potencial de Dactylopius coccus (Hemiptera: Dactylopiidae) bajo condiciones de invernadero. Revista Colombiana de Entomología 39 (1): 170-173. [ Links ]
SOCHA, R.; SULA, J.; KODRIK, D.; GELBIC, I. 1991. Hormonal control of vitellogenin synthesis in Pyrrhocoris apterus (L.) (Heteroptera). Journal of Insect Physiology 37 (11): 805-816. [ Links ]
STOKA, A. M.; SALOMON, O. D.; NORIEGA, F. G. 1987. Physiology of Triatominae's reproduction. pp. 109-129. In: Brener, R.; Stoka, A. M. (Eds.). Chagas´ disease vectors. Anatomic and physiological aspects. Vol II. CRC Press. Inc. Boca Raton. Florida. 136 p. [ Links ]
SZKLARZEWICZ, T. 1998. Structure of ovaries in scale insects. I. Pseudococcidae, Kermesidae, Eriococcidae and Cryptococcidae (Insecta, Hemiptera, Coccinea). International Journal of Insect Morphology and Embryology 27 (3): 167-172. [ Links ]
SZKLARZEWICZ, T.; KATARZYNA, K.; NIZNIK, S. 2005. Ultrastructural studies of the ovary of Palaeococcus fuscipennis (Burmeister) (Insecta, Hemiptera, Coccinea: Monophlebidae). Folia Biologica (Kraków)53 (1-2): 45-50. [ Links ]
VOGELGESANG, M.; SZKLARZEWICZ, T. 2001. Formation and structure of egg scale insects (Hemiptera, Coccinea) I. Ortheziidae. Arthropod Structure and Development 30: 63-68. [ Links ]
Recibido: 25-nov-2013
Aceptado: 10-ago-2014













