Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.40 no.2 Bogotá July/Dec. 2014
ARTÍCULOS DE INVESTIGACIÓN / RESEARCH PAPERS
Parasitoidismo de dos especies de mariposas en dos sistemas de producción de café
Parasitoidism of two butterflies in two coffee production systems
Sandra B. Muriel RI; Jhonatan Muñoz GII; Alejandra Restrepo DIII
IPh. D. Facultad de Ciencias Agrarias, Politécnico Colombiano Jaime Isaza Cadavid. Carrera 48 # 7- 151. Medellín, Colombia. sbmuriel@elpoli.edu.co. Autor para correspondencia
IIIngeniero Agropecuario. Programa de pós-graduação em agroecologia, Universidade Estadual do Maranhão, Cidade Universitária Paulo VI- São Luís/MA, Brasil. energiaselvatica@gmail.com
IIIEstudiante de Ingeniería Agropecuaria. Politécnico Colombiano Jaime Isaza Cadavid, Medellín, Colombia. arestrepod@gmail.com
RESUMEN
El parasitoidismo es una interacción importante en los paisajes agropecuarios debido a su potencial aplicación en el control biológico de insectos plagas, y cuya efectividad puede ser modificada por factores como la diversidad y estructura de las plantas. Este trabajo evaluó el parasitoidismo de dos especies de mariposas, Mechanitis menapis (Nymphalidae: Danainae: Ithomiini) y Eurema arbela (Pieridae: Coliadinae), en sistemas de producción de café con estructura contrastante. Para ello, se seleccionaron dos fincas de café: una en monocultivo y otra en arreglo agroforestal; se establecieron cuatro parches artificiales de recursos para las mariposas dentro de las parcelas de café, además se marcaron plantas hospederas de la vegetación natural y se denominaron parches naturales. Se cuantificaron estados inmaduros en parches artificiales y naturales en cuatro eventos de muestreo. Los estados inmaduros colectados se criaron en laboratorio. Se evaluó el efecto del tipo de parche y el sistema de producción sobre la abundancia de las mariposas y el parasitoidismo, y la densodependencia parasitoide-hospedero. Se encontraron más adultos de ambos lepidópteros en el sistema agroforestal, M. menapis presentó más estados inmaduros en el monocultivo, explicado por la menor actividad de depredadores y parasitoides en este sistema. E. arbela fue igualmente abundante en ambos sistemas pero tuvo mayor mortalidad en el monocultivo. Los parasitoides de ambas especies fueron positivamente afectados por la abundancia de larvas y el sistema agroforestal de café. Este sistema favoreció la abundancia de ambas mariposas silvestres y sus parasitoides. En paisajes cafeteros colombianos, donde la deforestación ha sido alta, el sistema agroforestal de café puede ser importante para la conservación de la biodiversidad funcional.
Palabras clave: Colonización; Parasitoides; Parches; Heterogeneidad espacial.
ABSTRACT
Parasitoidism is an important interaction in agricultural landscapes due to its potential application in the biological control of insect pests, and its effectiveness can be modified by factors such as structure and diversity of plants. This study evaluated the parasitism of two butterflies, Mechanitis menapis (Nymphalidae: Danainae: Ithomiini) y Eurema arbela (Pieridae: Coliadinae) in coffee production systems with contrasting structure. To do this, we selected two coffee farms: One in monoculture and another under agroforestry system. We established four artificial resource patches for butterflies within plots of coffee. In addition, were labeled other host plants present in the natural vegetation and they were called natural patches. Immature stages in artificial and natural patches were quantified in four sampling events. The collected individuals were reared in the laboratory. We evaluated the effect of patch type and production system on butterflies and parasitism, and parasitoid-host density dependence. We found more adults of both Lepidoptera in the agroforestry system. M. menapis presented more immature stages in the monoculture, explained by the lower activity of predators and parasitoids in this system. E. arbela was equally abundant in both systems, but it had higher mortality in the monoculture. The parasitoids of both species were positively affected by the abundance of larvae and coffee agroforestry system. This system favored the abundance of both wild butterflies and their parasitoids. In Colombian coffee landscapes, where deforestation has been high, the coffee agroforestry system may be important for functional biodiversity conservation.
Key words: Colonization; Parasitoids; Patch; Spatial heterogeneity.
Introducción
La intensificación de la agricultura incluye procesos de simplificación de los paisajes por la expansión de las tierras cultivadas, la remoción de hábitats naturales y el uso de grandes cantidades de insumos químicos, lo cual ha tenido efectos adversos sobre la biodiversidad (Krebs et al. 1999; Moguel y Toledo 1999; Armbrecht y Perfecto 2003; Mas y Dietsch 2003; Bianchi et al. 2006; Gagic et al. 2012). Como resultado de esta intensificación, los paisajes agropecuarios generalmente se caracterizan por ser altamente fragmentados, los hábitats naturales se encuentran mezclados con varios tipos de cultivos y pasturas, formando mosaicos complejos (Rengifo 2001; Ricketts et al. 2006). La proximidad, configuración, tamaño de los hábitats y la calidad de la matriz agropecuaria afectan las dinámicas poblacionales de las especies y la estructura de las comunidades de las que hacen parte (Rengifo 2001; Tscharntke et al. 2002; Bender y Fahrig 2005; Ricketts et al. 2006). En una revisión de estudios relacionados con el efecto de la composición del paisaje sobre la biodiversidad y el control de insectos herbívoros, Bianchi et al. (2006) mostraron que la simplificación del paisaje y la reducción de las áreas no cultivadas disminuyen el control natural de los herbívoros y el intercambio de enemigos naturales entre los cultivos y los hábitats no cultivados.
En los paisajes agropecuarios, la matriz está dominada por agroecosistemas. Los sistemas agroforestales pueden ser matrices de buena calidad para las especies silvestres que llegan allí, ya que tienen una complejidad estructural, composición y diversidad de plantas mayor que los monocultivos, y por ello, una diversidad y complejidad de nichos mayor (Stamps y Linit 1998), con lo cual podría esperarse que alberguen una mayor diversidad de especies, además de facilitar su dispersión. Estudios centrados en sistemas agroforestales de café (Coffea arabica L.) con alta diversidad de árboles como sombrío, mostraron que éstos hospedan una diversidad de fauna silvestre importante comparados con sistemas de café en monocultivo (Greenberg et al. 1997a, b; Calvo y Blake 1998; Estrada et al. 1998; Moguel y Toledo 1999; Gallego y Armbrecht 2005; Muriel et al. 2011). Por ejemplo, las aves migratorias de Norteamérica cruzan el continente en invierno para llegar al trópico y dependen de las fincas tradicionales de café con sombrío para su refugio y para la obtención de alimento, especialmente en regiones donde la deforestación ha sido intensa (Rice y Ward 1996; Perfecto et al. 2009).
Una de las interacciones que ha recibido atención en los paisajes agropecuarios es la del parasitoidismo, debido a su potencial aplicación en el control biológico de insectos plagas (Gardiner et al. 2009). A partir de ejercicios de modelación (Stiling 1987; Pacala y Hassell 1991; Ives 1992) y estudios de caso (Price 1988; Sieman et al. 1998; Elzinga et al. 2007), se ha evidenciado que la efectividad de los parasitoides depende, en cierta medida, de la diversidad y abundancia de los hospederos; pero existen otros factores que inciden en el éxito de los parasitoides, entre los cuales se destacan sus requerimientos internos y características de historia de vida (Lewis et al. 1998) como la habilidad de dispersión (Van Nouhuys y Hanski 2002; Elzinga et al. 2007) y su grado de especialización (Elzinga et al. 2007). Así mismo, factores de tipo espacial como la diversidad y estructura de las plantas del agroecosistema, el tamaño del parche de recursos de sus hospederos, pueden modificar su efectividad (Sheehan y Shelton 1989; Tenhumberg et al. 2001). Debe tenerse en cuenta que la diversidad de plantas incluye la presencia de arvenses en calles y bordes de las áreas cultivadas.
La heterogeneidad espacial interviene en la actividad de los parasitoides y el parasitoidismo (Bianchi et al. 2006). Sin embargo, los estudios que han evaluado el efecto del componente espacial, han tenido resultados en direcciones opuestas. Así, algunos han mostrado una relación directa entre la complejidad espacial, principalmente proporcionada por hábitats silvestres, y el parasitoidismo (Marino y Landis 1996; Thies et al. 2003; Gardiner et al. 2009). Otros trabajos han registrado resultados parcialmente inconsistentes con esta generalización, como Mellaned et al. (1999), quienes encontraron una relación directa entre complejidad del paisaje y diversidad de parasitoides y parasitoidismo, solo en una de tres regiones estudiadas; los autores propusieron como explicación que las regiones pudieron diferir en el "pool" inicial de especies o que los organismos responderían a escalas diferentes a las consideradas en el estudio. Otro trabajo determinó que la complejidad del paisaje se relacionó negativamente con los parasitoides y las tasas de parasitismo, pero estuvo relacionada positivamente con los hiperparasitoides (Gagic et al. 2011, 2012).
Los parasitoides adultos deben encontrar hospederos para su descendencia y a la vez alimento para satisfacer sus necesidades nutricionales a corto plazo (Lewis et al. 1998), por lo cual se esperaría que sean más eficientes en ambientes donde encuentren simultáneamente recursos para sí mismos y para su descendencia, ya que minimizarían el tiempo invertido en la búsqueda. El objetivo de este trabajo fue evaluar el parasitoidismo de dos especies de mariposas, Mechanitis menapis menapis (Hewitson, 1856) (Nymphalidae: Danainae: Ithomiini) y Eurema arbela gratiosa (E. Doubleday, 1847) (Pieridae: Coliadinae), en agroecosistemas de café con estructura contrastante. El efecto de los agroecosistemas puede ser diferencial sobre mariposas que presentan estrategias de vida diferentes y sobre sus parasitoides. En un estudio anterior en la misma región, Muriel et al. (2011) evaluaron el efecto de tres variables sobre la diversidad y abundancia de las mariposas Ithomiini: los sistemas de producción de café (café de monocultivo vs. café en sistema agroforestal), el área en bosque alrededor de las parcelas de café y la diversidad de plantas hospederas de las larvas; los autores encontraron que la mayor diversidad de plantas hospederas y la oferta de fuentes de néctar de las flores en el sistema agroforestal, determinan una mayor diversidad de mariposas de este grupo. M. menapis es una mariposa aposemática, perteneciente a la tribu Ithomiini, que ha desarrollado la habilidad de capturar los compuestos tóxicos de sus plantas hospederas, para usarlos como defensa contra sus enemigos naturales (Brown 1984). Posiblemente por este mecanismo de defensa, el parasitismo de las mariposas Ithomiini tiene baja representación en la literatura (Monteiro 1981; Shaw y Jones 2009), a pesar de ser un grupo ampliamente estudiado (Freitas 1993, 1996; Brown y Freitas 1994; Beccaloni 1997; Haber 2001; Joron y Lamas 2004; Willmott y Mallet 2004; Mallarino et al. 2005; Brower et al. 2006; entre otros). Esta especie es de vuelo lento y sus plantas hospederas en Colombia son Solanum atropurpureum Schrank, S. acerifolium Dunal y S. rudepannum Dunal (=S. torvum), S. hirtum Vahl (Constantino 1997; Beccaloni et al. 2008; Giraldo y Uribe 2010; Muriel et al. 2011). E. arbela es una especie no aposemática, de vuelo rápido, muy común en sitios abiertos y soleados, los registros de parasitoidismo de las especies de la familia Pieridae se concentran principalmente en las especies del género Pieris, de importancia económica (e.g. Ohsaki y Sato 1994; Vos et al. 1998; Coleman et al. 1999). Las plantas hospederas de E. arbela son del género Senna (Beccaloni et al. 2008), algunas de las cuales se siembran en el sistema agroforestal de café para otorgar sombra al cultivo (Giraldo et al. 2009), como son Senna spectabilis (DC.) H.S. Irwin y Barneby, S. occidentalis (L.) Link y S. septemtrionalis (Viv.) H.S. Irwin y Barneby. E. arbela gratiosa muestra preferencia por S. septemtrionalis (observaciones de campo de los autores).
Materiales y métodos
Área de estudio. El estudio se realizó entre agosto de 2009 y junio de 2010, en dos fincas productoras de café (Coffea arabica) del municipio de Fredonia (Antioquia-Colombia), a 62,3 Km. de distancia de Medellín (05°58'25,6" N 75°38'51,8"O). Las dos fincas fueron escogidas en un estudio previo realizado en diez fincas de café certificadas por UTZ, RAINFOREST y C4, y organizativamente agrupadas en el Grupo Cerro Bravo. En ese estudio se realizó un inventario de las plantas hospederas y se evaluó la disponibilidad de recursos para las mariposas Ithomiini y Coliadinae (Muriel et. al. 2011).
Las fincas seleccionadas representan dos ambientes contrastantes, resultantes de las actividades de producción: en una de ellas, ubicada a una altura de 1.300 a 1.450 msnm, se cultiva bajo el sistema de sombrío con especies forestales (27 ha), y presenta un bosque de 22 ha. Las especies que conforman el sombrío están distribuidas de forma irregular, y entre ellas se encuentran varias especies de cítricos (Citrus spp.), aguacate (Persea americana Mill), nogal cafetero Cordia alliodora (Ruiz & Pav.) (Oken), algunas de leguminosas como guamos (Inga spp.), Gliricidia sepium (Jacq.) Kunth ex Walp., y especies del género Senna. Este último tiene especies que son hospederas de E. arbela.
En la segunda finca, localizada entre 1.660 y 1.800 msnm, se cultiva el café en monocultivo (63 ha), presenta otros usos agropecuarios y pequeños fragmentos de bosque distribuidos entre el café, cuya área alcanza 9,2 ha. Las dos fincas tienen una producción de café altamente tecnificada, sembrados a una distancia de 1m, con manejo de plantas arvenses.
Establecimiento de parches en las parcelas de café. Se propagaron en bolsas de vivero las especies Solanum atropurpureum y S. acerifolium, ambas hospederas de M. menapis (Ithomiini), y Senna septentrionalis hospedera de E. arbela. Cuando las plantas tuvieron entre 50 y 100 cm de altura se llevaron a campo y se dispusieron al interior del cultivo de café, formando cuatro parches artificiales de seis plantas hospederas en cada finca, para cada una de las especies de Lepidoptera (Fig. 1). S. atropurpureum y S. acerifolium se sembraron en igual proporción en todos los parches, por si la mariposa mostraba preferencia por alguna de las dos especies. Entre la vegetación natural presente en cada finca, se marcaron otras plantas hospederas aisladas presentes en las fincas, que podrían incidir en los resultados del estudio, por lo cual se trataron como parches naturales (Fig. 1). Estos parches fueron conformados por una especie (Senna occidentalis) para E. arbela (un individuo en cada finca) y tres especies (Solanum ovalifolium, S. atropurpureum y S. acerifolium) para M. menapis (cuatro individuos en la finca con sombrío y tres individuos en la finca a libre exposición). En los parches se colectaron estados inmaduros y se comparó el parasitoidismo con los parches artificiales establecidos entre el café.
Colonización de las mariposas. Para conocer la abundancia de los adultos, se realizaron diez muestreos durante un periodo de diez meses, con una intensidad de muestreo total de 40 horas por finca. El jameo se hizo patrullando por los caminos establecidos entre los lotes de café, entre las 9 am y las 4 pm. Se cuantificó el número de mariposas avistadas en vuelo en las dos fincas. Para evaluar la colonización de los parches artificiales y naturales, estos fueron revisados cada 45 días (cuatro eventos de colecta), y se cuantificaron todos los individuos inmaduros de M. menapis y E. arbela observados en las plantas (huevos y larvas en diferentes estadíos), y pupas de parasitoides que se aprendieron a reconocer de colectas previas realizadas por los autores. Los estados inmaduros fueron transportados al laboratorio del mariposario del Parque Zoológico Santa Fe de Medellín, en bolsas plásticas, debidamente rotuladas y con suficiente alimento, para su cría hasta la emergencia de las mariposas adultas o de sus parasitoides. La cría de los estados inmaduros se hizo en cajas plásticas, en cuyo fondo se dispuso una toalla de papel humedecida, las cajas se cubrieron con una tela porosa. Cada día por medio se aseaba la caja, se humedecía y cambiaba el alimento.
Parasitoidismo. Los parasitoides se conservaron en etanol al 70% para su identificación, los parasitoides de M. menapis se registran en Muñoz et al. (2011), se identificaron seis parasitoides, tres de la familia Tachinidae (Diptera), y tres Hymenoptera (Familias Scelionidae, Chalcididae e Ichneumonidae). Sobre E. arbela se encontraron tres especies de parasitoides de la familia Braconidae (Hymenoptera), que están en proceso de identificación. El porcentaje de parasitoidismo fue calculado dividiendo el número de huevos y larvas parasitadas/total de individuos colectados, excluyendo el número de larvas que murieron ya que no se podría detectar la existencia o no de parasitoides (Monteiro 1981). De cada parasitoide se registró el estado del hospedero que parasita, el número de individuos que emergieron/hospedero y la planta de la cual se colectó el hospedero. Además en las mismas plantas se hizo un registro de posibles depredadores de los estados inmaduros de las mariposas estudiadas.
Análisis de los datos. Las variables independientes (sistema de producción y tipo de parche) y las variables respuesta (abundancia de mariposas adultas, abundancia de estados inmaduros, y porcentaje de parasitoidismo) fueron analizadas a través de tablas de contingencia. Inicialmente se discriminó evaluando el efecto de las unidades espaciales tipo de parche (natural, artificial) y sistema de producción (monocultivo, agroforestal), sobre las mariposas y los parasitoides; posteriormente se hizo otro análisis discriminando por tiempo, en combinación con los factores anteriores. A través de un análisis de componentes principales categóricos se evaluó el efecto de relaciones conjuntas. Finalmente, se determinó la denso-dependencia del sistema hospedero-parasitoide con un análisis de regresión de Poisson, para lo cual se evaluaron varios modelos a través de pruebas de razón de verosimilitud, y considerando los mismos factores; en los modelos de Poisson se debió eliminar la variable parche, quedando finalmente sistema de producción y la covariable abundancia de mariposas. Para todos los análisis se usó el paquete IBM SPSS Statistics 21.
Resultados
En las dos fincas de café se registraron 229 adultos de M. menapis y 70 de E. arbela. Además se colectaron 165 individuos de M. menapis y 113 de E. arbela, en estadios de huevo, larva y pupa, en parches artificiales y naturales. Los adultos de ambas especies fueron observados en vuelo, en mayor proporción en el sistema agroforestal que en el sistema de monocultivo de café: M. menapis, a razón de 9:1, y E. arbela a razón de 2,5:1. Las dos mariposas colonizaron los parches artificiales establecidos en los agroecosistemas. En el sistema agroforestal se encontró una mayor diversidad y actividad de depredadores, entre los cuales se reconocieron avispas Polistes sp., chinches Pentatomidae transportando larvas, Mantodea y varias especies de Aracnidae. En el sistema de monocultivo predominaron varias especies de Aracnidae.
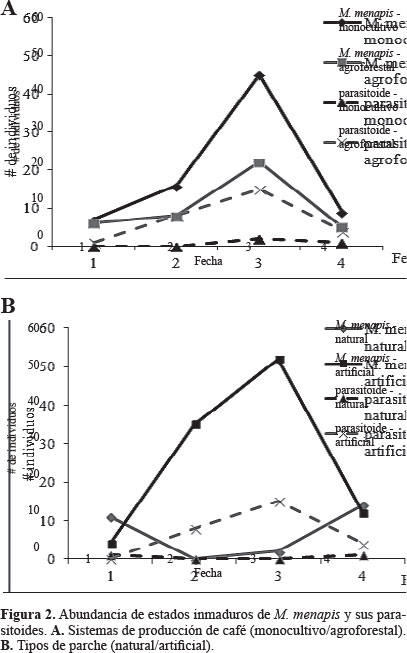
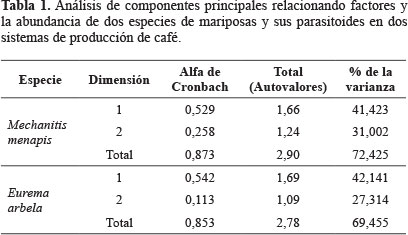
Mechanitis menapis y su parasitoidismo. El parasitoidismo de M. menapis fue de 18,8%. La abundancia de los estados inmaduros de la mariposa y de los parasitoides fue similar en parches naturales y parches artificiales (P = 0,70). En contraste, la abundancia de larvas y huevos de M. menapis y de sus parasitoides difirió en ambos sistemas de producción de café (P = 0,00) (Fig. 2), especialmente en los eventos de muestreo 2 y 3; M. menapis fue más abundante en el café de monocultivo, y los parasitoides fueron más abundantes en el sistema agroforestal. El resultado anterior se confirmó con el análisis de componentes principales, el cual explicó un 72,42% de la varianza en dos dimensiones (Tabla 1), este análisis mostró que los parasitoides se asociaron al sistema agroforestal y la mariposa (larvas y huevos) al sistema monocultivo.
En el análisis de denso-dependencia de parasitoidismo, el modelo de Poisson ajustado que presentó el mejor comportamiento fue: # de individuos parasitados = exp (-2,102 + 0,063*#mariposas +3,090* Sistema=1);
El análisis de regresión de Poisson mostró que, tanto la abundancia de estados inmaduros de la mariposa, como el sistema de producción de café explicaron el parasitoidismo sobre M. menapis (Tabla 2), es decir que aunque se detectó densodependencia del parasitoide con relación a la abundancia de la mariposa, la variable sistema de producción también influyó en el parasitoidismo.
Eurema arbela y su parasitoidismo. El parasitoidismo de E. arbela fue de 15%. La abundancia de los estados inmaduros de la mariposa fue similar en ambos sistemas de producción de café (P = 0,16). Sin embargo, es importante resaltar que solo se encontraron en dos eventos de colectas (2 y 3) en el monocultivo de café, mientras que en el sistema agroforestal siempre se encontraron, lo cual puede representar condiciones adversas para la especie en el primer sistema (Fig. 3). La abundancia de los estados inmaduros difirió entre parches (P = 0,02), siendo más abundantes en los parches artificiales, mientras que los parasitoides fueron más abundantes en los parches de vegetación naturales (Fig. 3). En el sistema de monocultivo no se presentaron parasitoides en ninguna de las colectas, mientras que en el sistema agroforestal se presentaron en todos los muestreos. El análisis de componentes principales explicó un 69,45% de la varianza en dos dimensiones, confirmando una mayor abundancia de mariposas del sistema agroforestal y una mayor mortalidad de la misma asociada al sistema de monocultivo (Tabla 1 y Fig. 3).
Las tres especies de parasitoides encontrados en E. arbela, se registraron en el sistema agroforestal de café y en los parches naturales, mostrando que los parasitoides son más frecuentes en sistemas con mayor vegetación natural y más conservados.
En el análisis de densodependencia de parasitoidismo, el modelo de Poisson ajustado que presentó el mejor comportamiento fue: # de individuos parasitados = exp (-16,355 + 0,037*#mariposas + 16,57 Sistema=1);
El análisis de regresión de Poisson mostró que si bien se presentó denso-dependencia en el parasitoidismo sobre E. arbela, el sistema de producción también incidió en el parasitoidismo (Tabla 2).
Discusión
Este trabajo aporta más elementos que soportan la generalidad de un aumento de la diversidad y abundancia de insectos en policultivos, como los sistemas agroforestales de café, en comparación con los monocultivos (Stamp y Linit 1998). Aunque las dos especies de Lepidoptera con las que se realizó este estudio fueron más abundantes en el sistema agroforestal de café, lo cual se evidenció en la observación directa de los adultos y en el caso de E. arbela también de los estados inmaduros, sus enemigos naturales también fueron más activos en ese sistema. Esto posiblemente se debe a que en el sistema agroforestal la diversidad de vegetación, la complejidad espacial y la disponibilidad de recursos son mayores para las mariposas adultas y para los parasitoides.
M. menapis es una especie relativamente común en Antioquia - Colombia (Giraldo et al. 2013) y usa varias plantas de Solanaceae como hospederas, las cuales son comunes en bordes de parches de vegetación natural, o aisladas en potreros abandonados, caminos, etc. A pesar de que es común, es evidente su sensibilidad a las condiciones asociadas a los dos sistemas de café. En este estudio, los adultos de M. menapis fueron más abundantes en el sistema agroforestal, pero en el de monocultivo se encontraron más larvas y huevos, lo cual podría explicarse por la distribución de las plantas hospederas de las larvas y el efecto del mismo sistema sobre parasitoides y otros depredadores, ya que mientras en el sistema agroforestal se observó gran actividad de estos, en el monocultivo fueron menos abundantes y activos. La tribu Ithomiini, presenta muchas especies afines con sitios sombreados (en especial aquellas denominadas "alas de cristal"), pero también otras que toleran un espectro amplio de condiciones ambientales (aquellas con patrones de bandas de color amarillo, naranja y negro, denominadas "tigres"), (Burd 1994; Beccaloni 1997), que son frecuentes también en sitios abiertos, como M. menapis. Además, las plantas hospederas de las larvas de esta especie son comunes en sitios soleados, lo anterior, unido a una menor actividad de enemigos naturales en el sistema de monocultivo, explicaría su presencia mayor en este sistema.
E. arbela también es una especie común en la región, y algunas de sus plantas hospederas son incluidas en las fincas de café como sombrío. Los adultos de E. arbela fueron más abundantes en este sistema, ya que allí encuentran recursos para los adultos y para su descendencia. Sin embargo, los huevos y larvas fueron igualmente abundantes en ambos sistemas, aunque debe considerarse que en el monocultivo hubo dos eventos de colectas en las cuales no se encontró ningún individuo en los parches y la mortalidad allí fue mayor que en el sistema agroforestal. A pesar de una menor actividad de depredadores y a la ausencia de parasitoides en el monocultivo, la mortalidad mayor podría explicarse por condiciones microclimáticas más adversas que afectaron la sobrevivencia de E. arbela, ya que en el café de sol, se presentan temperaturas máximas y mínimas más extremas, a diferencia del sistema agroforestal cuyas condiciones microclimáticas son más similares a los parches de vegetación natural (Muriel y Kattan 2009).
Los parasitoides de ambas especies de Lepidoptera respondieron de forma similar en los dos sistemas de producción, siendo positivamente afectados por la abundancia de los hospederos de las larvas y por el sistema agroforestal de café, en el caso de E. arbela no se registró parasitoidismo en el monocultivo. Los enemigos naturales tienen una mayor efectividad en policultivos (Risch et al. 1983), esto se debe a que hay una provisión de recursos de polen y néctar mayor para ellos, y de ese modo, favorece una mayor supresión de insectos herbívoros (Root 1973). Los depredadores y parasitoides son más sensibles a la diversidad de plantas en relación con sus presas herbívoras (Haddad et al. 2009), algunas familias de Hymenoptera, como bracónidos (Campos y Sharkey 2006) o ichneumónidos, se han relacionado como indicadoras de estabilidad de ecosistemas que están estrechamente relacionados con los bosques sombreados y áreas con una humedad relativamente alta (Palacio y Wahl 2006; Schmidt y Schmidt 2011), condiciones más afines con el sistema agroforestal de café (Muriel y Kattan 2009).
Si bien se determinó denso-dependencia en los dos sistemas M. menapis-parasitoides y E. arbela-parasitoides, el sistema de producción de café fue un factor que intervino de forma simultánea para modificar este efecto, en ambos casos.
El sistema agroforestal presentó el área en bosque de tamaño mayor que la de monocultivo, lo cual debió sumarse al efecto del cultivo mismo sobre los organismos estudiados, debido a que el sistema completo podría representar mayores recursos disponibles para mariposas y parasitoides. A nivel de paisaje la distribución espacial de los hábitats, puede afectar en diferentes grados a herbívoros y parasitoides, en una extensión que va más allá de los márgenes de cultivo (Cronin y Reeve 2005). Los fragmentos de bosques pueden desempeñar un papel importante en el mantenimiento de la biodiversidad en paisajes agropecuarios, su distribución adecuada ayuda a aumentar la complejidad del paisaje, para mejorar la diversidad de enemigos naturales en áreas de cultivos (Fraser et al. 2007), también ellos pueden mitigar el riesgo de su extinción en paisajes empobrecidos cuando la disponibilidad del hábitat en un paisaje es baja (Tscharntke et al. 2002). Por ello, en paisajes cafeteros colombianos, donde la deforestación ha sido alta, la diversidad en el sistema agroforestal de café, unida a la de vegetación natural, pueden ser muy importantes para sostener una alta biodiversidad funcional, lo que favorece a los mismos sistemas de producción.
Agradecimientos
El Politécnico Colombiano Jaime Isaza Cadavid, El Tecnológico de Antioquia - institución universitaria, International Foundation for Science, dieron el apoyo económico para realizar esta investigación. Los propietarios de las fincas Santa Isabel y Mango Chiquito nos permitieron hacer los muestreos en sus fincas, estamos muy agradecidos con los administradores y trabajadores que nos acogieron amablemente. La Sociedad de Mejoras Públicas - Parque Zoológico Santa Fe permitió realizar algunas crías de mariposas en su mariposario y Corantioquia facilitó los mapas digitalizados de la zona de estudio. Diferentes amigos y estudiantes participaron del trabajo, entre ellos Guiomar A. Rodríguez, Jorge Andrés Betancur, Wesley Balvin, Diana Urueña, Yeison Vásquez, Jhonatan López, Silvia Orozco y Carlos E. Úsuga. María Cristina Gallego de la Universidad del Cauca hizo una revisión preliminar de este trabajo.
Literatura citada
ARMBRECHT, I.; PERFECTO, I. 2003. Litter ant's diversity and predation potential in two Mexican coffee matrices and forest fragments. Agriculture, Ecosystems and Environment 97 (1-3): 107-115. [ Links ]
BECCALONI, G. W. 1997. Vertical stratification of Ithomiinae butterfly (Nymphalidae, Ithomiinae) mimicry complexes: the relationship between adult height flight and larval host-plant height. Biological Journal of the Linnean Society 62 (3): 313-341. [ Links ]
BECCALONI, G.; VILORIA, A.; HALL S.; ROBINSON, G. 2008. Catálogo de las plantas huésped de las mariposas neotropicales. Tercer Milenio. Zaragoza, España. 536 p. [ Links ]
BENDER, D.; FAHRIG, L. 2005. Matrix structure obscures the relationship between interpatch movement and patch size and isolation. Ecological Society of America 86 (4): 1023-1033. [ Links ]
BIANCHI, F. J.; BOOIJ, C. J.; TSCHARNTKE, T. 2006. Sustainable pest regulation in agricultural landscapes: A review on landscape composition, biodiversity and natural pest control. Proceedings: Biological Sciences 273 (1595): 1715-1727. [ Links ]
BROWN, J. R K. 1984. Adult - obtained pyrrolizidine alkaloids defend Ithomiine butterflies against a spider predator. Nature 309 (5970): 707-709. [ Links ]
BROWN, J. R. K.; FREITAS, A.V. 1994. Juvenil stages of Ithomiinae: Overview and systematics (Lepidoptera: Nymphalidae). Tropical Lepidoptera 5 (1): 9-20. [ Links ]
BROWER, A. V.; FREITAS, A. V.; LEE, M.; SILVA-BRANDÃO, K.; WHINNETT, A.; WILLMOTT, K. R. 2006. Phylogenetic relationships among the Ithomiinae (Lepidoptera: Nymphalidae) inferred from one mitochondrial and two nuclear gene regions. Systematic Entomology 31 (2): 288-301. [ Links ]
BURD, M. 1994. Butterfly wing colour patterns and flying heights in the seasonally wet forest of Barro Colorado Island, Panamá. Journal of Tropical Ecology 10: 601-610. [ Links ]
CALVO, L.; BLAKE, J. 1998. Bird diversity and abundance on two different shade coffee plantations in Guatemala. Bird Conservation International 8 (3): 297-308. [ Links ]
CAMPOS, D.; SHARKEY, M. J. 2006. Familia Braconidae. pp. 331-3384. En: Fernández, F.; Sharkey, M. J. (Eds.). Introducción a los Hymenoptera de la region Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia. Bogotá, D.C. 894 p. [ Links ]
COLEMAN, R.; BARKER, A.; FENNER, M. 1999. Parasitism of the herbivore Pieris brassicae L. (Lep., Pieridae) by Cotesia glomerata L. (Hym., Braconidae) does not benefit the host plant by reduction of herbivory. Journal of Applied Entomology 123 (3): 171-177. [ Links ]
CONSTANTINO, L. M. 1997. Conocimiento de los ciclos de vida y plantas hospederas de lepidópteros diurnos de Colombia como estrategia para el manejo, uso y conservación de poblaciones silvestres. Seminario Aconteceres Entomológicos. Octubre 30 y 31 (Medellín- Colombia): 57-81. [ Links ]
CRONIN, J; REEVE, J. 2005. Host-parasitoid spatial ecology: a plea for a landscape-level synthesis. Proceedings of the Royal Society 272 (1578): 2225-2235. [ Links ]
ELZINGA, J. A.; VAN NOUHUYS, S.; VAN LEEUWEN, D.; BIERE, A. 2007. Distribution and colonisation ability of three parasitoids and their herbivorous host in a fragmented landscape. Basic and Applied Ecology 8 (1): 75-88. [ Links ]
ESTRADA, A.; COATES-ESTRADA, R.; ANZURES, A.; CAMMARANO, P. 1998. Dung and carrion beetles in tropical rain forest fragments and agricultural habitats at Los Tuxlas, Mexico. Journal of Tropical Ecology 14 (5): 577-593. [ Links ]
FRASER, S.; DYTHAM, C.; MAYHEW, P. 2007. Determinants of parasitoid abundance and diversity in woodland habitats. Journal of Applied Ecology 44 (2): 352-361. [ Links ]
FREITAS, A.V. 1993. Biology and population dynamics of Placidula euryanassa, a relict Ithomiinae butterfly (Nymphalidae: Ithomiinae). Journal of Lepidoptera Society 47 (2): 87-105. [ Links ]
FREITAS, A.V. 1996. Population biology of Heterosais odessa (Nymphalidae) and this associated Atlantic Forest Ithomiinae community. Journal of Lepidoptera Society 50: 273-289. [ Links ]
GAGIC, V.; TSCHARNTKE, T.; DORMANN, C.; GRUBER, B.; WILSTERMANN, A.; THIES, C. 2011. Food web structure and biocontrol in a four-trophic level system across a landscape complexity gradient. Proceedings Royal Society B 278 (1720): 2946-2953. [ Links ]
GAGIC, V.; HANKE, S.; THIES, C. 2012. Agricultural intensification and cereal aphid-parasitoid-hyperparasitoid food webs: network complexity, temporal variability and parasitism rates. Oecologia 170 (4): 1099-1109. [ Links ]
GALLEGO, M. C.; ARMBRECHT, I. 2005. Depredación por hormigas sobre la broca del café Hypothenemus hampei (Curculionidae: Scolytinae) en cafetales cultivados bajo dos niveles de sombra en Colombia. Manejo de Plagas y Agroecología (Costa Rica) 76: 32-40. [ Links ]
GARDINER, M. M.; LANDIS, D.; GRATTON, C.; DIFONZO, C.; O'NEAL, M.; CHACON, J. M.; WAYO, M.; SCHMIDT, N.; MUELLER, E.; HEIMPEI, G. 2009. Landscape diversity enhances biological control of an introduced crop pest in the North-Central USA. Ecological Applications 19 (1): 143-154. [ Links ]
GIRALDO, P.; LAINA, A.; LOPEZ, J. H.; AGUIRRE, J. F.; TORO, Y. 2009. Café una alternativa para la conservación. Wildlife Conservation Society, WWF, RESNATUR y la Federación Nacional de Cafeteros de Colombia. 64 p. [ Links ]
GIRALDO, C. E; URIBE, S. 2010. Immature stages and host plant of Mechanitis menapis menapis (Hewitson, 1856) (Lepidoptera: Ithomiinae) in Colombia. Revista Colombiana de Entomología 36 (1): 169-171. [ Links ]
GIRALDO, C. E; WILLMOTT, K. R.; VILA, R.; URIBE, S. I. 2013. Ithomiini butterflies (Lepidoptera: Nymphalidae) of Antioquia, Colombia. Neotropical Entomology 42 (2): 146-157. [ Links ]
GREENBERG, R.; BICHIER, P.; CRUZ-ANGÓN, A.; REITSMA, A. 1997a. Bird populations in shade and sun coffee plantations in central Guatemala. Conservation Biology 11 (2): 448-459. [ Links ]
HABER, W. 2001. Mariposas de Costa Rica. Web site. Disponible en: http://www.cs.umb.edu/~whaber/Monte/Ithomid/Ithomid-fram.html (Fecha revisión: 4 marzo 2011). [ Links ]
HADDAD, N. M.; CRUTSINGER, G. M.; GROSS, K.; HAARSTAD, J.; KNOPS, J. M.; TILMAN, D. 2009. Plant species loss decreases arthropod diversity and shifts trophic structure. Ecology Letters, 12 (10): 1029-1039. [ Links ]
IVES, A. 1992. Density-dependent and density-independet parasitoid aggregation in model host-parasitoid systems. The American Naturalist 140 (6): 912-937. [ Links ]
JORON, M.; LAMAS, G. 2004. Ithomiinae of San Martín Perú. Web site. Disponible en: http//:www.zeldia.cap.ed.ac.uk (Fecha revisión: 24 enero 2011). [ Links ]
KREBS, J.; WILSON, J.; BRADBURY, R.; SIRIWARDENA, G. 1999. The second silent spring?. Nature 400: 611-612. [ Links ]
LEWIS, W. J.; STAPEL, J.; CORTESERO, A. M.; TAKASU, K. 1998. Understanding how parasitoids balance food and host needs: Importance to biological control. Biological Control 11 (2): 175-183. [ Links ]
MALLARINO, R.; BERMINGHAM, E.; WILLMOTT, K. R.; WHINNETT, A.; JIGGINS, C. D. 2005. Molecular systematics of the butterfly genus Ithomia (Lepidoptera: Ithomiinae): A composite phylogenetic hypothesis based on seven genes. Molecular Phylogenetics and Evolution 34 (3): 625-644. [ Links ]
MARINO, P.; LANDIS, D. 1996. Effect of landscape structure on parasitoid diversity and parasitism in agroecosystems. Ecological Applications 6 (1): 276-284. [ Links ]
MAS, A.; DIETSCH, T. 2003. An index of management intensity for coffee agroecosystems to evaluate butterfly species richness. Ecological Applications 13 (5): 1491-1501. [ Links ]
MELLANED, F.; MARINO, P. C.; GAGE, S. H.; LANDIS, D. A. 1999. Does agricultural landscape structure affect parasitism and parasitoid diversity?. Ecological Applications 9 (2): 634-641. [ Links ]
MOGUEL, P.; TOLEDO, V. M. 2001. Biodiversity conservation in traditional coffee systems of Mexico. Conservation Biology 13 (1): 11-21. [ Links ]
MONTEIRO, R. F. 1981. Regulação populacional em Ithomiinae (Lep. Nymphalidae): ecologia da interagfio parasitdide x hospedeiro. Master Thesis, Universidade Estadual de Campinas, SP. Brasil. 98 p. [ Links ]
MUÑOZ, J.; RESTREPO, A.; MURIEL, S. 2011. Nuevos registros de parasitoides de cuatro especies de Ithomiini (Lepidoptera: Nymphalidae: Danainae), asociados a plantas hospederas de Solanum (Solanaceae) en fincas cafeteras de Antioquia - Colombia. Boletín del Museo de Entomología de la Universidad del Valle 14 (1): 70-74. [ Links ]
MURIEL, S. B.; KATTAN, G. 2009. Effects of patch size and type of coffee matrix on Ithomiine butterfly diversity and dispersal in cloud forest fragments. Conservation Biology 23 (4): 948-956. [ Links ]
MURIEL, S. B.; MONTOYA, J.; RESTREPO, A.; MUÑOZ, J. 2011. Nuevos registros de plantas hospederas y disponibilidad de recursos para mariposas Ithomiini (Lepidoptera: Nymphalidae: Danainae), en agroecosistemas de café colombianos. Revista Actualidades Biológicas 33 (95): 275-285. [ Links ]
OHSAKI, N.; SATO Y. 1994. Food plant choice of Pieris butterflies as a trade-off between parasitoid avoidance and quality of plants. Ecology 75 (1): 59-68. [ Links ]
PACALA S. W; HASSELL M. P. 1991. The persistence of host-parasitoid associations in patchy environments. II. Evaluation of field data. American Naturalist 138 (3): 584-605. [ Links ]
PALACIO, E. E.; WAHL, D. B. 2006. Familia Ichneumonidae. pp. 293-329. En: Fernández, F.; Sharkey, M. J. (Eds.). Introducción a los Hymenoptera de la region Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia. Bogotá, D.C. 894 p. [ Links ]
PERFECTO, I.; VANDERMEER, J.; WRIGHT, A. 2009. Natures matrix, linking agriculture, conservation and food sovereignty. Earthscan Editor. Londres. 257 p. [ Links ]
PRICE, P. W. 1988. Inversely density-dependent parasitism: the role of plant refuges for hosts. Journal Animal Ecology 57: 89-96. [ Links ]
RENGIFO, L. M. 2001. Effect of natural and anthropogenic landscape matrices on the abundance of subandean bird species. Ecological Applications 11 (1): 14-31. [ Links ]
RICE, R.; WARD, J. R. 1996. Coffee, conservation, and commerce in the Western Hemisphere. Natural Resources Defense Council - Smithsonian Migratory Bird Center. Web site. Disponible en: http://nationalzoo.si.edu/scbi/migratorybirds/coffee/whitepaper.pdf. (Fecha revision: 03 septiembre 2011). [ Links ]
RICKETTS, T.; WILLIAMS, N. M.; MAYFIELD, M. M. 2006. Connectivity and ecosystem services: crop pollination in agricultural landscapes. pp. 255-289. En: Crooks, K. R.; Sanjayan, M. (Eds.). Connectivity conservation. Cambridge University Press. 712 p. [ Links ]
RISCH, S. J.; ANDOW, D.; ALTIERI, M. A. 1983. Agroecosystem diversity and pest control: data, tentative conclusions, and new research directions. Environmental Entomology 12 (3): 625-629. [ Links ]
ROOT, R. B. 1973. Organization of a plant-arthropod association in simple and diverse habitats: the fauna of collards (Brassica oleracea). Ecological Monographs 43 (1): 95-124. [ Links ]
SCHMIDT, O.; SCHMIDT, S. 2011. Primary types of Ichneumoninae described by Gerd H. Heinrich deposited in the Zoologische Staatssammlung München (Hymenoptera, Ichneumonidae). Spixiana 34 (1): 59-107. [ Links ]
SHAW, S. R.; JONES, G. Z. 2009. A new species of solitary Meteorus (Hymenoptera: Braconidae) reared from caterpillars of toxic butterflies (Lepidoptera: Nymphalidae) in Ecuador. Journal of Insect Science 9 (34): 1-8. [ Links ]
SHEEHAN, W.; SHELTON, A. M. 1989. Parasitoid response to concentration of herbivore food plants: finding and leaving plants. Ecology 70 (4): 99-998. [ Links ]
SIEMAN, E.; TILMAN, D.; HAARSTAD, J.; RITCHIE, M. 1998. Experimental tests of the dependence of arthropod diversity on plant piversity. The American Naturalist 152 (5): 738-750. [ Links ]
STAMPS, W. T.; LINIT, M. J. 1998. Plant diversity and arthropod communities: Implications for temperate agroforestry. Agroforestry Systems 39 (1): 73-89. [ Links ]
STILING, P. D. 1987. The frequency of density dependence in insect host-parasitoid systems. Ecology 68 (4): 844- 856. [ Links ]
TENHUMBERG, B.: KELLER, M.; TYRE, A.; POSSINGHAM, H. 2001. The effect of resource aggregation at different scales: optimal foraging behavior of Cotesia rubecula. The American Naturalist 158 (5): 505-518. [ Links ]
THIES, C.; STEFFAN-DEWENTER, I.; TSCHARNTKE, T. 2003. Effects of landscape context on herbivory and parasitism at different spatial scales. Oikos 101 (1): 18-25. [ Links ]
TSCHARNTKE, T.; STEFFAN-DEWENTER, I.; KRUESS, A.; THIES, C. 2002. Contribution of small habitat fragments to conservation of insect communities of grassland-cropland landscapes. Ecological Applications 12 (2): 354-363. [ Links ]
VAN NOUHUYS, S; HANSKI, I. 2002. Colonization rates and distances of a host butterfly and two specific parasitoids in a fragmented landscape. Journal of Animal Ecology 71 (4): 639-650. [ Links ]
VOS, M.; HEMERIK, L.; VET, L. 1998. Patch exploitation by the parasitoids Cotesia rubecula and Cotesia glomerata in multi-patch environments with different host distributions. Journal of Animal Ecology 67 (5): 774-783. [ Links ]
WILLMOTT, K. R.; MALLET, J. 2004. Correlations between adult mimicry and larval host plants in Ithomiine butterflies. Proceedings of the Royal Society London B 271 (suppl. 5): S266-S269. [ Links ]
Recibido: 27-may-2013
Aceptado: 3-nov-2014













