Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.40 no.2 Bogotá July/Dec. 2014
ARTÍCULOS DE INVESTIGACIÓN / RESEARCH PAPERS
Comportamiento reproductivo del picudo de la caña, Sphenophorus levis (Coleoptera: Curculionidae) en laboratorio
Reproductive behavior of the sugarcane weevil, Sphenophorus levis (Coleoptera: Curculionidae) in laboratory
Nancy Barreto-trianaI; Carlos Tadeu dos Santos DiasII; Jose Mauricio S. BentoIII
IPh. D. Investigadora Grupo Manejo Fitosanitario. Corporación Colombiana de Investigación Agropecuaria CORPOICA. C.I. Tibaitatá, Km.14 vía Mosquera. Colombia. nbarreto@corpoica.org.co. Autor para correspondencia
IIPh. D. Professor Departamento de Ciências Exatas, ESALQ/USP, Av. Pádua Dias, 11, Caixa Postal 9, CEP 13418-900, Piracicaba, São Paulo, Brasil. ctsdias@usp.br
IIIPh. D. Professor Departamento de Entomologia e Acarologia, ESALQ/USP, Av. Pádua Dias, 11, Caixa Postal 9, CEP 13418-900, Piracicaba, São Paulo, Brasil; jmsbento@usp.br
RESUMEN
Con el objetivo de estudiar el comportamiento reproductivo del picudo de la caña de azúcar Sphenophorus levis se realizaron ensayos para determinar edad, horario y duración de cópula, periodo de pre-oviposición, fecundidad y fertilidad en adultos de diferentes edades. Se determinó que las parejas con edad entre 14 a 35 días presentaron las mayores frecuencias de cópula con 76 a 88%, respectivamente, las cuales ocurren en cualquier hora del día y pueden ser múltiples. La duración media de la primera cópula fue de 5,75 ± 4,22 h, y el tiempo total de ella osciló entre 1 a 17 h. El período de pre-oviposición en hembras de 14 a 35 días de edad fue de 5,52 ± 4,53 a 10,90 ± 5,37 días, con menor duración a mayor edad. El número de huevos/hembra fue de 0,25 a 7,80, con viabilidad entre 33 y 63%. Las hembras de S. levis con 85 y 210 días de edad fueron receptivas a los machos (66%), ovipositaron en media 4,50 a 7,09 huevos, con viabilidad entre 49 y 79%. Se concluye que los adultos de S. levis con edad entre 21 a 35 días son más receptivos para la cópula y reproducción. Esta información es importante para entender la biología y hacer un manejo de poblaciones de S. levis en campo.
Palabras clave: Cópula; Oviposición; Reproducción.
ABSTRACT
This study aimed to determine the reproductive behavior of the sugarcane weevil Sphenophorus levis. For this insect, the mating occurs at any hour of the day and multiple mating can occur. Fourteen to thirty five days-old couples showed the highest mating frequencies 76 and 88%, respectively. The mean duration of the first mating was 5.75 ± 4.22 h, and the total mating time fluctuated between 1 to 17 h. The pre-oviposition period of 14 to 35 days-old females ranged from 5.52 ± 4.53 to 10.90 ± 5.37 days. The number of eggs per female was 0.25 to 7.80 with viability between 33 and 63%. S. levis 85 and 210 days-old females were receptive to the males (66%), oviposited on average 4.50 to 1.09 eggs, with viability between 49 and 79%. This behavioral study concluded that S. levis 21 to 35 days-old adults presented better receptivity to mating and reproduction. The current work provides important information for the understanding of S. levis biology and population management in the field.
Key words: Courtship; Oviposition; Reproduction.
Introducción
En Brasil, el picudo, Sphenophorus levis Vaurie, 1978 (Coleoptera: Curculionidae) es considerado plaga primaria de la caña de azúcar, por el daño que ocasionan sus larvas al destruir la parte subterránea de la base de la planta y los tallos. En las áreas infestadas las pérdidas pueden alcanzar anualmente entre 20 a 30 toneladas de caña por hectárea (Degaspari et al. 1987). En condiciones de laboratorio (27 a 30 ºC y fotofase de 12 horas), su ciclo de vida varía entre 58 y 307 días, con 173,2 días en promedio. Las hembras pueden durar hasta 249 días y los machos 247 (Degaspari et al. 1987). Su distribución está restringida a América del Sur con presencia en Argentina, Paraguay y Brasil. En este último país se registró en 1977 y fue descrita como especie nueva en 1978 (Vaurie 1978). Se encuentra distribuida en los estados de Paraná, Santa Catarina, Minas Gerais, São Paulo y Mato Grosso do Sul (Arrigoni 2008; Pinto et al. 2009; Moraes y Ávila 2013). Para su control, según Almeida y Estingel (2005), se aplican insecticidas o trampas tóxicas (pedazos de caña + insecticida) colocadas en la base de la planta que a su vez sirven para el monitoreo de la plaga, pero presentan desventajas por el elevado costo de mano de obra y la necesidad de hacer reaplicaciones constantes. Se han evaluado varias alternativas promisorias como el control biológico con Beauveria bassiana, Metharizium anisopliae, Bacillus thuringiensis (Badilla y Alves 1991; Polanczyk et al. 2004), nematodos Heterorhabditis indica y Steinernema sp. (Tavares et al. 2007), trampas con caña + melaza al 10% fermentada y cáscaras de piña con atracción de adultos del 90% y 62,5% en laboratorio (Girón et al. 2009) pero poco se conoce sobre aspectos básicos relacionados con la capacidad reproductiva y comportamiento sexual de estos insectos que permitan hacer un manejo de sus poblaciones en campo.
Según Le Cato y Pienkowski (1970), las especies de curculiónidos de ciclo de vida largo (un año o más) requieren cópulas múltiples para incrementar la fecundidad como es el caso de Hypera postica (Gyllenhal). Arnqvist y Nilsson (2000), mencionan que los machos de los insectos necesitan cópulas múltiples para incrementar su éxito reproductivo, mientras que las hembras con una o pocas cópulas lo maximizan. Arnqvist et al. (2004), comprobaron que la mayoría de hembras copulan varias veces con diferentes machos (poliandría) o con el mismo macho, con efecto directo en su éxito reproductivo, beneficiándolas con ganancias directas de 30-70% en el incremento de su fecundidad y fertilidad. El costo-beneficio de la poliandría tiene implicaciones en términos de efectos directos en el aumento de fecundidad y fertilidad, costos biológicos por daño físico del tracto genital (presencia de espinas en el edeago) y menor longevidad; costos ecológicos de tiempo, energía y riesgo de depredación.
Según Sadek (2001), citado por Campbell (2005), el costo-beneficio de las cópulas múltiples para cada sexo, puede influir en varios aspectos del comportamiento y ecología de los organismos y tienen consecuencias sobre el monitoreo y manejo de la población de plagas. Teniendo en cuenta estos antecedentes es posible que el picudo, Sphenophorus levis presente este tipo de comportamiento, de ahí la importancia de realizar estudios que permitan contribuir al conocimiento de estos aspectos y aportar herramientas para el adecuado manejo de la especie. Basados en estos argumentos, el objetivo de este estudio fue determinar aspectos básicos del comportamiento reproductivo de S. levis, tales como edad, horario y número de cópulas, periodo de pre-oviposición, fertilidad y fecundidad. Estos estudios podrán ser útiles, por ejemplo, para la obtención de feromonas de S. levis con el objetivo de usarlas en su monitoreo y control.
Materiales y métodos
Insectos. Para los diferentes bioensayos fueron utilizados adultos de S. levis obtenidos de la cría del Centro de Tecnología de la Caña - CTC, Piracicaba-SP, Brasil, los cuales fueron mantenidos en condiciones controladas de temperatura (25 ± 2 ºC), humedad relativa (70 ± 10%) y fotoperiodo (14:10h) en el Laboratorio de Comportamiento de Insectos - ESALQ/Universidade de São Paulo, USP. Para garantizar adultos vírgenes de edad conocida, los individuos fueron separados por sexo según Vaurie (1978), un día después de la emergencia y mantenidos en cajas de Petri de 5 cm de diámetro, con un pedazo de caña de 5 cm partido por la mitad, el cual era cambiado cada cuatro días.
Comportamiento de cópula. Para determinar el horario, duración y número de cópulas por edad, fueron conformadas parejas de adultos vírgenes de S. levis de 1, 7, 14, 21, 28 y 35 días de edad, las cuales se observaron directamente cada hora durante 24 horas para registrar el momento de cópula. Cada pareja se colocó en una caja de Petri con un pedazo de caña de 5cm. Para observar su comportamiento durante la noche, la sala se mantuvo con luz roja para visualizar los insectos sin interferirlos. El diseño experimental fue completamente al azar, con seis tratamientos (edad) y 25 repeticiones (parejas). Para la edad de 35 días se utilizaron 23 parejas. Los datos se sometieron a análisis de varianza y las medias fueron comparadas por la prueba DMS (mínima diferencia significativa) (P ≤ 0,05). Para la frecuencia de cópula, los datos se transformaron utilizando (x + 0,5)-5,4. Para el caso de las múltiples cópulas se tuvo en cuenta: la duración de cada cópula y el tiempo total de cópula por edad, y para normalizar los datos se transformaron según el tiempo de comportamiento así: '1 cópula' (xlog10), '2 cópulas' (x + 0,5)-1, '3 e 4 cópulas' (x + 0,5)2 y para 'tiempo total de cópula' se utilizó (√x).
Pre-oviposición, oviposición y viabilidad de huevos. Para determinar el período de pre-oviposición, el número de huevos depositados y su viabilidad; las hembras del anterior ensayo que copularon, se aislaron en cajas de Petri y se mantuvieron con un pedazo de caña para su alimentación y oviposición. El periodo de pre-oviposición correspondió al tiempo (días) entre la cópula y la primera oviposición. Se realizaron evaluaciones cada tres días durante 35 días. Para determinar la viabilidad, los huevos de cada hembra se colectaron y colocaron sobre papel filtro humedecido dentro de una caja de Petri. Paralelamente, como control de este experimento, se aislaron 30 hembras vírgenes de 21 días de edad, para evaluar su capacidad de producir huevos durante 60 días. Los datos se sometieron a un análisis de varianza y para la comparación de medias se utilizó la prueba de DMS (P ≤ 0,05). Con los datos de edad, duración de cada cópula, tiempo total de cópula, fertilidad, fecundidad y viabilidad (%) se calculó el coeficiente de correlación de Spearman (CCS).
Edad y éxito reproductivo. Considerando la longevidad de los adultos, se evaluó la influencia de la edad de hembras de S. levis de (85, 105 y 210 días), sobre la capacidad de cópula, oviposición, fertilidad y fecundidad. Cada hembra fue mantenida aislada hasta completar la edad seleccionada y colocada con un macho de 21 días de edad, durante 24 horas. Después de la cópula, se aislaron las hembras y se mantuvieron igual que el experimento anterior, durante 60 días consecutivos. El diseño experimental usado fue completamente al azar con tres tratamientos (edades) y 25 repeticiones, excepto para la edad de 210 días, con 15 repeticiones. Los datos se sometieron a un análisis de varianza y las medias fueron comparadas utilizando la prueba de DMS (P ≤0,05). Con las variables edad, pre-oviposición, total de huevos y viabilidad (%) se calculó el coeficiente de correlación de Spearman (CCS).
Resultados y discusión
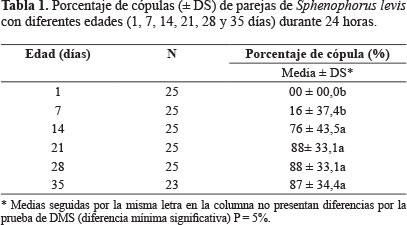
Horario, edad, duración y número de cópulas de S. levis. Se registraron cópulas en todas las horas del día (Fig. 1), con aumento de la frecuencia de cópula a mayor edad (Tabla 1). Este patrón de apareamiento de S. levis, es semejante a otros curculiónidos como Hyperia postica, Homalinotus coriaceus (Gyllenhal), Hylobitelus xiaoi Zhang, y Odoiporus longicollis Oliver, que copulan en cualquier horario (Le Cato y Pienkowski 1970; Sarro et al. 2004; Wen et al. 2004).
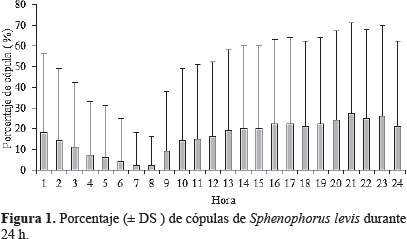
En relación con la edad de la primera cópula, se observó que individuos de un día de edad no copularon y los de siete días presentaron baja frecuencia de cópula (16%). Los adultos entre 14 y 35 días presentaron la mayor frecuencia de cópula con respecto a las demás edades, con 76 a 88%, respectivamente (Tabla 2). Estos resultados muestran un mecanismo importante en el comportamiento de cópula de S. levis, en cuanto a la madurez sexual de los individuos. Aparentemente, los adultos adquieren su madurez sexual dos semanas después de emergencia, tornándose más receptivos para la cópula. Casos similares se presentan en otros curculiónidos como Euscepes postfasciatus Fairmaire 9 - 15 días (Kohama y Shimoji 1997); Conotrachelus psidii Marshall 21 días (Bailez et al. 2003); Diaprepes abbrevaitus (Linnaeus) 10 días (Lapointe et al. 2004) y Cosmopolites sordidus hembras 5 a 20 días y machos 18 a 31 días (Gold et al. 2001). Esto sugiere que los adultos después de la emergencia, así como otras especies de insectos, necesitan alimentarse por cierto período para alcanzar su madurez sexual antes de realizar la cópula y de este modo garantizan su éxito reproductivo.
El comportamiento de múltiples cópulas a lo largo del día también se presentó en S. levis, principalmente para las edades entre 7 a 35 días. El 59,3% de las parejas observadas copularon una única vez; 35% dos veces; y en menor proporción tres y cuatro cópulas con 3,5 y 2,3%. Teniendo en cuenta la edad de las parejas de S. levis, no hubo diferencia en el tiempo de duración de la primera cópula para las edades de 14 y 35 días, con una variación media de 4,78 ± 3,48 a 7,75 ± 4,15 h. La duración media de la primera cópula a los siete días (1,75 ± 1,50 horas) fue inferior a las edades de 21 y 35 días. En cuanto a la duración media de la segunda, tercera y cuarta cópula no hubo diferencia en función de la edad (Tabla 2). Para la duración media de todas las cópulas no hubo diferencias para las edades de 21 y 35 días, con intervalos de duración entre 6,61 ± 5,34 h (a los 28 días) y 8,70 ± 4,28 h (a los 35 días), pero sí con las de siete días que presentaron menor tiempo de cópula con 2,00 ± 1,41 h (Tabla 2).
Por otra parte, sin considerar la edad de las parejas, la duración media de la primera cópula fue de 5,75 ± 4,22 h, con variación entre 1 y 14 h. Las demás cópulas presentaron menor duración así: la segunda cópula con duración media de 1,09 ± 1,94 h; la tercera y cuarta cópula con 0,11 ± 0,47 y 0,03 ± 0,32 h, respectivamente. El tiempo total de cópula durante un día por pareja independiente de la edad, varió de 1 a 17 h, con media de 7 h.
Estos datos demuestran que en la primera cópula S. levis presentó mayor duración, independiente de la edad y fue común observar a las parejas pasar varias horas en este comportamiento. De acuerdo con Le Cato y Pienkowski (1970), las especies longevas de más de un año, en su fase adulta necesitan múltiples cópulas para incrementar su fecundidad; pero según Sadek (2001), citado por Campbell (2005), el costo-beneficio de las múltiples cópulas para cada sexo puede influir en varios aspectos del comportamiento y ecología de los individuos, con implicaciones sobre el seguimiento y manejo de estos insectos.
Varios estudios en curculiónidos evidencian la importancia de las cópulas múltiples o prolongadas. Campbell (2005), demostró en Sitophilus oryzae (L.) que la continua exposición de hembras a los machos incrementa la fecundidad y la progenie al comparar con hembras que copularon una sola vez. En H. postica la duración media de la cópula puede llegar a 12 h y durante ese periodo ocurren varias cópulas (Le Cato y Pienkowski 1970). Según estos autores, las cópulas múltiples permiten a las hembras almacenar esperma suficiente para producir huevos fértiles durante su periodo reproductivo de seis meses. Así, a bajas densidades poblacionales donde los chances de nuevas cópulas son reducidos, las hembras se mantienen fértiles. Sirot y Lapointe (2008), demostraron que en D. abbreviatus las cópulas generalmente ocurren durante el día y tienen duración entre 3 a 9 horas. Los mismos autores documentaron que machos y hembras copulan repetidas veces; pero las hembras que copulan una sola vez, cesan sus posturas dos semanas después, lo que sugiere que las hembras requieren más de una cópula para renovar su reserva de esperma. Contrario a estos resultados, Adair et al. (1999), afirman que las hembras de esta especie que copularon una única vez presentaron alta capacidad de almacenar gran cantidad de esperma, suficiente para fertilizar huevos durante 20 semanas, lo que indica que no son necesarias varias cópulas para garantizar su éxito reproductivo. Otros autores afirman que las hembras de algunas especies de diferentes insectos pueden discriminar y seleccionar el esperma almacenado de varios machos y, por ejemplo, no utilizar el esperma del último macho (Córdoba 2000; Siva-Jothy y Hooper 1996).
Mayer y Brazzel (1963), observaron un mayor número de cópulas a mayor edad en Anthonomus grandis (Boheman), llegando hasta cinco cópulas durante 24 horas. Según Wen et al. (2004), en H. xiaoi ambos sexos copulan repetidas veces y la duración varía entre 0,1 a 4,8 h. Lo mismo ocurre con C. humeropictus Fiedler, con cópulas de 89,25 min. (Mendes et al. 1997). Sin embargo, otras especies de curculiónidos presentan menor duración de cópula, como Trichobaris championi Barber 16,67 ± 0,21min.; H. coriaceus 30,40 min.; y C. sordius 3 a 24 min., pero es tiempo suficiente para generar progenie (Calyecac-Cortero et al. 2004; Sarro et al. 2004; Viana y Vilela 1996). Arnqvist y Nilsson (2000), afirman que la presencia de esperma en las hembras estimula la madurez y la producción de huevos, pero tiene un costo directo en la reproducción afectando la longevidad de las hembras, además de disminuir la re-cópula e inhibir la receptividad de las hembras al repeler los machos.
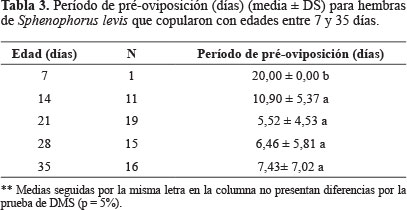
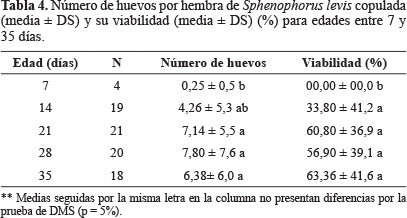
Periodo de pre-oviposición, número de huevos por hembra y viabilidad de huevos. El período medio de pre-oviposición en S. levis fue de 20 días para hembras copuladas en el 7º día de vida. Para el caso de hembras que copularon con edades entre 14 y 35 días, el periodo de pre-oviposición tuvo una duración entre 5,52 ± 4,53 a 10,90 ± 5,37 días (Tabla 3). El número medio de huevos por hembra varió entre 0,25 y 7,80 en hembras copuladas de 7 y 28 días, respectivamente. A medida que las hembras fueron más activas en relación con el comportamiento de cópula se tornaron más maduras sexualmente y a partir de 21 días de edad hubo un aumento significativo en la media de huevos por hembra en comparación con hembras de 7 días (Tabla 4). No hubo diferencia significativa en la viabilidad de los huevos provenientes de hembras de 14, 21, 28 y 35 días de edad, variando entre 33 y 63%, pero hubo diferencia con hembras de siete días ya que los huevos no fueron fecundados, sugiriendo que a esa edad las hembras no están maduras sexualmente. En general, en S. levis hay un aumento en el número medio de huevos y su viabilidad en hembras copuladas con edades entre 14 y 35 días de vida, comparadas con las más jóvenes (Tabla 4).
El ritmo diario de oviposición fue intermitente. Los picos máximos de postura se observaron entre los 7 y 14 días después de la cópula, para todas las edades, excepto en hembras de siete días. Después de estos picos, las posturas diarias se redujeron gradualmente con el paso del tiempo. Los huevos fueron ovipositados de forma individual, oscilando de uno a cuatro por hembra. El número medio diario de huevos por hembra varió de 0,1 a 1,7; con una media general diaria de 0,9 huevos por hembra (Fig. 2). Los resultados demostraron que la reproducción de S. levis es sexual, hecho corroborado al evaluar 30 hembras vírgenes (sin copular), de las cuales solo dos ovipositaron huevos inviables.
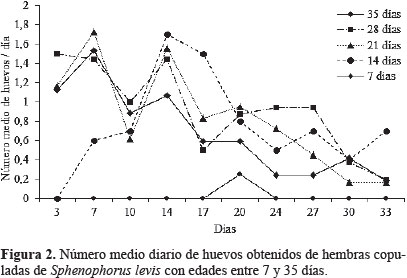
El coeficiente de correlación de Spearman (CCS) indicó alta correlación entre la duración de la primera cópula y tiempo total de cópula (CCS = 0,85; P = 0,0001). Sin embargo, para las otras variables las correlaciones fueron bajas pero significativas para fertilidad (CCS = 0,26; P = 0,0100), total de huevos (CCS = 0,35; P = 0,0007), y viabilidad (CCS = 0,36; P = 0,0006). El tiempo total de cópula también presentó baja correlación pero significativa con las variables fertilidad (CCS = 0,25; P = 0,0100), total de huevos (CCS = 0,38; P = 0,0003), y viabilidad (CCS = 0,36; P = 0,0006).
Considerando que de forma general los curculiónidos presentan ciclo de vida largo y baja fecundidad, los resultados observados para S. levis están dentro de lo esperado. Según Wainhouse et al. (2001), los efectos de la edad y disponibilidad de alimento influyen en el desarrollo reproductivo y en la duración del periodo de pre-oviposición en H. abietis. Para el picudo de la guayaba, C. psidii, el periodo de pre-oviposición fue de dos días para hembras copuladas de 21 días de edad (Bailez et al. 2003); para C. sordidus, el picudo del plátano, este período fue muy variable de 7 hasta más de 60 días (Gold et al. 2001); y para H. xiaoi de 46 días (Wen et al. 2004). En S. rufus este período fue de 11,1 ± 7,5 días, siendo que para 54,4% de las hembras fue inferior a siete días (Barreto et al. 1999); y para C. humeropictus Fiedler, 16 días (Mendes et al. 1997).
De acuerdo con Suazo et al. (2006), en M. hemipterus sericeus (Oliver) y M. quadrilineatus Champion, las hembras pueden copular con uno y dos días de edad, pero presentan un período de pre-oviposición de 3,3 semanas. En algunas especies de la tribu Naupactini el período de pre-oviposición es variable, por ejemplo de 24,0 ± 2,8 días para Cyrtomon luridus Boheman; 6,7 días para Naupactus versatilis (Hustache); y 11,6 días para N. cervinus (Boheman), (Tironi et al. 2005). Del mismo modo, Stubbs (1982), demostró que para S. granarius (L.), hembras copuladas hasta los 10 días de vida iniciaban la oviposición 15 días después, mientras que hembras que copularon a los 15 días de edad iniciaron oviposición 3 a 4 días después de la cópula.
En S. levis, según Degaspari et al. (1987), la capacidad media de oviposición de las hembras es de 40 huevos con valores máximos de 70 huevos, siendo que el 75% de estos son depositados en la primera mitad de vida. La baja producción de huevos observada en el presente estudio con una media de 6,39 huevos por hembra con edades entre 14 y 35 días, puede estar relacionada no solamente con la baja fecundidad de la especie, sino también con el poco tiempo de permanencia de la hembra con el macho (24 horas) y su posterior aislamiento, como reporta Sirot y Lapointe (2008) para D. abbreviatus, al privar a las hembras de nuevas cópulas y por el corto tiempo de evaluación del presente estudio (35 días).
En relación con la viabilidad de huevos de S. levis, esta fue en promedio de 53,72% para hembras entre 14 y 35 días, un valor muy parecido con lo observado por Degaspari et al. (1987), de 47,16% en huevos provenientes de hembras colectadas en campo.
Weissling y Giblin-Davis (1994), mencionan que en R. cruentatus (Fabricius), el número diario de huevos por hembra declinó 14 semanas después de la cópula y la viabilidad fue nula a partir de las ocho semanas después de la cópula, lo que sugiere que las hembras agotaron el esperma o requieren de varias cópulas para mantener la fertilidad. Para S. acupunctatus la ausencia o presencia del macho después de la primera cópula no afectó significativamente la oviposición ni la viabilidad de huevos (Hernández et al. 2006). Según estos autores, con el aumento de edad de los adultos hubo tendencia a disminuir el número de huevos y su viabilidad, relacionado posiblemente con la fisiología reproductiva de la hembra de mecanismos de autorregulación de la población. Para A. grandis, las hembras con una o más cópulas no presentaron diferencia en cuanto a número y viabilidad de huevos (Mayer y Brazzel 1963).
De forma general, la baja tasa de oviposición observada en S. levis fue similar a la observada en otros curculionidos como H. xiaoi con media de 36 huevos por hembra, presentando un pico de 2 huevos por día (Wen et al. 2004); C. humeropictus con promedio de 108 huevos durante su vida reproductiva (Mendes et al. 1997), y M. quadrilineatus con una variación de 1,4 a 3,3 huevos por hembra por semana (Suazo et al. 2006).
El coeficiente correlación de Spearman (CCS) reveló una relación positiva entre las variables edad, duración de la primera cópula, tiempo total de cópula, fertilidad y viabilidad de huevos de S. levis. Hembras con 35 días de edad fueron las que presentaron mejor desempeño para cada una de estas variables; sin embargo, no hubo diferencia con los resultados observados en hembras de 14, 21 y 28 días. También se observó alta correlación entre la duración de la primera cópula con las variables tiempo total de cópula, fertilidad y viabilidad de huevos, lo que indica que la cópula prolongada en S. levis fue importante para garantizar su éxito reproductivo.
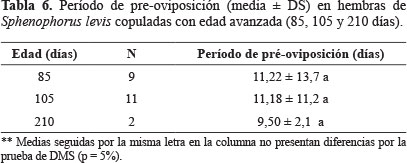
Influencia de la edad avanzada de hembras de S. levis sobre el éxito reproductivo de la especie. Las hembras de S. levis con edad entre 85 y 210 días, copularon en más del 66% de las oportunidades de encuentro con machos jóvenes (Tabla 5). Así mismo, la cópula y la fertilidad de huevos en estas hembras fueron exitosas. El período de pre-oviposición y el promedio de huevos por hembra no presentaron diferencia significativa para las condiciones de este trabajo, estuvo entre 9 y 11 días (Tabla 6), y 4,50 a 7,09 con viabilidad media entre 49 y 79% (Tabla 7).


Estos resultados sugieren que en S. levis, las hembras continúan receptivas para la cópula, independiente de la edad y que, posiblemente, esta habilidad se extienda durante su fase adulta, considerando que las hembras y machos de esta especie presentan longevidad de hasta 249 e 247 días, respectivamente (Degaspari et al. 1987). Aparentemente, esta es una característica común entre muchas especies de curculiónidos. En S. rufus, por ejemplo, hembras vírgenes fueron capaces de copular a los 60, 120 y 240 días de edad, generando descendientes en 80, 90 y 10% de los casos, respectivamente (Barreto et al. 1999).
Los resultados demuestran que en S. levis, como en la mayoría de curculiónidos con alta longevidad, hay receptividad por parte de las hembras de diferentes edades sin discriminar la edad del macho, presentan cópula prolongada, múltiples cópulas y tienen éxito reproductivo. La explicación puede estar relacionada con el sistema de comunicación química para estas especies la cual es mediada generalmente por feromonas de agregación liberadas por los machos que tienen como función ayudar a la atracción de hembras para la selección sexual y potencializar la cópula; aunque esta, solamente se produce en presencia de alimento y atrae a los dos sexos, lo que representa costos para el macho emisor en términos de mayor competencia sexual y de alimento (Bartel 1999; Calyecac-Cortero et al. 2004; Sirot y Lapointe 2008). Este comportamiento que presenta el picudo de la caña puede ser aprovechado para implementar el uso de la feromona de agregación (Zarbin et al. 2003) para el manejo de sus poblaciones ya que tanto hembras como machos copulan a cualquier edad.
Conclusiones
Fue posible determinar que los adultos de S. levis copulan en cualquier hora del día, con mayor frecuencia en edades entre los 14 a 35 días. Se registraron múltiples cópulas de una misma pareja y en general la primera cópula fue la de mayor duración. El periodo de pre-oviposición observado varió entre 5,52 a 20,0 días, con un aumento de tiempo en hembras de menor edad. El número medio de huevos por hembra fue 0,25 y 7,80 y presentaron viabilidad entre 33 y 63%. Las hembras de edad avanzada entre 85 y 210 días mostraron capacidad para perpetuar su especie, fueron altamente receptivas a la cópula y la viabilidad de sus huevos fue alta. Para esta especie se encontró correlación positiva entre las variables edad, duración de la primera cópula, tiempo total de cópula, fertilidad y viabilidad de huevos; lo que demuestra que el comportamiento reproductivo de S. levis es similar a la de otras especies de curculiónidos y permitirá continuar con estudios que tiendan a conocer su comportamiento sexual y de comunicación para desarrollar estrategias de manejo integrado.
Agradecimientos
Los autores agradecen al Profesor Sergio Vanin (Museu de Zoologia-USP), por la confirmación de la especie; a los revisores y editores de la Revista por sus valiosos aportes al manuscrito; al Ingeniero Luiz Carlos de Almeida y Sueli A. Piacentini del Centro de Tecnologia Canavieira CTC, Cristiane Nardi, Fernanda Peñaflor, Vitalis Wafula Wekesa, Isabel Fancelli-Tomazella (ESALQ/USP), Yuly Sandoval (Corpoica), por la colaboración en los bioensayos y revisión del manuscrito. Al INCT Semioquimicos na Agricultura (Fapesp/CNPq) y Corporación Colombiana de Investigación Agropecuaria Corpoica, por el apoyo logístico.
Literatura citada
ADAIR, R. C.; NIGG, H. N.; SIMPSON, S. E; LEFEVRE, L. 1999. Observations on the oviposition process of Diaprepes abbreviatus (Coleoptera: Curculionidae). Florida Entomologist 82: 362-365. [ Links ]
ALMEIDA, L.; ESTINGEL, E. 2005. Curso de monitoramento e controle de pragas da cana-de-açúçar. Piracicaba: Centro de Tecnologia Canavieira, 2005. 32 p. [ Links ]
ARNQVIST, G.; NILSSON, T. 2000. The evolution of polyandry: multiple mating and female fitness in insects. Animal Behavior 60: 145-164. [ Links ]
ARNQVIST, G.; NILSSON, T.; KATVALA, M. 2004. Mating rate and fitness in female bean weevils. Behavioral Ecology 16: 123-127. [ Links ]
ARRIGONI, E. D. B. 2008. Pragas de solo em cana-de-açúcar. Workshop tecnológico sobre "Pragas da cana-de-açúcar" Piracicaba, SP. PPPP-FAPESP. Disponible en: http://www.apta.sp.gov.br/cana/anexos/Workshop_Pragas_sessao1_Enrico.pdf. (Fecha revisión: 12 de febrero de 2013). [ Links ]
BADILLA, F.; ALVES, S. 1991. Control del picudo de la caña de azúcar Sphenophorus levis Vaurie, 1978 (Col: Curculionidae) con Beauveria bassiana y Beauveria brongniartii en condiciones de laboratorio y campo. Manejo Integrado de Plagas. San José Costa Rica 20/21: 34-38. [ Links ]
BAILEZ, O. E.; VIANA-BAILEZ, A. M.; LIMA, J. O. G.; MOREIRA, D. D. O. 2003. Life history of the guava weevil, Conotrachelus psidii Marshall (Coleoptera: Curculionidae), under laboratory conditions. Neotropical Entomology 32: 203-207. [ Links ]
BARRETO, M.; ANJOS, N.; DELLA LUCIA, T. 1999. Comportamento reprodutivo de Spermologus rufus Boheman (Coleoptera: Curculionidae). Anais Sociedade Entomológica do Brasil 8: 351-354. [ Links ]
BARTELT, R. 1999. Weevils. pp. 91-112. In: Hardie, J.; Minks, A. (Eds.). Pheromones of non-lepidopteran insects associated with agricultural plants. Wallingford: CABI publishing. 466 p. [ Links ]
CALYECAC-CORTERO, H. G.; CIBRIÁN-TOVAR, J.; BAUTISTA-MARTINEZ, N.; LÓPEZ-COLLADO, J. 2004. Comportamiento de alimentación, cortejo, cópula y oviposición de Trichobaris championi Barber (Coleoptera: Curculionidae). Agrociencia 38: 365-373. [ Links ]
CAMPBELL, J. F. 2005. Fitness consequences of multiple mating on female Sitophilus oryzae L. (Coleoptera: Curculionidae). Environmental Entomology 34: 833-843. [ Links ]
CÍCERO, E. A. S.; FERRAUDO, A. S.; LEMOS, M. V. F. 2009. Identificação de genes cry de Bacillus thuringiensis no controle de Sphenophorus levis, o bicudo da cana-de-açúcar. Bragantia 68 (4): 817-823. [ Links ]
CÓRDOBA, A. A. 2000. Evolución y diversidad de la morfología de los genitales masculinos en insectos. Folia Entomológica Mexicana 110: 95-111. [ Links ]
DEGASPARI, N.; BOTELHO, P.; ALMEIDA, L.; CASTILLO, H. 1987. Biologia de Sphenophorus levis Vaurie,1978 (Col: Curculionidae) em dieta artificial e no campo. Pesquisa Agropecuária Brasileira 22: 553-558. [ Links ]
GIRÓN-PÉREZ, K.; NAKANO, O.; SILVA, A.C.; ODA-SOUZA, M. 2009. Atração de adultos de Sphenophorus levis Vaurie (Coleoptera: Curculionidae) a fragmentos vegetais em diferentes estados de conservação. Neotropical Entomology 38 (6): 842-846. [ Links ]
GOLD, C .S.; PENA, J. E.; KARAMURA, E. B. 2001. Biology and integrated pest management for the banana weevil Cosmopolites sordidus (Germar) (Coleoptera: Curculionidae). Integrated Pest Management 6: 79-155. [ Links ]
HERNÁNDEZ, M.; GUTIÉRREZ, M.; ALDANA, L.; VALDÉS, M. 2006. Fecundity of the sisal weevil, Scyphophorus acupunctatus (Coleoptera: Curculionidae), on Polianthes tuberosa (Liliales: Agavaceae). Florida Entomologist 89: 518-520. [ Links ]
KOHAMA, T.; SHIMOJI, Y. 1997. Reproductive maturity of the female West Indian sweet potato weevil, Euscepes postfasciatus (Fairmaire) (Coleoptera: Curculionidae). Applied Entomology and Zoology 33: 1-4. [ Links ]
LAPOINTE, S. L.; HUNTER, W. B.; ALESSANDRO, R. T. 2004. Cuticular hydrocarbons on elytra of the diaprepes root weevil Diaprepes abbreviatus (L.) (Coleoptera: Curculionidae). Agricultural and Forest Entomology 6: 251-257. [ Links ]
LE CATO, G. L.; PIENKOWSKI, R. L. 1970. Laboratory mating behavior of the alfalfa weevil Hypera postica. Annals of the Entomological Society of America 63: 1000-1007. [ Links ]
MAYER, M. S.; BRAZZEL, J. R. 1963. The mating behavior of the boll weevil, Anthonomus grandis. Journal of Economic Entomology 56: 605-609. [ Links ]
MENDES, A. C. B.; MAGALHÃES, B. P.; OHASHI, O. S. 1997. Biologia de Conotrachelus humeropictus, Fiedler, 1940 (Coleoptera: Curculionidae), praga do cacaueiro e do cupuaçuzeiro na Amazônia brasileira. Acta Amazonica 27: 135-144. [ Links ]
MORAES, G. C.; ÁVILA, C. J . 2013. Sphenophorus levis detected in Mato Grosso do Sul, Brazil. Agricultural Science Research Journals 3 (1): 36-37. [ Links ]
PINTO, A. de S.; BOTELHO, P. S. M.; OLIVEIRA, H. N. 2009. Guia ilustrado de pragas e insetos benéficos da cana-de-açúcar. CP2. Piracicaba, 160 p. [ Links ]
POLANCZYK, R.; ALMEIDA, L.; PADULLA, L.; ALVES, S. B. 2004. Praga de cana-de-açúcar x métodos alternativos de controle. Biotecnologia Ciência & Desenvolvimento 33: 13-17. [ Links ]
SARRO, F.; CROCOMO, W. B.; FERREIRA, J. M. S. 2004. Biologia da broca do pedúnculo floral do coqueiro Homalinotus coriaceus Gyllenhal, 1836, (Coleoptera: Curculionidae) em três diferentes dietas. Neotropical Entomology 33 (1): 7-12. [ Links ]
SIROT, L.; LAPOINTE, S. 2008. Patterns and consequences of mating behavior of the root weevil Diaprepes abbreviatus (Coleoptera: Curculionidae). Florida Entomologist 91: 400-406. [ Links ]
SIVA-JOTHY, M. T.; HOOPER, R. E. 1996. Differential use of stored sperm during oviposition in the Damselfly Calopteryx splendens xanthostoma (Charpentier). Behavioral Ecology and Sociobiology 39: 389-391. [ Links ]
STUBBS, M. 1982. The influence of age of female at mating and duration of male presence upon the length of the pre-oviposition period and productivity of Sitophilus granarius (L.) (Coleoptera: Curculionidae) at 20°C. Journal of Stored Products Research 18: 171-175. [ Links ]
SUAZO, A.; PACHECO, D. P.; CAVE, R. D.; FRANK, J. H. 2006. Longevity and fecundity of Metamasius quadrilineatus Champion (Coleoptera: Dryophthoridae) on a natural bromeliad host in the laboratory. The Coleopterist Bulletin 60: 264-270. [ Links ]
TAVARES, F. M.; BATISTA FILHO, A.; LEITE, L. G.; ALMEIDA, L. C.; SILVA, A. C.; AMBRÓS, C. M. G. 2007. Efeito de Heterorhabditis indica e Steinernema sp. (Nemata: Rhabditida) sobre larvas do bicudo da cana-de-açúcar Sphenophorus levis (Coleoptera: Curculionidae), em laboratório e casa-de-vegetação. Nematologia Brasileira 31 (1): 12-19. [ Links ]
TIRONI, P.; VON TREUENFELS, A.; PARRA, J. R. P. 2005. Population dynamics of Cyrtomon luridus Boheman (Coleoptera: Curculionidae) on Duboisia sp. (Solanaceae) in Brazil. Scientia Agricola 62: 473-477. [ Links ]
VAURIE, P. 1978. Revision of the genus Sphenophorus in South America. American Museum Novitates 26: 1-30. [ Links ]
VIANA, A.; VILELA, E. 1996. Comportamento de agregação e acasalamento de Cosmopolites sordidus Germar (Coleoptera: Curculionidae). Anais da Sociedade Entomológica do Brasil 25: 347-350. [ Links ]
WAINHOUSE, D.; ASHBURNER, R.; BOSWELL, R. 2001. Reproductive development and maternal effects in the pine Hylobius abietis. Ecological Entomology 26: 655-61. [ Links ]
WEISSLING, T. J.; GIBLIN-DAVIS, R. M. 1994. Fecundity and fertility of Rhynchophorus cruentatus (Coleoptera: Curculionidae). Florida Entomologist 77: 373-376. [ Links ]
WEN, X.; KUANG, Y.; SHI, M.; LI, H.; LUO, Y.; DENG, R. 2004. Biology of Hylobitelus xiaoi (Coleoptera: Curculionidae), a new pest of slash pine, Pinus elliottii. Jorunal of Economic Entomology 97: 1958-1964. [ Links ]
ZARBIN, P. H. G.; ARRIGONI, E.; RECKZEGEL, A.; MOREIRA, J.; BARALDI, P.; VIEIRA, P. 2003. Identification of male specific chiral compound from the sugarcane weevil Sphenophorus levis. Journal of Chemical Ecology 29 (2): 377-386. [ Links ]
Recibido: 5-may-2014
Aceptado: 1-dic-2014













