Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.41 no.1 Bogotá Jan./June 2015
Efectos indirectos de insecticidas convencionales y biorracionales sobre la alimentación de Rachiplusia nu (Lepidoptera: Noctuidae)
Indirect effects of conventional and biorational insecticides on feeding of Rachiplusia nu (Lepidoptera: Noctuidae)
FEDERICO RIMOLDI1,2, MARILINA NOELIA FOGEL4,5, MARCELA INÉS SCHNEIDER4,6y ALICIA ESTELA RONCO1,31 Ph. D. Centro de Investigaciones de Medio Ambiente - CIMA - Facultad de Ciencias Exactas, Universidad Nacional de La Plata (UNLP), La Plata, Argentina. CONICET.
2 frimoldi@quimica.unlp.edu.ar.
3 cima@quimica.unlp.edu.ar. Autor para correspondencia.
4 Ph. D. Centro de Estudios Parasitológicos y de Vectores - CEPAVE - (CONICET La Plata - UNLP) La Plata, Argentina.
5 mfogel@quimica.unlp.edu.ar.
6 mschneider@cepave.edu.ar.
Resumen: La evaluación conjunta de los efectos letales y subletales de insecticidas sobre plagas, permite alcanzar un mejor conocimiento de su eficacia de acción. En este sentido, la alteración de los patrones de consumo foliar de una plaga, es un importante punto final para analizar la efectividad de insecticidas sobre insectos fitófagos. Los insecticidas que interfieren con el normal comportamiento alimentario de un insecto plaga contribuyen en el manejo de su población. El objetivo del presente estudio fue evaluar el efecto del endosulfán, cipermetrina, spinosad y metoxifenocida sobre el comportamiento alimentario de Rachiplusia nu, plaga potencial de varios cultivos, en especial soya, a través de experimentos de elección en laboratorio (Centro de Investigaciones del Medio Ambiente (CIMA) La Plata, Argentina). Además, se evaluó la supervivencia de las larvas expuestas a dichos productos. La cipermetrina y el spinosad indujeron efectos antialimentarios sobre las larvas tratadas. El endosulfán no causó efectos significativos sobre este punto final, mientras que las larvas expuestas a metoxifenocida mostraron preferencia por las hojas tratadas. Los insecticidas biorracionales ocasionaron mayor mortalidad sobre R. nu que los convencionales. Estos Resultados aportan conocimientos básicos para redefinir estrategias de control.
Palabras clave: Patrones de consumo. Plaga agrícola. Control químico. Efectos letales. Efectos subletales.
Abstract: The assessment of sublethal and lethal effects of insecticides on pests allows obtaining further insight of their efficacy. In this way, the pest feeding pattern is a relevant toxicological endpoint to analyze the effectiveness of insecticides on phytophagous insects, due to insecticides that interfere with the normal feeding behavior of a pest contributing to its population management. The objective of the present study was evaluating the effects of endosulfan, cypermethrin, spinosad and methoxyfenozide on feeding pattern of Rachiplusia nu, a potential pest in several crops but mainly in soybean, using laboratory choice test (Centro de Investigaciones del Medio Ambiente (CIMumen: A) La Plata, Argentina). Additionally, the larval survival was also assessed. Cypermethrin and spinosad induced antifeedant effects on exposed larvae. Endosulfan did not cause significant effects, while larvae exposed to methoxyfenozide showed preference towards the treated leaves. Biorational insecticides showed higher mortality to R. nu control than conventional ones. These new insights contribute with knowledge for redefining effective pest control strategies.
Key words: Consumption patterns. Agricultural pest. Chemical control. Lethal effects. Sublethal effects.
Introducción
Históricamente, el manejo intensivo de sistemas agrícolas ha utilizado insecticidas de amplio espectro para el control de plagas sin considerar, en la mayoría de los casos, el impacto potencial que estos productos pueden ocasionar sobre los distintos componentes ambientales. Sin embargo, actualmente las tendencias mundiales en protección de cultivos abogan por la implementación de programas de manejo integrado de plagas, que incorporen insecticidas biorracionales, con bajo impacto sobre las especies no blanco. El conocimiento de factores ecológicos y de los efectos de los insecticidas que afectan a las poblaciones de los artrópodos plaga es esencial para planear adecuadas estrategias de control (Birch 1963).
La utilización de productos biorracionales en algunos países como Argentina es aún incipiente, debido principalmente a su elevado costo. De esta manera, algunos insecticidas convencionales que utilizan como principio activo cipermetrina y endosulfán se encuentran entre los más utilizados para el control de plagas agrícolas (CASAFE 2011).
La cipermetrina actúa a nivel fisiológico alterando el funcionamiento normal del sistema nervioso central, prolongando la conductancia de los canales axónicos de sodio y, por lo tanto, permitiendo el ingreso excesivo del ión a la célula, generando en el insecto impulsos repetitivos y, finalmente, la muerte (Stenersen 2004). Por su parte, el endosulfán es un neurotóxico con alta afinidad por los receptores GABA (ácido gamma-aminobutírico) que causa excitabilidad, temblores y convulsiones antes de la muerte del organismo (Stenersen 2004). Aunque ha sido prohibido o su uso restringido en más de 30 países, en algunos continúa siendo utilizado. En Argentina, la importación ha sido prohibida desde julio de 2012 y su elaboración y uso desde 2013, por Resolución 511/2011 del Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA 2012). Para reemplazar estos insecticidas convencionales han emergido nuevos compuestos con modos de acción más selectivos, como el spinosad y la metoxifenocida. El spinosad es un bioinsecticida derivado de la fermentación del actinomiceto del suelo Saccharopolyspora spinosa (Mertz y Yao, 1990). Inicialmente, fue considerado de baja toxicidad para organismos benéficos (enemigos naturales y polinizadores) (Cisneros et al. 2002) sin embargo, estudios recientes han indicado efectos adversos sobre varios enemigos naturales (Dagli y Bah§i 2009; Biondi et al. 2012). Se trata también de un neuroinsecticida que actúa de manera diferente a los insecticidas convencionales, ya que altera la unión de la acetilcolina en los receptores específicos de las células postsinápticas. Además, altera el funcionamiento de los receptores GABA (Millar y Denholm 2007).
Por su parte, el metoxifenocida es un compuesto acelerador de la muda (CAM), perteneciente al grupo de insecticidas reguladores de crecimiento (IRC). Los CAM mimetizan la acción de la hormona esteroidea natural (ecdisona), uniéndose a los mismos receptores que ésta, causando una muda anticipada y letal (Dhadialla et al. 1998). Este principio activo es específico para lepidópteros, siendo inocuo o de muy baja toxicidad para enemigos naturales (Schneider et al. 2008; Rimoldi et al. 2012a). Debido a su elevada selectividad, es muy utilizado en Estados Unidos y Europa, además de haber tenido muy buena aceptación en países latinoamericanos como Argentina.
Rachiplusia nu (Guenée, 1852) (Lepidoptera: Noctuidae) es un fitófago considerado plaga potencial de muchos cultivos tales como soya (Glycine max L., 1737), girasol (Helianthus annuus L., 1753), maíz (Zea mays L., 1753), trigo (Triticum sp.) y alfalfa (Medicago sativa L., 1753). Además, infestaciones de R. nu han sido observadas también en cultivos hortícolas de poroto o frijol (Phaseolus vulgaris L., 1753), tomate (Lycopersicon sculentum L., 1753), lechuga (Lactuca sativa L., 1753), zapallo (Cucumis sativus L., 1753), calabaza (Cucurbita maxima D., 1786), guisante (Pisum sati-vum L., 1753) y brócoli (Brassica oleracea L., 1753), entre otros (Aragón et al. 1997). Este lepidóptero es comúnmente encontrado en Argentina, Bolivia, Brasil, Chile, y Uruguay (Barrionuevo et al. 2012).
A pesar que se ha avanzado en el estudio de la toxicidad y el metabolismo de cipermetrina, endosulfán, spinosad y me-toxifenocida sobre organismos blanco, poco se sabe acerca de sus efectos subletales como la alteración de los patrones de alimentación, que tiene una incidencia directa en la toma de decisiones para el control de plagas fitófagas. Estudios han permitido observar que algunos de estos insecticidas producen alteraciones del consumo de alimento en larvas de R. nu durante las primeras 24 h de exposición (Rimoldi et al. 2012b).
El esquema secuencial de análisis de compatibilidad de plaguicidas sobre organismos benéficos que plantea la Organización Internacional para a Lucha Biológica (OILB) tiene en cuenta realizar en una primera etapa los análisis en condiciones de laboratorio para luego, de ser necesario, continuar los mismos en condiciones de semicampo y campo. El presente estudio se enmarca en una misma lógica de evaluación para organismos plaga. De esta forma, el objetivo de este trabajo fue evaluar en condiciones de laboratorio los efectos de la cipermetrina, el endosulfán, spinosad y la metoxifeno-cida sobre el patrón de consumo foliar de las larvas de R. nu, mediante experimentos de elección de dieta. Además, se evaluó la mortalidad y el tiempo medio de supervivencia como medida de efectividad de dichos insecticidas.
Materiales y métodosCría de insectos. El estudio se llevó a cabo en el Centro de Investigaciones del Medio Ambiente (CIMA) Facultad de Ciencias Exactas - Universidad Nacional de La Plata (UNLP). La Plata, Buenos Aires, Argentina. Las colonias de R. nu fueron iniciadas con insectos recolectados en campos sin historia de aplicación de insecticidas. Una vez iniciado el pie de cría, se incorporaron periódicamente entre 20 y 50 larvas a fin de mantener la variabilidad alélica de las colonias. Las larvas del pie de cría fueron alimentadas con dieta semi sintética (Greene et al. 1976) y mantenidas en condiciones controladas de temperatura 25 ± 2 °C, humedad relativa 75 ± 5% y fotoperíodo 16:8 h (L:O). Los adultos fueron alimentados con solución de miel al 15 %. Como sustrato de oviposición y para la fácil identificación y extracción de los huevos los recipientes de cría de los adultos fueron cubiertos con cartulina negra. Para los bioensayos se utilizó la progenie del pie de cría mantenido en laboratorio.
Insecticidas. Se utilizaron las siguientes formulaciones comerciales: Tracer® (48% spinosad, Dow Agroscience, Argentina), Intrepid® (24% methoxyfenozide, Dow Agrosciences, Argentina), Glexin25® (25% cypermethrin, Gleba, Argentina) y Endosulfán 35 Glex® (35% endosulfan, Gleba, Argentina). Las soluciones fueron preparadas utilizando agua destilada como disolvente y se incorporó un surfactante (Tween®80, 0,01%, Merck) para mejorar la adherencia de los insecticidas a la superficie de las hojas.
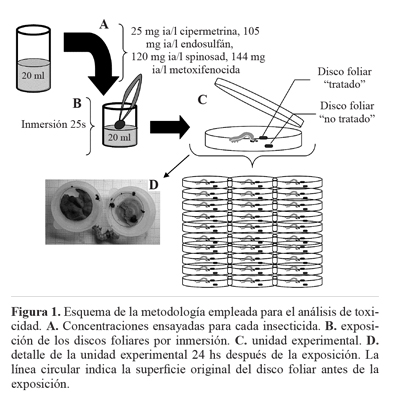
Bioensayos de toxicidad. Para los ensayos de toxicidad se utilizaron larvas de quinto estadio de R. nu pertenecientes a una misma cohorte. Se seleccionó el quinto estadio larval, debido a que su elevada tasa de consumo permite un mejor análisis del comportamiento alimentario. Cada unidad experimental consistió en una caja de Petri plástica (9 cm de diámetro, 1.4 cm de alto), que contenía una larva y dos discos foliares. De esta manera, a cada larva se le ofreció durante 24 h dos discos foliares de espinaca sin historia de exposición a insecticidas, de 3,8 cm2 de diámetro (uno de los discos con insecticida -denominado "tratado"- y uno sin insecticida -"no tratado"-, experimento de elección). En experimentos piloto, con diferentes plantas hospederas, se escogió la espinaca como fuente de alimento para los ensayos, ya que sus discos foliares no se deshidratan y tienen buena palatabilidad para las larvas (datos no mostrados).
La exposición de los discos foliares a los distintos insecticidas se realizó por inmersión durante 25 segundos. Para los
discos "tratados" se utilizó la máxima concentración esperada en el ambiente del insecticida correspondiente de acuerdo a la guía de registro de productos de Argentina (CASAFE 2011), los otros discos, "no tratados", fueron expuestos a agua destilada siguiendo el método explicado (Fig. 1).
Para cada insecticida se utilizaron tres réplicas de diez unidades experimentales, mientras que para el tratamiento control se siguió el mismo método utilizado en el resto de los tratamientos, ofreciendo un disco foliar expuesto a agua destilada y el otro a agua destilada con surfactante a fin de corroborar la inocuidad de éste. Durante el resto del experimento, las larvas fueron alimentadas con hojas de espinacas no tratadas.
Luego de las primeras 24 h el remanente de los discos foliares fue fotografiado, y se utilizó el programa libre ImageJ (http://imagej.en.softonic.com/) para estimar la superficie. Para la evaluación de los patrones de alimentación (efectos antialimentarios o atrayentes), se calculó un índice de inhibición alimentaría (IIA - ecuación a) (Rossetti et al. 2008). Además, se evaluó el porcentaje total de consumo (CT -ecuación b) y el porcentaje de consumo para cada disco foliar ("tratado" y "no tratado"). Este análisis diferencial permite discriminar la inhibición del consumo respecto de los efectos antialimentarios o atrayentes.

Para completar el análisis de los efectos de los insecticidas evaluados sobre el comportamiento alimentario de las larvas de R. nu, se incluyó el porcentaje de unidades experimentales por tratamiento en donde se observó consumo de cada uno de los discos foliares ofrecidos, como una medida de la cantidad de larvas que ingirieron uno u otro disco foliar. En este sentido, se consideró que una larva consumió de un determinado disco foliar cuando se observó en el mismo una disminución del área respecto a la superficie original del disco, pudiendo una misma larva consumir ambos discos foliares. Además, cada 24 h y hasta que llegaron al estado adulto, se evaluó el efecto de los insecticidas sobre su supervivencia. Las larvas y pupas fueron consideradas muertas cuando no respondieron al ser estimuladas con un pincel. Para evaluar la supervivencia a corto plazo se aplicó un análisis de supervivencia durante los primeros cinco días.
Análisis de datos. Los datos son presentados como valores medios ± error estándar. En todas las pruebas estadísticas se trabajó con un intervalo de confianza del 95%. La normalidad de los datos fue evaluada mediante la prueba de Jarque-Bera. La prueba de Student (en muestras pareadas) para datos aditivos fue utilizada para evaluar diferencias de consumo dentro de cada tratamiento. Cuando los datos no presentaron distribución normal, se utilizó la prueba de Kruskal-Wallis y posteriormente la de Dun para comparaciones de a pares. Cuando los datos siguieron una distribución normal se utilizó ANOVA, y la prueba a posterirori de Fisher (LSD) para determinar diferencias entre los tratamientos. En los casos donde se requirió analizar diferencias con un tratamiento control, se utilizó la prueba a posteriori de Dunnet. El tiempo de supervivencia medio se estimó mediante el análisis de supervivencia durante los primeros cinco días utilizando como función el método de Kaplan-Meier, además se usó la prueba de log-rank con la aplicación de la corrección de Bonferroni para comparar tratamientos por pares. Los análisis estadísticos se realizaron con el programa XLStat (Addinsoft XLstat for Excel, Paris, Francia. 2009. http://xlstat.softonic.com).
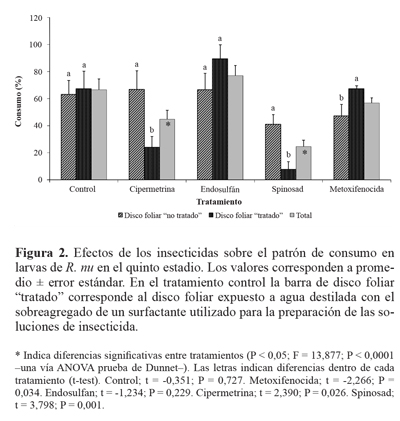
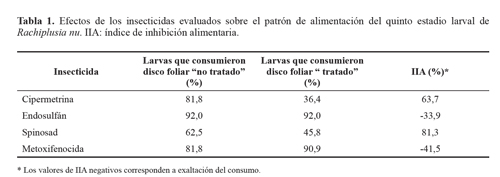
ResultadosEl análisis de los efectos de los insecticidas sobre el comportamiento alimentario de R. nu mostró que las larvas de los tratamientos con cipermetrina y spinosad consumieron un porcentaje significativamente menor del disco foliar "tratado" que del "no tratado" (Fig. 2). En el mismo sentido, se registraron mayores valores de IIA, evidenciando efectos antialimentarios sobre las larvas expuestas (Tabla 1) . Asimismo, al considerar el porcentaje total de consumo ("tratados" más "no tratados"), las larvas expuestas a estos insecticidas evidenciaron una reducción significativa de este punto final respecto a las larvas del tratamiento control (Fig. 2) . Para estos insecticidas, fueron más las unidades experimentales en las que se observó consumo de disco foliar "no tratado", que en las que se observó consumo del disco foliar "tratado". Esta diferencia fue mayor para el caso de cipermetrina (Tabla 1).
En el tratamiento con endosulfán no se observaron efectos significativos sobre el comportamiento alimentario de las larvas expuestas de R. nu. Si bien se obtuvo un valor negativo de IIA (Tabla 1), evidenciando un incremento hacia el consumo del disco foliar "tratado", al analizarse las diferencias en los porcentajes de consumo de disco foliar "tratado" y "no tratado" (Fig. 2), y en el porcentaje de unidades experimentales en las que se registró consumo de cada uno de los discos foliares ofrecidos (Tabla 1), los Resultados no mostraron diferencias estadísticas significativas. Por otro lado, los porcentajes de consumo total registrados en este tratamiento fueron similares a los del control.
A diferencia de los efectos antialimentarios producidos por los insecticidas cipermetrina y spinosad sobre el quinto estadio larval de R. nu, en el tratamiento con metoxifenoci-da se observó preferencia de las larvas hacia el consumo del disco foliar "tratado", con efecto atrayente de este compuesto (Fig. 2). Esto fue corroborado con el valor negativo de IIA obtenido para este insecticida (Tabla 1). Sin embargo, al considerar el porcentaje de unidades experimentales en las que se observó consumo de disco foliar "tratado" y "no tratado", no se registraron diferencias significativas en este punto final (Tabla 1).
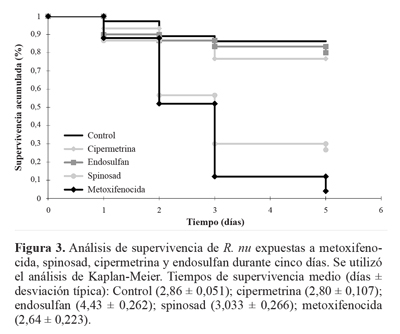
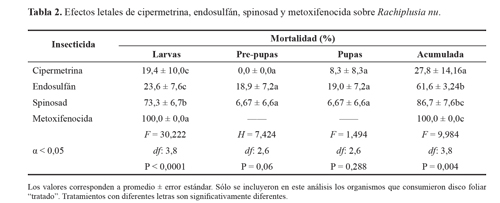
Finalmente, en el tratamiento control no se observaron diferencias en los patrones de alimentación de las larvas de R. nu, por lo que pudo corroborarse la inocuidad del surfactante utilizado para la preparación de las soluciones de insecticida. A pesar que la exposición a los insecticidas se realizó solo durante 24 h, los organismos fueron controlados diariamente hasta que alcanzaron el estado adulto a fin de evaluar efectos a largo plazo sobre la supervivencia y, por lo tanto, la eficacia de acción de estos insecticidas en estas condiciones de exposición. En este contexto, los insecticidas biorracionales (spinosad y metoxifenocida) resultaron ser más efectivos que los convencionales (cipermetrina y endosulfán), ya que indujeron mayores porcentajes de mortalidad y menores tiempos medios de supervivencia (Tabla 2; Fig. 3).
Al considerar la mortalidad a corto plazo (5 días), incluyendo la totalidad de los organismos al análisis, los tratamientos con cipermetrina y endosulfán no indujeron efectos significativos sobre la supervivencia de R. nu, produciendo mortalidades y tiempos medios de supervivencia significativamente similares a los registrados para el tratamiento control (Fig. 3). Sin embargo, cuando se analizó la mortalidad a largo plazo y considerando sólo los organismos en los que se pudo verificar el consumo de disco foliar "tratado", endosulfán indujo una elevada mortalidad acumulada que se distribuyó de manera homogénea entre los distintos estadios evaluados. Por su parte, para el caso de la cipermetrina se registró una baja mortalidad acumulada (Tabla 2).
Contrario a lo observado para los insecticidas convencionales, metoxifenocida y spinosad indujeron mayores mortalidades durante los primeros cinco días de exposición considerando la totalidad de los organismos al inicio de los experimentos. Si bien los tiempos medios de supervivencia obtenidos para estos tratamientos no fueron muy diferentes a los registrados para la mortalidad natural en el tratamiento control, el metoxifenocida exhibe mayor celeridad de acción que el spinosad (Fig. 3). Cuando se incluye en el análisis solamente a los organismos en los cuales se verificó el consumo de disco foliar "tratado", en el caso del metoxifenocida todos los organismos murieron durante el quinto estadio larval (estadio de exposición). Mientras que para el caso de spinosad se observó una gran mortalidad acumulada la cual se produjo principalmente sobre el estadio de exposición (Tabla 2).
DiscusiónSi bien la mayoría de los plaguicidas sintéticos han sido diseñados para producir efectos directos sobre la supervivencia de los organismos blanco, la actividad antialimentaria es un atributo complementario muy importante para mejorar su potencialidad de control y reducir los daños en los cultivos. Existen muchos productos utilizados para el control de plagas que poseen este tipo de efectos, en la mayoría de los casos se trata de extractos de plantas vasculares que contienen terpe-nos entre sus principales componentes (Rossetti et al. 2008).
Rimoldi et al. (2012b) en estudios de "no elección" con larvas de R. nu observaron disrupción del consumo de dieta artificial contaminada con algunos de los insecticidas aquí evaluados. En ese estudio, la cipermetrina indujo una reducción del consumo en las larvas expuestas, mientras que metoxifenocida estimuló el mismo. De forma similar, en el presente estudio, la cipermetrina inhibió el porcentaje de consumo total en las larvas de R. nu. Por otro lado, en ambos estudios se observa que cuando las larvas del lepidóptero son sometidas a elección de hojas con el insecticida y sin el mismo, prefieren el alimento "no tratado", evidenciando efectos repelentes. La repelencia de piretroides ha sido documentada por Longley y Jepson (1996) para el parasitoide Aphidius rhopalosiphi (DeStefani-Perez, 1902) (Hymenoptera: Aphidiidae), al detectar menor porcentaje de parasitismo sobre áfidos expuestos a delta-metrina. Para el caso específico de efectos antialimentarios Baumler y Potter (2007), registraron inhibición en Popillia japónica (Newman, 1841) (Coleoptera: Scarabaeidae) con varios piretroides. Del mismo modo, otros autores han observado inhibición del consumo de dieta contaminada con ciper-metrina en Spodoptera exempta (Walker, 1856) (Lepidoptera: Noctuidae) (Fisk y Wright 1992), Panonychus ulmi (Koch, 1836) (Actinotrichida: Tetranychidae) y Tetranychus urti-cae (Koch, 1836) (Actinotrichida: Tetranychidae) (Ahn et al. 1993), entre otras especies de artrópodos. Benamú et al. (2013) observaron efectos antialimentarios de la cipermetrina sobre la araña Alpaida veniliae (Keyserling, 1865).
De acuerdo a los Resultados obtenidos en el presente estudio, el spinosad al igual que la cipermetrina, induce efectos antialimentarios sobre el quinto estadio larval de R. nu. Los antecedentes relacionados a este tipo de efectos del principio activo spinosad son dispares. Villanueva y Walgenbach (2006), en experimentos de elección utilizando este insecticida, detectaron repelencia en T. urticae, aunque no observaron efectos en P ulmi. Contrario a lo observado en nuestros Resultados, el spinosad pareciera no inducir repelencia en Orius majusculus (Reuter, 1879) (Hemiptera: Anthocoridae) (Dagli y Bah§i 2009). Sin embargo, Disbury et al. (2004) sugirieron que, en experimentos de campo, produce efectos repelentes sobre la oviposición de Nematus oligospilus (Foerster, 1854) (= N. desantisi Smith) (Hymenoptera: Tenthredinidae). Finalmente, otros autores indicaron que spinosad indujo diferencias en los porcentajes de consumo de huevos del depredador O. insidiosus, pero no en G. punctipes (Elzen et al. 2001).
Existen pocos datos relacionados a los efectos de IRC sobre el comportamiento alimentario de lepidópteros plaga (Aguirre et al. 2013). Sin embargo algunos autores han registrado efectos disuasivos del compuesto acelerador de la muda (CAM) tebufenocida cuando en experimentos de elección se le ofreció a adultos de Choristoneura fumiferana (Clemens, 1865) (Lepidoptera: Tortricidae) sobre superficies de oviposición tratadas y no tratadas con este insecticida (Cadogan et al. 2002). Normalmente la muda de los insectos es precedida por un decrecimiento de la alimentación (Nation 2002). Por lo tanto, debido a que los CAM mimetizan a la ecdisona natural (hormona de la muda de insectos), un cese de la alimentación en los organismos blanco sería esperado. Más aún, si se tiene en cuenta que los CAM también estimulan la formación de una doble cápsula cefálica en las larvas expuestas, interfiriendo con su normal alimentación. En este sentido, metoxifenocida y otros IRC han inhibido el consumo en Diatrea grandiosella (Dyar, 1911) (Lepidoptera: Crambidae), Spodoptera littora-lis (Boisduval, 1833) (Lepidoptera: Noctuidae), y Mhytimna unipuncta (Haworth, 1809) (Lepidoptera: Noctuidae) (Gobbi et al. 2000; Pineda et al. 2007). Del mismo modo, se observó detrimento del consumo en larvas de R. nu, 48 h después de la exposición a metoxifenocida. En ese caso, durante las primeras 24 h se notó un incremento en el consumo de dieta artificial contaminada (Rimoldi et al. 2012b). En el presente estudio, el comportamiento alimentario fue evaluado durante 24 h en experimentos de elección, registrándose también efectos atrayentes. Este tipo de efectos estaría asegurando la exposición de los organismos blanco, y teniendo en cuenta la rápida letalidad que induce este insecticida, resultaría un valor agregado para este producto en lo que respecta a su potencialidad de control.
El endosulfán no produjo alteraciones en el comportamiento alimentario de las larvas de R. nu. Resultados similares han sido observados por Bagnarello et al. (2009) y Flores et al. (2008) al exponer adultos de Bemisia tabaci (Gennadius, 1889) (Homoptera: Aleyrodidae) a plantas de tomate tratadas con endosulfán. Elzen (2001) no observó afectación en el consumo de huevos de O. insidiosus contaminados con endosulfán, aunque registró inhibición en G. punctipes.
La actividad larvicida de los insecticidas analizados en el presente estudio sobre R. nu ha sido ampliamente documentada (Mendez et al. 2002; Pineda et al. 2007; Rimoldi et al. 2012b). Sin embargo, Resultados de mortalidad obtenidos en experimentos de elección proveen información adicional a la existente. Como se mencionó, teniendo en cuenta los métodos del ensayo, la mortalidad fue analizada por un lado considerando la totalidad de individuos al inicio de los experimentos (independiente de que consumieran discos foliares "tratados", "no tratados" o ambos) y por otra parte, teniendo en cuenta sólo a las larvas en las que se pudo verificar que consumieron del disco foliar "tratado".
Los insecticidas biorracionales resultaron más efectivos en estas condiciones para el control de R. nu que los convencionales, al producir mortalidades superiores y con tasas más elevadas. El metoxifenocida fue el insecticida que más afectó la supervivencia de esta especie, matando la totalidad de las larvas que consumieron el disco foliar "tratado" y con elevados porcentajes de mortalidad cuando se analizó la totalidad de los organismos. Esta elevada actividad larvi-cida sobre R. nu ha sido registrada en experimentos crónicos (Rimoldi et al. 2012b). Del mismo modo, Pineda et al. (2007) observaron, para este insecticida, elevada mortalidad de larvas de S. littoralis cuando fueron transferidas desde una dieta contaminada a una no tratada. Los autores atribuyeron estos efectos a la elevada estabilidad del insecticida en los tejidos corporales de las larvas. Gobbi et al. (2000) también informaron efectos significativos sobre la supervivencia de S. littoralis, M. unipuncta y S. exigua, expuestos al CAM tebufenocida.
A su vez, el spinosad también indujo elevada mortalidad y gran velocidad de acción sobre R. nu, cuando se tuvo en cuenta a los organismos que consumieron disco foliar "tratado". Esta elevada efectividad por ingestión ha sido documentada para noctuidos plaga tales como S. frugiper-da (Smith) (Mendez et al. 2002), S. littoralis (Pineda et al. 2007), Pseudoplusia includens (Walker, 1857) (Mascarenhas y Boethel 1997) y R. nu (Rimoldi et al. 2012b).
Existen varios antecedentes que alertan acerca de la acción insecticida de endosulfán en otras plagas tales como Apolygus lucorum (Meyer-Dür, 1843) (Hemiptera: Miridae) (Liu et al. 2008), Taumetopoea pityocampa (Schiffermüller) (Lepidoptera: Thaumetopoeidae) (Kalender et al. 2005), Helicoverpa punctigera (Wallengren, 1860) (Lepidoptera: Noctuidae) (Gunning y Easton 1994) y Piezodorus guildinii (Westwood, 1837) (Heteroptera: Pentatomidae) (Stadler et al. 2006). En el presente trabajo, la efectividad de endosulfán sobre R. nu fue menor a la registrada para los insecticidas biorracionales, ya que si bien se alcanzaron valores relativamente elevados de mortalidad acumulada, la mortalidad parcial por estadio se distribuyó de manera más homogénea, evidenciando un retardo en el efecto.
Por su parte, la cipermetrina pareciera requerir exposiciones prolongadas para inducir efectos significativos sobre la supervivencia de R. nu, ya que se detectaron bajos porcentajes de mortalidad en los organismos expuestos. Por el contrario, muchos autores han detectado alta toxicidad de éste y otros piretroides sobre lepidópteros plaga (Usmani y Knowles 200l; Abdullah et al. 2001). En este caso, la baja mortalidad registrada, pone en evidencia aún más la importancia de los efectos antialimentarios, ya que a pesar de que este insecticida no estaría reduciendo la densidad de plaga, si disminuiría sus daños potenciales sobre la planta hospedera al inhibir su consumo.
ConclusionesLa disrupción del comportamiento alimentario es un efecto indirecto que debe ser considerado en la evaluación de la efectividad de un insecticida, en especial cuando se trata de plagas defoliadoras. La inhibición del consumo inducida por los insecticidas cipermetrina y spinosad colabora con el control de la plaga, más allá de la mortalidad que causen estos compuestos. Por su parte, la exaltación del consumo observada con metoxifenocida favorece la exposición de los organismos al insecticida, esto asociado a la elevada mortalidad que induce este producto maximiza su efectividad de control. Los Resultados del presente estudio son novedosos para R. nu, una especie de relevancia económica regional, al contribuir con información básica para la toma de decisiones en el marco del control de éste y otros lepidópteros plaga. Se planean estudios en condiciones de semi-campo y campo a fin completar el perfil toxicológico de estos compuestos y redefinir concentraciones de aplicación, considerando estas variables adicionales.
AgradecimientosEsta investigación fue financiada por un proyecto de la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT - PICT 0891 - BID) de Argentina. Los autores agradecen a los evaluadores que revisaron este trabajo; a DowAgroscience S. A. y Gleba S. A. por proveer los insecticidas utilizados en los bioensayos.
Literatura citadaABDULLAH, M.; SARNTHOY, O.; ISICHAIKUL, S.; TANTA-KOM, S. 2001. Efficacy of cypermethrin, neem extract and Bacillus thuringiensis for controlling insect pests of vegetable soybean. Kasetsart Journal Natural Science 35: 14-22. [ Links ]
AGUIRRE, O. U.; MARTÍNEZ, A. M.; CAMPOS GARCÍA, J.; HERNÁNDEZ, L. A.; FIGUEROA, J. I.; LOBIT, P.; VIÑUELA, E.; CHAVARRIETA, J. M.; SMAGGHE, G.; PINEDA, S. 2013. Foliar persistence and residual activity of methoxyfeno-zide against beet armyworm (Lepidoptera: Noctuidae). Insect Science 6: 734-742. [ Links ]
AHN, Y J.; KWON, M.; YOO, J. K.; BYUN, S. J. 1993. Toxicity of flufenoxuron alone and in mixture with alphacypermethrin or fenbutain oxide to Tetranychus urticae and Panonychus ulmi (Acari: Tetranychidae). Journal of Economic Entomology 86: 1334-1338. [ Links ]
ARAGON, J. R.; MOLINARI, A.; LORENZATTI DE DIEZ, S. 1997. El cultivo de la soja en Argentina. pp. 247-308. En: Giorda, L. M.; Baigorri, H. E. J. (Eds.). Manejo integrado de plagas. INTA. Córdoba. Argentina. [ Links ]
BAGNARELLO, G.; HILJE, L.; BAGNARELLO, V; CARTIN, V; CALVO, M. 2009.Actividad fagodisuasiva de las plantas Tithonia diversifolia y Montanoa hibiscifolia (Asteraceae) sobre adultos del insecto plaga Bemisia tabaci (Homoptera:Aleyrodidae). Revista de Biología Tropical 57: 1201-1215. [ Links ]
BARRIONUEVO, M. J.; MURUA, M. G.; GOANE, L.; MEA-GHER, G.; NAVARRO, F. 2012. Life table studies of Ra-chiplusia nu (Guenée) and Chrysodeixis (= Pseudoplusia) includens (Walker) (Lepidoptera: Noctuidae) on artificial diet. Florida Entomologist 95: 944-951. [ Links ]
BAUMLER, R. E.; POTTER, D. A. 2007. Knockdown, residual and antifeedant activity of pyrethroids and home landscape bioinsec-ticides against Japanese beetle (Coleoptera: Scarabaeidae) on linden foliage. Journal of Economic Entomology 100: 451-458. [ Links ]
BENAMÚ, M. A.; SCHNEIDER, M. I.; GONZALEZ, A.; SÁNCHEZ, N. E. 2013. Short and long-term effects of three neurotoxic insecticides on the orb-web spider Alpaida veni-liae (Araneae, Araneidae): Implications for IPM programs. Ecotoxicology 22: 1155-1164. [ Links ]
BIONDI, A.; MOMMAERTS, V; SMAGGHE, G.; VIÑUELA, E.; ZAPPALA, L.; DESNEUX, N. 2012. The non-target impact of spinosyns on beneficial arthropods. Pest Management Science 68: 1523-1536. [ Links ]
BIRCH, L. 1963. Population ecology and the control of pests. Bulletin of the World Health Organization 29: 141-146. [ Links ]
CADOGAN, B. L.; SCHARBACH, R. D.; KRAUSE, R. E.; KNOWLES, R. 2002. Evaluation of tebufenozide carry-over effects on spruce budworm (Lepidoptera: Tortricidae). Journal of Economic Entomology 95: 578-586. [ Links ]
CASAFE - CÁMARA ARGENTINA DE SANIDAD AGROPECUARIA Y FERTILIZANTES. 2011. Guía de productos fitosa-nitarios. Eds. CASAFE 15th, Buenos Aires. 996 p. [ Links ]
CISNEROS, J.; GOULSON, D.; DERWENT, L. C.; PENAGOS, D. I.; HERNÁNDEZ, O.; WILLIAMS, T. 2002. Toxic effects of spinosad on predatory insects. Biological Control 23: 156-163. [ Links ]
DAGLI, F.; BAHSI, S. U. 2009. Topical and residual toxicity of six pesticides to Orius majusculus. Phytoparasitica 37: 399-405. [ Links ]
DHADIALLA, T. S.; CARLSON, G. R.; LE, D. P. 1998. New insecticides with ecdysteroidal and juvenile hormone activity. Annual Review of Entomology 43: 545-569. [ Links ]
DISBURY, M.; CANE, R. P.; HAW, J. M.; GILMER, S. E.; GARNER, S. J. 2004. Field evaluation of spinosad for control of the willow sawfly (Nematus oligospilus) in Hawke`s bay. New Zealand Plant Protection 57: 244-247. [ Links ]
ELZEN, G. W. 2001. Lethal and sublethal effects of insecticides residues on Orius insidiosus (Hemiptera: Anthocoridae) and Geocoris punctipes (Hemiptera: Lygaeidae). Journal of Economic Entomology 94: 55-59. [ Links ]
FISK, T.; WRIGHT, D. J. 1992. Comparative studies on acylurea insect growth regulators and neuroactive insecticides for the control of the army worm Spodoptera exempta (Walk). Pesticide Science 35: 175-182. [ Links ]
FLORES, G.; HILJE, L.; MORA, G. A.; CARBALLO, M. 2008. Antifeedant activity of botanical crude extracts and their frac-tions on Bemisia tabaci (Homoptera: Aleyrodidae) adults: I. Gliricidia sepium (Fabaceae). Revista de Biología Tropical 56: 2099-2113. [ Links ]
GOBBI, A.; BUDIA,F.; SCHNEIDER, M. I.; DEL ESTAL, P.; PINEDA, S.; VINUELA, E. 2000. Acción del tebufenocida sobre Spodoptera littoralis (Boisduval), Mythimna unipuncta (Haworth) y Spodoptera exigua (Hübner). Boletín de Sanidad Vegetal Plagas 26: 119-127. [ Links ]
GREENE, G. L.; LEPPLA, N. C.; DICKERSON, W. A. 1976. Vel-vetbean caterpillar: A rearing procedure and artificial medium. Journal of Economic Entomology 69: 487-488. [ Links ]
GUNNING, R. V; EASTON, C. S. 1994. Endosulfan resistance in Helicoverpa armigera (Hubner) (Lepidoptera: Noctuidae) in Australia. Australian Journal of Entomology 33: 9-12. [ Links ]
KALENDER, Y; UZUNFFLSARCIKLI, M.; OGUTCU, A.; SU-LUDERE, Z.; KALENDER, S. 2005. Effects of endosulfan on Thaumetopoea pityocampa (Lepidoptera: Thaumetopoeidae) larvae. Folia Biologica 53: 229-233. [ Links ]
LIU, Y; LU, Y.; WU, K.; WYCKHUYS, K. A. G.; XUE, F. 2008. Lethal and sublethal effects of endosulfan on Apolygus lucorum (Hemiptera: Miridae). Journal of Economic Entomology 101: 1805-1810. [ Links ]
LONGLEY, M.; JEPSON, P. C. 1996. The influence of insecticide residues on primary parasitoid and hyperparasitoid foraging behaviour in the laboratory. Entomologia Experimentalis et Applicata 81: 259-269. [ Links ]
MASCARENHAS, N.; BOETHEL, J. 1997. Responses of field-collected strains of soybean looper (Lepidoptera: Noctuidae) to selected insecticides using an artificial diet overlay bioassay. Journal Economic Entomology 90: 1117-1124. [ Links ]
MÉNDEZ, W. A.; VALLE, J.; IBARRA, J. E.; CISNEROS, J.; PENAGOS, D. I.; WILLIAMS T. 2002. Spinosad and nucleopolyhedrovirus mixture for control of Spodoptera frugiperda (Lepidoptera: Noctuidae). Biological Control 25: 195-206. [ Links ]
MILLAR, N. S.; DENHOLM, I. 2007. Nicotinic acetycholine receptors: targets for commercially important insecticides. Invertebrate Neuroscience 7: 53-66. [ Links ]
NATION, J. L. 2002. Insect physiology and biochemistry, CRC Publisher, New York. 560 p. [ Links ]
PINEDA, S.; SCHNEIDER, M. I.; SMAGGHE, G.; MARTÍNEZ, A. M.; DEL ESTAL, P; VINUELA, E.; VALLE, J.; BUDIA, F. 2007. Lethal and sublethal effects of methoxyfenozide and spinosad on Spodoptera littoralis (Lepidoptera: Noctuidae). Journal of Economic Entomology 100: 773-780. [ Links ]
RIMOLDI, F.; SCHNEIDER, M. I.; RONCO, A. E. 2012a. Short and long-term effects of endosulfan, cypermethrin, spino-sad, and methoxyfenozide on adults of Chrysoperla externa (Neuroptera: Chrysopidae). Journal of Economic Entomology 105: 1982-1987. [ Links ]
RIMOLDI, F.; FOGEL, M.; SCHNEIDER, M. I.; RONCO, A. 2012b. Lethal and sublethal effects of cypermethrin and me-thoxyfenozide on the larvae of Rachiplusia nu (Guenée) (Lepidoptera: Noctuidae). Invertebrate Reproduction & Development 53: 202-208. [ Links ]
ROSSETTI, M. R.; DEFAGÓ, M.; CARPINELLA, M. C.; PALACIOS, S. M.; VALLADARES, G. 2008. Actividad biológica de extractos de Melia azedarach sobre larvas de Spodoptera eridania (Lepidoptera: Noctuidae). Revista de la Sociedad Entomológica Argentina 67: 115-125. [ Links ]
SCHNEIDER, M. I.; SMAGGHE, G.; PINEDA, S.; VINUELA, E. 2008. The ecological impact of four IGR insecticides in adults of Hyposoter didymator (Hymenoptera: Ichneumonidae) pharmacokinetics approach. Ecotoxicology 17: 181-188. [ Links ]
SENASA. 2012. Endosulfan: nuevas medidas para la importación, elaboración y uso en Argentina. Disponible en: http://www.senasa.gov.ar Fecha revisión: 20 noviembre 2013. [ Links ]
STADLER, T.; BUTELER, M.; FERRERO, A. A. 2006. Susceptibilidad de endosulfán y monitoreo de resistencia en poblaciones de Piezodorus guildinii (Insecta, Heteroptera: Pen-tatomidae), en cultivos de soja de Argentina. Revista de la Sociedad Entomológica Argentina 65: 109-119. [ Links ]
STENERSEN, J. 2004. Chemical pesticides. Mode of action and toxicology. CRC Press, Florida. 296 p. [ Links ]
USMANI, K. A.; KNOWLES, C. O. 2001. Toxicity of pyrethroids an effect of synergists to larval and adult Helicoverpa zea, Spodoptera frugiperda, and Agrotis ipsilon (Lepidoptera: Noctuidae). Journal of Economic Entomology 94: 868-873. [ Links ]
VILLANUEVA, R. T.; WALGENBACH, J. F. 2006. Acaricidal properties of spinosad against Tetranychus urticae and Pa-nonychus ulmi (Acari: Tetranychidae). Journal of Economic Entomology 99: 843-849. [ Links ]
Recibido: 30-may-2014
Aceptado: 27-abr-2015
Citación sugerida:
RIMOLDI, F.; FOGEL, M. N.; SCHNEIDER, M. I.; RONCO, A. E. 2015. Efectos indirectos de insecticidas convencionales y biorra-cionales sobre la alimentación de Rachiplusia nu (Lepidoptera: Noctuidae). Revista Colombiana de Entomología 41 (1): 41-47. Enero-Junio 2015. ISSN 0120-0488.