Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.41 no.1 Bogotá Jan./June 2015
Morfología larval de Pseudodoros clavatus (Díptera: Syrphidae) y su eficiencia depredadora del pulgón Aphis craccivora (Hemiptera: Aphididae)
Larval morphology of Pseudodoros clavatus (Diptera: Syrphidae) and efficiency ass predator of Aphis craccivora (Hemiptera: Aphididae)
NATALY DE LA PAVA S.1 y PAULA A. SEPÚLVEDA-CANO2
1 Ingeniero Agrónomo. Joven Investigador Universidad del Magdalena, Santa Marta , Colombia. Autor para correspondencia. Carrera 32 n.º 22 - 08 Hangar
B, Laboratorio de entomología (Puerta 2). natalydlp@gmail.com.
2 Ph. D. docente T.C Universidad del Magdalena, Santa Marta, Colombia Carrera 32 n.º 22 - 08 Hangar B, Laboratorio de Entomología (Puerta 2). sepulveda_cano@yahoo.es.
Resumen: Las larvas de sírfidos afidófagos (Diptera: Syrphidae: Syrphinae) tienen estructuras bucales fuertemente esclerotizadas que les permiten capturar y alimentarse de sus presas. Para considerar las larvas del sírfido Pseudodoros clavatus como depredadores eficientes, se analizó inicialmente la morfología de las partes bucales y, en segundo lugar, se evaluó el potencial como controlador biológico de Aphis craccivora. Se encontró que las partes bucales se componen de dos grupos de escleritos dentales, y además posee dos elementos exteriores o escleritos triangulares los cuales están ausentes en el primer estadio, aparecen en el segundo y permanencen en el tercero. Esta estructura probablemente sirve para anclar la parte anterior del depredador dentro de la presa lo que impide su escape. La succión se caracterizó por un movimiento activo del esqueleto cefalofaríngeo y un movimiento peristáltico del abdomen. Para evaluar la respuesta funcional de la especie, se estableció la cría de este depredador a partir de las larvas y adultos obtenidos en campo y se realizaron pruebas con diversas densidades de la presa (10, 20, 30 áfidos) y el depredador (1, 2, 3 larvas de tercer estadio). Los Resultados sobre depredación se observaron a las 24 horas y revelaron que a mayor presencia de áfidos más consumo por parte de las larvas. Se observó aproximadamente un 100% de depredación cuando se utilizan dos o más individuos.
Palabras clave: Syrphidae afidófago. Aphis craccivora. Moscas de las flores. Control biológico. Piezas bucales.
Abstract: The larvae of aphidophagous hoverflies (Diptera: Syrphidae: Syrphinae) have bly sclerotized mouthparts that allow them to capture and eat their prey. To consider the larvae of the syrphid Pseudodoros clavatus as efficient predators, the morphology of larval mouthparts was analyzed and larvae were evaluated as potential biological control of Aphis craccivora. As a result, mouthparts are composed by two groups of dental sclerites, corresponding to the tento pharyngeal and hypopharyngeal sclerite. Mouthparts have two outer elements or triangular sclerites which are absent in the first instar, appear in the second and remains in the third instar. This structure probably works to anchor the front part of the predator in the dam that prevents its scape. Suction is characterized by an active movement of the cephalopharyngeal skeleton and a peristaltic movement of the abdomen. In assessing the functional response of the species, the breeding of this predator was established departing from the larvae and adults obtained in the field, test were done with different prey density (10, 20, 30 aphids) and different predator densities (1, 2, 3 third-instar larvae). The results of predation assays were observed on 24 hours showing that a bigger the presence of aphids, bigger the consumption of the larvae. A 100% of predation was observed when two or more individuals were used.
Key words: Aphidophagous Syrphid. Aphis craccivora. Hoverflies. Biological control. Mouthparts.
Introducción
Los sírfidos son una familia importante de dípteros debido a que algunos, en fase adulta, son polinizadores de plantas y otros, en estados preimaginales, son controladores biológicos de insectos fitófagos como pulgones o áfidos (Auad 2003; Chambers y Adams 1986; Cevallos 1973). Los sirfidos afidófagos son especies voraces cuya aparición en las plantaciones depende de la presencia y abundancia de colonias de áfidos; sus larvas pueden llegar a consumir miles de sus presas en un par de semanas (Schneider 1969) como es el caso de Pseudodoros clavatus (Fabricius, 1794), una de las especies más abundantes e importantes en la reducción de áfidos en América del Sur (Auad 2003; Goncalves y Goncalves 1976) Estados Unidos (Florida) (Michaud 1999) y las islas del Caribe (White 1995). Díaz et al. (2004) reportaron su interacción con los siguientes áfidos: Aphis craccivora (Koch, 1854), A. gossypii (Glover, 1877), A. illinoisensis (Schimer, 1866), A. nerii (Boyer de Fonscolombe, 1841), A. spiraecola (Patch, 1914), Myzuspersicae (Sulzer, 1776), Rhopalosiphum maidis (Fitch, 1856), Toxoptera citricida (Kirkaldy, 1907), T. auran-tii (Boyer de Fonscolombe, 1841); también es conocida por su capacidad de depredar cochinillas (Freitas 1982) y psílidos como Diaphorina citri (Kuwayama, 1908) (Michaud 2002). La mayor parte de las plagas conocidas depredadas por este sírfido son insectos fluidófagos que ocasionan pérdidas económicas en cultivos agrícolas, principalmente en cítricos y hortalizas (Díaz et al. 2004).
Belliure y Michaud (2001) evaluaron los aspectos básicos sobre la biología y el comportamiento del adulto, mostrando el potencial de este sírfido en el control de T. citricida y A. spiraecola en cultivos de cítricos. Con relación a la morfología de las larvas y los adultos de P. clavatus son relevantes, la descripción de Heiss (1938) del último estadio y la pupa, y la descripción del adulto y el último estadio de Freitas (1982).
En el Caribe colombiano es común observar plantas de fríjol caupí (Vigna unguiculata L. Walp, 1843) atacadas por colonias del áfido A. craccivora, las cuales son controladas naturalmente por las larvas de dos Syrphidae: Ocyptamus sp. y P. clavatus y, en ocasiones, por larvas de Coccinellidae (De la Pava y Sepúlveda, datos sin publicar), sin embargo, se desconocen aspectos sobre su biología y comportamiento.
En este contexto, este trabajo tiene como finalidad contribuir al conocimiento de la morfología de los tres estadios de la especie y su eficiencia como depredador de las colonias del pulgón A. craccivora en condiciones controladas.
Materiales y métodosEl trabajo se realizó en las instalaciones del laboratorio de Entomología de la Universidad del Magdalena, ubicado en el Distrito de Santa Marta, Colombia.
Cría y descripción de los estados inmaduros de P. clavatus.La cría de P. clavatus se estableció en mayo de 2013, las larvas y pupas del sírfido se recolectaron de parcelas de frijol caupí (V unguiculata) en el Centro de Desarrollo Agrícola y Forestal de la Universidad del Magdalena (11°13'28,98"N 74°11'5,33"O, 21 msnm) infestadas con colonias de A. crac-civora.
Las hembras se mantuvieron en una caja de cría (Bug Dorm 2) -de 61 x 61 x 61 cm, auto-soportada por dos varas de fibra de vidrio sólida de 54.6 cm por arco- con una planta de frijol caupí infestada con el áfido para propiciar la ovopo-sición; para la alimentación de los adultos se incorporó solución de agua estéril, azúcar moreno y miel (1:2:2) en una caja Petri provista de gasa y en otra se suministró polen comercial triturado. La cría se mantuvo en condiciones ambientales controladas a una temperatura promedio de 26 °C día y 22 °C noche, 70% de humedad relativa y un fotoperiodo 12/12. Las plantas de la cámara de cría se cambiaron cada 24 h con el fin de suministrar nuevas colonias de áfidos y aislar las larvas recién emergidas, debido a que la oviposición se detiene cuando hay un número de posturas que cubren cerca del 60% de la planta y a que las larvas emergen casi 12 h después de la oviposición. Las larvas de sírfido emergidas sobre la planta se transfirieron a cajas Petri plásticas (5 cm diámetro) provistas de una hoja de fríjol con pulgones, colocando cuatro larvas por caja como máximo, debido a que al incrementar este número se observó canibalismo. Las pupas se transfirieron a una caja Petri (8 cm de diámetro) hasta la emergencia del adulto y, posteriormente, se usaron para renovar el pie de cría. Con 22 de las larvas procedentes de la cría se realizó la descripción de caracteres morfológicos de los estadios, realizando la medición con un microscopio binocular Axio Lab. A1 con una cámara AxioCam ERc 5s adaptada a él. Para la descripción se usó la terminología propuesta por McAlpine et al. (1981), Rotheray (1993) y Lemke et al. (2009).
Evaluación de la respuesta funcional de Pseudodoros clavatus. Con el fin de evaluar el comportamiento depredador de P. clavatus, se siguió la metodología propuesta por Emmen y Quiros (2006). Para tal fin se usaron larvas de tercer estadio dejadas sin alimentación durante 12 horas. Posteriormente, se ubicaron diferentes densidades del depredador (1, 2, 3 larvas) dentro de cajas Petri plásticas (8,5 cm de diámetro) con una hoja fresca de frijol caupí y se incorporaron diferentes densidades (10, 20, 30) de áfidos. Se establecieron cinco réplicas por cada tratamiento, para un total de 45 unidades experimentales. La información sobre áfidos consumidos se tomó 24 horas después.
Análisis de los datos. Debido a que los datos de depredación de P. clavatus sobre A. craccivora violaron el supuesto de normalidad y homocedasticidad de varianzas al realizar las prueba de Shapiro Wilk y Kolmogorov-Smirnov, se sometieron a una prueba de Kruskal-Wallis y otra de U de Mann-Whitney para dos variables categóricas - A: tres densidades de la presa y B: tres densidades del depredador - y su interacción. Los análisis se realizaron utilizando el programa Statistix 9.
Resultados
Las características morfológicas del tercer estadio y pupa de P clavatus correspondieron a las descritas por Heiss (1983), sin embargo, con el fin de complementar la información sobre algunos caracteres y ofrecer herramientas para la diferenciación de los primeros dos estadios se realizó una descripción detallada del aparato bucal y de algunas características corporales generales para los tres estadíos larvales.
Todos los estadios presentaron forma cilíndrica y un amplio número de espinas a lo largo de toda la cutícula y sen-silios segmentados a la altura de los pliegues del tegumento (Fig. 1). Una descripción detallada de la quetotaxia del tercer estadio se puede revisar en Arcaya (2012). Las larvas tienen coloración gris-verdosa con una línea mesal blanca, seguida por dos líneas laterales naranja, acentuadas por un borde poco definido de coloración negra; estos colores no son cuticulares -puesto que ésta es transparente-, sino que corresponden a la pigmentación de órganos y sustancias internas.
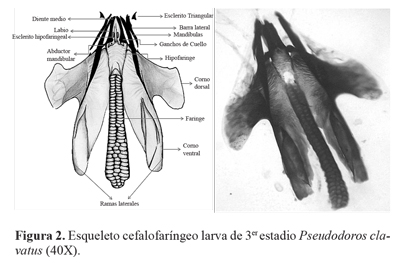
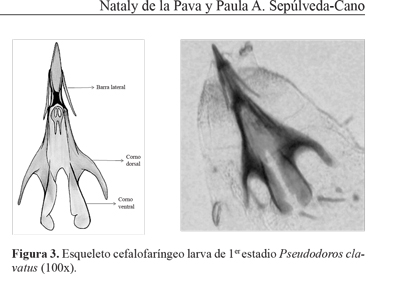
Descripción del aparato bucal. El esqueleto cefalofaríngeo de la larva está formado por dos elementos de soporte de la boca y la faringe; las partes implicadas más importantes son: el esclerito basal (o tentorofaringeal), el esclerito hipofarin-geal y las mandíbulas (Fig. 2). El basal consiste en un par de escleritos reclinables en forma de U a ambos lados de la faringe, los dos brazos de cada uno se conocen como cornos (astas) dorsal y ventral; ambos cornos ventrales se fusionan a cada lado con la faringe y proporcionan una adecuada superficie para la fijación de los músculos mandibulares y labial (McAlpine et al. 1981). El esclerito hipofaringeal está constituido por la fusión de varias estructuras entre ellas la hipofaringe y el esclerito labial. Las mandíbulas son fuertemente esclerotizadas, éstas se articulan con las barras laterales del esclerito hipofaringeal (McAlpine et al. 1981) y sirven de sostén para las estructuras de las partes externas (esclerito triangular, barras laterales, labrum y labio) y como una estructura que contribuye a llevar el alimento hacia el intestino (Tinkeu y Hance 1998). Las barras laterales están presentes desde el primer estadio, su longitud parece sugerir una extensión de la apertura de la boca (Bhatia 1939). Los escleritos triangulares están presentes sólo en larvas afidófagas y en Microdontini y tienen como función anclarse en la cutícula de la presa durante el proceso de alimentación evitando que escapen (Rotheray 1993). Algunas estructuras, tales como las barras laterales y los escleritos triangulares, están claramente vinculados a la actividad depredadora de larvas afidófagas (Tinkeu y Hance 1998).
Primer estadio. la larva longitud de 2,5 mm y 1 mm de ancho, llega a medir 4,5 mm y 1,5 mm de ancho antes de cambiar de estadio (n = 8). Lóbulo antenomaxilar bien desarrollado; palpos maxilares tan largos como las antenas; esqueleto cefalofaríngeo de 0,29 ± 0,12 mm (n = 3). Piezas bucales fusionadas, siendo posible diferenciar únicamente las estructuras del esclerito basal y las barras laterales (Fig. 3); esclerito triangular ausente, lo que puede explicar el comportamiento de elevación de las larvas durante la alimentación en éste estadio. Ganchos bucales internos inconspicuos.
Segundo estadio. Longitud promedio de la larva 5,7 mm y 1,7 mm de ancho (n = 8); esqueleto cefalofaríngeo totalmente desarrollado, éste difiere del tercer estadio únicamente en el tamaño siendo de 0,79 ± 0,05 mm (n = 6); mandíbulas de 0,44 ± 0,04 mm (n = 6). Ganchos bucales internos débilmente esclerotizados. La principal característica del segundo estadio es la aparición del esclerito triangular.
Tercer estadio. Longitud de 7,3 mm y 2,7 mm de ancho (n = 5). Ganchos bucales internos totalmente esclerotizados; labio con disposición ventral; las dos barras laterales conspicuas; mandíbulas con un solo diente curvado. Los cornos dorsales y ventrales ensanchados y pareados, éstos sostienen la cavidad faringeal. Escleritos triangulares esclerotizados, ubicados cerca de la boca (Fig. 2). Esclerito cefalofaríngeo de 0,85 ± 0,05 mm de largo (n = 6); mandíbulas de 0,46 ± 0,02 mm (n = 6) de largo.
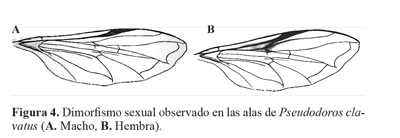
Los adultos mostraron dimorfismo sexual, desatacándose a simple vista rasgos como: una coloración ligeramente amarilla del VIII terguito abdominal del macho ausente en las hembras, las cuales a partir del terguito VI carecen de esa pigmentación como lo registró Freitas (1982). Además, el ala del macho presenta una mácula castaña que ocupa toda la celda subcostal, mientras que en las hembras esta mancha se difumina sobre la base de la primera vena radial (q) y la r2+3 (n = 20) (Fig. 4). Estos aspectos hacen posible diferenciar a simple vista los sexos, facilitando las labores de cría del depredador.
Evaluación respuesta funcional de Pseudodoros clavatus. En general, el proceso de captura de la presa se produjo inmediatamente después del reconocimiento por contacto por parte de la larva del sírfido y la succión se caracterizó por un movimiento activo del esqueleto cefalofaríngeo y otro peristáltico del abdomen.
Con respecto a la eficiencia depredadora de las larvas de tercer estadio de P. clavatus ante diferentes densidades de la presa (A. craccivora), al realizar la prueba de Kruskall Wallis no se obtuvieron diferencias significativas (P > 0,05) entre el consumo y el número de depredadores, mientras que si se presentaron diferencias entre la densidad de presas y el consumo (P < 0,05); la prueba pareada de Mann-Whitney indicó que existen diferencias entre todos los tratamientos. Como se observa en la tabla 1 el mayor consumo se alcanza cuando se emplean dos larvas por unidad experimental, en ese sentido, es importante señalar que en los tratamientos con tres depredadores se presentó canibalismo, aun con las densidades más altas de presa (30).
Discusión
Existen pocos trabajos con relación a la morfología de las larvas de P clavatus; se destacan los de Heiss (1938) y Freitas (1982) quienes realizaron una descripción e ilustración de las características del tercer estadio, pupa y adulto. Las larvas de dípteros Cyclorrhapha no poseen cabeza distintiva, en su lugar poseen un pseudocefalo el cual contiene los órganos sensoriales, faringe y aparato depredador (Tinkeu y Hance 1998). El desarrollo de los diferentes estadios de P clavatus se caracteriza por un aumento en el tamaño corporal, la morfología y esclerotización del esqueleto cefalofaríngeo, al igual que la eficiencia en la depredación, reportado también para Rachiptera limbata (Frías, 2008) y Episyrphus balteatus (Tinkeu y Hance 1998) y la aparición de un par de escleritos triangulares propios de larvas afidófagas (Rotheray 1993).
Las machos confinados de P. clavatus formaron "lek" en una de las caras superiores de la jaula, de donde las hembras seleccionaron a su pareja para cópula; esta conducta fue descrita para ésta y otras especies de Syrphidae (Belliure y Michaud 2001; Gilbert 1984). Los periodos de cópula y oviposición se concentraron de 06:00 a 07:00, 10:00 a 12:00 y de 17:00 a 18:30 h coincidiendo con lo reportado por Belliure y Michaud (2001) para esta especie criada con A. spiraecola. La hembra de P. clavatus ovipositó en los tejidos de la planta colonizados por A. craccivora, nunca en tejidos limpios o sólo con residuos de miel de rocío. En un trabajo similar se demuestra la ausencia de oviposición en plantas sin áfidos para Platycheirus fulviventris (Macquart) (Rotheray 1987) y Episyrphus balteatus (De Geer) (Bhat y Ahmad 1988).
Para la producción de huevos viables se requirió de una dieta suplementada con polen, el cual incrementó la longevidad de los especímenes. Se ha demostrado para P. clava-tus que cuando las hembras se privan de este elemento no ovipositan o los huevos no se desarrollan bien (Belliure y Michaud 2001). Holloway (1976) sugiere que varias especies de Syrphidae necesitan de los aminoácidos del polen y que la cantidad consumida modifica su comportamiento e incluso morfología. El polen es una fuente rica de nitrógeno (Panizzi y Parra 2012) y proteínas, requerido por la mayoría de las hembras durante las fases tempranas del desarrollo ovárico, consumiendo generalmente más este recurso que los machos, como lo revelan los Resultados obtenidos por Haslett (1989) para Rhingia campestris (Meigen,1822).
Las larvas de P. clavatus alimentadas con A. craccivora presentaron tres estadios, los dos primeros con una duración de un día y un tercero de dos a tres días a 22 °C - 26 °C (n = 45), lo que coincide con lo reportado por Auad (2003) para esta especie alimentada con Schizaphis graminum (Rondani, 1852) y Schneider (1969) para otros sírfidos afidófagos. Las larvas emergieron tras 24 horas de la oviposición y cuando no se individualizaron se observó canibalismo frecuente en las larvas recién emergidas, este comportamiento ha sido descrito para otros sirfidos (Branquart et al. 1997) y ha sido revelado previamente por Belliure y Michaud (2001) para esta especie en específico, se observó que con altas densidades de áfidos el canibalismo se reduce al igual que al incrementar su edad, posiblemente porque su eficiencia aumenta y ubica con mayor precisión a la presa (Chambers 1988) evitando alimentarse de sus congéneres.
Los Resultados del estudio demuestran el potencial de P clavatus como controlador biológico de A. craccivora dado que la mayor densidad incorporada de la plaga fue insuficiente para satisfacer al depredador en 24 horas de consumo. Resultados similares se reportaron para Ocyptamus gastros-tactus (Wiedemann, 1830) con las mismas densidades del áfido usadas en este trabajo (Emmen y Quirós 2006). Ten-humberg (1995) demostró que la eficiencia de depredación es directamente proporcional a la infestación de áfidos, dado al incremento en el tiempo de búsqueda los depredadores son capaces de adaptar su tasa de alimentación a la fuente de alimento real, como lo evidencia el trabajo de Torrealba y Ar-caya (2014), donde el consumo de P. clavatus se incrementó a medida que se le ofreció un mayor número de presas con densidades de 30, 40, 50, 60, 80 y 100 individuos de A. crac-civora.
Solo hasta 2004 se registró la actividad depredadora de P clavatus sobre colonias del áfido A. craccivora en Venezuela (Díaz et al. 2004); éste es el primer registro para Colombia de la acción de P. clavatus sobre este pulgón en plantas de frijol caupí (V. unguiculata). Dado el potencial depredador de esta especie y la escasa información sobre sus relaciones ecológicas, sería importante evaluar su desempeño en diferentes cultivos y especies de áfidos, debido a que tanto la planta hospedera como el pulgón del que se alimentan, modifican considerablemente el comportamiento sexual y reproductivo de varios sírfidos (Díaz et al. 2004; Almohamad et al. 2007).
AgradecimientosEsta investigación se realizó con el apoyo de la Universidad del Magdalena, Colciencias y el Programa Jóvenes Investigadores e Innovadores -convenio Colciencias- UNIMAGDA-LENA No. 0739 de 2012.
Literatura citadaALMOHAMAD, R.; VERHEGGEN, F. J.; FRANCIS, F.; HAU-BRUGE, E. 2007. Predatory hoverflies select their oviposition site according to aphid host plant and aphid species. Entomolo-gia Experimentalis et Applicata 125 (1): 13-21. [ Links ]
ARCAYA SÁNCHEZ, E. A. 2012. Tesis doctoral. Bionomía, diversidad y morfología preimaginal de sírfidos depredadores (Dipte-ra: Syrphidae) en el Estado Lara, Venezuela. Programa de Doctorado Biodiversidad: Conservación y gestión de las especies y sus hábitats. Importancia en el control biológico de plagas. Disponible en: http://rua.ua.es/dspace/handle/10045/26778. [Fecha revisión: 15 diciembre 2013] [ Links ].
AUAD, A. M. 2003. Aspectos biológicos dos estágios imaturos de Pseudodoros clavatus (Fabricius) (Diptera: Syrphidae) alimentados com Schizaphis graminum (Rondani) (Hemiptera: Aphi-didae) em diferentes temperaturas. Neotropical Entomology 32 (3): 475-480. [ Links ]
BHAT, M. R.; AHMAD, D. 1988. Observations on the biology of Episyrphus balteatus (Degeer) (Diptera: Syrphidae) in Kashmir. Bulletin of Entomology. New Delhi 29 (2): 216 - 217. [ Links ]
BHATIA, M. L. 1939. Biology, morphology and anatomy of aphi-dophagous syrphid larvae. Parasitology 31 (1): 78-129. [ Links ]
BRANQUART, E.; HEMPTINNE, J. L.; BAUFFE, C.; BENFE-KIH, L. 1997. Cannibalism in Episyrphus balteatus (Ditp.: Syrphidae). Entomophaga 42 (1-2): 145-152. [ Links ]
BELLIURE, B.; MICHAUD, J. P. 2001. Biology and behavior of Pseudodoros clavatus (Diptera: Syrphidae), an important pre-dator of citrus aphids. Annals of the Entomological Society of America 94 (1): 91-96. [ Links ]
CHAMBERS, R. J.; ADAMS, T. H. L. 1986. Quantification of the impact of hoverflies (Diptera: Syrphidae) on cereal aphids in winter wheat: an analysis of field populations. Journal of Applied Ecology 23 (3): 895-904. [ Links ]
CHAMBERS, R. J. 1988. Syrphidae. pp. 259-270. sqb. World crop pests: aphids, their biology, natural enemies and control, vol. B. Elsevier, Amsterdam, Países Bajos. [ Links ]
CEVALLOS, E. 1973. Allograpta exótica Wiedemann y Syrphus shorae Fluke, dos Syrphidae (Diptera) predatores de áfidos en maíz. Revista Peruana de Entomologia 16 (1): 24-29. [ Links ]
DÍAZ, F.; ARCAYA, E.; MARCOS-GARCÍA, M. 2004. Nuevos áfidos presa de Pseudodoros clavatus (Fabricius, 1794) (Dip-tera, Syrphidae) potencial agente de control biológico. Boletín de la Asociación Española de Entomología 28 (1-2): 245-249. [ Links ]
EMMEN, D. A.; QUIRÓS, D. I. 2006. Estudio preliminar sobre la capacidad de depredación de Ocyptamus gastrostactus (Diptera: Syrphidae) sobre Toxoptera citricida (Homoptera: Aphididae) en cítricos. Tecno Ciencia 8 (1): 153-165. [ Links ]
FREITAS, C. D. 1982. Estudo sobre os Syrphidae Neotropicais. I: redescrijao de Pseudodoros clavatus (Fabricius, 1974) (Diptera). Revista Brasileira de Biologia 42 (3): 583-587. [ Links ]
FRÍAS, D. 2008. Morphology of immature stages in the neotropical nonfrugivorous Tephritinae fruit fly species Rachiptera limbata Bigot (Diptera: Tephritidae) on Baccharis linearis (R. et Pav.) (Asteraceae). Neotropical Entomology 37 (5): 536-545. [ Links ]
GILBERT, F. S. 1984. Thermoregulation and the structure of swarms in Syrphus ribesii (Syrphidae). Oikos 42 (2): 249-255. [ Links ]
GONCALVES, C. R.; GONCALVES A. J. L. 1976. Observations on syrphid flies as predators of Homoptera. Anais da Sociedade Entomológica do Brasil 5 (1): 3-10. [ Links ]
HASLETT, J. R. 1989. Adult feeding by holometabolous insects: pollen and nectar as complementary nutrient sources for Rhin-gia campestris (Diptera: Syrphidae). Oecologia 81 (3): 361-363. [ Links ]
HEISS, E. M. 1938. A classification of the larvae and puparia of the Syrphidae of Illinois exclusive of aquatic forms. University of Illinois Bulletin 36 (1): 73-75. [ Links ]
HOLLOWAY, B. A. 1976. Pollen-feeding in hover-flies (Diptera: Syrphidae). New Zealand Journal of Zoology 3 (4): 339-350. [ Links ]
LEMMKE, S.; SCHMIDT-OTT, U. 2009. Evidence for a composite anterior determinant in the hover fly Episyrphus balteatus (Syr-phidae), a cyclorrhaphan fly with an anterodorsal serosa anlage. Development 136 (1): 117-127. [ Links ]
MCALPINE, J. F.; PETERSON, B. V.; SHEWELL, G. E.; TES-KEY, H. J.; VOCKEROTH, J. R.; WOOD, D. M. 1981. Manual of Nearctic Diptera. The Entomological Society of Canada 1 (27): 75-78 [ Links ]
MICHAUD, J. P. 1999. Sources of mortality in colonies of brown citrus aphid, Toxoptera citricida. Biocontrol 44 (3): 347-367. [ Links ]
MICHAUD, J. P. 2002. Biological control of Asian citrus psyllid, Diaphorina citri (Hemiptera: Psyllidae) in Florida: A prelimi-nary report. Entomological News 113 (3): 216-222. [ Links ]
PANIZZI, A. R.; PARRA, J. R. P. (Eds.). 2012. Insect bioecology and nutrition for integrated pest management. Taylor & Francis Group, LLC-Embrapa. 729 p. [ Links ]
ROTHERAY, G. E. 1987. Aphidophagy and the larval and pupal stages of the syrphid Platycheirus fulviventris (Macquart). Entomologist is Gazette 38 (3): 245-251. [ Links ]
ROTHERAY, G. E. 1993. Colour guide to hoverfly larvae (Diptera, Syrphidae) in Britain and Europe. Derek Whiteley. Dipterists Digest (9): 35-45. [ Links ]
SCHNEIDER, F. 1969. Bionomics and physiology of aphidopha-gous Syrphidae. Annual Review of Entomology 14 (1): 103-124. [ Links ]
TENHUMBERG, B. 1995. Estimating predatory efficiency of Episyrphus balteatus (Diptera: Syrphidae) in cereal fields. Environ-mental Entomology 24 (3): 687-691. [ Links ]
TINKEU, L. N.; HANCE, T. 1998. Functional morphology of the mandibles of the larvae of Episyrphus balteatus (De Geer, 1776) (Diptera: Syrphidae). International Journal of Insect Morphology and Embryology 27 (2): 135-142. [ Links ]
TORREALBA, J. A.; ARCAYA, E. A. 2014. Respuesta funcional de la larva de Pseudodoros clavatus (Fabricius, 1794) (Dipte-ra: Syrphidae) al áfido negro del matarratón Aphis craccivora Koch, 1854 (Hemiptera: Aphididae). Entomotropica 29 (1): 9-16. [ Links ]
WHITE, G. 1995. Natural enemies of Toxoptera citricida in Trinidad WI. In: Proceedings of the Third International Workshop on Citrus Tristeza Virus and Brown Citrus Aphid in the Caribbean Basin: Management Strategies. Lake Alfred, EEUU 41-43 p. [ Links ]
Recibido: 21-may-2014
Aceptado: 22-may-2015
Citación sugerida:
DE LA PAVA, N.; SEPÚLVEDA-CANO, P. A. 2015. Morfología larval de Pseudodoros clavatus (Diptera: Syrphidae) y su eficiencia depredadora del pulgón Aphis craccivora (Hemiptera: Aphididae). Revista Colombiana de Entomología 41 (1): 58-62. Enero-Junio 2015. ISSN 0120-0488.