Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Entomología
versión impresa ISSN 0120-0488
Rev. Colomb. Entomol. vol.41 no.1 Bogotá ene./jun. 2015
Evaluación del potencial insecticida del néctar de Spathodea campanulata (Bignoniaceae) sobre Sitophilus zeamais (Coleóptera: Curculionidae)
Evaluation of insecticide potential of Spathodea campanulata (Bignoniaceae) néctar on Sitophilus zeamais (Coleoptera: Curculionidae)
DENISE PAIVA FRANCO1, JÚLIO CÉSAR GUERREIRO2, MARCELO GUSTAVO RUIZ3y REGILDO MÁRCIO GONÇALVES DA SILVA1
1 Universidade Estadual Paulista (Departamento de Ciências Biológicas/Laboratório de Fitoterápicos), Avenida Dom Antônio 2100, CEP: 19806-900, Assis, SP, Brasil.
2 Universidade Estadual de Maringá - UEM, Departamento de Ciências Agronômicas, Campus de Umuarama. Estrada da Paca s/n, CEP: 87501-
190, Bairro São Cristóvão, Umuarama, PR, Brasil. jcguerreiro@uem.br. Autor para correspondencia.
3 Ph. D. Facultad de Ciencias Agrarias - Universidad Nacional del Comahue, C.C. 81, (8324) Cinco Saltos, Río Negro, Argentina.
Resumen: Spathodea campanulata es una especie de origen africano, introducida en el Brasil como árbol ornamental, cuyas flores producen gran cantidad de néctar que presenta toxicidad a los insectos. El presente trabajo tuvo por objetivo evaluar el potencial insecticida del néctar de S. campanulata mediante ensayos de mortalidad sobre Sitophilus zeamais en Assis, Estado de Sao Paulo, Brasil. La mayor concentración de azúcares en el néctar se encontró en flores recolectadas en el período vespertino. En todas las evaluaciones de mortalidad el tratamiento en que se utilizó la aspersión de néctar puro presentó diferencias estadísticamente significativas en relación a los demás tratamientos y al testigo. El tratamiento en que se utilizó la aspersión de néctar puro presentó control eficiente con 89% de mortalidad de la población de gorgojos.
Palabras clave: Planta insecticida. Terpenos. Eficiencia de control. Plaga. Gorgojo del arroz.
Abstract: Spathodea campanulata is an ornamental plant species native to Africa introduced to Brazil whose flowers produce large amounts of nectar that is toxic to insects. The aim of this work was to assess the insecticidal potential of S. campanulata nectar through mortality tests performed on Sitophilus zeamais in Assis, Sao Paulo State, Brazil. The highest sugar concentrations were recorded in nectar harvested from flowers in the evening. Pure nectar spray treatments showed a control efficiency of 89% of the insect population, which was a statistically significant difference as related to other nectar and control treatments.
Key words: Plant insecticide. Terpenes. Control efficiency. Pest. Rice weevil.
Introducción
La especie Spathodea campanulata P. Beav. (Bignoniaceae) es originaria de África desde donde fue introducida a Brasil como ornamental. Es conocida como "chama da floresta" en este país y como "tulipanero de Gabón" en países de habla hispana (Cintra et al. 2005). Es un árbol de porte medio (15 a 25 m de altura) que presenta flores carnosas de color rojo. Además del Brasil puede ser encontrada en varios países de América del Sur formando parte de las especies utilizadas en paisajismo (Joly 1985).
Además de su llamativa belleza y uso ornamental, esta especie ha merecido atención debido a sus propiedades medicinales y la utilización de sus compuestos como controladores naturales de plagas.
La medicina popular relata las propiedades diuréticas y antiinflamatorias de sus flores y el empleo de sus hojas contra enfermedades renales, inflamaciones de la uretra y como antídoto contra venenos. Preparaciones de la cáscara del tronco pueden utilizarse para el tratamiento de edemas, micosis, herpes, dolores de estómago y diarrea (Pianaro et al. 2007). Estudios fitoquímicos realizados con diferentes partes de S. campanulata demuestran la presencia de varios ácidos (espa-tódico, cafeíco, fenólicos), flavonoides, hidroxiesterol espa-todol y P-sitosterol (Subramanian et al. 1973; Ngouela et al. 1990; El-Hela, 2001a, 2001b).
Sus flores producen gran cantidad de néctar y son polinizadas por aves, lémures y murciélagos. El néctar atrae a sus polinizadores y animales oportunistas pero, debido a características adaptativas de la planta, puede resultar tóxico para otros organismos que no tienen acción directa en la polinización (Gentry 1974; Sussman y Raven 1978; Trigo y Santos 2000; Cintra et al. 2005).
De acuerdo con Davis et al. (1998) el néctar está constituido por carbohidratos, proteínas, aminoácidos, una compleja mezcla de terpenoides y esteroides, además de componentes volátiles como 1-octen-3-ol y 1-octen-3-ona. Estos últimos actúan de forma similar a feromonas de insectos.
En lo que se refiere a la toxicidad de S. campanulata a insectos, es posible relacionar la mortalidad de abejas, mosquitos y hormigas con la entrada de los mismos a las inflorescencias de la planta. De acuerdo con Queiroz et al. (2014) ésta puede deberse a la presencia de sustancias mucilaginosas junto al néctar en botones florales y flores jóvenes. El mismo autor indica que la mayoría de los insectos muertos encontrados en las flores estuvo compuesta por especies de abejas, las que no actúan como polinizadoras de la planta.
El gran desafío del manejo integrado de plagas es el uso más racional de los insecticidas y la búsqueda incesante de métodos de control menos dañinos para el medio ambiente y la salud de agricultores y consumidores. Las sustancias producidas por el metabolismo secundario de las plantas pueden presentar actividades biológicas variadas. El énfasis en el reconocimiento de estos compuestos para la supresión de insectos se debe sus propiedades insecticidas, repelentes, disuasivas o inhibidoras de la alimentación (Saito et al. 2004).
En este contexto, extractos vegetales con acción insecticida son históricamente conocidos y utilizados en el control de insectos. Ejemplos de ello son el piretro, sustancia extraída de las flores de Chrysanthemum cinerariaefolium Vis. cuyo uso como insecticida se inició en Persia; la rotenona, presente en las raíces de Lonchocarpus spp., Derris spp. que fuera utilizada por primera vez en 1848 y la azidaractina, presente en Azadirachta indica A. Juss. y utilizada desde hace siglos en la India (Isman 2006).
Sitophilus zeamais Motschulsky, 1855 (Coleoptera: Cur-culionidae) es una de las plagas más importantes de productos almacenados. Su control se ha realizado a través de plaguicidas químicos, sin embargo, el uso de insecticidas de origen vegetal puede tener una influencia positiva al reducir la contaminación ambiental y la residualidad de venenos en los en los granos mejora efectivamente la calidad de sus productos (Tavares y Vendramim 2005).
Las investigaciones actuales buscan sustancias vegetales que promuevan un control de insectos plaga más eficiente y que atiendan las leyes ambientales vigentes. Por lo expuesto se evidencia la importancia del estudio de compuestos naturales con acción insecticida. Así, el presente trabajo tuvo por objeto evaluar el potencial insecticida del néctar de S. campa-nulata mediante ensayos de mortalidad sobre S. zeamais.
Materiales y métodosRecolección y acondicionamiento del néctar de S. campa-nulata. Las flores de S. campanulata se recogieron y se llevaron al laboratorio donde, con la ayuda de una aguja y jeringa, el néctar fue extraído. Este material se recogió en ejemplares de S. campanulata situados en el tejido urbano de la localidad de Assis, Estado de Sao Paulo, Brasil (22°39'42,33"S 50°24'49,51"O). Previamente fue determinada por refracto-metría la concentración de azúcares en el mismo, a fin de establecer el momento de su mayor concentración a lo largo del día.
Para protegerlas de la acción del viento, de los depredadores y de los visitantes, las inflorescencias se colocaron en bolsas de tela de malla, para asegurar la calidad del néctar. Una vez determinado el período de mayor concentración de azúcares, el néctar se recolectó a partir de flores abiertas y botones florales parcialmente abiertos. Una parte de este material, que tiene la apariencia física de un líquido transparente, se sometió a congelamiento y liofilización y otra se mantuvo en estado natural (puro) para su uso en los ensayos de potencial insecticida.
Tratamiento estadístico de la concentración de azúcares en el néctar de S. campanulata. Para este fin se utilizó el programa Bioestat, realizándose las pruebas de normalidad de Shapiro-Wilks y de homogeneidad de Levene, análisis de varianza por medio de la prueba de F (Anava) y las medias comparadas mediante el test de Tukey a 5% de significancia.
Ensayo insecticida de soluciones del néctar de S. campanulata
Obtención y cría de los insectos. En los ensayos de efecto insecticida del néctar de S. campanulata se utilizó la plaga S. zeamais, criada sobre granos de maíz (Zea mais L.) en frascos plásticos de boca ancha cubierta con una malla perforada, de 1L de capacidad. El pie de cría de S. zeamais provino de la producción en masa que mantiene el Laboratorio de Fito-sanidad de la Universidad Estadual Paulista (UNESP) en la localidad de Jaboticabal, Estado de Sao Paulo, Brasil, asegurando la calidad y procedencia de los ejemplares utilizados en los experimentos. Los insectos se tomaron al azar y se confinaron sin alimento durante las 3h previas al establecimiento de los ensayos, de acuerdo con la metodología descrita por Prates y Santos (2000).
Evaluación de la acción insecticida por aplicación tópica.
Se utilizaron cajas de Petri en las que se colocaron 20 insectos adultos y 20 semillas (de maíz) previamente esterilizadas con hipoclorito de sodio al 10%, realizándose posterior a la aspersión correspondiente. Se utilizó un diseño experimental completamente aleatorizado con 18 repeticiones. Los tratamientos consistieron en soluciones de néctar, a las concentraciones de 5, 10, 20, 100% (néctar puro) y agua destilada en el grupo control.
Las aspersiones se realizaron sobre los insectos en las cajas de Petri utilizando un aspersor manual con capacidad para 600 mL asegurando una aplicación de 1,5 ± 0,5 mL por cm2. La calibración del pulverizador se realizó mediante la pulverización de agua sobre discos de papel de filtro que fueron pesados antes y después de las aplicaciones. El promedio de las diferencias entre ambos valores fue utilizado como patrón (Hassan 1997). El ensayo fue realizado en condiciones de laboratorio, con temperatura de 25 ± 2 °C, humedad relativa del aire de 70 ± 2 % y foto-período de 12:12 h. Se registró la mortalidad de los insectos cada 12 h durante las primeras 72 h posteriores al tratamiento.
Tratamiento estadístico de la evaluación insecticida. Se utilizó el programa computacional Assistat 7.6 Beta. Se realizaron las pruebas de normalidad (Shapiro-Wilks) y homogeneidad (Levene) y cuando necesario se transformaron los datos, mediante raíz de x + 0,5. A continuación se hizo un análisis de varianza (Anava) y los valores medios se compararon por medio de la prueba de Tukey al 5% de significancia. La determinación de la eficiencia de las dosis del néctar de S. campanulata se realizó mediante la metodología establecida por Abbott (1925). Con los datos así obtenidos se estableció la curva de regresión dosis-respuesta para concentración de néctar y mortalidad.
Resultados y Discusión
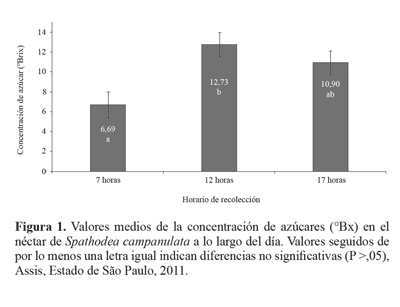
Concentración de azúcares en el néctar de S. campanu-lata. La concentración de azúcares en el néctar de las flores varió con el momento del día en que se lo recolectó (Fig. 1). Las mayores concentraciones se registraron a las 12 y 17 h, con valores medios de 12,73 y 10,90 °Brix, respectivamente, y se recogió aproximadamente 80% del total de néctar que se encuentra en cada flor.
La producción de néctar y el aumento de su concentración están asociados a factores climáticos como temperatura y humedad, tal como en Baker y Baker (1983). En condiciones climáticas adversas, tales como bajas temperaturas y alta humedad relativa ambiente, el néctar presenta baja concentración de azúcares; en condiciones opuestas la concentración aumenta.
La mayor concentración de azúcar presente en el néctar de S. campanulata puede influenciar la presencia de insectos polinizadores y oportunistas. Es por eso que según Funari et al. (1996); Pegoraro y Chaves-Neto (2005), el mayor número de visitas de insectos polinizadores se produce al iniciarse el período vespertino, existiendo de este modo correlación positiva entre ambos factores.
Ante los Resultados obtenidos en este experimento se dio prioridad a la recolección de néctar en el período vespertino para la realización del experimento de aspersión, período coincidente con la mayor concentración de azúcares en el néctar, caracterizando indirectamente la presencia de mayores proporciones de sustancias tóxicas para los insectos.
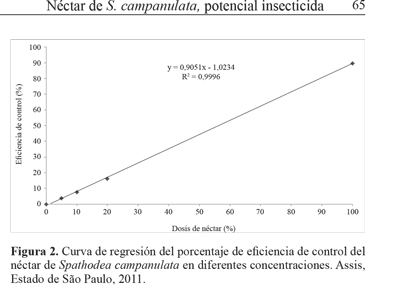
Experimento de aspersión de néctar de S. campanulata.De modo general se perciben diferencias significativas en términos de acción insecticida y eficiencia en el control de insectos entre los tratamientos ensayados (Tablas 1 y 2 y Fig. 2). Cuando de observa la diferencia estadística del número medio de ejemplares de S. zeamais muertos en relación al tipo de tratamiento utilizado (Tabla 1) en el primer recuento, 12 horas después de la aplicación, el tratamiento con néctar puro presentó un resultado estadísticamente significativo y distinto, en comparación con el resto de los tratamientos y el testigo, con un valor medio de ocho insectos muertos en cada unidad experimental.
Al evaluar el experimento de forma comparada (Tabla 2) es posible observar el aumento de la eficiencia de control en los tratamientos de acuerdo con la mayor concentración de néctar aplicada. En el primer período de evaluación tras la pulverización (12 h) el néctar puro mostró una eficiencia de control cercana al 40% en comparación con el tratamiento testigo.
Al aumentar el lapso evaluación se observa que el tratamiento con néctar puro mantiene el nivel de mortalidad, distinguiéndose de los demás tratamientos utilizados. La mortalidad media fue de 17,94 insectos en la última evaluación, con eficiencia de control cercana al 90%.
Con base en los Resultados con la mayor concentración de néctar, puede afirmarse que tuvo una eficiencia semejante a la observada para insecticidas sintéticos (Gallo et al. 2002). Las concentraciones consideradas intermedias en este ensayo (10 y 20%), mostraron siempre mayor mortalidad que las correspondientes a la menor concentración y al testigo. Sin embargo no igualan al néctar puro en ninguna observación.
Las mayores mortalidades medias encontradas para las concentraciones de 10 y 20% fueron 1,50 y 3,22 insectos muertos, respectivamente. Estos tratamientos presentaron baja eficiencia de control, con valores siempre inferiores a 16% de mortalidad (Tablas 1 y 2). Esta es la concentración mínima de solución de néctar necesaria para eliminar al 80% de los insectos en ensayo. En el modelo encontrado (Fig. 2), una dosis aproximada a los 72% de concentración produce una mortalidad comparable a la de insecticidas sintéticos y este valor, estimado mediante regresión linear, de acuerdo con Barros et al. (2005) y Procópio et al. (2003) es satisfactorio para el control de plagas cuando se utilizan insecticidas químicos.
La mortalidad de S. zeamais observada puede estar relacionada con la presencia de compuestos químicos secundarios en el néctar de S. campanulata. De acuerdo con Flach (2005), el néctar de esta especie está constituido por una mezcla de terpenos y esteroides. Gershenzon y Croteau (1992) establecieron que la clase química de los terpenos presenta toxicidad para mamíferos y muchos insectos herbívoros, con lo que ejercen importantes funciones de defensa en el reino vegetal. Como ejemplo pueden citarse los ésteres de monoterpeno las piretrinas, encontrados en hojas y flores de Chrysanthemum cinerariaefollium Vis. que presentan gran actividad insecticida (Macconn et al. 1997; Trapp y Croteau 2001). Estos mismos autores demostraron que algunas coní-feras, como pinos y abetos, acumulan monoterpenos en los canales resiníferos que resultan tóxicos para un gran número de insectos. La azidarachtina que es, posiblemente, la sustancia insecticida más conocida y eficaz, es obtenida a partir de Azadirachta indica A. Juss. ("nim") y se trata de un complejo limonoide que pertenece al grupo de los triterpenos (Aerts y Mordue 1997).
En referencia a los esteroides de origen vegetal, las fi-toecdisonas constituyen un grupo de éstos con una estructura básica similar a la de las hormonas de la muda de los insectos, de donde la ingestión de fitoecdisonas produce ellos la interrupción de la muda y otros procesos de su desarrollo, muchas veces con consecuencias letales (Taiz 2004). En vista de lo expuesto se puede inferir que posiblemente terpenos y esteroides presentes en el néctar de S. campanulata están relacionados con la toxicidad actuando directamente en el control y muerte de los insectos utilizados en el ensayo, y que la extracción controlada de estos compuestos naturales podría ser útil como estrategia de control de plagas.
ConclusionesDe la experiencia realizada se concluye que la concentración de azúcares (°Bx) en el néctar de Spathodea campanulata a lo largo del día puede ser variada y que sus concentraciones más altas se dan en el período vespertino. El tratamiento de aspersión de néctar puro produjo un control tan eficiente como el de un producto químico en la población del gorgojo del arroz, S. zeamais.
Literatura citadaABBOTT, W. S. 1925. A method for computing the effectiveness of an insecticide. Journal Economic Entomology 18: 265-267. [ Links ]
AERTS, R. J.; MORDUE, A. J. 1997. Feeding deterrence and toxicity of neem triterpenoids. Journal of Chemical Ecology 23 (9): 2117-2132. [ Links ]
BAKER, H. G.; BAKER, I. 1983. Floral nectar sugar constituents relation to pollinator type. pp. 117-141. In: Jones, C. E.; Little, R. J. (Eds.). Handbook of experimental pollination biology. Van Nostrand Reinhold. 558 p. [ Links ]
BARROS, R. G.; ALBENAZ, K. C.; TAKATSUKA, F. S.; CZE-PAK, C.; FERNANDES, P. M.; TOFOLI, G. R. 2005. Eficiencia de inseticidas no controle de Spodoptera frugiperda (J. E. Smith, 1797) (Lepidoptera: Noctuidae) na cultura do algodoeiro. Pesquisa Agropecuária Tropical 35 (3): 179-182. [ Links ]
CINTRA, P.; MALASPINA, O.; BUENO, O. P. 2005. Plantas tóxicas para abelhas. Arquivos do Instituto Biológico 72: 547-551. [ Links ]
DAVIS, A. R.; PYLATIUK, J. D.; PORADIS, J. C.; LOW, N. H. 1998. Nectar carbohydrate and composition vary in relation to nectar anatomy and location within individual flowers of several species of Brassicaceae. Planta 305-318. [ Links ]
El-HELA, A. A. 2001a. Phenolics from Spathodea campanulata Beauv. leaves. Journal of Pharmaceutical Sciences 27: 152-162. [ Links ]
El-HELA, A.A. 2001b. The new iridoid glucoside from Spathodea campanulata Beauv. leaves. Journal of Pharmaceutical Sciences 27: 115-120. [ Links ]
FLACH, A. 2005. Ecologia química em Maxillariinae, Spathodea campanulata e Meliponiinae. Tese Doutorado em Química. Instituto de Química, Unicamp Universidade Estadual de Campi-nas, Campinas, Brasil, 178 p. [ Links ]
FUNARI, S. R. C, BAUAB-VIANA, M. J., CURI, P. R., FUNARI, A. R. M. 1996. Perfil diário de coleta de abelhas africanizadas (Apis mellifera L.) na regiao de Botucatu SP. Boletim de Industria Animal 53: 99-103. [ Links ]
GALLO et al. 2002. Entomologia agrícola. Fealq, Piracicaba, pp. 920. [ Links ]
GENTRY, A. H. 1974. Coevolutionary patterns in Central American Bignoniaceae. Annals of the Missouri Botanical Garden 61: 728-759. [ Links ]
GERSHENZON, J.; CROTEAU, R. 1992. Terpenoides, pp. 165-219. In Herbivores: Their interactions with secondary plant metabolites, vol. 1: The Chemical Participants, 2nd ed.. Rosenthal, G. A.; Berenbaum, M. R. (Eds.) Academic Press, San Diego, CA. [ Links ]
HASSAN, A. S. 1997. Métodos padronizados para testes de seletividade, com enfase em Trichogramma, pp. 207-234. In: Parra, J. R. P.; Zucchi, R. A. (Eds.). Trichogramma e o controle biológico aplicado. FeAlQ, 324 p. [ Links ]
ISMAN, M. B. 2006. Botanical insecticides, deterrents and repellents in modern agriculture and increasingly regulated world. Annual Review of Entomology 51: 45-66. [ Links ]
JOLY, A. B. 1985. Introdujo á taxonomia vegetal. 7. ed. Sao Paulo: Ed. Nacional, 503 p. [ Links ]
MACCONN, M.; CREELMAN, R. A.; BELL, E.; MULLET, J. E.; BROWSE, J. 1997. Jasmonate is essential for insect defense in Arabidopsis. Proceedings of the National Academy of Sciences 94: 5473-5477. [ Links ]
NGOUELA, S.; NYASSE, B.; TSAMO, E.; SONDENGAM, B. L.; CONNOLLY, J. D. 1990. Spathodic acid: a triterpene acid from the stem bark of Spathodea campanulata. Phytochemistry 29: 3959-3961. [ Links ]
PEGORARO, A.; CHAVES NETO, A. 2005. Disponibilidade de alimento coletado por operárias da abelha africanizada em funjao dos fatores ambientais. Scientia Agricola 6: 35-39. [ Links ]
PIANARO, A.; FERREIRA, D. T.; PINTO, J. P.; ISHIKAWA, N. K.; BRAZ-FILHO, R. 2007. Iridoid glucoside and antifungal phenolic compounds from Spathodea campanulata roots. Semina: Ciencias Agrárias 28: 251-256. [ Links ]
PRATES, H. T.; SANTOS, J. P. 2000. Óleos essenciais no controle de pragas de graos armazenados, pp. 443-461. In: Lorini, I.; Miike, L. H.; Scussel, V. M. Armazenagem de Graos. IBG, Campinas 1000 p. [ Links ]
PROCÓPIO, S. O.; VENDRAMIM, J. D.; RIBEIRO JÚNIOR, J. I.; SANTOS, J. B. 2003. Bioatividade de diversos pós de origem vegetal em relajao á Sitophilus zeamais Mots. (Coleoptera: Cur-culionidae). Ciencia e Agrotecnologia 27 (6): 1231-1236. [ Links ]
QUEIROZ, A. C. M.; CONTRERA, F. A. L.; VENTURIERI, G. C. 2014. The effect of toxic nectar and pollen from Spathodea campanulata on the worker survival of Melipona fasciculata Smith and Melipona seminigra Friese, two Amazonian stingless bees (Hymenoptera: Apidae: Meliponini). Sociobiology 61 (4): 536-540. [ Links ]
SAITO, M. L.; POTT, A.; FERRAZ, J. M. G.; NASCIMENTO, R. S.; SANTOS, R. 2004. Avaliajao da atividade inseticida em espécies de plantas do pantanal mato-grossense. Jaguariúna: Embrapa Meio Ambiente, 19 p. - (Boletim de Pesquisa e Desen-volvimento / Embrapa Meio Ambiente 24). [ Links ]
SUBRAMANIAN, S. S.; SULOCHANA, N.; NAGARAJAN, S. 1973. Caffeic acid from the leaves of Spathodea campanulata. Current Science 42: 403. [ Links ]
SUSSMAN, R. W.; RAVEN, P. H. 1978.Pollination by lemurs and marsupials: an archaic coevolutionary system. Science 200: 731-734. [ Links ]
TAIZ, L.; ZEIGER, E. 2004. Fisiologia Vegetal. Artmed, Porto Alegre, pp. 314-316. [ Links ]
TAVARES, M. A. G. C.; VENDRAMIM, J. D. 2005. Bioatividade da erva-de-santa-maria, Chenopodium ambrosioides L., sobre Sitophilus zeamais Mots. (Coleoptera: Curculionidae). Neotropical Entomology 34 (2): 319-323. [ Links ]
TRAPP, S.; CROTEAU, R. 2001. Defensive resin biosynthesis in conifers. Annual Review of Plant Physiology and Plant Molecular Biology 52: 689-724. [ Links ]
TRIGO J. R.; SANTOS W. F. 2000. Insect mortality in Spathodea campanulata Beauv. (Bignoniaceae) flowers. Revista Brasileira de Biologia 60: 537-538. [ Links ]
Recibido: 20-ago-2014
Aceptado: 1-may-2015
Citación sugerida:
FRANCO, P. D.; GUERREIRO, J. C.; RUIZ, M. G.; DA SILVA, R. M. G. 2015. Evaluación del potencial insecticida del néctar de Spathodea campanulata (Bignoniaceae) sobre Sitophilus zea-mais (Coleoptera: Curculionidae). Revista Colombiana de Entomología 41 (1): 63-67. Enero-Junio 2015. ISSN 0120-0488.