Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.41 no.2 Bogotá July/Dec. 2015
Productos biológicos para el control de Spodoptera frugiperda (Lepidoptera: Noctuidae)
Biological products for the control of Spodoptera frugiperda (Lepidoptera: Noctuidae)
MARÍA BERENICE GONZÁLEZ-MALDONADO12, J. NATIVIDAD GURROLA-REYES 13 e ISAÍAS CHAÍREZ-HERNÁNDEZ 14
1Instituto Politécnico Nacional. CIIDIR Unidad Durango. COFAA. Sigma No. 119. Fracc. 20 de Nov. II. C. P. 34220. Durango, México.
2 M. en C. mbgonzalez@ipn.mx. Autor para correspondencia.
3,4 Dr. ngurrola@ipn.mx, ichairez@hotmail.com.
Resumen: El gusano cogollero Spodoptera frugiperda (Lepidoptera: Noctuidae) es una de las principales plagas polífagas de cultivos en Durango, México, en su control se emplean muchos químicos, generalmente, nocivos para la salud. Como una alternativa al uso de estos insecticidas, se evaluó la toxicidad de diferentes productos comerciales para el control biológico de gusano cogollero. Los productos evaluados en laboratorio contra larvas neonatas fueron: Micoralis® a base de Beauveria bassiana , Crimax® (Bacillus thuringiensis) y Neempower® (aceite de neem), así como un insecticida químico, como control positivo (Lorsban®). Se utilizó un diseño completamente al azar con mediciones repetidas cada 24 h. El producto más efectivo para el control de gusano cogollero fue Neempower®, a una dosis del 20,00%, se obtuvo una mortalidad promedio del 86,66%; fue seguido por Crimax® (70,66%), con una CL50 de 189,53 pg mL". Micoralis® resultó menos efectivo, a una concentración de 1 x 109 esporas mL-1 (49,33%) con una CL50 de 2,53 x 109 esporas mL-1. Se encontró que es posible combinar el producto biorracional (neem) con B. thuringiensis para lograr un control efectivo. Lorsban® causó el 100% de mortalidad, a una concentración del 1%, lo que indica que este producto es altamente tóxico tanto para el insecto plaga, así como para sus enemigos naturales y polinizadores, por lo que no se recomienda su uso. Se encontraron diferencias significativas entre los tratamientos (F = 673,23; P = 0,001). El trabajo reveló que es posible implementar el uso de bioinsecticidas y biorracionales para el control de S. frugiperda en la región de estudio.
Palabras clave: Bioinsecticidas. Biorracional. Gusano Cogollero. Toxicidad.
Abstract: The armyworm Spodoptera frugiperda (Lepidoptera: Noctuidae) is a major polyphagous pest of crops in Durango, Mexico. Many chemicals are used to control it, which are generally harmful to health; thus, as an alternative to the use of these insecticides, the toxicities of different commercial products were evaluated for the biological control of armyworm. The products evaluated in the laboratory for use against neonate larvae were: Micoralis®, with a base of Beauveria bassiana ; Crimax® (Bacillus thuringiensis ); Neempower®, consisting of neem oil and a chemical insecticide; and Lorsban® as the positive control. The design was completely randomized with repeated measurements every 24 h. Neempower® was the most effective, with an average mortality rate of 86.66% at a dose of 20.00%; followed by Crimax® (70.66%), which obtained an LC50 of 189.53 pg mL-1. Micoralis® was less effective at a concentration of 1 x 109 spores mL-1 (49.33%), with an LC50 of 2.53 x 109 spores mL-1. It was also found that it is possible to combine a bio-rational product (Neem) with B. thuringiensis to achieve efficient control. Lorsban® caused 100% mortality at a concentration of 1%, which suggests that this product causes the death of insect pests, natural enemies, and pollinators even at very low doses; thus, its use is not recommended. Significant differences were found between treatments (F = 673.23; P = 0.001). This study revealed that it is possible to implement the use of bio-insecticides and bio-rationals to control S. frugiperda in the study region.
Key words: Bio-insecticides. Bio-rationals. Armyworm. Toxicity.
Introducción
En Durango, México, el maíz es el segundo cultivo en importancia después del frijol. En el ciclo primavera-verano 2013 se sembraron 154.505,25 ha, con una producción de 297.383,44 ton y un rendimiento de 1,97 ton/ha (SIAP 2014). Sin embargo, el rendimiento del grano es afectado cada año, porque se presenta un complejo de plagas que ataca al cultivo durante su desarrollo fenológico, entre las principales destacan el gusano cogollero Spodoptera frugiperda (J. E. Smith, 1797) (Lepidoptera: Noctuidae), el gusano elotero Helicover-pa zea (Bodie, 1850) (Lepidoptera: Noctuidae), el chapulín Brachystola magna (Girard, 1854) (Orthoptera: Acrididae), entre otros. Además en 2013 se presentó una explosión po-blacional de gusano soldado S. exigua (Hübner, 1808) (Lepi-doptera: Noctuidae) que además del maíz ataca otros cultivos y pastizales.
En el control de estas plagas se utilizan insecticidas químicos, como Lorsban® (clorpirifós etil), un organofosforado, que actúa por contacto, ingestión e inhalación. El clorpirifós aunque moderadamente tóxico tiene efectos neurológicos, trastornos del desarrollo y autoinmunes en exposiciones crónicas (Cao et al. 2011). En Durango, en algunas localidades, este producto es mezclado con "polvo de avión", el cual contiene paratión metílico, actualmente de uso restringido por la ERA (Agencia de Protección Ambiental) (DSHS 2015). El paratión metílico muestra una toxicidad distinta para varios grupos de organismos: en insectos varía de alta a extremadamente alta, las abejas son especialmente sensibles a este insecticida; mortalidades en estos insectos han sido registradas incluso bajo dosis recomendadas, en mamíferos interfiere en la transmisión de los impulsos nerviosos por inhibición de la colinesterasa y produce acumulación de acetilcolina en las uniones colinérgicas de las neuronas y en ganglios autónomos (INECC 2015; Fuentes et al. 2011).
Otro insecticida que se usa con frecuencia es el piretroide Karate® (Lambda-cihalotrina), muy tóxico para organismos acuáticos, abejas y polinizadores como Bombus spp. (Syngenta 2015).
Con la finalidad de disminuir el impacto ambiental derivado del uso de insecticidas químicos para la protección de cultivos, se hace necesaria la búsqueda de estrategias alternativas para el control de las principales plagas de maíz en Durango. Entre ellas se pueden utilizar agentes de control biológico (Carballo 2002), como el hongo entomopatógeno Beauveria bassiana Bálsamo Vuill., para el control de larvas de S. frugiperda (Gardner et al. 1977; García et al. 2011), de la bacteria entomopatógena B. thuringiensis, que produce proteínas insecticidas durante su esporulación (genes Cry I) altamente específicas para lepidópteros, en teoría segura para humanos, otros vertebrados, plantas y además es biodegradable (Carmona 2002; Monnerat et al. 2006; Dos Santos et al. 2009). Así mismo, algunos insecticidas biorracionales tienen suficiente toxicidad cuando se usan en conjunto con agentes de control biológico, estos generalmente son productos naturales, como el orégano, ajo, cempasúchil, donde se extraen sus compuestos activos (timol, carvacrol, alicina, entre otros) (Zamora et al. 2008; Aguirre 2010). Para el control de gusano cogollero se ha utilizado la azadiractina, extraída del árbol de neem (Azadirachta indica A. Juss), un tetranorditerpenoide (C 35H 44O 16), que inhibe la oviposición y el proceso de metamorfosis aunque también tiene efectos antialimentarios en otros lepidópteros, homópteros, coleópteros, himenópteros, hemípteros, dípteros y tisanópteros (Adel y Sehnal 2000).
Por lo anterior, el objetivo del presente trabajo fue: establecer y comparar la actividad insecticida de diferentes productos biológicos: B. bassiana, B. thuringiensis, así como de extracto de neem para el control de gusano cogollero, mediante bioensayos en laboratorio, comparando los resultados con el control químico, a base de clorpirifós como ingrediente activo.
Materiales y métodos
Área de estudio. El estudio se realizó en tres regiones agrícolas del Estado de Durango, que corresponden a 16 localidades pertenecientes a la parte central y sureste del Estado de Durango, formado por los Valles del Guadiana (Col. Minerva y Lerdo de Tejada), Pánuco de Coronado (Francisco I. Madero) y Canatlán (J. Guadalupe Aguilera). Localizadas entre los 23°57’33.6"N 104°37’43.9"O, altitud 1.884 m y 24°23’20.7"N 104°20’06.6"O, altitud 1.954 m.
Muestreos.En estos sitios y localidades se efectuaron colectas manuales de larvas y posturas de gusano cogollero/ sitio de muestreo, con la finalidad de contar con una muestra homogénea de especímenes de la zona de mayor interés, en cuanto a la producción de maíz en el estado. La recolecta se realizó en el ciclo primavera-verano, cada 15 días, de junio a septiembre de 2014. Se muestrearon plantas que presentaban en las hojas apicales signos de defoliación y restos de excrementos de la plaga, el material se depositó en envases de plástico con dieta natural y fueron trasladados al laboratorio de entomología del CIIDIR-IPN Unidad Durango, para su manejo y disposición.
Cría de gusano cogollero. Se utilizó un cuarto de cría o incubación: humedad relativa del 60%, temperatura entre 25 y 27 °C, un fotoperiodo de 14:10 H: L (horas-luz), las larvas se alimentaron con dieta artificial, a base de proteínas y carbohidratos, elementos químicos, un agente aglutinante y vitaminas, para proporcionarle al insecto todos los requerimientos nutricionales necesarios hasta su desarrollo completo (Ashby 1972; García et al. 2011).
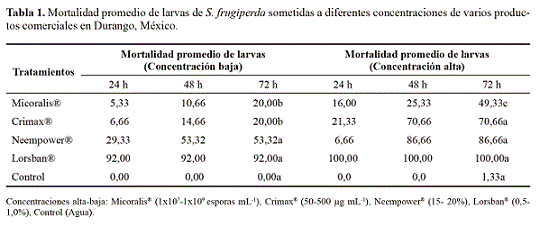
Productos comerciales. Se evaluó la toxicidad de cuatro productos comerciales contra larvas de gusano cogollero. Previamente se realizó una ventana de respuesta biológica, que permitiera conocer las concentraciones a las cuales podía ser probado cada producto, utilizando concentraciones bajas y altas. Se utilizaron seis concentraciones diferentes para cada producto, con menos individuos que en el bioensayo (cinco por concentración), para seleccionar solo una concentración alta y baja para realizar los bioensayos. Esta selección fue de acuerdo a la formulación de cada producto y a la forma de actuar en el insecto, por lo cual, las concentraciones que se utilizaron de cada producto fueron diferentes.
En cada bioensayo y ensayo (en el caso del insecticida químico), se utilizaron 25 larvas neonatas de gusano cogo-llero de la tercera generación (F3), de la cría obtenida en el laboratorio, con dos concentraciones, con tres repeticiones y con un control con agua destilada, para cada uno de los productos.
Bacillus thuringiensis.Se utilizó el producto Crimax®, por contaminación de dieta artificial, utilizando concentraciones de 50 y 500 pg mL-1, de su formulación en gránulos disper-sables (B. thuringiensissubespecie kurstaki, cepa EG 7,841, equivalente a 150g de i.a kg-1). A cada 5g de dieta, se le agregó cada concentración, las cuales fueron distribuidas en vasos de plástico (3,5 cm de diámetro por 3,8 cm de altura), para después introducir la larva para su alimentación y experimentación, cada 24 h se registró el porcentaje de mortalidad, reportada como mortalidad acumulada.
Beauveria bassiana. Se utilizó el producto comercial Mico-ralis® (líquido miscible, 2,3 x 10 7 esporas mL -1 viables de B. bassiana, en 1,67% en peso del producto), mediante el método tópico. Las larvas estuvieron en contacto con B. bassiana a las concentraciones de 1 x 10 7 y 1 x 10 9 esporas mL-1. Con un pincel se introdujo cada larva neonata en la suspensión con el hongo, durante un intervalo de 1 a 3 segundos, para evitar que la causa de su muerte fuese por ahogamiento. Posteriormente, la larva se depositó en su respectivo vaso con dieta artificial (5 g), cada 24 h se cuantificó el porcentaje de mortalidad.
Neem. Este bioensayo se realizó por contacto, considerando dos concentraciones: 15 y 20%, empleando un producto comercial, elaborado a partir de aceite de neem al 100%, denominado Neempower®.
Insecticida químico. En este caso se utilizó Lorsban® 480 EM, contiene 480 g de i.a L-1, como control positivo.
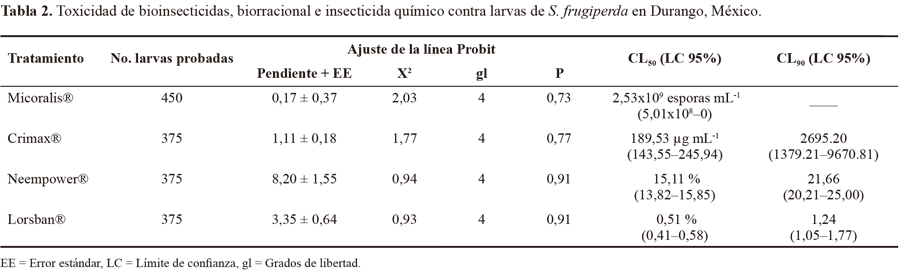
Análisis de datos. Para los análisis, la mortalidad de larvas se registró cada 24h, como mortalidad acumulada hasta las 72 h, pero continuamente cada 24h, hasta que todas las larvas murieron. Se corrigieron los datos de mortalidad de acuerdo a la fórmula de Abbott (1925), posteriormente se analizaron mediante un análisis probit, dosis-respuesta, usando el programa computacional POLO-PC (LeOra 2003). Se calcularon las concentraciones letales (50 y 90). Dos valores cualquiera son considerados significativamente diferentes si sus límites de confianza no se superponen (95%).
Para el análisis estadístico de la eficacia de los bioinsec-ticidas a S. frugiperda, la mortalidad debida a los diferentes productos fue analizada utilizando el programa Statistica, ver. 7. Se realizó un ANOVA completamente al azar con mediciones repetidas, donde los tratamientos fueron: B. thurin-giensis, B. bassiana, neem e insecticida químico y las repeticiones, cada 24 h y la variable dependiente fue el número de larvas muertas.
Resultados y discusión
El producto más efectivo para el control de gusano cogolle-ro fue Neempower®, a una dosis del 20%, con una mortalidad promedio del 86, 66%; seguido por Crimax® (70,66%), a una concentración de 500 pg mL-1, Micoralis® resultó menos efectivo, a una concentración de 1 x 10 9 esporas mL -1 (49,33%). Lorsban® causó el 100% de mortalidad, al 1%, la mortalidad fue mayor en todos los productos biológicos, cuando se utilizaron concentraciones mayores del toxico en condiciones de laboratorio y ésta fue en aumento a través del tiempo, dependiendo del producto utilizado y de su modo de acción, tal como lo reportan Agarwaal et al.(2006) quienes evaluaron la mortalidad de larvas de S. exigua del 2do y 4to estadio de desarrollo, con biorracionales y bioinsecticidas y la combinación de estos, ellos indican que la mortalidad se atribuye al modo de acción de los productos, siendo mejor cuando estos se combinan. También encontraron una disminución significativa en la mortalidad de larvas de S. exigua del segundo y cuarto estadio, tanto en condiciones de laboratorio como en invernadero.
Bacillus thuringiensis. Las larvas de S. frugiperdasometidas a B. thuringiensis mostraron la máxima mortalidad a las 72 h de estar en contacto con el tóxico, a una concentración de 50 pg mL -1 (20%), sin embargo, se observó que para obtener una mortalidad mayor (70,66%) (Tabla 1), se requiere de una mayor concentración del tóxico (500 pg mL-1), a menor tiempo (48 h), la CL 50 fue de 189,53 pg mL-1. Si observamos el valor de la CL 90 (2695,2 pg mL-1) (Tabla 2), éste nos indica que se requerirá una concentración alta del bioinsecticida para eliminar al 90% de la población. Además estos valores de concentraciones letales también son altos si se comparan con los resultados de Castro (1994), quien reporta una DL 50 = 83,71 pg mL-1. Este autor utilizó una cepa de B. thuringuien-sis serovar aizawai GM-10, la cual se obtuvo de la colección internacional del laboratorio de microbiología industrial y de suelo de la Facultad de Ciencias Biológicas de la UANL. También la DL 90 fue menor: 300 pg mL-1, para el control de S. frugiperda en bioensayos en laboratorio, al utilizar un bio-insecticida microencapsulado, lo cual indica que Crimax®, es efectivo si se utiliza a dosis entre 1.500-10.000 pg mL -1 para tener un control efectivo de la plaga (Tabla 2). Aun cuando se requieran altas dosis deB.t., es bioseguro, usar esta bacteria en campo, como lo demuestran, al igual que este estudio, López et al. (2010) quienes evaluaron el efecto de los productos comerciales Spinetoram y clorpirifós etil (insecticidas químicos) y B. thuringiensis (bioinsecticida), para el control de larvas de gusano cogollero y concluyen que los productos biológicos no atentan sobre las poblaciones de la fauna benéfica de Chrysoperla sp., además controlan efectivamente a la plaga.
Por otro lado, es importante contar con aislamientos de microrganismos nativos de la región de origen, que se puedan producir de forma local y aplicarse en fresco, sin afectación del ingrediente activo, debido a que cuando se adquieren productos comerciales a base de estos entomopatógenos, en ocasiones se desconoce su origen y si son o no efectivos para el control de plagas diferentes a las que viene indicado el producto. Es importante conocer el tipo de genes Cry que contiene la bacteria para saber a qué orden de insectos ataca. Bravo et al. (1998) indican que los genes Cry I (cristales bipi-ramidales), atacan lepidópteros y son los que predominan en México, y que los genes Cry III, son tóxicos para coleópteros. Ellos además aislaron una gran variedad de cepas de B.t., en varios Estados de la República Mexicana, incluyendo Durango, que pueden ser útiles como cepas de referencia, para comparar la toxicidad de dichos microorganismos en una región en particular.
Beauveria bassiana. Los resultados indicaron mortalidades bajas a las concentraciones probadas, siendo la mortalidad más alta de 49,33% a las 72 h (3 días) a una concentración de 1x10 9 esporas mL-1, debido probablemente a la especificidad del aislamiento evaluado. El producto comercial indica que es efectivo contra mosca blanca (hemíptero) y no contra lepidópteros. Los insectos fueron cubiertos por el micelio del hongo en promedio a los ocho días, algunas larvas no tuvieron al hongo presente en su exoesqueleto, sin embargo, al realizar una disección del mismo, el hongo se encontraba dentro de la larva (5-20%), se presentó micosis en la cutículade las larvas (40%). Sin embargo, la alta CL 50 (2,53x109 esporas mL-1) nos indica que, aún a dosis mayores, el producto (Micoralis®) no matará a más del 50% de la población de larvas de S. frugiperda (Tabla 2). Se ha encontrado que el hongo entomopatógeno Nomuraea rileyi F. (Samson) tiene mayor especificidad para el control de gusano cogollero (DL 50 de 400 esporas mm -2 ~ 4x10 5esporas mL-1) y que se requiere de menor concentración del hongo para matar la misma cantidad de insectos que con B. bassiana (Maniania y Fargues 1985).
Neem. El producto biorracional a base de extracto de neem Neempower® causó la mayor mortalidad en larvas de gusano cogollero ( 86, 66%) al segundo día de la aplicación, a una dosis del 20% del producto comercial (CL 50 = 15,11 y CL 90 = 21,66%) (Tabla 2). Al respecto, Cortez et al. (2011) evaluaron diferentes preparaciones de extracto de neem con mejores resultados con el tratamiento a base de semilla molida más material inerte (para su formulación). A las 72 h después de aplicar el tratamiento, la protección del cultivo de maíz duró hasta por siete días en campo. No se encontraron larvas de gusano cogollero en las plantas donde se aplicó este tratamiento. Las semillas de neem tienen la ventaja de ser un producto muy económico, debido a que en algunas regiones tropicales y subtropicales del país existen árboles de esta planta de tipo silvestre, por lo que obtener sus semillas representaría un bajo costo.
En el presente estudio, a través de los días, el producto ensayado provocó en larvas de S. frugiperda un efecto repelente, inhibió la alimentación e indujo la muda. Además causó malformaciones (pronoto) e impidió el desarrollo y crecimiento de las larvas, por lo que también puede constituir un riesgo para otros organismos, entre ellos los benéficos, siendo importante tomar en cuenta estas observaciones.
Producto químico. El producto químico causó mortalidades del 92 al 100%, el primer día de su aplicación, aún a dosis muy bajas (0,5 y 1%, respectivamente).
El ANOVA general mostró diferencias significativas (F = 673, 23, P = 0,001) y los ANOVAS cada 24 h, mostraron diferencias significativas con P < 0,001.
Conclusiones
El producto biológico Neempower® es efectivo para el control de larvas de S. frugiperda a bajas concentraciones del producto, en donde la mortalidad más alta se presenta a los dos días, es posible su uso combinado con B. thuringiensis, lo que da como resultado una alta mortalidad.
El contar con aislamientos nativos de hongos y bacterias entomopatógenos y extractos de plantas de la región de origen, adaptados a las condiciones climáticas, garantiza que exhiban mayor toxicidad, virulencia y patogenicidad sobre el insecto blanco.
Este estudio sienta las bases para futuras investigaciones, que permitan establecer las mejores alternativas para el control de gusano cogollero, con la aplicación de productos biológicos, dentro de un manejo rural sustentable.
Literatura citada
ADEL, M. M.; SEHNAL, F. 2000. Azaridachtin potentiates the action of ecdyteroid against RH-2485 in Spodoptera littoralis. Journal of Insect Physiology 46: 267-274. [ Links ]
AGUIRRE, Z. O. 2010. Efecto de los residuos de metaxifenocida sobre el gusano soldado Spodoptera exigua (Hübner) (Lepidop-tera: Noctuidae). Tesis de licenciatura. Universidad Michoacana de San Nicolás de Hidalgo. Morelia, Mich., México. 60 p. [ Links ]
ABBOTT, S. W. 1925. A method of computing the effectiveness of an insecticide. Journal of Economic Entomology 18: 265-267. [ Links ]
AGARWAAL, N.; HOLASCHKE, M.; BASEDOW, T. 2006. Evaluation of bio-rational insecticides to control Helicoverpa armigera (Hübner) and Spodoptera exigua (Hübner) (Lepidoptera: Noctuidae) fed on Vicia faba L. Mitteilungen der Deutschen Gesellschaft für allgemeine und angewandte Entomologie 21 (24): 245-250. [ Links ]
AsHbY, G. 1972. The UFAW handbook on the care and management of laboratory animals. pp. 582-587. In: Worden, A. N.; Lane-Petter, W. (Eds.). The Universities Federation for Animal Welfare, Londres. [ Links ]
BRAVO, A.; SARABIA, E.; LÓPEZ, L.; ONTIVEROS, H.; ABARCA, C.; ORTIZ, M.; ORTIZ, M.; LINA, L.; VILLALOBOS, F. J.; PEÑA, G.; NUÑEZ, V M.; SOBERÓN, M.; QUINTERO, R. 1998. Characterization of cry genes in a Mexican Bacillus thuringiensis strain collection. Applied and Environmental Microbiology 64 (2): 49-65. [ Links ]
CAO, J.; VARNELL, A.; COOPER, D. 2011. Gulf war syndrome: A role for organophosphate induced plasticity of locus coeru-leus neurons. Disponible en:http://hdl.handle.net/10101/npre.2011.6057.1. 2011.6057.1. (Fecha revisión: 11 junio 2015). [ Links ]
CARBALLO, M. 2002. Manejo de insectos mediante parasitoides. En: Avances en el fomento de productos fitosanitarios no sintéticos. Manejo Integrado de Plagas y Agroecología 66: 118-122. [ Links ]
CARMONA, A. 2002. Aislamiento y caracterización parcial de una cepa de Bacillus thuringiensis tóxica a Spodoptera frugiperda (Lepidoptera: Noctuidae). Bioagro 14 (1): 3-10. [ Links ]
CORTEZ, M. E.; VALENZUELA, F. E. 2011. Efectividad de insecticidas novedosos al 100% y 50% de la dosis sobre gusano co-gollero Spodoptera frugiperda Smith (Lepidoptera: Noctuidae) en maíz. Entomología Mexicana 10: 488-492. [ Links ]
CASTRO, F. 1996. Desarrollo de un bioinsecticida a partir de Baci-llus thuringiensis y extracto de agave lechuguilla para el control de Spodoptera frugiperda (J. E. Smith). Tesis de Doctorado. Facultad de Ciencias Biológicas. UANL. Monterrey, N. L. México. 89 p. [ Links ]
DEPARTMENT OF STATE HEALTH SERVICES. DSHS. 2015. Programa de vigilancia de exposición a pesticidas en Texas. Disponible en: https://www.dshs.state.tx.us/epitox/pestspanish.shtm. shtm. (Fecha revisión:12 marzo 2015). [ Links ]
DOS SANTOS, K. B.; NEVES, P; MENEGUIM, A. M.; BIANCHI, D. R.; DOS SANTOS, W. J.; VILLAS, B. G.; DUMAS, V; MARTINS, E.; BOTELHO, P. L.; QUEIROZ, P.; BERRY, C.; MONNERAT, R. 2009. Selection and characterization of the Bacillus thuringiensis strain toxic to Spodoptera eridania (Cramer), Spodoptera cosmioides (Walker) and Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae). Biological Control 50: 157-163. [ Links ]
FUENTES, D. V; QUEZADA, A. C.; MARTÍNEZ, S. M.; JARA-MILLO, J. F.; RODRÍGUEZ, V M.; JARAMILLO, G. F.; REYES, S. J. 2011. Hepatotoxicidad subaguda y crónica producida por el plaguicida paratión-metílico en la rata. Revista Mexicana de Ciencias Farmacéuticas 42 (3): 50-56. [ Links ]
GARDNER, W. A.; SUTTON, R. M.; NOBLE, R. 1977. Persistence of Beauveria bassiana, Nomuraea rileyi , and Nosema necatrix on soybean foliage. Disponible en: http://dx.doi.org/10.1093/ee/6.5.616 616-618. (Fecha revisión: 9 septiembre 2014). [ Links ]
GARCÍA, G. C.; GONZÁLEZ, M. M.; BAUTISTA, M. N. 2011. Patogenicidad de aislamientos de hongos entomopatógenos contra Spodoptera frugiperda (Lepidoptera: Noctuidae) y Epi-lachna varivestis (Coleoptera: Coccinellidae). Revista Colombiana de Entomología 37 (2): 217-222. [ Links ]
INSTITUTO NACIONAL DE ECOLOGÍA Y CAMBIO CLIMÁTICO - INECC. 2015. Paratión metílico. Disponible en: http:// www.inecc.gob.mx/sistemas/plaguicidas/pdf/paration_metili-co.pdf. (Fecha revisión: 11 junio 2015). [ Links ]
LEORA SOFTWARE. 2003. Poloplus, a user's guide to probit or logit analysis. Leora software, Berkeley, CA, EE. UU. [ Links ]
LÓPEZ, V. J.; CORIA, A. C.; MUÑOZ, F. H.; NÁJERA, R. M.; OROZCO, G. G. 2010. Efecto de Spinoteram y Bacillus thuringiensis sobre Spodoptera frugiperda (J.E Smith) (Lepidoptera: Noctuidae) y Chrysoperla sp. en una plantación comercial de maíz en Yurécuaro, Michoacán. pp. 304-307. XXXIII Congreso Nacional de Control Biológico. Michoacán, México. [ Links ]
MANIANIA, N. K.; FARGUES, J. 1985. Susceptibility of the fall armyworm Spodoptera frugiperda to the fungal pathogens Pae-cilomyces fumosoroseus and Nomuraea rileyi. Florida Entomologist 68: 178-183. [ Links ]
MONNERAT, R.; MARTINS, E.; QUEIROZ, P.; ORDÚ, S.; JARAMILLO, G.; BENINTENDE, G.; COZZI, J.; REAL, M. D.; MARTÍNEZ, R. A.; RAUSELL, C.; CERÓN, J.; IBARRA, R. E.; DEL RINCÓN, C. M.; ESPINOZA, A. M.; MEZA, B. L.; CABRERA, L.; SÁNCHEZ, J.; SOBERÓN, M.; BRAVO, A. 2006. Genetic variability of Spodoptera frugiperda Smith (Le-pidoptera: Noctuidae) populations from Latin America is associated with variations in susceptibility to Bacillus thuringiensis cry toxins. Applied and Environmental Microbiology 72 (11): 7029-7036. [ Links ]
SERVICIO DE INFORMACIÓN AGROPECUARIA Y PESQUERA. SIAP. 2014. Cierre de la producción agrícola por cultivo. Disponible en: http://www.siap.gob.mx/cierre-de-la-produc-cion-agricola-por-cultivo/. (Fecha revisión: 22 abril 2014). [ Links ]
SYNGENTA. 2015. Karate® con tecnología zeon 050 CS. Disponible en: http://www3.syngenta.com/country/cl/cl/soluciones/ proteccioncultivos/Documents/Etiquetas/KarateZeon.pdf. (Fecha revisión: 18 de junio 2015). [ Links ]
ZAMORA, M. C.; MARTÍNEZ, A. M.; NIETO, M. S.; SCHNEI-NER, M. I.; FIGUEROA, J. I.; PINEDA, S. 2008. Actividad de algunos bioinsecticidas biorracionales contra el gusano cogolle-ro. Revista Fitotecnia Mexicana 31 (4): 351-357. [ Links ]
Recibido: 6-sep-2015
Aceptado: 26-dic-2015
Citación sugerida:
GONZÁLEZ-MALDONADO, M. B.; GURROLA-REYES, J. N.; CHAÍREZ-HERNÁNDEZ, I. 2015. Productos biológicos para el control de Spodoptera frugiperda (Lepidoptera: Noctuidae). Revista Colombiana de Entomología 41 (2): 200-204. Julio -Diciembre 2015. ISSN 0120-0488.