Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.41 no.2 Bogotá July/Dec. 2015
Sección Básica / Basic Artículos de investigación / Research paper
Aspectos biológicos de Diaphorina citri (Hemiptera: Liviidae) bajo condiciones no controladas en invernadero
Biological aspects of Diaphorina citri (Hemiptera: Liviidae) reared in uncontrolled greenhouse conditions
MARTÍN PALOMARES-PÉREZ1, ESTHER GISELA CÓRDOBA-URTIZ2, JORGE ANTONIO SÁNCHEZ-GONZÁLEZ3, NANCY INÉS MEDINA-GARCÍA4, REYNALDO HERNÁNDEZ-MENDOZA5, VÍCTOR HUGO PÉREZ-DÍAZ6 y HUGO CESAR ARREDONDO-BERNAL7
1Dr. Coordinador de investigaciones en control biológico de plagas agrícolas. mpalomares@colpos.mx. Autor para correspondencia.
2 Biólogo, auxiliar de investigador. gisela_1704@hotmail.com;
3 Ing. coordinador del área de entomófagos. j_asg2@hotmail.com;
4 Biólogo, auxiliar de investigador. hijadelachicalota@hotmail.com;
5 Estudiante, Instituto Tecnológico del Valle de Oaxaca. Ex Hacienda de Nazareno, Xoxocotlan, Oaxaca, Mé xico,
6 Estudiante, Universidad Autónoma Agraria Antonio Narro. Calzada Antonio Narro No. 1923. Col. Buenavista, Saltillo, Coahuila, México.
7 M. C. Subdirector del CNRCB, hcesar_64@yahoo.com.mx; Centro Nacional de Referencia de Control Biológico, Km 1.5 Carretera Tecomán-Estación FFCC, Colonia Tepeyac, Colima México. C.P. 28110.
Resumen: El estudio fue realizado para determinar aspectos biológicos de D. citri reproducido en invernadero bajo condiciones no controladas durante el verano de 2013 e invierno 2013-2014 en Tecomán, Colima, México. El ciclo de vida de D. citri presentó una duración de 52,78 ± 5,52 días para la época de verano y 68,7 ± 5,43 días para la de invierno. La fecundidad (mx) y la tasa neta de reproducción (R0) alcanzaron valores superiores a la unidad, indicando que la población en estudio se encontraba en crecimiento. La velocidad de crecimiento de la población en invierno fue mayor (16,1) que en verano (4,1). La prueba de Logrank (χ2cal= 39,1> χ20,05 (2-1) = 3,8415) mostró una diferencia entre las tablas de vida evaluadas. La prueba Z (│Z(cal)│= 5,05 > │Z(tab)│= 1,96) nos indicó que esa diferencia ocurrió en el estado de huevo y en los primeros estadios ninfales (I-II). La hembra de D. citri ovipositó 541 y 786 huevos en verano e invierno, respectivamente, sin embargo la prueba de "t" indicó que no existe diferencia en la oviposición durante el verano e invierno (F = 1,59; P > 0,1512). La época de invierno fue la más apropiada para producir, en los invernaderos del CNRCB, una mayor cantidad de ninfas de D. citri.
Palabras clave: Psílido asiático. Cítricos. Biología. Invernadero.
Abstract: This study was aimed at determining biological aspects of D. citri reared in a greenhouse under uncontrolled conditions during summer and winter seasons in Tecomán, Colima, México. The life cycle of D. citri lasted 52.78 ± 5.52 days in the summer and 68.7 ± 5.43 in the winter. The fecundity (mx) and the net reproductive rate (R0) reached values greater than unity, showing that the population was growing. The growth rate of the population in winter was higher (16.1) than in summer (4.1). The Logrank (χ2cal = 39,1> χ20,05 (2-1)= 3,8415) test showed a difference between life tables evaluated. The Z (│ Z(cal) = 5,05 │> │ Z(tab) │ = 1,96) test indicated that this difference occurred in eggs and early nymph instars (I-II). A female of D. citri oviposited 541 and 786 eggs in summer and winter, respectively. However, a "t" test showed that there was no difference between the oviposition of D. citri during the summer and winter seasons (F = 1.59; P > 0.1512). Winter was the most suitable season for producing the greatest amount of nymphs.
Key words: Asian psyllid. Citrus. Biology. Greenhouse.
Introducción
El psílido asiático de los cítricos, Diaphorina citri Kuwayama, 1908 (Hemiptera: Liviidae), es actualmente la plaga más importante de los cítricos. Transmite las bacterias Candidatus Liberibacter asiaticus y C. L. americanus(Martínez y Wallace 1967) limitadas al floema y causantes de la enfermedad Huanglongbing (HLB) (Huang et al. 1984) que ha provocado la muerte de millones de árboles cítricos en el mundo (Tsai et al. 2002; Halbert y Manjunath 2004; Bové 2006; Alemán et al. 2007). Diaphorina citri ha sido objetivo de numerosos estudios relacionados con su biología y comportamiento reproductivo con la finalidad de hacer más eficiente la cría masiva de su parasitoide Tamarixia radiata (Waterston, 1922) (Hymenoptera: Eulophidae). Desde enero de 2010, aproximadamente 1,6 millones de T. radiata se producen anualmente en el laboratorio de insectos entomófagos del Centro Nacional de Referencia de Control Biológico (CNRCB), en Tecomán, Colima México (CNRCB 2014).
En los invernaderos del CNRCB, donde se cría a T. radiata, las temperaturas varían de 17 a 35 °C en invierno y a más de 40 °C, en verano. Bajo estas condiciones, no se ha generado información sobre aquellos aspectos importantes en el desarrollo biológico de D. citri, solamente se ha observado mayor población del psílido en la época de invierno que en la de verano.
El presente estudio fue realizado con el objetivo de registrar el ciclo biológico, tablas de vida y de fertilidad de D. citri durante el verano y el invierno en invernaderos del CNRCB bajo condiciones no controladas, para determinar su época de producción más abundante y otras características que permitan mayor eficiencia para la cría masiva de T. radiata.
Materiales y métodos
Las actividades se realizaron en los invernaderos del CNRCB ubicado en el Km. 1,5 Carretera Tecomán-Estación FFCC. Colonia Tepeyac C.P. 28110 Tecomán, Colima, México (18°55’37,62"N 103°53’01,45"O; 45 msnm), en condiciones de producción del parasitoide T. radiata.
Los adultos de D. citri y las plantas de Murraya paniculata (L.) Jack (Rutaceae) cuyos brotes se usaron como sustrato de oviposición y alimentación de D. citri, fueron proporcionados por el Departamento de Insectos Entomófagos del CN- RCB.
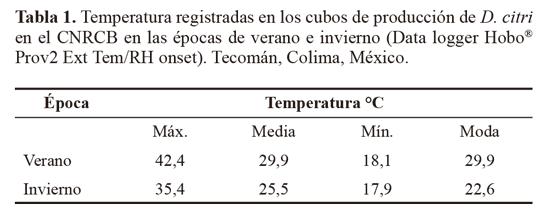
Ciclo de vida. El ciclo de vida de D. citri fue estudiado a las temperaturas ocurridas durante las épocas de verano (2013) e invierno (2013-2014), registradas cada media hora mediante un data logger Hobo® Prov2 Ext Tem/RH onset colocado dentro de los cubos de producción de D. citri construidos de tubos angulares con dimensiones de70x70x70 cm y cubierto con malla antiáfidos.
Los estudios de verano e invierno fueron desarrollados bajo un método similar: en tres plantas de M. paniculata con 15 brotes tiernos de 3 a 5 cm de longitud y establecidas en un cubo de producción se colocaron cincuenta parejas de adultos de D. citri, donde permanecieron 24 h para que ovipositaran; posteriormente se retiraron con un succionador bucal de 20 mL, registrándose la fecha de oviposición. Con la ayuda de un estereoscopio se seleccionaron brotes de M. paniculata que contenían 100 huevos, y fueron llevados hasta completar su fase embrionaria.
La duración de cada estadio ninfal se estimó con base a las exuvias observadas. Al cambiar de estadío, cada ninfa fue colocada en un brote nuevo mediante un pincel de cerdas finas. Las ninfas de quinto estadio se transfirieron a plantas de M. paniculata de 10 cm de longitud. Las plantas se cubrieron con tela de organza para evitar el escape del insecto.
Una vez emergido el adulto fue mantenido hasta su muerte. La longevidad fue determinada con base al número de días de vida promedio de las ninfas y adultos. Se comparó de igual forma la longevidad entre hembras y machos mediante una prueba logística binaria con el programa estadístico SAS® (2008).
Tablas de vida. Para el registro de las tablas de vida de D. citri se utilizaron de igual manera, como en el estudio del ciclo de vida tres plantas de M. paniculata. De esta manera se determinó un grupo de individuos (cohorte) nacidos dentro de un mismo intervalo de tiempo, desde su nacimiento hasta la muerte del último individuo (Rabinovich 1980; Begon et al. 1988). Se utilizó una cohorte de 215 (verano 2013) y 260 (invierno 2013-14) huevos bajo las temperaturas anotadas en la Tabla 1, estableciéndose para cada intervalo de edad los siguientes parámetros:
x= Edad en unidad de tiempo (días)
Nx= Número total de individuos observados al inicio de cada estadio o estado
lx= Proporción de sobrevivientes al inicio de edad (Nx/N0)
dx= Número de muertos entre edades lx y lx+1
qx= Tasa de mortalidad (dx/lx)
Lx= Individuos vivos entre lx y lx+1
Tx= Tiempo que falta vivir hasta la extinción (∑ inversa lx)
ex= Esperanza de vida (Tx/lx)
mx= No. de hijas producidas por unidad de tiempo
hx= Número de hijas producidas durante el intervalo x a x+1
Ro= Tasa neta de reproducción lxmx
Para determinar diferencia entre las tablas de vida de las poblaciones de verano e invierno, se realizó la prueba de Logrank, con una escala de medición en días.
La hipótesis de nulidad para esta prueba fue que las tablas de vida son iguales, es decir, las probabilidades de que se presentara la muerte en cualquier momento eran las mismas para todos los individuos que formaron los cohortes comparados. Mediante una prueba de X2 se calcularon y compararon las discrepancias de las frecuencias de mortalidad observadas (O) frente a las esperadas (E).
Con base a esto se compararon las dos tablas de vida; cohorte en la época de verano y la otra en invierno con los siguientes datos:
X= Intervalo de edad
nx(a) = Tabla de vida bajo la condición de verano (a)
nx(b) = Tabla de vida bajo la condición de invierno (b)
Nx = Número total de individuos en riesgo de muerte [nx(a) + nx(b)]
fx = Número de individuos muertos de x a x+1, tanto en a como en b
Con la ecuaciones fx nx(a) ÷ Nx y fx nx(b) ÷ Nx, (magnitud de exposición al riesgo de muerte) se calculó el número teórico de individuos muertos esperados para la época de verano (Ea) e invierno (Eb), bajo la hipótesis de nulidad de la prueba.
Para determinar si existía diferencia entre las tablas de vida de invierno y de verano, los datos fueron analizados bajo la fórmula:
χ2cal = [(O(a) – E(a))2 ÷ E(a)] + [(O(b) – E(b))2 ÷ E(b)]
Como una sumatoria de valores (O – E)2 ÷ E sigue una distribución de χ2α (P-1), la cual fue comparada con el valor tabular de χ2α (P-1), [siendo P en este caso el número de cohortes a comparar con el nivel de significancia de α = 0,05 (χ20,05 (2-1) = 3,8415)].
De acuerdo a esto, la regla de decisión para el experimento fue: si χ2cal ≥ χ2α (P-1) se rechaza la hipótesis de nulidad y se considera que las tablas de vida difieren entre sí.
La prueba de Logrank solo indica si dos (o más) tablas de vida son diferentes entonces, para detectar en qué etapa de las tablas de vida existió diferencia, se realizó una prueba de Z, para determinar si la proporción de individuos vivos (lx) de dos cohortes difiere al inicio de un intervalo dado (x a x+1). Esta prueba está basada en el teorema central del límite, que establece que la proporción de sobrevivientes tienen una distribución normal cuando la muestra es grande (nx > 30).
Por esta razón se denominó pa y pb a las proporciones estimadas de sobrevivientes de un cohorte bajo la condición de verano (a) y de invierno (b), respectivamente; las hipótesis planteadas fueron:
Ho: pa = pb
Ha: pa ≠ pb (al inicio del intervalo x a x + 1)
El valor de Z(cal) fue estimado como:
Z(cal) = (pa – pb) ÷ Error estándar de la diferencia; Siendo este error:
S(dif) = V{[pa(1–pa) ÷ nx(a)] + [pb(1–pb) ÷ nx(b)]}
Por lo tanto la regla de decisión con un α= 0,05 es: Sí │Z(cal)│≥ 1,96; fue rechazar la hipótesis nula.
Características reproductivas. Para evaluar la duración del periodo de preoviposición, oviposición y número total de huevos depositados por la hembra, se seleccionaron de la cría de producción de D. citri del CNRCB 50 ninfas al azar del quinto estadio y se colocaron de la manera antes mencionada, en brotes de M. paniculata en un cubo diferente; se observaron durante periodos de 12 h y cada vez que se detectaba la presencia de un adulto, se recolectaba con un succionador bucal de 20 mL. Los adultos fueron sexados con el apoyo de un estereoscopio con base a la característica que distingue al macho de la hembra; los machos son ligeramente más pequeños que las hembras y con la punta del abdomen roma, mientras que el abdomen de las hembras termina en punta bien marcada (Mead 1977). De los 50 individuos, se seleccionaron 16 hembras y 16 machos y se colocaron por parejas en brotes de plantas de M. paniculata. Cada brote fue cubierto con bolsas de tela de organza de 12x4x4 cm para evitar la fuga del insecto. Los brotes infestados fueron cortados diariamente y trasladados al laboratorio donde se contabilizaron los huevos depositados; inmediatamente cada pareja fue transferida a un brote nuevo y así sucesivamente hasta la muerte de la hembra. Cuando ocurrió la muerte del macho, éste fue sustituido.
Mediante una prueba de "t" se comparó la producción de huevos de D. citri en verano e invierno. Los datos obtenidos se analizaron mediante la prueba de Shapiro-Wilk para determinar si se ajustaban a una distribución normal. El análisis estadístico se realizó utilizando el programa estadístico SAS® (2008).
Resultados y discusión
Todo ser vivo es influenciado por la temperatura ambiente, lo cual supone un cambio en el comportamiento y distribución tanto en especies animales como vegetales. Muchos animales tienen la capacidad de controlar un incremento o decremento de la temperatura, sin embargo otros organismos como los insectos, no pueden controlar ésta condición y dependen directamente de ella para completar su desarrollo (VelázquezBlanco 2003). Los resultados del presente estudio involucraron temperaturas que rebasaron las óptimas (25 a 28 °C) para el desarrollo de D. citri (Liu y Tsai 2000b) así como humedades que llegaron hasta el 95% en ambas épocas con una media por día de 67% para verano y 75% para invierno; se registró una diferencia de 7 °C entre las temperaturas máximas de verano e invierno y de 7,3 °C entre las temperaturas que se presentan con mayor frecuencia (moda) entre las mismas épocas (Tabla 1). La humedad máxima por su lado registró el mismo valor en ambas épocas (95%) y una diferencia de 11% en la mínima humedad y 6% en la moda; condiciones que sin duda alguna intervienen en el desarrollo de D. citri, como lo comentan Liu y Tsai (2000a), Fung y Chen (2006), Nakata (2006) y Nava et al. (2007) quienes indican que la biología de D. citri es afectada por la temperatura debido a que se relaciona con el desarrollo de los inmaduros y la longevidad de los adultos. De igual forma Hodkinson (2009) menciona que la temperatura ambiente es un factor determinante en la tasa de desarrollo de huevos y ninfas de D. citri.
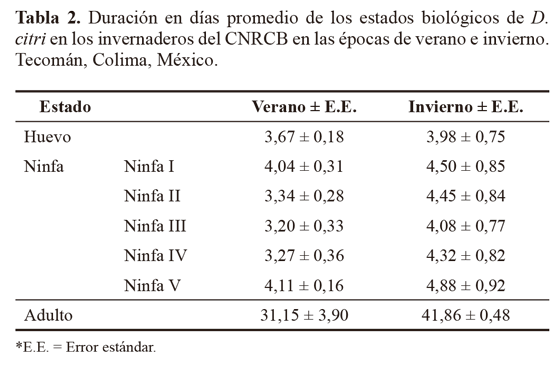
Ciclo de vida. El ciclo de vida de D. citri registró una duración de 52,7 ± 5,52 días en el verano y 68,7 ± 5,43 en el invierno (Tabla 2). Esta diferencia puede deberse a las condiciones de temperatura y humedad que se presentaron en ambas épocas, tal y como lo comentan Chavan y Summanwar (1993). Así también, sin mencionar bajo qué condiciones, la EPPO (2013) señala que el ciclo de vida de D. citri en un insectario tarda de 14 a 48 días.
El periodo de incubación de D. citri correspondió a 3,67 ± 0,18 y 3,98 ± 0,75 días para verano e invierno respectivamente (Tabla 2). En condiciones controladas de 21 ºC, y utilizando a M. paniculata como hospedero, Baños et al. (2012) reportan un periodo de incubación de 3,21días. Morales et al. (2010) mencionan el período de incubación de D. citri en 5,2 días a 24 ºC. De igual forma Tsai y Liu (2000) y Tsai et al. (2000) indican que cuando la temperatura es de 25 °C y 75-80% HR la eclosión ocurre entre 4,1 y 4,3 días, mientras que Ebratt-Ravelo et al. (2011), reportan un periodo de incubación de 6 días con temperaturas que varían de 18 como mínima hasta 27 °C como máxima. Nava et al. (2010) hacen referencia que otros factores como los climáticos, fundamentalmente la temperatura, tienen una mayor influencia en esta variable.
La duración del desarrollo ninfal se registró en 17,96 ± 1,44 y 22,23 ± 4,2 días para verano e invierno respectivamente, siendo para ambas épocas la ninfa V la de mayor longevidad (Tabla 2). Tsai y Liu (2000) reportan que D. citri en plantas de M. paniculata en condiciones controladas de 25°C presenta una duración de la ninfa de 12,82 días, mientras que Etíenne et al. (2001), a la misma temperatura, lo reportan en 15 días. Morales et al. (2010) mencionan que el periodo ninfal tiene una duración de 10,6 días a 24 °C utilizando a M. paniculata como hospedero. En otros estudios, con temperaturas que oscilan entre 18 °C a 27 °C, Ebratt-Ravelo et al. (2011) reportan un periodo ninfal de 20,5 días. La EPPO (2013), indica que la duración del estado de ninfa va de 11 a 30 días. Estas diferencias asumen el poder de adaptación de D. citri a diferentes condiciones de temperatura.
En el presente trabajo, al igual que en los estudios de Tsai y Liu (2000), Fonseca et al. (2007), Morales et al. (2010) y Ebratt-Ravelo et al. (2011), la ninfa V de D. citri fue el estadio de mayor longevidad (Tabla 2) a diferencia de Baños et al. (2012), quienes mencionan que es la de menor duración. Dato importante para la producción de T. radiata si consideramos que es uno de los estadios ninfales preferidos por el parasitoide para ovipositar.
La longevidad de los adultos varió entre sexos, los machos sobrevivieron en promedio 23,31 ± 5,15 días, mientras que las hembras 39,68 ± 5,41 en verano. Para invierno los machos presentaron un periodo de vida de 40,3 ± 6,1 y las hembras de 50,92 ± 6,8. El análisis estadístico (α = 0,05) mostró una diferencia significativa entre sexos (P = 0,3132) indicando que en ambas épocas, las hembras fueron más longevas que los machos, observación que coincide con Mead (1977). Por otro lado, Tsai y Liu (2000) indican que la hembra de D. citri desarrollándose a 25 °C sobre plantas de M. paniculata promedió 39,7 días de vida, asimismo, Etienne et al. (2001) señalan que el rango de longevidad para la hembra es de 39,6 a 46,5 días a la misma temperatura. La mayor longevidad del macho fue de 68 días en verano y 50 en invierno, mientras que la hembra más longeva registró 97 días en verano y 93 en invierno. Chavan y Summanwar (1993) indican que en la India los adultos indistintamente del sexo pueden vivir 190 días en invierno, pero sólo 20 días en verano, dato que difiere con lo observado en el presente estudio ya que en verano se registró la mayor longevidad en un individuo. Husain y Nath (1927, citados por Tsai y Liu 2000) reportaron que la longevidad de los adultos varió de 20 a 89 días, dependiendo de la época del año. El estudio realizado por Fung y Chen (2006) señala que la longevidad del adulto de D. citri sobre M. paniculata se reduce a más de la mitad cuando la temperatura aumenta (de 84 días a 20 °C a 36 días a 28 °C). Los datos obtenidos nos indican que el insecto se ha adaptado a las condiciones de temperatura que prevalecen en los invernaderos del CNRCB atribuyéndose una mayor longevidad en la época de invierno debido a que es donde se presentan las temperaturas más cercanas a las óptimas para el desarrollo de D. citri (Liu y Tsai 2000b).
Tablas de vida. Los parámetros biológicos de la población estudiada muestran que la tasa de mortalidad específica (qx) mantiene valores bajos en los estadios III, IV y V (Tabla 3), indicando con esto que las condiciones de temperatura y humedad que se presentan en los invernaderos del CNRCB son adecuadas para el desarrollo de estos estadios, preferidos por T. radiata para ovipositar. Esta condición difiere para el estado de huevo, ninfas I y II donde los valores de qx se incrementan, indicando mayor vulnerabilidad a la temperatura. Esta observación coincide con el estudio realizado por Sule et al. (2012), donde mencionan que la mayor mortalidad de D. citri en laboratorio a 29 ± 1 °C se presenta en el primero y segundo estadio seguido del estado de huevo.
La esperanza de vida (ex) mostró los valores más bajos para el último estadio ninfal y para el adulto en ambas épocas. La fecundidad (mx = 12,2 verano; mx = 13,4 invierno) y la tasa neta de reproducción (Ro) alcanzaron valores superiores a la unidad revelando con esto que la población se encuentra en crecimiento (Southwood 1978; Rabinovich 1980) e indicando que la velocidad de crecimiento de la población de invierno fue mayor (Ro = 16,1) que la de verano (Ro = 4,1) (Tabla 3).
El porcentaje de inmaduros emergidos de los huevos, fue de 61,86 en verano y 76,92 en invierno (Tabla 3) debido posiblemente a la deshidratación originada por las altas temperaturas que se presentan en el invernadero del CNRCB. Bajo temperaturas controladas de 21 °C y utilizando a M. paniculata como hospedero, Baños et al. (2012) reportan porcentajes de viabilidad de 96,19. De igual forma Tsai y Liu (2000) mencionan que cuando la temperatura se ajusta a las óptimas (25 a 28 °C), la eclosión de los huevos ocurre en un 95,3 a 96% de los casos.
De las dos poblaciones evaluadas, 33 individuos llegaron a su fase adulta en verano (15,34%), y 102 en invierno (39,23%). A la fase de ninfa III, importante en la producción de parasitoides, se logró el 19,06% y 58,07% en verano e invierno respectivamente (Tabla 3). Bajo condiciones controladas de 21 ± 1 °C, Baños et al. (2012) reportan un 36% para la fase adulta y un 66,4% para la ninfa III; estudios comparativos que nos hacen suponer que las condiciones de invierno son más apropiadas para que el insecto pueda completar su ciclo debido a que se asemejan más a las condiciones que requiere D. citri para desarrollarse.
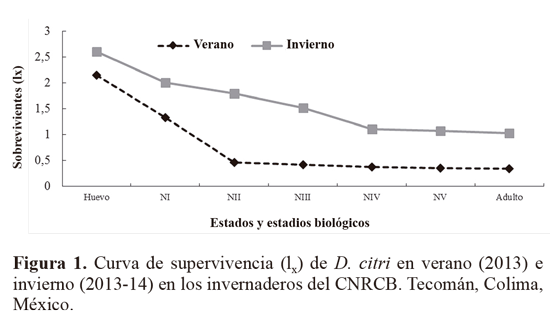
Individuos que superaron el estado de huevo y los estadios I y II tuvieron mayor probabilidad de vida, lo que se evidencia con la curva de supervivencia (lx). De acuerdo con los principales tipos de curvas de supervivencia propuestos en la literatura, los datos (Tabla 3) de D. citri obtenidos en verano asemejan una curva tipo II que se caracteriza porque la mortalidad natural afecta fundamentalmente a los individuos jóvenes de la población (Rabinovich 1980), caso contrario a la población de invierno que coincide con la obtenida por Baños et al. (2012), donde la curva de supervivencia se comportó de tipo IV, donde la posibilidad de vida en las primeras fases de desarrollo se mantuvo relativamente constante debido probablemente a que los estadios jóvenes son los más vulnerables a las elevadas temperatura (Fig. 1).
La prueba de Logrank, con una χ2cal = 39,1>χ20,05 (2-1) = 3,8415 nos revela que existió una diferencia entre las tablas de vida para D. citri en verano e invierno. Ésta observación se comprueba con la prueba Z│Z(cal)│= 5,05 > │Z(tab)│= 1,96, indicando que la proporción de individuos entre ambas tablas de vida difieren en el estado de huevo y en los estadios ninfales I y II donde ocurrió mayor mortalidad en verano (Tabla 3). Este comportamiento puede deberse a lo que comentan García-González et al. (2005) donde concluyen que los primeros estados de desarrollo de algunos insectos [Delphastus pusillus (Coleoptera: Coccinellidae)] son los más sensibles a las condiciones naturales de mortalidad, entre ellos la temperatura.
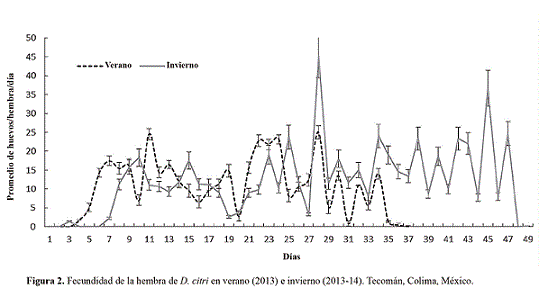
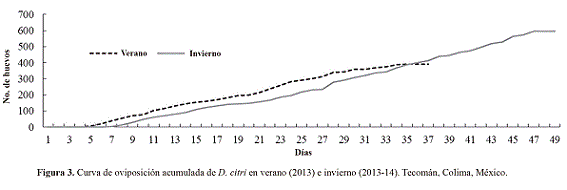
Características reproductivas. Para el periodo de oviposición en verano se registró en promedio un tiempo inferior (34,91 ± 0,51 días) que en invierno (47,33 ± 1,36 días) (Fig. 2) mientras que para la preoviposición el rango fue de 3 hasta 9 días en ambas épocas (Fig. 3).
El número de huevos que ovipositó la hembra de D. citri durante toda su vida en los cubos de producción fue de 541en verano con un promedio 391,1 ± 20,55, mientras que en invierno la mayor cantidad de huevos depositados por una hembra fue de 786 con un promedio de 597,4 ± 38,21. Esta diferencia se debe a que en la época de invierno el periodo de oviposición fue más prolongado con una longevidad mayor de la hembra. Huang (1990) y Chavan y Summanwar (1993) señalan que el número máximo de huevos por hembra varía de 630 a 900 dependiendo de las condiciones ambientales y de la planta hospedera. Así también Liu y Tsai (2000a) comentan que D. citri puede ovipositar 857 huevos en toronja y 572 en limón.
Una hembra ovipositó en promedio 11,5 ± 1,7 huevos en verano y 12,7 ± 2,1 en invierno, lo cual hace suponer que la densidad poblacional en la época de verano puede verse afectada por la mortalidad que sufran los primeros estadios ninfales y el estado de huevo debido a las altas temperaturas.
Bajo las condiciones del experimento, la producción huevo/hembra/día (Fig. 2) presentó los picos más altos a los 11 días en verano (24,50 ± 3,99 huevos) y 28 días para invierno (45,38 ± 5,85 huevos). Lin et al. (1973) reportan que la mayoría de los huevos de D. citri son puestos en los primeros 12 días, dato que difiere con la presente investigación ya que después del día 12, se presentaron durante 15 días posturas mayores a 20 huevos/día.
En la figura 2 se puede observar que la mayoría de las hembras se encontraron en la fase de postura después de los 7 días de vida, dato que se debe tomar en cuenta al momento de establecer el pie de cría de D. citri. Si consideramos esta condición y si sabemos que en el CNRCB se utiliza a los adultos de D. citri para infestar plantas de M. paniculata en tres ocasiones durante un periodo de siete días cada una, entonces, conociendo que la hembra ovipositó hasta su muerte, podemos recomendar utilizar los adultos en cuatro ocasiones para verano y seis para invierno.
La curva de oviposición acumulada (Fig. 3) muestra un incremento en la cantidad de huevos puestos por la hembra desde el día 5 en verano y 7 en invierno hasta su muerte. Esta observación nos indica que la hembra, en presencia del macho, oviposita durante toda su vida. En la misma figura 3 se puede observar que en verano, las hembras ovipositan una mayor cantidad de huevos que en invierno; sin embargo, la prueba de "t" con una α = 0,05 indica que no existió diferencia entre ambas poblaciones (F = 1,59; P > 0,1512); la cantidad de huevos ovipositados por una hembra fue similar en las dos épocas. Aunque no existe diferencia estadística en la producción de huevos la curva acumulada de oviposición nos muestra que la mayor longevidad de las hembras además de un mayor periodo de oviposición, resulta en una mayor cantidad de huevos puestos en invierno.
Los datos obtenidos sin duda alguna forman parte de la información básica en el manejo de D. citri y su parasitoide T. radiata los cuales serán utilizados en el programa de control biológico del psílido asíatico de los cítricos. Así mismo, esta información permitirá realizar un manejo de la biología del insecto, optimizar recurso económico y humano y hacer predicciones en el proceso de producción.
Conclusiones
En este trabajo se generó información sobre la duración de los estados y estadios de D. citri producida bajo condiciones no controladas en invernaderos, mismos que son utilizados para la producción de su parasitoide T. radiata. El ciclo biológico fue mayor en invierno que en verano donde la ninfa V, preferida por el parasitoide, fue la que más vivió en ambas épocas. En el estado adulto, las hembras fueron más longevas que los machos. La época de invierno fue la más apropiada para producir mayor cantidad de individuos de D. citri para ser utilizados en el proceso de producción masiva del parasitoide T. radiata. La temperatura afectó en mayor proporción al estado de huevo y los primeros estadios ninfales principalmente en la época de verano. Las hembras se caracterizaron por ovipositar durante toda su vida siendo la mayor postura en la época de invierno. Con el periodo de preoviposición y oviposición determinados, se recomienda calendarizar el tiempo durante el cual las hembras deben permanecer en el proceso de producción de insectos.
Literatura citada
ALEMÁN, J.; BAÑOS, H.; RAVELO, J. 2007. Diaphorina citri y la enfermedad huanglongbing: una combinación destructiva para la producción citrícola. Revista Protección Vegetal 22 (3): 154-165. [ Links ]
BAÑOS, H.; ALEMÁN, J.; MARTÍNEZ, MA. Á.; MIRANDA, I.; RODRÍGUEZ H.; SURIS, M.; RAVELO, J. 2012. Ciclo y tablas de vida horizontal de Diaphorina citri Kuwayama (Hemiptera: Psillidae) sobre Murralla paniculata L. Revista Protección Vegetal 27 (2): 95-101. [ Links ]
BEGON, M.; HARPER, J. L.; COLIN, C. R. 1988. Ecología: individuos, poblaciones y comunidades. Editorial Omega S. A. Barcelona. 883 p. [ Links ]
BOVÉ, J. M. 2006. Huanglongbing: A destructive, newly emerging, century-old disease of citrus. Journal of Plant Pathology 88: 7-37. [ Links ]
CNRCB. (Centro Nacional de Referencia de Control Biológico). 2014. Laboratorio de Reproducción Masiva de Tamarixia radiata del CNRCB. Disponible en: http://senasica.gob.mx/?id=4157(México) [Fecha revisión: 21 julio 2014] [ Links ].
CHAVAN, V. M.; SUMMANWAR, A. S. 1993. Population dynamics and aspects of the biology of citrus psyla, Diaphorina citri Kuw. in Maharashtra. En: Morales, V. P.; Fonseca, O.; Noguera, Y.; Cabaña, W.; Ramos, F.; Escalona, E.; Rosales, C.; Cermeli, M.; Salas, B.; Sandoval, E. 2010. Evaluación del ciclo de vida del psílido asiático de los cítricos en cinco plantas hospederas. Agronomía Tropical 60 (3): 283-286. [ Links ]
EBRATT-RAVELO, E. E.; RUBIO-GONZÁLEZ, L. T.; COSTA V., A.; CASTRO-ÁVILA, Á. P.; ZAMBRANO-GÓMEZ, E. M.; ÁNGEL-DÍAZ, J. E. 2011. Diaphorina citri (Kuwayama, 1907) and Tamarixia radiata (Waterston, 1922) in citrus crops of Cundinamarca, Colombia. Agronomía Colombiana 29 (3): 487-493. [ Links ]
EPPO. European and Mediterranean Plant Protection Organization. 2013. Database on quarantine pest. Diaphorina citri. (En línea). Disponible en: http://www.eppo.org/QUARANTINE/insects/Diaphorina_citri/DIAACI_ds.pdf. [Fecha revisión: 2 julio 2013] [ Links ].
ETIENNE, J.; QUILICI, S.; MARIVAL, D.; FRANCK, A. 2001. Biological control of Diaphorina citri (Hemiptera: Psyllidae) in Guadeloupe by imported Tamarixia radiata (Hymenoptera: Eulophidae). Fruits 56 (5): 307-315. [ Links ]
FONSECA, O.; VALERA, N.; VÁSQUEZ, C. 2007. Registro y ciclo de vida de Diaphorina citri Kuwayama (Hemiptera: Psyllidae) en tres hospederos en el estado Lara, Venezuela. Entomotropica 22 (3): 145-152. [ Links ]
FUNG, Y. C.; CHEN, C. N. 2006. Effects of temperature and host plant on population parameters of the citrus psyllid (Diaphorina citri Kuwayama). Formosan Entomologia 26:109-123. [ Links ]
GARCÍA-GONZÁLEZ, J.; BENÍTEZ S., E. R.; LÓPEZ-ÁVILA, A 2005. Tabla de vida de Delphastus pusillus(Coleoptera: Coccinellidae) en la mosca blanca Trialeurodes vaporariorum (Hemiptera: Aleyrodidae). Revista Colombiana de Entomología 31 (2): 155-160. [ Links ]
HALBERT, S. E.; MANJUNATH, K. L. 2004. Asian citrus psyllids Diaphorina citri (Sternorrhyncha: Psyllidae) and greening disease in citrus: A literature review and assessment of risk in Florida. Florida Entomologist 87: 330-353. [ Links ]
HODKINSON, I. D. 2009. Life cycle variation and adaptation in jumping plant lice (Insecta: Hemiptera: Psylloidea): a global synthesis. Journal of Natural History 43:1-2, 65-179. [ Links ]
HUANG, B. 1990. Citrus psyllid. Chinese Agricultural Encyclopedia (Volume Insects). Beijing: Agriculture Press. (En chino con resumen en inglés). pp. 119-120. [ Links ]
HUANG, C. H.; TSAI, M. Y.; WANG, C. L. 1984.Transmission of citrus likubin by a psyllid, Diaphorina citri. Journal Agricultural Research China33 (1): 15-72. [ Links ]
HUSAIN, M. A.; NATH, D. 1927. The citrus psylla Diaphorina citri, (Kuw.) Psyllidae: Homoptera. En: Tsai, J. H.; Liu, Y. H. 2000. Biology of Diaphorina citri (Homoptera: Psyllidae) on Four Host Plants. Journal of Economic Entomology 93 (6): 1721-1725. [ Links ]
LIN, S.; Ke, Y; TAO, C. 1973. Bionomic observation and integrated control of citrus psylla, Diaphorina citri Kuwayama. China Horticulture 19: 234-242 (En chino con resumen en inglés). [ Links ]
LIU, Y. H.; TSAI, J. H. 2000a. Effect of the temperature on biology and life table parameters of the Asian citrus psyllid Diaphorina citri Kuwayama (Homopetra: Psyllidae). Annals of Applied Biology137: 201-216. [ Links ]
LIU, Y. H.; TSAI, J. H. 2000b. Biology of Diaphorina citri (Homoptera: Psyllidae) on four host plants. Journal of Economic Entomology 93: 1722-1725. [ Links ]
MARTINEZ, A. L.; WALLACE, J. M. 1967. Citrus leaf-mottle-yellows disease in the Philippines and transmission of the causal virus by a psyllid, Diaphorina citri. En: Donovan, N. J.; Beattie, G. A. C.; Chambers, G. A.; Holford, P.; Englezou, A.; Hardy, S.; Dorjee; Phuntsho Wangdi; Thinlay; Nagay Om. 2012. First report of 'Candidatus Liberibacterasiaticus' in Diaphorina communis. Australasian Plant Disease Notes 7: 1-4. [ Links ]
MEAD, F. W. 1977. The Asiatic citrus psyllid, Diaphorina citri Kuwayama (Homoptera: Psyllidae). Florida Departament of Agriculture and Consumer Services. Division of Plant Industry. Circular No. 180. 4 p. [ Links ]
MORALES, V. P.; FONSECA, O.; NOGUERA, Y.; CABAÑA, W.; RAMOS, F.; ESCALONA, E.; ROSALES, C.; CERMELI, M.; SALAS, B.; SANDOVAL, E. 2010. Evaluación del ciclo de vida del psílido asiático de los cítricos en cinco plantas hospederas. Agronomía Tropical 60 (3): 283-286. [ Links ]
NAKATA, T. 2006. Temperature-dependent development of the citrus psyllid, Diaphorina citri (Homoptera: Psylloidea), and the predicted limit of its spread based on overwintering in the nymphal stage in temperate regions of Japan. Applied Entomology and Zoology 41: 383-387. [ Links ]
NAVA, D. E.; TORRES, M. L. G.; RODRIGUES, M. D. A.; BENTO, J. M. S.; PARRA, J. R. P. 2007. Biology of Diaphorina citri (Hem., Psyllidae) on different hosts and at different temperatures. Journal of Applied Entomology 131: 709-715. [ Links ]
NAVA, D. E.; TORRES, M. L. G.; RODRIGUES, M. D. A.; BENTO, J. M. S.; HADDAD, M. L.; PARRA, J. R. P. 2010. The effects of host, geographic origin, and gender on the thermal requirements of Diaphorina citri (Hemiptera: Psyllidae). Entomological Society of America 39 (2): 678-684. [ Links ]
RABINONOVICH, J. 1980. Introducción a la ecología de poblaciones animales. Editorial Continental S. A. México. 313 p. [ Links ]
SAS Institute. 2008. SAS Users Guide: Statistics version 9.02 for Windows. SAS Institute Inc., Cary, North Carolina. [ Links ]
SULE, H.; MUHAMAD, R.; OMAR, D.; HEE, A. 2012. Life table and demographic parameters of Asian citrus Psyllid Diaphorina citri on Limau Madu Citrus suhuensis. Journal of Entomology 9 (3): 146-154. [ Links ]
SOUTHWOOD, T. R. E. 1978. Ecological methods with particular reference to the study of insect population. Chapman and Hall, Londres (Inglaterra), pp. 357-387. [ Links ]
TSAI, J. H.; LIU, Y. H. 2000. Biology of Diaphorina citri (Homoptera: Psyllidae) on four host plants. Journal of Economic Entomology 93 (6): 1721-1725. [ Links ]
TSAI, J.; WANG, J.; LIU, Y. H. 2000. Sampling of Diaphorina citri (Homoptera: Psyllidae) on orange jessamine in Southern Florida. Florida Entomologist 83 (4): 446-459. [ Links ]
TSAI, J.; WANG, J.; LIU Y. 2002. Seasonal abundance of the Asian citrus Psyllid, Diaphorina citri (Homoptera: Psyllidae) in Southern Florida. Florida Entomologist 85 (3): 446-451. [ Links ]
VELÁZQUEZ-BLANCO, L. 2003. Aspectos biológicos de las plagas en los cultivos agrícolas. INATEC (Nicaragua) 39 p. [ Links ]
WATERSTON, J. 1922. On the chalcidoid parasites of psyllids (Hemiptera, Homoptera). Bulletin of Entomological Research 13 (1): 41-58. [ Links ]
Recibido: 17-oct-2014
Aceptado: 23-nov-2015
Citación sugerida:
PALOMARES-PÉREZ, M.; CÓRDOBA-URTIZ, E. G.; SÁN- CHEZ-GONZÁLEZ, J. A.; MEDINA-GARCÍA, N. I.; HERNÁNDEZ-MENDOZA, R.; PÉREZ-DÍAZ, V. H.; ARREDONDO-BERNAL, H. C. 2015. Aspectos biológicos de Diaphorina citri (Hemiptera: Liviidae) bajo condiciones no controladas en invernadero. Revista Colombiana de Entomología 41 (2): 228234. Julio - Diciembre 2015. ISSN 0120-0488.