Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. v.42 n.2 Bogotá 2016
Enemigos naturales de Stenoma cecropia (Lepidoptera: Elachistidae) en palma de aceite, en el suroccidente de Colombia
Natural enemies of Stenoma cecropia (Lepidoptera: Elachistidae) in oil palm, in the southwest of Colombia
CARLOS ANDRÉS SENDOYA-CORRALES1 y ALEX ENRIQUE BUSTILLO-PARDEY2
1 Ing. Agr. Auxiliar de Investigación Área Entomología, Programa Plagas y Enfermedades, Cenipalma. Bogotá, Colombia. Apartado Postal 111611, csendoya@cenipalma.org, autor para correspondencia.
2 Ing. Agr., Ph. D. Coordinador Programa Plagas y Enfermedades, Cenipalma. Bogotá, Colombia, abustillo@cenipalma.org.
RESUMEN
Stenoma cecropia infesta las nuevas siembras del híbrido interespecífico (Elaeis oleifera x E. guineensis) de palma de aceite en la zona de Tumaco (Nariño). Sus infestaciones afectan grandes extensiones de palma y causan defoliaciones de importancia económica. Por tal motivo, el objetivo de este trabajo fue determinar los factores bióticos y abióticos que afectan las poblaciones de la plaga a través de muestreos secuenciales quincenales, siguiendo un sistema móvil de desplazamiento 2 x 2, que consistió en realizar un muestreo cada dos palmas y cada dos líneas, en una hectárea de palma de aceite, contabilizando el número de individuos vivos y muertos de S. cecropia presentes en la hoja 17 y 25 de cada palma evaluada. Los resultados indican que S. cecropia es atacada por una diversidad de depredadores, parasitoides y entomopatógenos. Entre los primeros se encuentran las arañas (Araneae), chinches (Reduviidae), avispas (Vespidae) y hormigas (Formicidae), destacándose el género Crematogaster. Se encontró que Brachymeria sp. y Rhysipolis sp., fueron los parasitoides más frecuentes. Estas especies requieren del néctar de plantas como: Melanthera aspera, Solanum quitoense, Emilia sonchifolia, Lantana camara, Cassia reticulata, Stachytarphetacayennensis y Urena lobata, para su alimentación. También se colectaron larvas de S. cecropia infectadas por el hongoIsaria sp. Al estimar el efecto de estos controladores biológicos sobre las poblaciones de S. cecropia, se encontró que la depredación de la hormiga Crematogaster sp., sobre larvas de S. cecropia fue de 42,0 %. El parasitismo causado porBrachymeria sp., a las pupas fue de 16,8 %, la mortalidad causada por Rhysipolis sp., sobre el estado larval fue de 3,5 % y el efecto de Isaria sp., fue de 1,5 %. Se concluye que estos controladores biológicos son importantes en la regulación de las poblaciones de S. cecropia en el cultivo de la palma de aceite en Colombia.
Palabras clave: Control biológico. Análisis faunístico. Crematogaster. Brachymeria. Rhysipolis. Isaria sp.
ABSTRACT
Stenoma cecropia infests new plantations of hybrid oil palm (Elaeis oleifera x E. guineensis) in Tumaco (Nariño). These infestations are causing defoliation of economic importance to the oil palm. For this reason, the aim of this study was to determine the biotic and abiotic factors affecting populations through fortnightly sequential sampling, following a 2 x 2 moving displacement system, which sampled every two palms and every other line in a one hectare oil palm plantation, counting the number of live and dead individuals present in the 17th and 25th S. cecropia leaves of each palm evaluated. Results indicate that S. cecropia is attacked by a variety of predators, parasitoids and entomopathogens. Among the former are the spiders (Araneae), bugs (Reduviidae), wasps (Vespidae), and ants (Formicidae), with Crematogaster being the most important. Among the parasitoids, Brachymeria sp. and Rhysipolis sp. were most abundant. These species require the nectar of plants such as Melanthera aspera, Solanum quitoense, Emilia sonchifolia, Lantana camera, Cassia reticulata, Stachytarpheta cayennensis and Urena lobata, for food until the adult stage. An entomopathogenic fungus was also detected infecting the larval stage and was identified as Isaria sp. Crematogaster sp. predation on larval stages of S. cecropia was estimated to be 42 %. Parasitism by Brachymeria sp. in pupal stages was 16.8 %, mortality caused by Rhysipolis sp. on larval stages was 3.5 % and mortality by Isaria sp. was 1.5 %. It is concluded that these biological control agents are important in the regulation of S. cecropia populations in oil palm plantations in Colombia.
Key words: Biological control. Faunal analysis. Crematogaster. Brachymeria. Rhysipolis. Isaria sp.
Introduction
Stenoma cecropia Meyrick (Lepidoptera: Elachistidae) se ha registrado ocasionando graves pérdidas en el cultivo de palma de aceite en países como Colombia, Brasil y Ecuador (Genty 1978). En Colombia se encuentra en las zonas palmeras de Santander (Cesar), Norte de Santander y en Tumaco (Nariño) en Elaeis guineensis Jacquin (Arecaceae) (Rahmana 1994). A partir del 2011 en la zona suroccidental palmera, se han presentado ataques de este insecto en las nuevas plantaciones del híbrido interespecífico Elaeis oleifera x E. guineensis (O x G).
En la zona suroccidental (Tumaco) de Colombia la emergencia fitosanitaria originada por la enfermedad pudrición del cogollo (PC) ocasionó la pérdida y erradicación de 36.934 ha de E. guineensis, entre enero de 2007 y febrero de 2008 (Corredor et al. 2008). Como respuesta a esta problemática fitosanitaria los palmicultores emprendieron la renovación del cultivo con la siembra de 15.902 ha (Fedepalma 2013) del híbrido interespecífico E. oleifera x E. guineensis de palma de aceite, tolerante a esta enfermedad que puso en peligro la economía local. Luego de la renovación de este cultivo con la siembra del híbrido interespecífico, se incrementaron las poblaciones existentes de Rhynchophorus palmarum (L.) (Coleoptera: Dryophthoridae) ya que este se encontraba reproduciéndose en las palmas del cultivo anterior de E. guineensis (Corredor et al. 2008; Quintero 2010), y empezaron a atacar las inflorescencias de los híbridos. Posterior a éste se sumó Strategus aloeus (L.) (Coleoptera: Melolonthidae) que infestó los estípites abandonados de las palmas muertas por la PC atacando a las palmas jóvenes de estas nuevas siembras del híbrido. Otros insectos que incrementaron sus poblaciones y que se detectaron afectando el híbrido fueron S. cecropia, Sagalassa valida Walker (Lepidoptera: Glyphipterigidae), Demotispa neivai Bondar (Coleoptera: Chrysomelidae) y Opsiphanes cassina Felder (Lepidoptera: Nymphalidae).
El comportamiento y la biología de S. cecropia, han sido estudiados por varios autores. Genty (1978) encontró que la duración de este insecto de huevo a adulto era de 57 a 60 días, bajo condiciones de campo, lo cual coincide con lo encontrado por Barrios et al. (2013) quienes indican que la duración promedia fue de 58,2 ± 6,4 días. Genty (1978) y Mexzón y Chinchilla (2004) describieron la morfología de los estados de desarrollo de la plaga. Genty (1978) encontró que una larva madura puede consumir 58,5 cm² del follaje; en contraste con esto, Barrios et al. (2013) hallaron que, bajo condiciones de laboratorio, el consumo foliar de una larva de S. cecropia fue de 36,7 ± 12,3 cm². Esta información muestra el potencial de S. cecropia para causar defoliaciones de importancia económica en la palma de aceite.
Entre las estrategias de control utilizadas para reducir las poblaciones de S. cecropia está la aplicación de insecticidas, que producen efectos negativos sobre la fauna de insectos benéficos que se encuentran en el agro ecosistema de la palma de aceite (Calvache 1991). Por lo tanto, una de las mejores opciones es la reducción del uso de insecticidas y el establecimiento de plantas nectaríferas sobre las cuales estos benéficos se puedan alimentar, asegurando así un equilibrio ecológico entre los insectos plagas y benéficos (Calvache 1991).
Se conoce un gran número de enemigos naturales de S. cecropia que regulan naturalmente sus poblaciones. En el estado de huevo se ha registrado el parasitoide Trichogramma pretiosum Riley (Hymenoptera: Trichogrammatidae) en Puerto Wilches (Santander) y en San Alberto (Cesar) (Castillo et al. 2000). En el estado larval se presentan Rhysipolis sp. Förster (Hymenoptera: Braconidae) en Colombia; Euphorocera floridensis Townsend (Diptera: Tachinidae), registrado en Brasil, Venezuela y Ecuador (Delvare y Genty 1992). De igual manera se registran varios parasitoides de pupa como: Brachymeria sp., B. subconica y Pseudobrachymeria sp. (Hymenoptera: Chalcididae), en Ecuador y Colombia frecuentando plantas como Solanum hirtum Vahl. (Solanaceae), nectarífera utilizada en el cultivo de palma de aceite (Delvare y Genty 1992). En Costa Rica, se registraron altos porcentajes de parasitismo de Trichospilus diatraeae Cherian y Margabandhu (Hymenoptera: Eulophidae) en pupas de S. cecropia (Mexzón y Chinchilla 1992). Entre los depredadores se encuentran varios de las familias Reduviidae y Pentatomidae (Hemiptera); dípteros (Syrphydae), coleópteros (Carabidae y Dermestidae); himenópteros (Formicidae y Vespidae) (Genty 1978); además arañas (Araneae), depredando sus poblaciones. Bajo condiciones de laboratorio Beauveria spp. Vuillemin (Clavicipitaceae) causaron mortalidades que oscilaban entre 36 % y 100 % sobre estados larvales de S. cecropia (Valencia 2007). Calvache y Gómez (1991) reportan que durante 1990 en Colombia se utilizó Bacillus thuringiensis Berliner (Bacillaceae) para el control de un amplio número de defoliadores del orden Lepidoptera, entre ellos S. cecropia (Fig. 1)
En las zonas palmeras de Colombia, se realizan continuamente muestreos para el monitoreo de plagas de la palma de aceite, para determinar las plagas presentes y la abundancia de sus estados de desarrollo, y así decidir cuándo se realiza un control químico, sin tener en cuenta las poblaciones de la fauna benéfica presente en el agro ecosistema de la palma de aceite. Este uso indiscriminado de insecticidas, conduce al desarrollo de resistencia del insecto, a la destrucción de la fauna benéfica y a elevar los costos de producción del palmicultor (Castillo et al. 2000; Morillo y Notz, 2001; León et al. 2012). Por lo tanto, para la toma de decisiones acertadas de manejo de sus poblaciones es importante conocer los factores claves de mortalidad que influyen en las poblaciones de S. cecropia y establecer si existe efecto de las condiciones ambientales en la dinámica poblacional de esta plaga. Por otra parte, se identificaron las plantas nectaríferas que sirven de alimento y refugio a la entomofauna asociada a esta plaga.
Materiales y métodos
Área de estudio. El estudio se llevó acabo en la plantación Palmeiras Colombia S.A. ubicada en la vereda Candelillas (1°26’8,83"N, 78°41’3,82"O), a 58 km del municipio de Tumaco (Nariño, Colombia) durante octubre de 2012 y febrero de 2014. El lote fue sembrado en el 2009 con híbrido interespecífico (E. oleífera x E. guineensis) a una distancia de siembra de 9 m entre plantas a tres bolillos, a una altitud de 51 msnm y con condiciones climáticas promedias durante el estudio de 25,4 ± 0,7 ºC, humedad relativa del 86,6 ± 2,1 %.
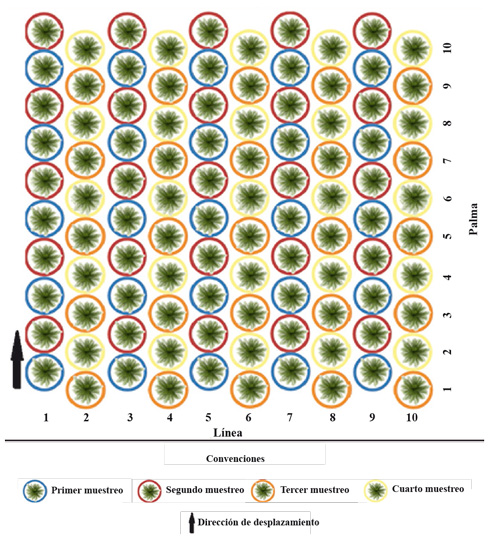
Se utilizó como área experimental una hectárea de un lote de híbrido de palma de aceite infestado por S. cecropia, el cual no fue intervenido para el control de plagas, el resto de la plantación fue manejada con aplicación de insecticidas de síntesis químico. Para cuantificar las poblaciones se realizaron muestreos secuenciales quincenales durante la mañana (8:00 am – 12:00 pm), siguiendo un sistema móvil de desplazamiento 2 x 2, que consistió en realizar un muestreo cada dos palmas y cada dos líneas. El primer muestreo se inició en la palma uno de la línea uno. El segundo muestreo en la palma dos de la línea uno, el tercero en la palma uno de la línea dos, el cuarto muestreo empezó en la palma dos de la línea dos y así sucesivamente (Fig. 2). Se evaluó un total de 25 palmas por muestreo del área de estudio. En cada palma muestreada, se colectó y registró el número de individuos de S. cecropia vivos y afectados por algún factor de mortalidad (entomopatógenos, depredadores y parasitoides) presentes en las hojas 17 y 25.
Factores de mortalidad. Para evaluar la depredación de las hormigas (Crematogaster sp.) sobre el estado larval de S. cecropia e identificar la presencia de parasitoides en el estado de pupa, se realizaron colectas de estos estados con su estructura de protección (cuerno) y con parte del folíolo, se llevaron al invernadero; donde las larvas se adhirieron a nuevos foliolos de palma con ayuda de un gancho (clip) metálico. El cambio de las larvas a nuevos folíolos dependió del consumo de follaje por parte de las larvas de S. cecropia. Cada grupo de larvas colectadas a través del tiempo se separaron en diferentes palmas que se encontraban dentro del invernadero y diariamente se contabilizó el número de larvas depredadas por grupos de hormigas (presencia de hormigas en el cuerno, con ausencia de larva dentro de este) que se encontraban establecidos sus nidos de manera natural dentro del invernadero. Las pupa colectadas, se confinaron en una jaula plástica de emergencia (largo 18 cm x ancho 15 cm x profundidad 9 cm); donde luego se obtuvieron los adultos de S. cecropia y los parasitoides que posteriormente fueron identificados comparando las características morfológicas, mediante el uso de claves taxonómicas (Fernández y Sharkey 2006).
Los individuos colectados muertos a través del tiempo, se llevaron al laboratorio para su observación e identificación. Las larvas infectadas con hongos, se depositaron en cajas Petri con humedad, para favorecer la manifestación del microorganismo, y se enviaron al Laboratorio de Entomopatógenos de Cenipalma en Bogotá, para su identificación. Además, aquellas larvas que tenían la boca de su estructura de protección (cuerno) taponada por una capa cerosa (con signos de parasitismo) se aislaron en vasos plásticos, hasta la emergencia del parasitoide y su posterior identificación con ayuda de claves taxonómicas (Fernández y Sharkey 2006).
Las condiciones climáticas (precipitación, humedad relativa y temperatura) se registraron cada 30 min durante todo el día, con ayuda de la estación meteorológica (Davis, serie Ventage Vue™), ubicada en la plantación.
Identificación de plantas nectaríferas. En el agro ecosistema de la palma de aceite existe una gran diversidad de plantas nectaríferas que los adultos de los insectos benéficos visitan para alimentarse y resguardarse. Por lo tanto se realizaron observaciones quincenales sobre la presencia de insectos benéficos en las plantas nectaríferas predominantes del lote en estudio. Estas observaciones se realizaron durante 16 meses entre las 8:00 am y 12:00 pm., para determinar que plantas visitan los insectos benéficos.
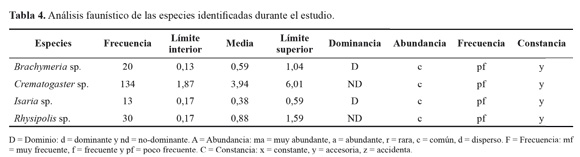
Análisis de datos. Se calculó el índice de correlación de Pearson de los dos estados de desarrollo (larva y pupa) de S. cecropia presentes durante el estudio, entre las variables climáticas (precipitación, humedad relativa y temperatura) y el total de enemigos naturales que controla cada estado de desarrollo de S. cecropia. El efecto depredador de las hormigas Crematogaster sp. y análisis faunístico (dominancia, abundancia, frecuencia y constancia), se analizó utilizando el paquete estadístico SAS 9.1.
La dominancia de las especies encontradas fue determinada a través de la ecuación propuesta por Silva (1993):
Donde LD = límite de dominio y S = número total de especies. De acuerdo con este parámetro, las especies fueron clasificadas en dominantes (d) cuando los valores de la frecuencia fueron superiores a este límite; y no dominantes (nd) cuando los valores encontrados fueron menores. La abundancia fue calculada según Silveira Neto et al. (1976). Los valores se obtuvieron a partir de los intervalos de confianza de 1 y 5 % sobre los promedios obtenidos del número total de individuos de cada especie en el lote de estudio. De esta manera, se obtuvieron intervalos alrededor del promedio, usados para clasificar las especies en raras (r), dispersas (d), comunes (c), abundantes (a) y muy abundantes (ma). El cálculo de la frecuencia agrupada de las especies encontradas durante el estudio, se clasificaron en poco frecuentes (pf), frecuentes (f) o muy frecuentes (mf) según Thomazini y Thomazini (2002). Este parámetro faunístico se determinó a través de la presencia de cada especie en relación con el total de muestreos realizados (Silveira Neto et al. 1976) y los valores obtenidos a partir de los cálculos de los intervalos de confianza de 5 % sobre los promedios de los registros totales para cada especie identificada. La constancia se determinó según la ecuación presentada por Silveira Neto et al. (1976).
Siendo C = porcentaje de constancia, P = número de colectas que contenían la misma especie y N = número total de colectas realizadas durante el estudio. Según lo anterior las especies fueron clasificadas en constantes (x); es decir que las especies estuvieron presentes en más de 50 % de los muestreos, accesorias (y) presentes entre 25 - 50 % de los muestreos o accidentales (z) presentes en menos de 25 % de los muestreos.
Resultados y discusión
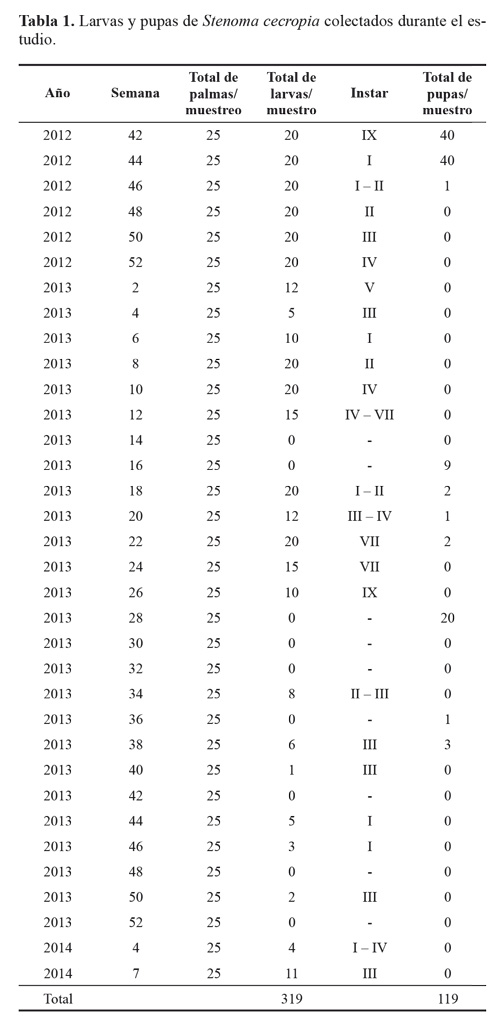
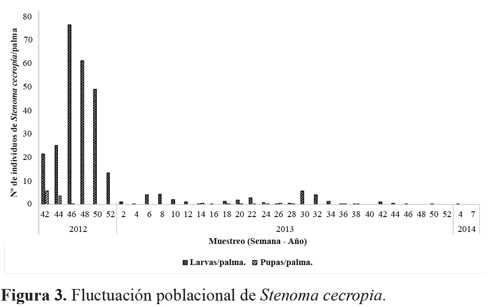
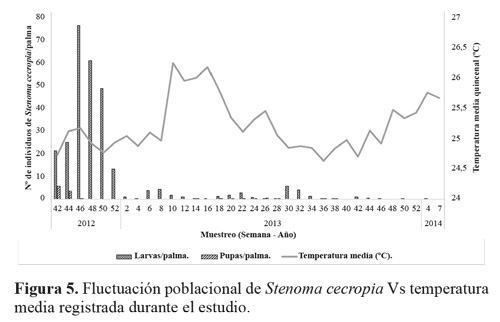
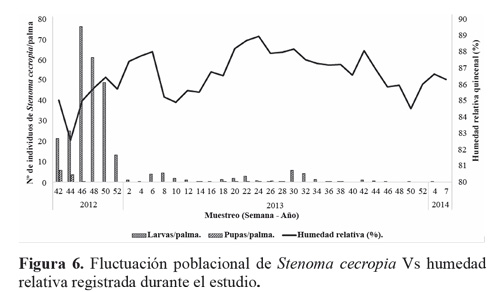
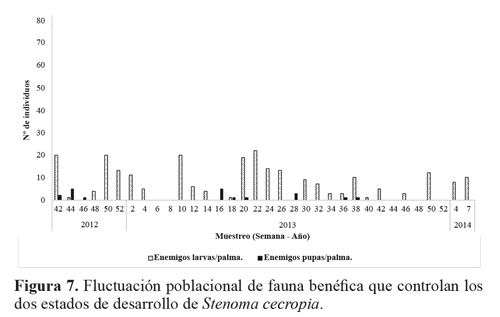
El estado larval de S. cecropia predominó durante todo el tiempo del experimento, muestreando un total de 319 larvas de todos los instares, y 119 pupas (Tabla 1). No se registraron huevos del insecto durante los muestreos; debido a la duración de este estado (4,8 ± 0,8 días) Barrios et al. (2013) y a que no coincidía con los periodos de muestreo. Al inicio del estudio se encontraron 21,5 larvas por palma y se tuvo un máximo de 76,5 larvas por palma. A medida que continuaron los muestreos a través del tiempo las poblaciones de S. cecropia disminuyeron hasta no encontrar más individuos (Fig. 3). Esto se atribuye al efecto de control de los enemigos naturales de los dos estados de desarrollo que estuvieron presentes durante todo el tiempo del estudio (Fig. 7).
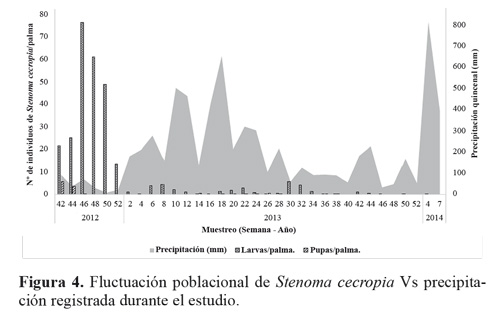
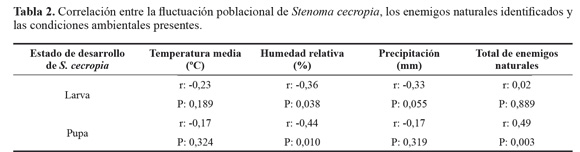
Al correlacionar la población de larvas y pupa de S. cecropia con las condiciones climáticas (temperatura media, humedad relativa y precipitación) y el total de enemigos naturales de cada estado de desarrollo de S. cecropia observados a través del tiempo (Fig. 7), se encontró que hay correlación (Pearson) significativa entre las poblaciones de larvas y pupas de S. cecropia con la humedad relativa y también entre el total de enemigos naturales del estado de pupa y la fluctuación poblacional de pupas de S. cecropia (Tabla 2).
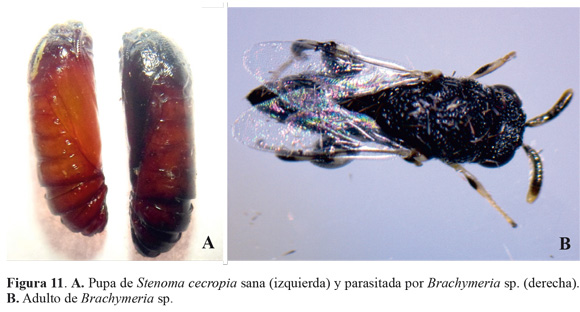
Los muestreos de larvas de S. cecropia indicaron que este estado fue afectado por un gran número de enemigos naturales que se encontraron en el agro ecosistema de la palma de aceite en la zona suroccidental de Colombia. Los más frecuentes fueron depredadores de larvas como arácnidos (Araneae), chinches (Reduviidae), avispas (Vespidae) (Fig. 8), pero resaltan hormigas del género Crematogaster sp. (Fig. 8E). Esta abundancia fue seguida por el grupo de parasitoides, entre los que se destaca Rhysipolis sp. (Fig. 9) para el estado de larvas y Brachymeria sp. (Fig. 11) en pupas. Además de estos controladores mencionados se detectó la presencia del hongo entomopatógeno Isaria sp. (Fig. 10) que contribuyó al control natural de esta plaga.
Las hormigas Crematogaster sp. fueron un factor de gran importancia en la regulación de las poblaciones de S. cecropia debido a que depredaron un 42 % de las larvas (Fig. 8E) (Tabla 3). La depredación fue más alta en larvas mayores al III estadio, con un promedio de depredación del 41,4 %. Con relación a las larvas de I y II estadio el efecto depredador fue menor (0,6 %), debido a que las hormigas no pudieron penetrar la estructura de protección (cuerno) del insecto ya que el orificio de entrada es muy pequeño. Esta actividad depredadora de Crematogaster sp., también se ha registrado sobre poblaciones de Leptopharsa gibbicarina Froeschner (Hemiptera: Tingidae), reduciendo sus poblaciones en 73 % (Montañez et al. 1997). Varios autores (Aldana et al. 1998; Aldana et al. 2000) recomiendan la protección y conservación de las colonias de Crematogaster sp., para el manejo de L. gibbicarina, práctica que favorece la reducción de sus poblaciones.
Otro de los controladores naturales fue el parasitoide Rhysipolis sp. (Fig. 9), que atacó larvas mayores al III estadio y causó una mortalidad del 3,5 % (Tabla 3). Se observó que por cada larva de S. cecropia parasitada emergían entre 6 y 8 adultos de este parasitoide, coincidiendo con lo registrado por Mexzón y Chinchilla (2004). Estos autores indican que Rhysipolis sp., causa una mortalidad entre el 7 y el 20 % en poblaciones de S. cecropia. Aldana et al. (2010) encontraron un parasitismo del 35 % sobre S. cecropia durante época seca, parasitando larvas del II al V estadio. Genty (1978) encontró que las hembras de Rhysipolis sp., adhieren sus huevos sobre la zona pleural del tórax de S. cecropia. Las larvas de Rhysipolis sp., son ectoparasitoides que construyen una serie de celdas cilíndricas de 6 mm de longitud dentro de las larvas de S. cecropia, contribuyendo así con el 18 % de parasitismo en las larvas de S. cecropia (Genty 1978).De larvas de S. cecropia se aisló un hongo entomopatógeno identificado como Isaria sp., que en el pasado se refería como Beauveria brongniartii (Fig. 10). Este hongo causó un parasitismo del 1,5 % pero es posible que, bajo otras condiciones de mayor humedad, su incidencia pueda ser mayor (Tabla 3).
En relación con Brachymeria sp. (Fig. 11), de las 119 pupas colectadas de S. cecropia se encontraron 20 pupas parasitadas, representado el 16,8 % de parasitismo (Tabla 3), coincidiendo la emergencia del parasitoide con épocas de baja precipitación; octubre y noviembre (2012), mayo, julio y septiembre (2013). Las pupas parasitadas mostraron una coloración rojiza opaca con segmentos negros, que contrastaron con las pupa sanas de color marrón brillante (Fig. 7). Genty (1989) indica que este parasitoide es uno de los más frecuentes en poblaciones bajas de S. cecropia. Mexzón y Chinchilla (1992) en Costa Rica encontraron que los géneros Brachymeria y Conura son los más comunes en palmas de aceite, atacando varias especies de defoliadores.
En relación con las plantas nectaríferas, se encontró que estas eran fuente de alimento para muchos de los adultos de las especies de insectos benéficos encontradas en este estudio. Estas especies son: Melanthera aspera Small. (Asteraceae), Emilia sonchifolia (L.) (Asteraceae), Solanum quitoense Lamarck. (Solanaceae), Lantana camara L. (Verbenaceae), Cassia reticulata Willd. (Fabaceae), Stachytarpheta cayennensis (Rich.) (Verbenaceae) y Urena lobata L. (Malvaceae) (Fig. 12). Mckenzie (1977) y Genty (1984) observaron Rhysipolis sp., en C. reticulata y M. aspera, y Brachymeria sp., presente en M. aspera y S. nigrum L. especies presentes en los ecosistemas de la palma de aceite en Colombia por Aldana et al. (1996) y Argumero (2000), Mexzón y Chinchilla (1992), Mexzón (1992) y Delvare y Genty (1992) mencionan un gran número de especies vegetales presentes en los cultivos de palma de aceite que sirven de alimento a muchos parasitoides presentes en los ecosistemas palmeros.
Al realizar el análisis faunístico de las especies identificadas (Tabla 4), se observó que la hormiga Crematogaster sp. y el parasitoide Rhysipolis sp. no fueron dominantes en este estudio, aunque el parasitoide de pupas Brachymeria sp. y el hongo Isaria sp., sí lo fueron. Siempre que había presencia del estado de pupa de S. cecropia, se presentaba dicho parasitoide ejerciendo un control sobre este estado, aunque su frecuencia fue poca durante los muestreos realizados a través del tiempo. Con relación a la abundancia de estas especies identificadas esta fue común y su presencia fue poca. Según Silveira Neto et al. (1976), la abundancia es el número de individuos por unidad de superficie, la cual varia en el espacio de un agroecosistema a otra. En relación a la constancia todas las especies fueron clasificadas como accesorias, debido a que estuvieron presentes en más del 26 % de los muestreos.
Conclusión
Los controladores biológicos encontrados en el agro ecosistema del cultivo de palma de aceite juegan un papel importante en la regulación de las poblaciones de S. cecropia en el cultivo de la palma de aceite en Colombia. Por lo tanto, se debe propender por su conservación con la siembra y establecimiento de plantas nectaríferas, como las identificadas durante el estudio y evitar el uso indiscriminado de insecticidas químicos para combatir las plagas de la palma de aceite. Esta investigación demuestra que la fauna benéfica existente es muy diversa y manejada apropiadamente puede reducir las poblaciones de este defoliador a niveles que no justifiquen su control con insecticidas químicos de amplio espectro, además hay una tendencia en que las condiciones climáticas influyan sobre el comportamiento poblacional de la plaga.
Agradecimientos
Los autores expresan su agradecimiento al Ing. Agrónomo Andrés Ulloa, a la plantación Palmeiras Colombia S.A., por la colaboración en el desarrollo de la investigación. A Colciencias a través del contrato Colciencias - Cenipalma RC 745 -2011 y al Fondo de Fomento Palmero administrado por Fedepalma, por la cofinanciación de esta investigación. Al Centro de Investigación en Palma de Aceite - Cenipalma, por el apoyo científico.
Literatura citada
ALDANA, J.; CALVACHE, H.; CASTRO, P.; ESCOBAR, B.; DÍAZ, A.; PICÓN, J. 1996. Las plantas arvenses en el manejo integrado de plagas. Palmas 18 (1): 11-21. [ Links ]
ALDANA, R.; ALDANA, J.; CALVACHE, H.; ARIAS, D. 1998. Papel de la hormiga Crematogaster spp., en el control natural de Leptopharsa gibbicarina en una plantación de palma de aceite de la Zona Central. Palmas 19 (4): 25-32. [ Links ]
ALDANA, J.; CALVACHE, H.; ARIAS, D. 2000. Programa comercial de manejo de Leptopharsa gibbicarina Froeschner (Hemiptera: Tingidae) con la hormiga Crematogaster spp. En una plantación de palma de aceite. Palmas 21 (1): 167-173. [ Links ]
ALDANA, R. C.; ALDANA, J. A.; CALVACHE, H.; FRANCO, P. N. 2010. Manual de plagas de palma de aceite en Colombia. Cuarta edición. Convenio Sena - Cenipalma. 198 p. [ Links ]
ARGUMERO, E. 2000. Evaluación de dos especies de plantas nectaríferas en la atracción de insectos benéficos. Palmas 21 (1): 201-202. [ Links ]
BARRIOS, C.; ALDANA, R.; BUSTILLO, A. 2013. Biología del defoliador de la palma de aceite, Stenoma cecropia Meyrick (Lepidoptera: Elachistidae). Palmas 34 (3): 13-19. [ Links ]
CALVACHE, H. 1991. Algunas consideraciones sobre manejo integrado de plagas en palma de aceite. Palmas 12 (1): 29-37. [ Links ]
CALVACHE, H.; GÓMEZ, P. 1991. Comportamiento de las plagas de la palma de aceite en Colombia durante 1990. Palmas 12 (3): 7-14. [ Links ]
CASTILLO, M. S.; ALDANA, J.; CALVAHE, H.; GRIJALVA, O. 2000. Evaluación de técnicas de liberación de Trichogramma pretiosum Riley (Hymenoptera: Trichogrammatidae) para el manejo de Stenoma cecropia Meyrick (Lepidoptera: Stenomidae) en el cultivo de palma de aceite (Elaeis guineensis Jacq.). Palmas 21 (1): 203-211. [ Links ]
CORREDOR, A.; MARTÍNEZ, G.; SILVA. A. 2008. Problemática de la Pudrición del cogollo en Tumaco e instrumentos para su manejo y la renovación del cultivo. Palmas 29 (3): 11-16. [ Links ]
DELVARE, G.; GENTY, P. 1992. Interés de las plantas atractivas para la fauna auxiliar de las plantaciones de palma en América tropical. Oleagineux 47 (10): 551-558. [ Links ]
FEDEPALMA. 2013. Anuario estadístico. La agroindustria de la palma de aceite en Colombia y el mundo. Bogotá. 174 p. [ Links ]
FERNÁNDEZ, F.; SHARKEY, M. 2006. Introducción a los Hymenoptera de la región Neotropical. Sociedad Colombiana de Entomología y Universidad Nacional de Colombia. Editorial Guadalupe Ltda., Bogotá. 893 p [ Links ]
GENTY, P. 1978. Morfología y biología de un defoliador de la palma africana en América Latina, Stenoma cecropia Meyrick. Oleagineux 33 (8-9): 421-427. [ Links ]
GENTY, P. 1984. Estudios entomológicos con relación a la palma aceitera en América Latina. Palmas 5 (1): 22-31. [ Links ]
LEÓN, I.; RODRÍGUEZ, E.; ORTEGA, L.; SOLIS, J. 2012. Susceptibilidad de Spodoptera frugiperda (J. E. Smith) (Lepidoptera: Noctuidae) a insecticidas asociada a césped en Quintana Roo, México. Agrociencia 46 (3): 279-287. [ Links ]
MCKENZIE, R. 1977. Observations on the control of some leafeating pests in oil palm. pp. 617-623. In: International Developments in Oil Palm. Proceedings: Malaysia International Agric. Oil Palm Conf. Kuala Lumpur. Earp, D. A. and Newall, W. (Eds.). The Inc. Soc. of Planters. [ Links ]
MEXZÓN, R. 1992. Insectos visitantes de malezas: manejo y conservación de la vegetación para incrementar los enemigos naturales en palma aceitera. Primer Congreso Centroamericano de Entomología y Combate Natural de Plagas. ASD p. 1-14. [ Links ]
MEXZÓN, R.; CHINCHILLA, C. 1992. Entomofauna perjudicial, enemigos naturales y malezas útiles en palma aceitera en América Central. ASD 20 (21): 1-7. [ Links ]
MEXZÓN, R.; CHINCHILLA, C. 2004. El gusano túnel, Stenoma cecropia Meyrick en palma aceitera en América Central. ASD 27: 27-31. [ Links ]
MONTAÑEZ, M.; CALVACHE, H.; LUQUE J.; MÉNDEZ, A. 1997. Control biológico de Leptopharsa gibbicarina Froeschner (Hemiptera: Tingidae) con la hormiga Crematogaster sp. (Hymenoptera: Formicidae) en palma de aceite. Palmas 18 (1): 23-30. [ Links ]
MORILLO, F.; NOTZ, A. 2001. Resistencia de Spodoptera frugiperda (Smith) (Lepidoptera: Noctuidae) a lambdacihalotrina y metomil. Entomotropica 16 (2): 79-87. [ Links ]
QUINTERO, J. 2010. Dinámica de captura de adultos de Rhynchophorus palmarum L. (Coleoptera: Curculionidae) en la red de monitoreo de la Zona Occidental. Palmas 31 (4): 17-27. [ Links ]
RAHMANA, D. S. 1994. Estudio del manejo de plagas en palma de aceite en Colombia. Palmas 15 (2): 55-68. [ Links ]
SILVA, N. M. 1993. Levantamiento y análisis faunístico de Diptera: Tephritidae en cuatro sitios del estado de Amazonas. Piracicaba. Tesis (Doctorado). Escuela Superior de Agricultura Luiz de Queiroz, USP, Piracicaba, Brasil. 152 p. [ Links ]
SILVEIRA NETO, S.; NAKANO, O.; BARDIN, D.; VILLA NOVA, N. A. 1976. Manual de ecología de insectos. São Paulo: Ceres, 420 p. [ Links ]
THOMAZINI, M. J.; THOMAZINI, A. P. 2002. Levantamiento de insectos y análisis entomofaunístico en bosque, matorral y pastizal en el sudeste acreano (de Acre). Embrapa. Boletín, Investigación y Desarrollo. N°35. Rio Branco. Acre. [ Links ]
VALENCIA, C. C. 2007. Patogenicidad de hongos entomopatógenos del género Beauveria sp., sobre larvas de Stenoma cecropia (Lepidoptera: Elachistidae), en condiciones de laboratorio. Ceniavances 147: 1-4. [ Links ]
Recibido: 27-ago-2014
Aceptado: 04-sep-2016