Introducción
La papa es uno de los cultivos más importantes en la dieta alimenticia a nivel mundial; ocupa el cuarto lugar en producción en Colombia después de la caña de azúcar, el banano y la palma con más de 2’139.000 ton al 2013 (FAOSTAT 2015) y cerca de 90.000 familias dependen directamente de dicho cultivo (Espinal et al. 2006).
Las flores de solanáceas están asociadas generalmente con la polinización por vibración (Endress 1996; Fenster et al. 2004); al igual que otras solanáceas cultivadas (Solanum lycopersicum L., Capsicum annuum L., Capsicum frutescens L., Nicotiana tabacum L. y Cyphomandra betacea Sendt), la papa posee flores pendulares, actinomorfas, con pétalos reflejos con un cono de estambres prominente, de filamentos cortos, gruesos y anteras poricidas y con dehiscencia introsa; además de un solo estilo que, generalmente, sobresale de la punta del cono que forman las anteras. El único recurso ofrecido por dichas flores es el polen con altos niveles de proteína (entre 48-50 %, superior a muchas angiospermas (Roubick 1995)) y no hay producción de néctar (Harder y Barclay 1994); sin embargo, Solanum cunninghamii Benth., Solanum dioicum W.V. Fitzg. y Solanum tudununggae Symon, presentan nectarios extraflorales (Anderson y Symon 1985) y ofrecen néctar como recompensa.
A pesar de que la papa es una planta nativa de los Andes y que su polinización natural es fundamental para mantener la diversidad de las variedades nativas, los estudios sobre visitantes florales y polinizadores son limitados y las características de fenología y de la morfología floral y su efecto en los polinizadores (que son principalmente abejorros) no ha sido estudiado (FAO 2008), posiblemente debido a que la papa se propaga normalmente de forma vegetativa. Algunos de los pocos trabajos sobre las abejas asociadas con el cultivo de papa se han realizado en Brasil, Bolivia, Perú, Suiza y Estados Unidos (Sandford y Hanneman 1981; Arndt et al. 1990; Batra 1993; Skogsmyr 1994; Chumbiauca et al. 2004; De Azeredo et al. 2006; Scurrah et al. 2008); en esas evaluaciones se ofrecen registros de los principales visitantes florales, en su mayoría abejas silvestres como Anthophora sp. Latreille, Apis mellifera Linnaeus, Bombus baeri Vachal, B. funebris Smith, B. opifex Smith, B. impatiens Cresson, B. terrícola Kirby, Centris flavohirta Friese, Trigona spinipes Fabricius, Thygater dispar Smith, Xylocopa (Neoxylocopa) spp. Michener, Xylocopa viridigaster Lepeletier, Lonchopria spp. Vachal y Megachile spp. Latreille.
De igual manera, es poco lo que se conoce sobre el efecto de la intervención antrópica en estos agroecosistemas, en especial sobre las poblaciones de insectos benéficos (como los polinizadores), a pesar de que en teoría toda alteración en los ecosistemas agrícolas puede ocasionar cambios en la composición y estructura de las comunidades de insectos asociados a estos (Odum y Barrett 2005) y pese a que el conocimiento sobre la conformación de las redes abeja-planta es importante para el desarrollo de programas de conservación y manejo de dichos polinizadores y de la biodiversidad de una zona de cultivo en general (Ramalho et al. 1990; Carreck y Williams 1998; Nates-Parra y González 2000; Aizen et al. 2002; Albuquerque et al. 2006).
En este trabajo se realizó un inventario de abejas asociadas a cultivos de papa en el departamento de Antioquia acompañado de un análisis de la estructura de sus poblaciones, con el ánimo de avanzar en el conocimiento de la melitofauna asociada a cultivos de papa en los diferentes tipos de uso del suelo encontrados en el país y además, de analizar el comportamiento de los ensamblajes de abejas en estos escenarios.
Materiales y métodos
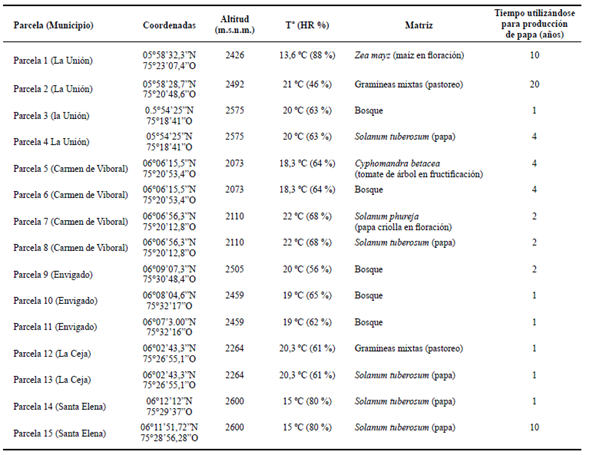
El inventario de abejas se realizó entre enero del 2008 y junio de 2010 en tres tipos diferentes del uso del suelo o agroecosistemas: (1) monocultivos de papa (PP), (2) cultivos de papa asociados a otros cultivos (PO) (pasto, maíz, papa criolla o tomate de árbol) y (3) cultivos de papa asociados a parches de vegetación natural o bosque secundario intervenido (PB). Los muestreos se realizaron en 15 parcelas (cinco por cada agroecosistema) de cultivos de S. tuberosum var. Diacol-Capiro con más del 75 % de plantas florecidas, del oriente del departamento de Antioquia, Colombia (Tabla 1).
Tabla 1 Características climáticas, geográficas y tipo de agroecosistema de las parcelas evaluadas en el departamento de Antioquia.
Al interior de cada parcela se definieron tres transectos de 200 m de largo por 4 m de ancho. El primer transecto se ubicó al interior del cultivo por lo menos a 50 m del borde del mismo, el segundo se trazó en el borde que separaba el cultivo de papa y su matriz y el tercer se ubicó al interior de la matriz. En cada transecto se usaron cinco métodos de muestreo: una trampa Malaise, una trampa de intercepción de vuelo, una trampa con eugenol como cebo y diez “pan traps” de color amarillo (platos de 14 cm de diámetro y capacidad de 200 ml, con agua jabonosa). Cada trampa se revisó con una frecuencia de 24 horas. Además, se realizaron recolectas con red entomológica recorriendo cada transecto durante una hora tres veces al día (8:00, 12:00 y 15:00 horas).
Los especímenes recolectados se prepararon siguiendo las normas establecidas por el Museo Entomológico Francisco Luis Gallego (MEFLG), y se identificaron mediante el uso de claves taxonómicas para los diferentes grupos, la comparación con ejemplares del MELFG y en casos especiales con la ayuda de los especialistas en cada grupo de abejas.
Toda la información (localidad, hora, transecto, trampa, temperatura y humedad relativa) se tabuló en una base de datos de Excel®, a partir de la cual se construyó una matriz de presencia/ausencia para realizar los análisis de diversidad. Con el fin de comparar la riqueza de los tres agroecosistemas, se utilizó el método propuesto por Moreno (2001), además, se realizaron curvas acumuladas de especies para los tres transectos de cada agroecosistema por medio de los estimadores no paramétricos (basados en ausencia/presencia) “boostrap”, ICE y Chao2. Finalmente, se graficó la riqueza de especies observadas contra la riqueza de especies esperada según el estimador de riqueza Chao2 (Villareal et al. 2006).
Para los análisis de composición de comunidades se tuvo como unidad muestreal el transecto/día, lo que equivalió a 75 unidades muestrales por cada tipo de agroecosistema (tres transectos x cinco parcelas x cinco días). Para el análisis de estructura de las comunidades se obtuvo la abundancia de las especies de abejas en cada agroecosistema y para cada uno de los tres transectos (matriz, borde y papa). Teniendo en cuenta que dentro de las abejas existen diferentes grados de socialidad, no se trabajó con las abundancias totales, sino que se sumó la presencia de cada especie durante los cinco días de cada muestreo en cada parcela sin discriminar el método de colecta (frecuencia de captura, FC), de tal forma que si una especie se recolectó tres de los cinco días de muestreo su abundancia fue tres. La diversidad alfa se estimó mediante el índice de Shannon y el índice de dominancia de Simpson, mientras que para la diversidad beta se utilizó el índice de Jaccard con el programa PAST (Hammer et al. 2001). Posteriormente, se usaron los valores de los índices para realizar pruebas de supuestos de normalidad y homogeneidad de varianzas utilizando las siguientes variables: riqueza de especies, abundancia relativa de especies (tomado como frecuencia de captura) y el valor del índice/transecto/día. Cuando se violaron los supuestos, para conseguir tener datos con normalidad de varianzas, las variables se transformaron con raíz cuadrada, arcoseno del inverso del dato o logaritmo del dato. Para el análisis comparativo entre agroecosistemas se realizó un análisis de varianza para cada variable, bajo un diseño completamente aleatorizado con arreglo factorial (agroecosistema (3) X transecto (3) = 9 tratamientos); mientras que para evaluar las diferencias al interior de cada agroecosistema se analizaron las variables con un diseño en bloques al azar. Todos los análisis se realizaron con el programa Statgraphics® centurión XV.I.
Finalmente, con el ánimo de comparar la composición de especies de abejas entre transectos, y determinar el grado de similitud o disimilitud ecológica entre estos, es decir la relación entre la riqueza de especies comunes y especies exclusivas entre unidades de paisaje, se utilizaron los datos de frecuencia de captura (abundancia relativa en este caso) de abejas en cada transecto para cada agroecosistema, con los cuales se construyeron dendrogramas de similitud con base en los índices de Bray Curtis y Jaccard utilizando el programa Biodivesity Pro®.
Resultados y discusión
Inventario de especies
En total se recolectaron 1.976 abejas (896 en PO, 666 en PB y 430 en PP), agrupadas en 70 especies y 30 géneros (Tabla 2) y distribuidas porcentualmente por familia de la siguiente manera: Halictidae (67,15 %), Apidae (24,28 %), Colletidae (5,71 %), Megachilidae (1,42 %) y Andrenidae (1,42 %).
Tabla 2 Especies de abejas asociadas a diferentes tipos de agroecosistema de S. tuberosum y sus distribución en los transectos.
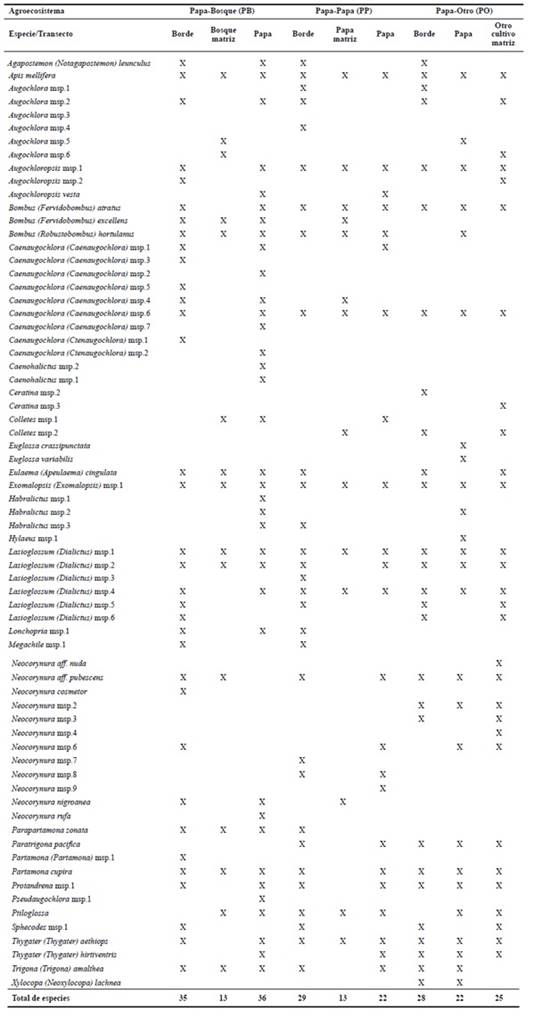
Como se observa en la tabla 2, los cultivos de papa que se encontraron adyacentes a fragmentos o parches de bosque, registraron una mayor cantidad de especies de abejas cuando se comparan con cultivos en monocultivos de papa o en matriz con otros cultivos. Las bondades de la conservación de áreas con vegetación natural para los agroecosistemas en el mundo son bien conocidas, registrándose incrementos en la biodiversidad de insectos y en los servicios ecosistémicos (como la polinización) en cultivos adyacentes a bosques o parches de vegetación natural (ej. Klein et al. 2001; 2003a; 2003b; 2003c; Kwaiser y Hendrix 2008; Vergara y Badano 2009; Taki et al. 2011); como lo describen Benton et al. (2003) “un paisaje heterogéneo que involucra relictos de vegetación natural en su matriz alternada con cultivos, generalmente tiene mayor biodiversidad que un paisaje homogéneo”. Tal es el caso de cultivos como vid, trigo, café, pasturas y otras especies vegetales rodeados por fragmentos de bosque, en donde a medida que se ingresa en el cultivo y se aleja del borde con el bosque, la polinización mediada por insectos disminuye, debido principalmente a la disminución en disponibilidad de sitios para nidificar y de fuentes de alimentación provistas por el fragmento (Free 1993; Klein et al. 2001; 2003a; 2003b; 2003c; Kremen et al. 2004; Ricketts et al. 2004; Chacoff y Aizen 2006; Vergara y Badano 2009; Batáry et al. 2010; Taki et al. 2011).
Diferencias de diversidad de abejas entre transectos.
En términos generales, para los tres tipos de agroecosistemas evaluados la riqueza de especies observadas estuvo entre 66-87 % de las estimadas por Chao 2, excepto para el transecto borde en el agroecosistema PP, en donde las especies encontradas estuvieron cercanas al 50 % de las esperadas (Fig. 1). Para este estudio, los bordes en los cultivos de papa, eran carreteras o caminos utilizados enel transporte de insumos, productos de cosecha y el tránsito de personas y por lo tanto, la diversidad de plantas y disposición de flores fue menor y por consiguiente, la cantidad de abejas capturadas fue también mucho menor de lo estimado por los índices de Chao2. Según Villareal et al. (2006), uno de los parámetros para considerar un muestreo como representativo es que se obtenga en el inventario al menos un 80 % de las especies estimadas por los estimadores de “boostrap”, Chao 2, o ICE. Bajo esta propuesta, se esperaría que una mayor intensidad de muestreos se podrían obtener entre 2 a 30 especies más de abejas para los agroecosistemas evaluados en este trabajo.
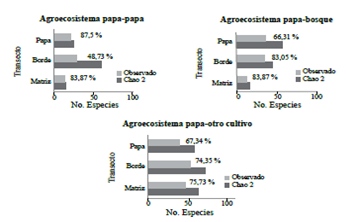
Figura 1 Especies observadas y estimadas para agroecosistemas paperos de Antioquia. Los números en frente de las barras indican el porcentaje del valor observado de especies con respecto al estimado.
En términos de la riqueza de especies, se observó que los transectos en los bordes presentaron la mayor riqueza, independiente del tipo de agroecosistema; seguidos por los transectos al interior de los cultivos de papa (cuando la matriz era del mismo cultivo) y de la matriz (Fig. 2). El análisis estadístico mostró diferencias significativas entre la riqueza y la abundancia recolectadas en el borde y al interior del cultivo de papa cuando se compararon con la matriz (P = 0,0022 y P = 0,0025, respectivamente). No se presentaron diferencias estadísticas significativas entre agroecosistemas, transectos y en sus interacciones en términos de la diversidad de Shannon (P = 0,5095; 0,0071; 0,0866, respectivamente) y con el inverso del índice de dominancia de Simpson (P = 0,8965; 0,0973; 0,1806, respectivamente).
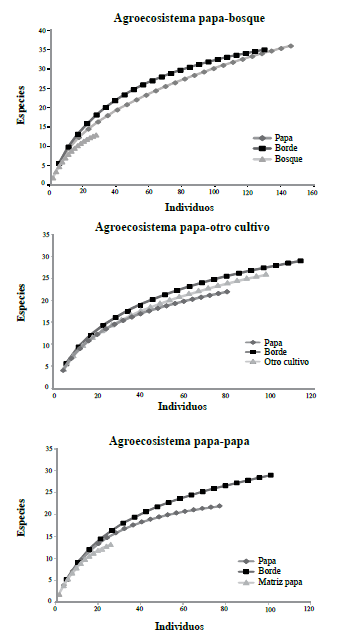
Figura 2 Curvas de rarefacción para los tres tipos de agroecosistemas de papa muestreados en Antioquia.
Según Odum y Barrett (2005), se define como efecto de borde a “la tendencia de un aumento en la variedad y diversidad en donde dos comunidades se encuentran”. Numerosos autores han discutido el efecto del borde en términos de diversidad (ej. López-Barrera 2004) y aunque algunos organismos responden de forma negativa al efecto de los bordes (Bogaert et al. 2001), otros tienden a ser más diversos porque presentan condiciones de los dos hábitats (Ries y Sisk 2004). En el caso específico de los insectos, el efecto de borde se ha observado en varios grupos como escarabajos y abejas, como los estudios de Chacoff y Aizen (2006); Klein et al. (2003a;b); Gemmill-Herrel y Ochieng (2008); Nemesio y Silveira (2006) y Ricketts et al. (2004).
El efecto de borde en la diversidad de abejas es variable y dependerá de las características propias del borde (no todos los bordes son iguales), algo que ha sido discutido por Ries y Sisk (2004), quienes además desarrollaron modelos que demostraron que una especie puede tener respuestas positivas, negativas y/o neutras, dependiendo del tipo de borde. Los mismos autores, en 2010, sugieren no clasificar organismos como “amantes” o “evasores” de bordes, y más bien identificar si estos son sensibles (aquellos que exhiben respuestas) o no a la presencia de bordes. En el caso de este trabajo, fue evidente que en agroecosistemas cultivados con S. tuberosum, las abejas son sensibles a los bordes (y por relación directa, es posible que las especies de plantas nectaríferas también lo sean), resultando en una mayor diversidad. Por lo tanto, las plantas arvenses y los arbustos que se encuentran en los bordes son una fuente de recursos sumamente importante para las abejas silvestres asociadas a cultivos y de hecho muchas de estas no transitan entre los dos ambientes cuando la matriz es diferente al cultivo, y se restringen a uno de ellos, como se discutirá más adelante.
En términos de conservación, varios estudios han mostrado la importancia de estas áreas de borde con arvenses o ruderales en el mantenimiento de la diversidad de abejas (ej.Rosso y Nates-Parra 2005; Gemmill-Herrel y Ochieng 2008; Kwaiser y Hendrix 2008), por lo cual se recomienda que los agricultores incluyan prácticas de manejo de arvenses en los bordes (al igual que al interior de los cultivos) y así mantener una mayor oferta floral cuando no hay floración en el cultivo.
Agroecosistema monocultivo de papa (PP).
En este agroecosistema no se encontraron diferencias significativas en la riqueza de especies entre parcelas, ni entre transectos (P = 0,1473 y 0,0809, respectivamente), pero si hubo diferencia significativa en la abundancia entre transectos (P = 0,0086), siendo la matriz la de menor cantidad de especímenes recolectados (Fig. 3). Tampoco se encontraron diferencias significativas entre la diversidad medida por Shannon (P = 0,853; 0,3241 para transecto y parcelas, respectivamente), ni entre los índices de dominancia de Simpson (P = 0,1557; 0,5284 para transecto y parcelas, respectivamente).

Figura 3 Abundancia relativa de abejas recolectadas por transecto en el agroecosistema Papa-Papa (PP). Las líneas fuera del cuadro representan intervalos de confianza cuando el nivel de confianza es del 95 % (margen de error del 5 %).
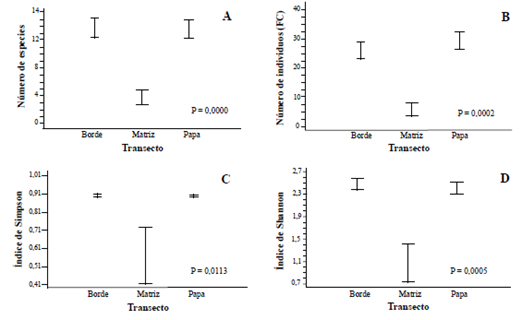
Figura 4 Variables evaluadas en el agroecosistema Papa-Bosque (PB). A. Número de especies. B. Número de individuos. C. Índice de dominancia de Simpson. D. Índice de Shannon. La longitud de las barras representa un intervalo de confianza del 95 % (margen de error del 5 %).
Los monocultivos de papa son paisajes homogéneos con diversidad florística reducida y en donde los bordes como tal (ecotonos), fueron establecidos para este trabajo de acuerdo al tamaño de la parcela de estudio y por esto no se presentó una diferencia estadística en la riqueza de los transectos en borde y los del interior y matriz del cultivo. Sin embargo, se presentaron diferencias al interior de las parcelas (cultivo vs matriz) atribuibles al manejo diferencial desde el punto de vista agronómico de las plantaciones (ej. en regímenes de fertilización, fumigación, manejo de malezas y demás), además de diferencias en el tiempo que cada parcela ha sido cultivada con papa (Tabla 1). Igualmente, debe tenerse en cuenta que la abundancia de abejas entre cultivos también puede verse influenciada por modificaciones del paisaje que no fueron tenidas en cuenta durante el desarrollo de esta investigación como el tamaño de los bordes, la composición florística de cada plantación, la topografía, entre otros.
También cabe resaltar la limitada representación de algunos grupos como las abejas de las orquídeas (Apoidea: Apidae: Euglossini) de las cuales solo se recolectó un ejemplar (Eulaema cingulata) durante este estudio para este tipo de agroecosistema, lo cual puede ser un indicativo de mayores exigencias de estas especies en cuanto a la diversidad florística y de sitios para nidificación. Para abejas como estas, con relaciones tan estrechas con plantas diferentes a la papa (ej. machos de Euglossini con orquídeas), S. tuberosum podría servir como fuente de polen, más otros recursos indispensables para ellas, como los aceites (Roubick y Hanson 2004), no pueden adquirirse bajo este sistema de producción, ya que es difícil pensar que en condiciones de monocultivo de papa crezcan árboles o zonas en donde las orquídeas se puedan desarrollar.
Agroecosistema papa asociado a bosque (vegetación natural) (PB).
A diferencia de los monocultivos de papa (PP), en el agroecosistema PB si se encontraron diferencias significativas entre los transectos para las variables: riqueza de especies (P = 0,000), abundancia relativa (FC) (P = 0,0002), índice de riqueza (P = 0,0005) e índice de Simpson (P = 0,0113), siendo el bosque el transecto con valores más bajos para todas las variables (Figs. 4A-C). No se encontraron diferencias significativas entre las parcelas evaluadas (P = 0,0447; 0,1764; 0,0912 y 0,2560) para las mismas variables enunciadas anteriormente en su orden, en parte quizás,porque todas las parcelas de este tipo de agroecosistema fueron similares en varios aspectos, entre los cuales están el hecho de que la vegetación natural consistió de parches de vegetación o bosque secundarios intervenidos, con presencia evidente de claros sembrados con plantas no nativas como coníferas y eucaliptos, además de ser zonas en donde no se había cultivado papa por más de cuatro años (Tabla 1).
Como se mencionó, el transecto bosque en este agroecosistema se trazó en parches de bosques secundarios intervenidos. La mayor abundancia y diversidad de especies de abejas observada en el cultivo cuando se comparó con el bosque, pudo haber sido el resultado de varios factores como el hecho de una floración masiva en el cultivo de papa que atrae una gran cantidad de abejas de diversas especies como lo observaron Le Féon et al. (2013) en márgenes de cultivos franceses y según los cuales, cuando no hay oferta floral del cultivo, las poblaciones de visitantes florales se mantienen estables, pero cuando se da la explosión de la floración del cultivo la diversidad se concentra allí. Además, las curvas acumuladas de especies (Fig. 2), demuestran que aún es posible encontrar especies nuevas lo cual tiene sentido si se tiene en cuenta que los muestreos con red y trampas en este estudio se limitaron al sotobosque y seguramente muestreando el dosel, la abundancia y diversidad de especies de abejas se incrementaría en estos transectos; de hecho, existen trabajos sobre distribución vertical que registran mayor diversidad y abundancia en el dosel de grupos de abejas como Euglossini de bosques húmedo tropicales cuando se comparan con estratos más cercanos al suelo (Santos et al. 2011). De manera similar, Ulyshen et al. (2010) en un estudio de riqueza de abejas capturadas en una distribución vertical de un bosque deciduo, encontraron que había diferencias en la composición de las comunidades de abejas entre los estratos verticales y determinaron que las disimilitudes podrían ser atribuibles, entre otros aspectos, a la presencia de recursos florales en el dosel y a los hábitos de nidificación de algunas abejas que prefieren estratos altos del bosque para construir sus nidos.
Algunas de las especies que se registraron, se recolectaron casi exclusivamente (con uno o dos ejemplares en otros agroecosistemas) en cultivos con vegetación natural asociada, como es el caso de Bombus excellens, Lonchopria msp.1, Ptiloglossa, Augochlora msp.5, Augochlora msp.6 y todas las especies de Caenaugochlora (con excepción de Caenaugoclora msp.8). También se presentaron algunas especies que aunque se capturaron en varios tipos de agroecosistemas, se encontraron en cantidades superiores en cultivos en matrices boscosas comparados con los monocultivos y las asociaciones con otros cultivos, y en especies de abejas como B. hortulanus (67 vs. 29 y 55, respectivamente), Parapartamona zonata (18 vs. 0 y 3), T. aethiops (61 vs. 17 y 22) y Trigona amalthea (21 vs. 6 y 7). Varias de las especies mencionadas nidifican en el suelo (Goncalves y Engel 2010) o pueden nidificar en árboles en pie, maderas caídas o en cavidades en el suelo (González y Nates-Parra 1999; Michener 2000; González y Ospina 2008). Estos resultados muestran que a pesar de que muchas de estas especies no se recolectaron al interior del bosque, éste ecosistema posee un valor indiscutible para estas abejas, que pueden tener sus nidos dentro de estos parches de vegetación natural, pero que se desplazan al borde o al cultivo de papa para recolectar alimento.
Agroecosistema papa asociado a otros cultivos (PO).
En este agroecosistema (PO) se encontraron diferencias entre las parcelas, es decir, cuando se muestreo papa-tomate de árbol, papa-pastos y papa capira-papa criolla hubo diferencias en las variables: riqueza de especies, abundancia relativa e índices de Shannon y Simpson (P = 0,0060; 0,0306; 0,0002 y 0,0004, respectivamente), lo que demuestra la importancia de la composición del paisaje sobre la biodiversidad de abejas silvestres. De los tres, los agroecosistemas con mayor riqueza de especies fueron aquellos asociados con tomate de árbol (25 especies) seguido por las asociaciones con papa criolla (21 especies), mientras que los de menor diversidad fueron aquellos asociados con gramíneas (pastos o maíz). Es importante resaltar además, que las parcelas de papa con menor diversidad, fueron aquellas que llevaban entre 10-20 años en explotaciones paperas (Tabla 1), localizadas en el municipio de la Unión, considerado el mayor productor de papa en Antioquia y cuya economía ha girado tradicionalmente en torno a este cultivo y a la producción de leche (Botero 2008). La antigüedad de este tipo de actividades agropecuarias, no solo ha diezmado los parches de vegetación natural en donde nidifican y se alimentan algunas abejas, sino que ha incrementado el grado de compactación lo cual puede tener efectos adversos sobre las abejas que nidifican en el suelo; de hecho, según Jeffery et al. (2010), las abejas que nidifican en suelo por lo general evitan suelos duros y compactos porque son difíciles de excavar, lo cual sumado a la carencia de sitios para nidificación en madera (por falta de especies arbóreas) puede explicar la menor diversidad en esta región.
Conclusiones y recomendaciones
Los Andes colombianos aun poseen muchas especies de abejas desconocidas para la ciencia, observando la gran cantidad de posibles especies nuevas encontradas en este estudio y determinadas a nivel de morfoespecie. Muestra de ello, son los resultados de este trabajo, que a pesar de realizarse sobre un cultivo con tan alta frecuencia de aplicaciones de productos químicos e intensidad de manejo que evidentemente tiene un alto impacto sobre la estructura de la flora y los suelos, sostienen aun así una diversidad alta de abejas.
Los resultados demuestran que a pesar de que las plantas de S. tuberosum no ofrecen néctar como recompensa floral, es un cultivo que atrae gran diversidad de abejas asociadas a él por la oferta de polen. Esta diversidad es afectada por el tipo de agroecosistema y se distribuye de manera diferencial entre sus componentes (cultivos, bordes y matriz) y depende de la composición mosaico que conforme dicho paisaje.
A pesar de que se encontró cierto grado de especialización de algunas especies de abejas por los bordes de los cultivos se observa que hay recambio de especies entre los transectos y que muchas abejas transitan entre el cultivo y las áreas adyacentes lo que significa hay un flujo de polen entre los cultivos de papa.
Con base en las curvas de rarefacción es de esperarse una diversidad mayor de abejas en todos los agroecosistemas evaluados. Para mejorar el conocimiento sobre la diversidad de estos insectos en zonas cultivadoras de S. tuberosum se recomienda incorporar en el diseño del muestreo un mayor tiempo de muestreo, métodos adicionales para los muestreos de abejas (ej. nidos trampa) y la inclusión de otros estratos, como el dosel, particularmente en aquellos cultivos aledaños a fragmentos de bosque o bordes con vegetación nativa o en proceso de s grados de sucesión.














