Introducción
El virus de la leprosis de los cítricos (CiLV), es un limitante fitosanitario de importancia cuarentenaria y económica, que significa millones de dólares en pérdidas para la citricultura de los países donde se ha establecido; afecta principalmente naranjos y mandarinos y únicamente se encuentra reportado en Suramérica, Centro América (Rodrigues et al. 2001) y el sur de México (NAPPO, 2005). La relevancia del CiLV, radica en que además de afectar la producción citrícola, genera restricciones para el mercadeo internacional de cítricos y algunos productos agropecuarios hospederos del ácaro vector, especialmente con países de Norteamérica, Europa y Asia donde no se ha registrado CiLV.
Childers et al. (2003a) y USDA (2004) afirman que la enfermedad fue descrita en Florida, Estados Unidos por primera vez en 1901 y se denominaba “escama de la corteza”; esta enfermedad, casi destruye la citricultura de la Florida antes de 1925, y no se volvió a registrar hasta 1968. En Sur América fue identificada inicialmente en Paraguay por Spegazzini (1920), quien la denominó “lepra explosiva”; luego la enfermedad fue observada en Argentina y en 1931 se registró en hojas de naranjo (Citrus sinensis (L.) Osbeck) variedad “Bahía” en Sao Paulo, Brasil, (Bastianel et al. 2006).
La leprosis de los cítricos, ha causado pérdidas económicas en Brasil, Argentina, Paraguay, Venezuela, Honduras, Costa Rica y Panamá; se registró en Bolivia por Gómez et al. (2005), Costa Rica por Araya (2000), Panamá por Saavedra et al. (2001), Guatemala por Mejía et al. (2005) y en Honduras por Rodrigues et al. (2007); la leprosis de los cítricos se detectó en naranjos dulces en México, 2005 (NAPPO 2005; Castillo et al. 2011) y en Belice, año 2013 (CABI/EPPO, 2013). Según Bastianel et al. 2006, Freitas-Astua et al. (2004) y Rodrigues et al. (2001), en Brasil se considera la enfermedad viral más importante en cítricos y los costos de control del ácaro transmisor suman alrededor de 100 millones de dólares/año.
En Colombia, el virus de la leprosis de los cítricos tipo citoplasmático (CiLV-C) fue detectado en 2004 (León et al. 2006b; 2006c) y para 2005, la enfermedad se encontraba distribuida en los departamentos del Meta y Casanare (Becerra et al. 2007; León et al. 2006c; León 2012). Posteriormente, se reportó virus de la leprosis en Ibagué, Tolima (Bastianel et al. 2010). En el Meta, el área sembrada en cítricos es cerca de 4.300 ha, y la producción se calcula en $180.000 millones de pesos/año; por tanto se requiere desarrollar programas de control, MADR-ASOHOFRUCOL (2002).
Algunas especies de ácaros del género Brevipalpus (Acari: Tenuipalpidae) se han reconocido como vectores del CiLV. La primera referencia de transmisión del virus de la leprosis de los cítricos por ácaros fue registrada en Argentina por Frezzi (1940) y la especie fue identificada como Tenuipalpus pseudocuneatus Blanchard, 1940, un sinónimo de B. obovatus Donnadieu. Posteriormente, Musumeci y Rossetti (1963) encontraron a B. phoenicis Geijskes (ahora B. yothersi Baker) como vector en Brasil. El ácaro rojo plano B. phoenicis, es la especie más diseminada y reportada como vector de este virus, es una especie polífaga, dispersa en muchas regiones tropicales y subtropicales del mundo (Chagas et al. 1983; Maia y Oliveira 2002; Childers et al. 2003b; Carvalho et al. 2008). Aun cuando el género Brevipalpus tiene más de 300 especies, únicamente las especies B. phoenicis, B. obovatus y B. californicus (Banks), están registradas como vectores del CiLV.
Para entender la transmisión del virus, además de los factores biológicos intrínsecos del vector, se debe estudiar la eficacia de la transmisión del CiLV, determinada por parámetros como tiempos de adquisición y transmisión, persistencia del virus en la planta y capacidad de diseminación de la enfermedad (Bastianel et al. 2006; Rodrigues y Childers 2013); Rodrigues (2000), también afirma que es necesario entender las formas de transmisión del virus de la leprosis de los cítricos, además de conocer la biología del ácaro vector y sus hábitos de alimentación.
Según Haramoto (1969), la longevidad de Brevipalpus spp. es más larga que la mayoría de especies de tetraníquidos. Bajo condiciones ambientales favorables (25 (C y 65-70 % HR), el ciclo de vida de B. phoenicis dura alrededor de 25 días; las hembras ponen hasta cuatro huevos por día, aproximadamente durante 20 días, con lo cual se presentan varias generaciones por año.
El ácaro B. phoenicis pasa por los estados de huevo, larva, protoninfa, deutoninfa y adulto. El adulto de B. phoenicis mide, aproximadamente, 0,3 mm de largo, es de color rojo oscuro con manchas un poco más claras sobre el dorso de su cuerpo; cuerpo aplanado, ovalado y con su parte anterior más ancha que la posterior; viven en el envés de las hojas y en los frutos; durante los estados de ninfa y adulto poseen ocho patas, mientras en su estado larval solo seis patas. Los huevos son color anaranjado, redondos y puestos individualmente en los rebrotes, frutos o en el envés de las hojas (Chiavegato 1996).
León et al. (2006a), encontraron que a temperatura de 27,6 ± 0,7 °C y humedad relativa de 69 ± 7,9 %, la duración del B. phoenicis fue: huevo 4 a 6 días; larva 3 a 4 días; protoninfa 5 a 7 días; deutoninfa 6 a 8 días y adulto 21 a 24 días. De acuerdo a estos datos, el ciclo de huevo a adulto demora entre 18 a 25 días y el estado adulto dura en promedio más de 21 días; se deduce que el ciclo de vida está influenciado por la temperatura y la humedad relativa. El tiempo de desarrollo de B. phoenicis en limón (Citrus lemon) según Sadana y Kumari (1991), se acorta a temperaturas de 25 a 30 (C y humedad relativa de 70 %; el período de ovoposición se alarga y la fecundidad, así como la viabilidad de los huevos es mejor.
El ácaro B. phoenicis se asocia con la roña Elsinoe fawcettii, o con lesiones en la superficie de las hojas ramas o frutos para encontrar protección contra la lluvia y los enemigos naturales (Knorr y Denmark 1970; Rodrigues et al. 2003) con lo cual su desarrollo es mejor que en hojas sanas y completa su fase inmadura en menos tiempo: 14,4 días sobre frutos y 17,6 días sobre hojas de naranja “Pera de Río”; la fecundidad fue mayor en frutos que en hojas, con promedios de 39,2 y 8,6 huevos por hembra, respectivamente (Chiavegato 1996). B. phoenicis vive en todos los órganos aéreos de las plantaciones, prefiere los frutos; en Brasil durante las épocas lluviosas, el número de ácaros tiende a disminuir (Oliveira 1996; Rodrigues et al. 2001). La capacidad de dispersión de B. phoenicis comparada con otras especies de ácaros en cítricos es relativamente limitada. El ácaro rojo plano se mueve menos de 1 cm al día y solo el 3 % alcanza distancias de 40 a 50 cm (Alves et al. 2005).
Algunos autores sugieren que el ácaro B. phoenicis puede transmitir el virus durante toda su vida, cuando inyecta y succiona saliva en frutos, hojas, ramas y otros tejidos de numerosas plantas (Chagas y Rosseti 1983; Kitajima et al. 2003). Por su parte, Nicolini et al. (2007) manifiestan que el virus circula pero no se replica dentro del ácaro vector, lo cual coincide con afirmaciones de Kitajima y Alberti (2014) quienes, basados en información citopatológica, transmisión por estados inmaduros del ácaro y el corto período de latencia del virus, confirman que este es del tipo circulativo. Recientemente, Roy et al. (2015) presentan evidencias preliminares de que el virus es de este tipo y se puede replicar dentro del cuerpo del ácaro. Según Chagas et al. (1983), dos días de alimentación son suficientes para que el ácaro adquiera y transmita el virus; las larvas transmiten la enfermedad con un 48,3 % y las ninfas y adultos son menos eficientes. Boaretto et al. (1993) afirman que no hay transmisión transovárica del virus de hembras adultas infectada hacia su descendencia.
De acuerdo a Chiavegato (1996), los síntomas se tornan visibles de 15 a 60 días después que la infección ha sido transmitida. Según León et al. (2006a) las lesiones crecen de 5-7 mm cada 15-20 días; cuando la severidad es mayor al 30 %, la caída de las hojas afectadas ocurre en promedio 70 días después de la aparición de la primera lesión. Los ácaros del género Brevipalpus que transmiten virus, inducen en las plantas hospederas lesiones con apariencia de clorosis o necrosis localizadas en el sitio de alimentación (Colariccio et al. 1995; Rodrigues et al. 2003; Kitajima et al. 2004).
Los tejidos de hojas sintomáticas presentan partículas virales, que no se observaron en las áreas asintomáticas cercanas (Kitajima et al. 2003), lo cual fue corroborado por medio de pruebas de RT-PCR (Locali et al. 2004) e indica que el virus no se disemina sistémicamente en el hospedero. Dentro de una plantación, la dispersión del virus ocurre a través del movimiento de los ácaros viruliferos y es una consecuencia de sus hábitos de alimentación (Rodrigues et al. 2001).
En Colombia, el principal transmisor del virus de la leprosis de los cítricos se conocía como Brevipalpus phoenicis (Geijskes) (Acari: Tenuipalpidae) denominado comúnmente ácaro rojo plano. Esta especie se encuentra diseminada por todas las regiones geográficas del país y ha sido reportada desde hace más de tres décadas en varias zonas citrícolas (León et al. 2006a; León 2012). Recientemente (Beard et al. 2015; Roy et al. 2015), determinaron que la especie B. phoenicis, procedente de Colombia corresponde a Brevipalpus yothersi Baker, 1949 (Acari: Tenuipalpidae). Teniendo en cuenta que los ácaros identificados como B. yothersi para este estudio provienen de muestras de huertos de cítricos del piedemonte llanero y de las colonias establecidas en el laboratorio, nos referiremos para efectos de metodología y resultados a la especie B. yothersi en lugar de B phoenicis. Se aclara además que la especie B. yothersi está fuertemente asociada con el complejo CiLV y que es vector de varios tipos de virus de leprosis detectados en Colombia, como el citoplasmático (CiLV-C) y el citoplasmático tipo2 (CiLV-C2), presentes en los departamentos del Meta y Casanare (León et al. 2014); posterior a este estudio, se detectaron también el tipo nuclear (CiLV-N) y el Hibiscus green spot virus 2 (HGSV-2), que también producen lesiones de leprosis y están relacionados con B. yothersi (Roy et al. 2014; Roy et al. 2015).
Dado que el conocimiento de los parámetros que inciden en la transmisión del CiLV, es fundamental para comprender cómo se disemina la enfermedad, en este trabajo se profundiza mediante pruebas de transmisión, en la cuantificación del tiempo de adquisición del virus, el porcentaje de ácaros infectados por el virus y el tiempo requerido por el ácaro B. yothersi para transmitirlo. Los resultados proveen bases para ampliar el conocimiento de las interacciones planta - virus - vector, lo cual es fundamental para el establecimiento de programas de prevención y manejo de la enfermedad.
Materiales y métodos
Por medio de pruebas controladas de adquisición y transmisión del virus de la leprosis de los cítricos, con ácaros B. yothersi y plantas de naranja Valencia C. sinensis, se estudiaron los parámetros de transmisión del CiLV por el ácaro vector B. yothersi, en el Centro de Investigación La Libertad de CORPOICA, Departamento del Meta, Colombia. Para ello se siguieron las siguientes etapas:
Establecimiento de colonias de ácaros B. yothersi
Se recolectaron ácaros B. yothersi en árboles sin síntomas de leprosis del huerto experimental de C. sinensis del C.I. La Libertad. Los ácaros recolectados, se llevaron al laboratorio de entomología y con la ayuda de pinceles finos y estereoscopios se ubicaron sobre frutos de naranja Valencia previamente lavados. Para establecer las colonias, los ácaros se colocaron en la parte superior de los frutos de naranjo, con lesiones de roña o daños de insectos, lo cual favorece el establecimiento y la reproducción de los ácaros y es modificación del método utilizado por Locali et al. (2004). Los frutos se demarcaron previamente con una línea de tinta indeleble en su parte ecuatorial y sobre dicha línea se aplicó una franja de vaselina para lograr el confinamiento de los ácaros en la parte superior de cada fruto. Los frutos se dispusieron en bandejas de plástico y se mantuvieron en el laboratorio a temperatura promedio de 25 +/- 4 °C y humedad relativa de 80 +/- 8 %.
Para garantizar el establecimiento de colonias con ácaros libres del virus de la leprosis, se utilizó como colonia madre la progenie descendiente de la población recolectada en campo. Cada vez que los frutos iniciaron su deshidratación, se reemplazaron por frutos más frescos, sobre los cuales se trasladaron los ácaros, para dar continuidad a la colonia. Siguiendo el método descrito, se garantizó el establecimiento y desarrollo de las poblaciones libres del virus, así como la cantidad de individuos requeridos para las pruebas de transmisión.
Siembra y mantenimiento del material vegetal
La planta receptora utilizada para estos estudios fue C. sinensis de tres meses de edad. Los arboles requeridos para las pruebas de transmisión, se sembraron individualmente por semilla en macetas y se mantuvieron en confinamiento libres de leprosis bajo condiciones de casa de malla en el C.I. La Libertad de CORPOICA. Una vez establecidas las colonias del ácaro y las plantas receptoras disponibles, se procedió a realizar las pruebas de transmisión del CiLV, para determinar los parámetros más importantes del proceso de transmisión del virus.
Determinación de los parámetros de transmisión
En este estudio, las lesiones de leprosis encontradas en las plantas receptoras se definen como causadas por el complejo CiLV, sin embargo las pruebas moleculares se realizaron con iniciadores para detección del CiLV-C2, puesto que al momento del estudio, la metodología de diagnóstico para el CiLV-C presente en la región no estaba aún estandarizada (Roy et al. 2013) y los CiLV-N y HGSV-2, que pudieron estar presentes, se detectaron y secuenciaron posteriormente (Roy et al. 2014; Roy et al. 2015).
Para determinar la efectividad de las pruebas de transmisión, se realizaron observaciones periódicas sobre las plantas utilizadas como receptoras, en busca de lesiones de leprosis. Las hojas que presentaron síntomas de la enfermedad, se recolectaron y codificaron para efectuar posteriormente análisis moleculares RT-PCR para detección del virus citoplasmático tipo 2 (CiLV-C2). Los ácaros utilizados en la prueba de transmisión para determinar el tiempo de adquisición y el porcentaje de población virulífera se recolectaron y almacenaron en etanol 90 % y, posteriormente, se efectuó sobre ellos detección molecular del CiLV-C2. Los parámetros analizados en este trabajo relacionados con la transmisión del virus fueron: período de adquisición, período de transmisión y porcentaje de población virulífera; las pruebas se desarrollaron de la siguiente manera:
Período de acceso para adquisición
El tiempo requerido para que un ácaro adquiera partículas virales al alimentarse de tejido infectado con CiLV-C2, se determinó bajo condiciones de confinamiento en el laboratorio de entomología del C.I. La Libertad de CORPOICA. Se evaluaron nueve tratamientos correspondientes a diferentes períodos de adquisición (0, 10, 30, 60 minutos; 2, 6, 24, 48 y 72 horas), en un diseño experimental completamente al azar con cuatro repeticiones. Cada unidad experimental (UE) se constituyó por una hoja de C. sinensis con lesiones de leprosis, colectada de árboles positivos a CiLV-C2 e infestada con 10 ácaros B. yothersi. Los ácaros se ubicaron sobre las lesiones de cada hoja, con la ayuda de estereoscopios y pinceles de punta fina. El pecíolo de las hojas se delimitó con vaselina, para confinar los ácaros; las hojas se colocaron sobre viales de vidrio con agua destilada para mantener humedad durante el tiempo de experimentación.
Una vez cumplido el período de adquisición de cada tratamiento, los ácaros se capturaron y se colocaron durante tres días en alimentación sobre plantas receptoras de tres meses de edad de C. sinensis sanas, para confirmar la adquisición del virus y permitir su transmisión. Cumplido este tiempo, se recolectaron los ácaros de cada tratamiento y se realizó una prueba de detección molecular RT-PCR para diagnosticar la presencia de partículas virales en su cuerpo.
Las plantas receptoras se conservaron para observación durante dos meses y las hojas se calificaron de acuerdo a la aparición o ausencia de lesiones de leprosis. Los resultados obtenidos, sobre aparición de síntomas en hojas, se analizaron estadísticamente mediante una regresión logística, para establecer el efecto del período de adquisición sobre la probabilidad de la presencia de síntomas de la enfermedad.
Período de acceso para inoculación
El tiempo requerido para que el ácaro B. yothersi pueda transmitir el virus de la leprosis después de su adquisición, se evaluó en el C.I. La Libertad bajo condiciones de invernadero, en plantas de C. sinensis. Los ácaros utilizados en estas pruebas, se alimentaron previamente durante 48 horas sobre hojas de C. sinensis positivas al CiLV-C2, para permitir la adquisición del virus. Luego de este período, los ácaros se trasladaron a las plantas de C. sinensis sanas, para evaluar diferentes tiempos de transmisión del virus. El experimento, consistió de ocho tratamientos correspondientes a diferentes períodos de transmisión (0, 10, 20, 30, 60 minutos; 2, 6 y 24 horas), en un diseño completamente al azar con cuatro repeticiones. Cada unidad experimental la constituyó una planta de naranja. Para efectuar las transmisiones, se utilizaron las cuatro hojas más jóvenes de cada planta; cada hoja constituyó una unidad de muestreo y sobre cada una de ellas se ubicaron 10 ácaros, con ayuda de un pincel de punta fina. Los ácaros se confinaron mediante la aplicación de vaselina en la base de las hojas expuestas para evitar su escape.
Luego de cumplido el período de acceso para inoculación de cada tratamiento, los ácaros se retiraron con un pincel y las plantas se dejaron en observación durante dos meses, o hasta la aparición de síntomas de leprosis. Los datos obtenidos se analizaron inicialmente mediante una prueba de dependencia de Chi2 y se ajustó un modelo de regresión logística, para establecer el efecto del período de transmisión sobre la probabilidad de aparición de síntomas. Para el tiempo de aparición de síntomas se efectuó análisis de varianza y prueba de Tukey. Las hojas sintomáticas, se colectaron posteriormente por cada tratamiento, para realizar pruebas moleculares RT-PCR y comprobar la presencia del CiLV-C2 en ellas.
Porcentaje de población virulifera
Este porcentaje de población virulifera, se refiere a la proporción de ácaros que luego de un tiempo de adquisición prudencial presentan partículas virales de CiLV-C2 detectables por medio de RT-PCR dentro de su cuerpo. Para esta prueba se utilizaron 10 grupos de 50 ácaros B. yothersi por grupo, provenientes de las colonias del laboratorio. Cada grupo se colocó en alimentación sobre hojas de C. sinensis positivas al CiLV-C2, bajo condiciones de confinamiento en el laboratorio de entomología de CORPOICA en el C.I. La Libertad. Los ácaros se situaron sobre las lesiones durante cinco días para asegurar la probabilidad de adquisición del CiLV-C2 y cumplido este tiempo, los grupos se recolectaron en viales de vidrio con etanol 90 %, para evaluar el porcentaje de virulencia de cada grupo mediante técnica RT-PCR según metodología desarrollada por Kubo et al. (2011).
Resultados y discusión
Período de acceso para adquisición
Para determinar el período de acceso para adquisición del virus de la leprosis por ácaros B. yothersi, se efectuó la prueba de detección RT-PCR a los ácaros luego de los tiempos de adquisición correspondientes a cada tratamiento. Previamente a la detección molecular, se permitió un período de acceso para inoculación de tres días sobre plantas de C. sinensis sanas y luego se evaluó la aparición de síntomas sobre las plantas receptoras. La detección molecular para CiLV-C2, efectuada en los ácaros mediante prueba RT-PCR, únicamente resultó positiva para ácaros con períodos de adquisición de 2 y 6 horas; los demás tratamientos no mostraron amplificación para CiLV-C2, según se observa en las columnas 5 y 6 de la Figura 1.

Figura 1 Detección de CiLV-C2 en ácaros B. yothersi expuestos a diferentes períodos de acceso para adquisición. 1: Marcador de peso molecular hyperladder IV; 2: 10 min; 3: 30 min; 4: 60 min; 5: 2 horas; 6: 6 horas; 7: 24 horas; 8: 48 horas; 9: 72 horas; 10: Control positivo; 11: Control negativo.
Sin embargo, cuando los ácaros se trasladaron a plantas sanas de C. sinensis para observar si lograban transmitir el virus, las plantas receptoras mostraron aparición de lesiones de leprosis, en los tratamientos en que los ácaros B. yothersi se alimentaron por más de 30 minutos sobre hojas sintomáticas, a pesar de que el diagnóstico molecular no fue positivo sobre estos grupos de ácaros. Dado que en este trabajo se utilizaron iniciadores específicos para la detección de CiLV-C2 por RT-PCR, esto explica por qué no fue posible detectar molecularmente otros tipos de virus, que pudieron causar los síntomas de leprosis observados en las plantas receptoras finales; dichos tipos de virus que también producen lesiones de leprosis, como el citoplasmático (CiLV-C), el nuclear (CiLV-N) o el hibiscus green spot virus (HGSV), se detectaron y secuenciaron en investigaciones posteriores al presente trabajo (Roy et al. 2014; Roy et al. 2015).
De acuerdo con la aparición de síntomas, se encontró que siete de los ocho tratamientos de ácaros que recibieron diferentes períodos de adquisición del virus, lograron causar lesiones visibles de la leprosis en las plantas receptoras, con excepción del tratamiento de 10 minutos de adquisición, estos resultados permiten afirmar que el ácaro B. yothersi puede adquirir el virus de la leprosis después de un período de acceso para adquisición de 30 minutos; así, para los tratamientos de 30 min y 2 h de adquisición, se observó aparición de lesiones de la enfermedad en 75 % de las hojas expuestas al ácaro; en los tratamientos de 60 min, 6 h, 48 h y 72 h, de período de adquisición, el 50 % de las hojas mostró aparición de síntomas del virus, y únicamente el tratamiento de 24 h de adquisición, presentó 100 % de las hojas expuestas al ácaro, con lesiones de leprosis de los cítricos (Tabla 1). Estos resultados complementan los estudios de Chagas et al. (1983), quienes observaron que un período de dos días de alimentación es suficiente para que el ácaro adquiera el virus.
Tabla 1 Desarrollo de lesiones de leprosis en plantas de naranja Valencia C. sinensis expuestas a ácaros B. yothersi con diferente período acceso para adquisición del virus.
| Período de acceso para adquisición | Plantas receptoras con lesiones de leprosis (%) |
|---|---|
| T1 - 10 min | 0 |
| T2 - 30 min | 75 |
| T3 - 60 min | 50 |
| T4 - 2 h | 75 |
| T5 - 6 h | 50 |
| T6 - 24 h | 100 |
| T7 - 48 h | 50 |
| T8 - 72 h | 50 |
Con base en el análisis de regresión logística para la aparición de lesiones de leprosis en función del período de acceso para adquisición (χ2 = 0,0272; Pr > χ2 = 0,8690), se logró establecer que no existe efecto significativo del tiempo de adquisición, sobre la probabilidad posterior de aparición de síntomas en hojas expuestas a los ácaros B. yothersi que han adquirido el virus. Esto implica que el ácaro vector consigue adquirir el virus después de 30 minutos de alimentación sobre hojas de C. sinensis con síntomas de leprosis, y por consiguiente lo podrá transmitir posteriormente. Una vez B. yothersi adquirió el virus y luego se alimentó durante tres días en plantas sanas de C. sinensis, las hojas de estas plantas receptoras presentaron las primeras lesiones de leprosis en un intervalo de 16 y 30 días, lo cual está de acuerdo con Locali et al. (2006), quienes observaron síntomas de leprosis en naranja “pera” después de 17 y 21 días de exposición a ácaros infectados.
Período de acceso para inoculación
Los resultados de las evaluaciones sobre el tiempo requerido por los ácaros B. yothersi para transmitir el CiLV hacia plantas de C. sinensis, después de un período de adquisición de 48 horas, muestran que hubo transmisión y aparición de lesiones de leprosis en todos los tiempos evaluados, con un intervalo entre 10 minutos y 6 horas de transmisión.
De acuerdo a la sintomatología desarrollada, el 25 % de las hojas de las plantas receptoras mostró lesiones de leprosis para períodos de transmisión de 10 y 20 minutos; 50 % de las hojas presentó síntomas de leprosis para los tratamientos de 30 y 60 minutos; cuando los ácaros tuvieron dos horas de transmisión, 56,25 % de las hojas presentó lesiones causadas por el virus; para el tratamiento de 24 horas de transmisión, 62,5 % de las hojas reveló sintomatología y en el tratamiento de seis horas de transmisión, el 68,75 % de las hojas mostró síntomas de infección por leprosis.
Mediante regresión logística, se logró explicar el efecto del tiempo de transmisión sobre la probabilidad de aparición de los síntomas del virus de la leprosis en las hojas de C. sinensis receptoras.
El modelo ajustado (α = 0,082), corresponde a la siguiente expresión: P = 1 / 1 + e (0,278 - 0,0007 t)
En donde: P = Probabilidad de aparición de síntomas y t = tiempo de transmisión. En la Figura 2, se presenta la probabilidad de aparición de lesiones producidas por el virus de la leprosis, asociados con cada uno de los tiempos de transmisión del virus por ácaros B. yothersi.
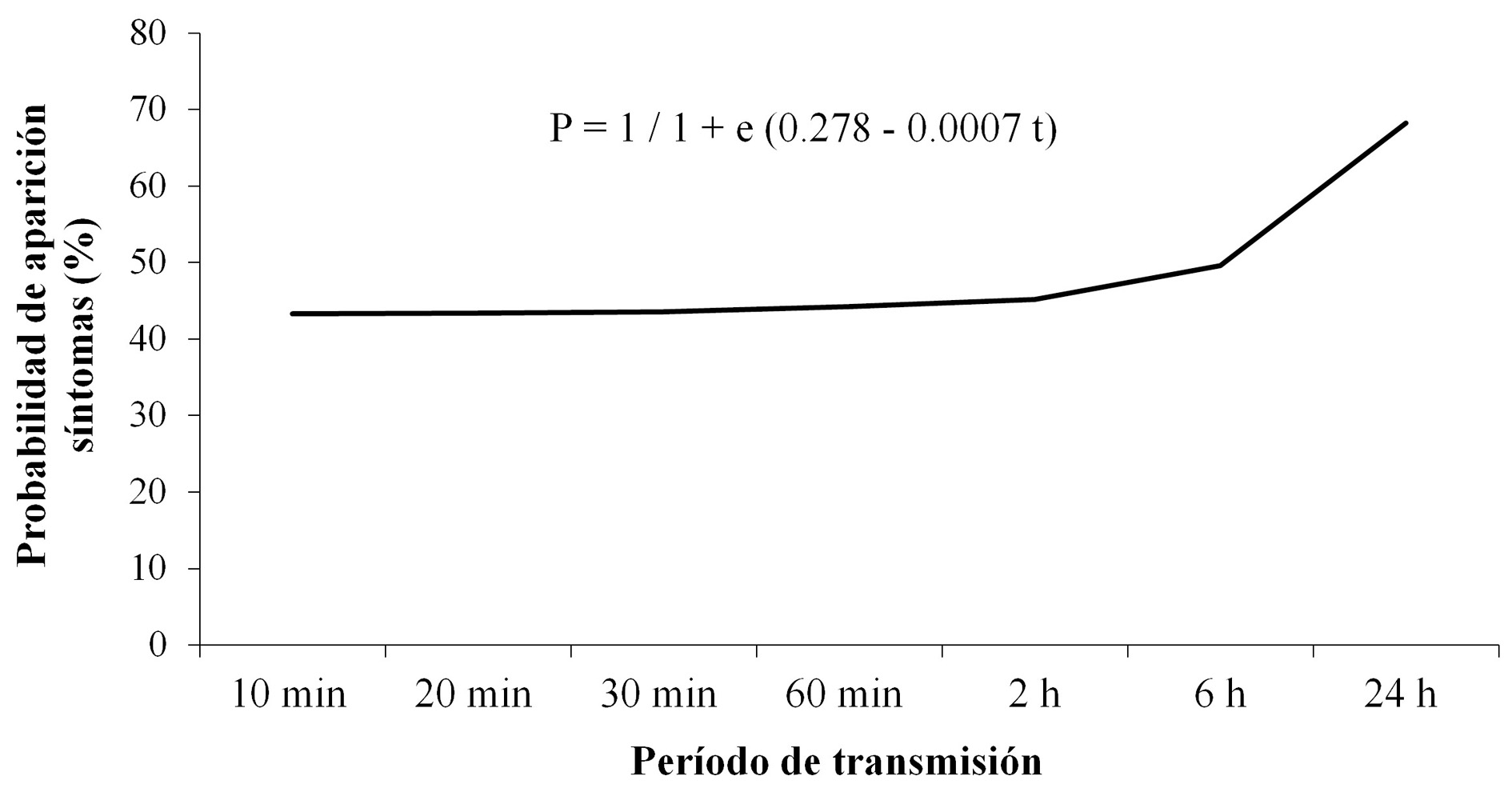
Figura 2 Probabilidad estimada de aparición de síntomas del virus de la leprosis de los cítricos en plantas de C. sinensis receptoras, en función del período de transmisión.
Con base en el modelo desarrollado, se estableció entre 43,3 y 68,2 % el rango de probabilidad de aparición de lesiones de leprosis en plantas receptoras de C. sinensis para tiempos de transmisión entre 10 min y 24 h. De acuerdo al modelo ajustado, la probabilidad de aparición de síntomas se incrementa cuando el período de transmisión es mayor, especialmente luego de 24 horas. Para tiempos de transmisión entre 10 minutos y 6 horas, el porcentaje de plantas con lesiones de leprosis no aumenta de manera considerable (entre 43,3 y 49,6 %, respectivamente), mientras que, a las 24 horas de transmisión, la probabilidad de aparición se incrementa hasta el 68,2 %. Los resultados permiten afirmar que el ácaro B. yothersi puede transmitir el virus de la leprosis de los cítricos con probabilidades superiores al 43,3 %, después de 10 minutos de permanencia sobre plantas sanas de naranja Valencia; cuando el ácaro infectado permanece durante de 24 horas sobre la planta receptora, las probabilidades de transmisión del virus se incrementan por encima de 62,5 %.
La prueba de detección molecular RT-PCR para CiLV-C2, sobre lesiones de leprosis en hojas de C. sinensis expuestas a diferentes períodos de transmisión del virus, resultó positiva para tiempos de transmisión de 20 min a 6 h, pero no amplificó para los tratamientos de 10, 30 min y 24 h. Esto se explica porque fueron utilizados iniciadores específicos para detección de CiLV-C2 y por tanto no se logró diagnosticar otros virus que pudieron producir lesiones de leprosis en las plantas receptoras; dichos tipos de virus pudieron ser el CiLV-N, el CiLV-C o el HGSV, los cuales no habían sido detectados antes de la presente investigación; de igual manera, posteriormente a este estudio, también se comprobó infección mixta por más de un virus de leprosis (CiLV-2 y CiLV-N) en plantas de C. sinensis y en ácaros B. yothersi en Colombia (Roy et al. 2014; Roy et al. 2015).
En la Figura 3, se muestra el gel de agarosa 1 % de los siete períodos de transmisión evaluados y se observa amplificación positiva para CiLV-C2 en las líneas 3, 5, 6, y 7 que representan los tratamientos con períodos de acceso para inoculación de 20 min, 60 min, 2 h y 6 h.
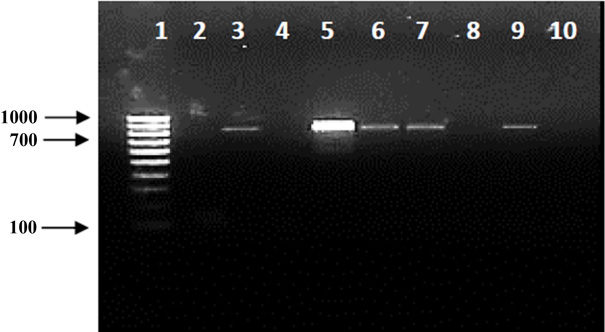
Figura 3 Detección de CiLV-C2 en hojas de C. sinensis expuestas a diferentes períodos de transmisión. 1: Marcador de peso molecular “hyperladder IV”; 2: 10 min; 3: 20 min; 4: 30 min; 5: 60 min; 6: 2 h; 7: 6 h; 8: 24 h; 9: Control positivo; 10: Control negativo.
El diagnóstico molecular por RT-PCR para detección del CiLV-C2 en ácaros B. yothersi, resultó positivo para las muestras de los mismos cuatro tratamientos que amplificaron en hojas, lo cual permite aseverar que los ácaros que lograron adquirir el virus, consiguieron la transmisión efectiva del CiLV-C2 después de 20 minutos en período de transmisión (Fig. 4).
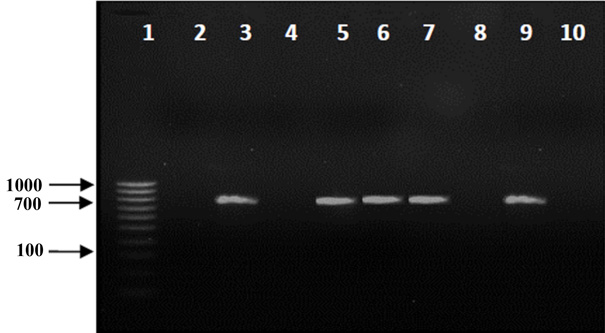
Figura 4 Detección del CiLV-C2 en ácaros B. yothersi con período de adquisición de 48 h y diferentes períodos de transmisión. 1: Marcador de peso molecular “hyperladder IV”; 2: 10 min; 3: 20 min; 4: 30 min; 5: 60 min; 6: 2 h; 7: 6 h; 8: 24 h; 9: Control positivo; 10: Control negativo.
Los primeros síntomas de leprosis en hojas receptoras de C. sinensis, aparecen entre 14 y 32 días después de la transmisión del virus, luego de ser expuestas a ácaros B. yothersi con períodos de transmisión entre 10 minutos y 24 horas. El análisis estadístico sobre la variable dependiente días de aparición de síntomas, no mostró diferencias significativas al efectuar la prueba de Tukey con nivel de significancia del 95 % (α = 0,05). Estas observaciones, sobre el tiempo de aparición de los primeros síntomas, amplían lo afirmado por Locali et al. (2006), quienes registran aparición de síntomas entre los 17 y 21 días. Otros autores (Knorr 1968; Freitas-Astua et al. 2004) reportan que los síntomas iniciales se pueden observar entre los 17 a los 60 días.
Porcentaje de población virulifera
Al efectuar el diagnóstico molecular mediante técnica RT-PCR, sobre 10 poblaciones de 50 ácaros B. yothersi, expuestos a un período de tres días de adquisición del complejo CiLV, se obtuvo que cuatro grupos (G3, G4, G5 y G10) resultaron positivos al CiLV-C2 (líneas 4, 5, 6 y 11) (Fig. 5).

Figura 5 Detección del CiLV-C2 para diez poblaciones de ácaros B. yothersi. 1: Marcador de peso molecular “hyperladder IV”; 2: G1; 3: G2; 4: G3; 5: G4; 6: G5; 7: G6; 8: G7; 9: G8; 10: G9; 11: G10; 12: Control positivo; 13: Control negativo.
Este resultado de detección molecular para CiLV-C2, significa que del total de una población de ácaros B. yothersi que ha permanecido alimentándose durante tres días sobre hojas de C. sinensis con lesiones de leprosis, únicamente el 40 % adquiere el CiLV-C2. Los resultados complementan las observaciones de Rodrigues y Childers (2013), quienes encontraron que los porcentajes de transmisión para hembras adultas de B. phoenicis no superan el 11 %. Otros autores como Chagas et al. (1983) y Chiavegato (1996) reportaron porcentajes de transmisión cercanos al 8 %. La detección molecular del virus en el 40 % de la población de ácaros B. yothersi, contribuye a explicar lo observado por Bassanezi y Laranjeira (2007), quienes al estudiar la distribución espacial del CiLV y su vector B. phoenicis en focos de huertos de cítricos encontraron muy baja correlación entre la enfermedad y el ácaro vector, debido a que solamente parte de la población es portadora del virus.
Kubo et al. (2011), manifiestan que la detección del CiLV en ácaros se debe utilizar como un instrumento importante para entender las relaciones entre virus y vector, así como para el monitoreo y diagnóstico del virus antes de la aparición de la enfermedad; por ello, los resultados de este estudio sobre la detección del CiLV-C2 en poblaciones del ácaro, así como los tiempos de adquisición, transmisión y la eficiencia de transmisión del virus por B. yothersi, aportan bases útiles para el futuro manejo del virus y su vector.
Conclusiones
El ácaro Brevipalpus yothersi Baker (Acari: Tenuipalpidae), adquiere el virus de la leprosis de los cítricos (CiLV-C2), después de 30 minutos de alimentación sobre hojas de naranjo Valencia (Citrus sinensis L.) con lesiones de leprosis, de acuerdo a los períodos de acceso para adquisición del virus evaluados en este estudio.
El ácaro B. yothersi puede transmitir el virus de la leprosis de los cítricos (CiLV-C2), después de 10 minutos de período de acceso para inoculación del virus sobre hojas de C. sinensis y de acuerdo a la sintomatología encontrada en hojas, los porcentajes de transmisión podrían variar entre 43,3 % y 68,2 %. De acuerdo a pruebas RT-PCR para detección en ácaros, se encontró que el 40 % de una población de ácaros B. yothersi adquiere el virus de la leprosis de los cítricos (CiLV-C2), es decir se convierte en virulifera, luego de tres días de adquisición sobre hojas de C. sinensis con lesiones de leprosis. Los resultados del presente estudio proporcionan bases técnico científicas para ampliar el conocimiento de las interacciones que suceden con el virus de la leprosis de los cítricos y su vector B. yothersi, lo cual es fundamental para la formulación y ejecución de programas de prevención y manejo de la enfermedad en el país.














