Introducción
Bactericera cockerelli Sulc (Hemiptera: Triozidae) es una plaga importante en el cultivo de solanáceas y está altamente distribuida en Estados Unidos, México, América Central y Nueva Zelanda (Garzón et al. 2005; Liu et al. 2006; Davidson et al. 2008). Este insecto es considerado el principal vector y transmisor de Candidatus Liberibacter solanacearum (Hansen et al. 2008; Liefting et al. 2009), bacteria asociada con la enfermedad “zebra chip” (ZC), siendo el mayor problema fitosanitario a nivel mundial en cultivos de solanáceas (Secor y Rivera-Varas 2004; Munyaneza et al. 2007). En cultivos de papa expuestas a este triózido, se reportan pérdidas de hasta un 93 % (Munyaneza et al. 2008) mientras que en la industria, el tubérculo pierde su valor comercial ya que al freírse presenta patrones de necrosis radial (Crosslin et al. 2010). Por otra parte, en la producción de tomate en fresco se estiman pérdidas hasta en un 80 % (Liu et al. 2006). Una de las principales acciones para disminuir la transmisión de esta bacteria está basada en reducir la población del insecto vector usando insecticidas sintéticos (Butler y Trumble 2012), tomando en cuenta factores como la irrigación, el nivel de lluvia, método de aplicación y el calendario de aplicación en cada región (Prager et al. 2013). El control en campo de este vector resulta difícil ya que puede elevar su densidad de población al ovipositar hasta 1.400 huevos en su ciclo de vida (Liu et al. 2006); además, presenta hábitos migratorios, o ser acarreados por los vientos dominantes e infestar cultivos alternos (Garzón et al. 2005). B. cockerelli se alimenta preferentemente de solanáceas, sin embargo, presenta un amplio rango de hospederos (Liu y Trumble 2007), a su vez, se han registrado cambios en la velocidad del desarrollo de este insecto dependiendo del tipo de planta de la cual se alimente (Yang y Liu 2009), así como las condiciones ambientales influyen en sus parámetros de fecundidad y supervivencia (Yang et al. 2010). La variación de estos parámetros ha permitido la diferenciación de biotipos, tal es el caso de los nativos de Texas y los migratorios procedentes de California (Liu y Trumble 2007). En México existen diferentes zonas productoras de solanáceas con diversas características climatológicas, hospederos alternos y manejo, por lo que conocer específicamente los parámetros biológicos como: ciclo de vida, tasa de reproducción y crecimiento poblacional de cada población permitirá un mejor manejo de B. cockerelli y además permitirá aplicar un control más certero sin que sobrepase los umbrales económicos de B. cockerelli en especial los debidos a la enfermedad provocada por Ca. Liberibacter solanacearum. Por lo que el objetivo de la presente investigación fue conocer las diferencias morfométricas y parámetros poblacionales de tres poblaciones del noreste de México.
Materiales y métodos
El presente trabajo se desarrolló en condiciones de invernadero y laboratorio en el Departamento de Parasitología de la Universidad Autónoma Agraria Antonio Narro, ubicado en Saltillo, Coahuila, México. La recolecta de B. cockerelli se llevó a cabo dentro de las principales zonas productoras de solanáceas de la región noreste de México donde se han reportado índices elevados de daños ocasionados por este insecto en los cultivos de papa, chile y tomate. Se hicieron muestreos en los municipios de Villa de Arista en San Luis Potosí (SLP) (22º39’N 100º51’O y 1.600 msnm) en cultivo de tomate, bajo alta presión de insecticidas; Rincón de Romos en Aguascalientes (AGS) (22º14’N 102º19’O y 1.940 msnm), en cultivo de chile bajo esquema biorracional y en Arteaga, Coahuila (25º25’N 101º50’O y 3.500 msnm) y Galeana, Nuevo León (24º50’N 100º04’O y 1.655 msnm), ambas localidades presentan las mismas condiciones agronómicas del cultivo de papa, bajo manejo integrado, por lo que se considera una sola población (CNL), tomando ejemplares de cinco a ocho localidades por municipio. Mediante pases de red entomológica se capturaron ninfas y adultos de cultivos, almácigos, invernaderos y malezas donde se encontró B. cockerelli; posteriormente los insectos se mantuvieron en quiescencia en una hielera a 2 °C para su traslado, también se utilizó para el presente estudio una población de laboratorio (LAB) mantenida sin presión de selección con insecticidas desde 2008. Las poblaciones recolectadas en campo (SLP, AGS, CNL) se trasladaron a un invernadero equipado con pared húmeda y climatizado y se liberaron sobre plantas de chile morrón variedad “california wonders” de 30 días, sembradas en camas de siembra de 2,5 x 1 m, cubiertas con tela de organza, empleando una cama por población, las plantas recibieron fertilización, utilizando la fórmula de fertirriego universal de Almería, aplicando los nutrimentos en cada uno de los riego, el manejo fitosanitario fue nulo ya que no se presentaron plagas y enfermedades ajenas al estudio. Para el establecimiento de las colonias, se mantuvieron a 26 ± 3 °C, 70 % de humedad relativa y se dejaron reproducir hasta la F3 la cual se obtuvo aproximadamente en 70 días, para tener material suficiente para las evaluaciones, ya que al llegar a la F3 en un mismo hospedante puede disminuir la variación morfológica y la variedad de características biológicas de cada población silvestre. Para las tablas de vida, se establecieron cohortes de 500 a 600 huevos, una por población, introduciendo en cada una de las camas cuatro macetas, con dos plantas de chile de 60 días después de haberse sembrado. Se dejó a los insectos ovipositar por un periodo de 24 h, pasado el tiempo se retiraron las plantas y éstas se trasladaron a jaulas de 50 x 50 cm cubiertas con tela organza dentro de una habitación aclimatada en condiciones de laboratorio a 25 ± 2 °C, con 65 ± 5 % de H. R. y un fotoperiodo de 14:10 h L:O. Con ayuda de una lupa de 10x se seleccionaron 150 huevos por maceta para registrar diariamente su eclosión y supervivencia hasta que todas las poblaciones llegaran al estado adulto, registrando también el periodo de pre-oviposición. El número de oviposturas se tomó en cuenta sólo hasta los 14 días después de la eclosión debido a que las plantas murieron. Los periodos de desarrollo y de supervivencia fueron analizados mediante un análisis de varianza, ambas con α = 0,05, y las medias entre las poblaciones se compararon usando Tukey para tiempo de desarrollo y diferencia mínima significativa (DMS) para la supervivencia tomando los porcentajes transformados mediante arcoseno. En cuanto a los parámetros poblacionales, se calcularon: la reproducción bruta (Σm x ), la tasa intrínseca de crecimiento natural (r m ), la tasa de reproducción neta (R o ), el tiempo generacional (T), el tiempo de duplicación (DT) y la capacidad finita de crecimiento (λ) de acuerdo Maia et al. (2000). Para la morfometría, se establecieron cuatro cohortes, una para cada población, de alrededor de 500 a 600 huevos. Se tomaron las medidas de anchura del tórax y largo de huevo y de ninfa, para diferenciar los estadios de B. cockerelli. Marín et al. (2002), mencionan que en el primer estadio no son evidentes la división de cabeza, tórax y abdomen, pero en el segundo se hace evidente; el tercer estadio presenta ojos rojos y paquetes alares visibles; el cuarto estadio presenta antenas bien formadas con setas sensoras visibles; en el quinto estadio la segmentación de antenas y patas es bien definida, así como los paquetes alares presentan ángulos humerales. Se usó el software DinoCapture 2.0 y el microscopio Digi 2, 1500, LABOMED, LaboAmerica Inc. EE.UU. empleando el objetivo 4x, para realizar las mediciones. A los datos obtenidos se les realizó un anova y la prueba de Tukey (α = 0,05), en todas las evaluaciones se utilizó el software SAS 9.1 (SAS Institute 2008).
Resultados
El tiempo de desarrollo de los estadios de B. cockerelli, de huevo hasta la formación de adultos, fueron diferentes estadísticamente (Tabla 1). Se puede observar que la población de SLP, es la que requiere de mayor tiempo para completar el ciclo de huevo a adulto; para el quinto estadio fueron las poblaciones AGS, CNL y SLP con un promedio de 5 a 5,5 días, para el cuarto estadio fueron las poblaciones SLP y AGS. Para el tercer, segundo y primer estadio la tendencia fue similar; mientras que para el huevo los valores más altos, los mostró la población de SLP con un promedio de 7,25 días.
Tabla 1 Tiempo de desarrollo de estadios inmaduros de las cuatro poblaciones de B. cockerelli.
| Estadio | Tiempo de desarrollo (días ± S. D.) * | |||
|---|---|---|---|---|
| LAB | SLP | CNL | AGS | |
| Huevo | 5,5 ± 0,5 b | 7,25 ± 0,5 a | 5,75 ± 0,5 b | 5,5 ± 0,5 b |
| Ninfa | 17 ± 0,8 c | 24,5 ± 0,5 a | 18,5 ± 1,0 c | 21,75 ± 0,5 b |
| 1er instar | 3,5 ± 0,5 b | 5,25 ± 0,5 a | 4,25 ± 0,5 ab | 5,00 ± 0,5 a |
| 2do instar | 3,25 ± 0,5 b | 4,5 ± 0,5 a | 3,25 ± 0,5 b | 3,5 ± 0,5 ab |
| 3er instar | 3,25 ± 0,5 b | 4,75 ± 0,5 a | 3,00 ± 0,0 b | 4,25 ± 0,0 a |
| 4to instar | 3,25 ± 0,5 bc | 4,5 ± 0,5 a | 3,00 ± 0,0 c | 4,00 ± 0,0 ab |
| 5to instar | 3,75 ± 0,5 b | 5,5 ± 0,5 a | 5,00 ± 0,0 a | 5,00 ± 0,0 a |
| Huevo-Adulto | 22,5 ± 0,5 d | 31,75 ± 0,5 a | 24,25 ± 0,5 c | 27,25 ± 0,5 b |
S. D.: desviación estándar. * Las medias en las mismas filas con diferente letra son estadísticamente diferentes (α = 0,05).
En la Tabla 2 se puede observar que, en la supervivencia en huevos, ninfas de primer y quinto estadio, no hubo diferencias estadísticas significativas entre las cuatro poblaciones. La población SLP presentó mayor mortalidad en el segundo instar al reducirse la supervivencia a un 27 %, mientras que LAB, CNL y AGS mostraron un comportamiento similar en este parámetro en los tres últimos estadios ninfales. La población AGS fue la que registró menor mortalidad desde huevo hasta la formación del adulto seguida de CNL, LAB y SLP.
Tabla 2 Supervivencia de estadios inmaduros de B. cockerelli, bajo condiciones de laboratorio a 25 ± 2 °C, 65 ± 5 % de H. R. y 14:10 h L:O.
| Estadio | Supervivencia (% ± S. D.) * | |||
|---|---|---|---|---|
| LAB | SLP | CNL | AGS | |
| Huevo | 98,6 ± 0,0 a | 90 ± 1,4 a | 96 ± 4,2 a | 95 ± 7,7 a |
| 1er instar | 88,6 ± 7,0 a | 85 ± 4,9 a | 79 ± 12 a | 85 ± 10,6 a |
| 2do instar | 57,6 ± 7,7 ab | 27 ± 2,1 c | 48 ± 4,2 b | 62 ± 2,1 a |
| 3er instar | 42,6 ± 1,4 a | 20 ± 3,5 b | 39 ± 4,9 a | 40 ± 9,9 a |
| 4to instar | 33,6 ± 0,7 a | 17 ± 3,5 b | 33 ± 7,7 a | 29 ± 6,3 a |
| 5to instar | 17,0 ± 0,7 a | 13 ± 2,1 a | 17 ± 7,0 a | 16 ± 1,4 a |
| Adulto | 9,0 ± 2,1 c | 6 ± 1,4 d | 10 ± 1,4 b | 13 ± 2,8 a |
S. D.: desviación estándar. * Las medias en las mismas filas con diferente letra son estadísticamente diferentes (α = 0,05).
En cuanto al periodo de pre-oviposición, ninguna población mostró diferencias, sin embargo, podemos mencionar que AGS y CNL fueron las que requirieron más tiempo (Tabla 3). Por otro lado, para el parámetro de fecundidad se encontraron diferencias significativas entre poblaciones, siendo SLP quien registró mayor número de oviposturas, seguida de AGS, CNL y LAB.
Tabla 3 Parámetros reproductivos de hembras de B. cockerelli, bajo condiciones de laboratorio a 25 ± 2 °C, 65 ± 5 % de H. R. y 14:10 h L: O.
| Parámetro | LAB | SLP | CNL | AGS |
|---|---|---|---|---|
| Pre-oviposición * | 7,5 ± 0,57 a | 7,75 ± 0,5 a | 8,25 ± 0,95 a | 8,25 ± 0,5 a |
| Fecundidad * | 156 ± 12,2 b | 178,5 ± 14,36 a | 159 ± 11,40 b | 162 ± 15,23 ab |
* Las medias en las mismas filas con diferente letra son estadísticamente diferentes (α = 0,05).
Con relación a los parámetros de tablas de vida (Tabla 4), para la tasa de reproducción bruta (Σm x ) las poblaciones SLP y LAB presentaron, respectivamente, el mayor y menor registro. Por otra parte, la tasa reproductiva neta (R o ) la población AGS fue significativamente diferente al resto de las demás, seguida por CNL y LAB las que presentaron un R o similar; por último, SLP la que registró menor número de hembras hija por hembras madre; mientras que para la tasa intrínseca de incremento natural (r m ) se obtuvieron diferencias, siendo AGS la que presenta mayor tasa de crecimiento, seguida de AGS, CNL, LAB y SLP. Respecto al tiempo generacional (T) SLP fue la más longeva y CNL la que menor tiempo requirió para completar un ciclo. En cuanto al tiempo de duplicación (DT) fue AGS la de menor tiempo y SLP la que mayor tiempo necesitó para duplicar su población ambas poblaciones con una diferencia de 4,65 días, en cuanto a la capacidad finita de crecimiento (λ), AGS fue la población que registró mayor tasa, seguida de CNL, LAB y SLP.
Tabla 4 Parámetros de tabla de vida de cuatro poblaciones B. cockerelli bajo condiciones de laboratorio a 25 ± 2 °C, 65 ± 5 % de H. R. y 14:10 h L:O.
| Param. | LAB | SLP | CNL | AGS | ||||
|---|---|---|---|---|---|---|---|---|
| Real | Jackknife (L.F. 95 %) | Real | Jackknife (L.F. 95 %) | Real | Jackknife (L.F. 95 %) | Real | Jackknife (L.F. 95 %) | |
| Σmx | 391,25 | -- | 446,25 | -- | 397,5 | -- | 405 | -- |
| R o | 7,04 | 7,0425 (6,1665-7,9185) b | 5,36 | 5,3550 (4,6693-6,0407) c | 7,95 | 7,95 (7,0428-8,8571) b | 10,53 | 10,53 (8,9546-12,1054) a |
| r m | 0,07 | 0,0732 (0,0666-0,0781) b | 0,06 | 0,0559 (0,0557-0,0693) c | 0,081 | 0,081 (0,0727-0,0893) ab | 0,0897 | 0,0897 (0,0810-0,0984) a |
| T (d) | 27 | 26,6667 (25,7217-28,2265) b | 26,8 | 30,00 (30,00-30,00) a | 25,586 | 25,5727 (24,3322-26,8132) bc | 26,232 | 26,2280 (24,5858-27,8703) b |
| DT (d) | 9,58 | 9,4618 (8,7993-10,3424) b | 11,1 | 12,3791 (9,8785-12,2634) a | 8,5544 | 8,54267 (7,6717-9,4136) bc | 7,7234 | 7,7149 (6,9776-8,4524) c |
| Λ | 1,08 | 1,0759 (1,0689-1,0812) b | 1,06 | 1,0575 (1,0573-1,0717) c | 1,0844 | 1,0844 (1,0754-1,0933) ab | 1,0939 | 1,0939 (1,0844-1,1034) a |
Tasa de reproducción bruta (Σm x ), tasa reproductiva neta (R o ), tasa intrínseca de incremento natural (r m ), tiempo generacional (T), tiempo de duplicación (DT) y capacidad finita de crecimiento (λ). Todos los parámetros fueron calculados usando el programa SAS escrito por Maia et al. (2000), los parámetros de estimación Jackknife en la misma fila con diferente letra son estadísticamente diferentes a α = 0,05 y L. F. 95 %: límites Fiduciales a 95 %.
En la Tabla 5, se presentan las medias de longitud de huevos y ninfas, la población SLP registró mayor longitud en huevos, seguido por las poblaciones CNL, LAB y AGS. Para el caso del primer estadio, CNL y LAB presentaron medidas similares, de igual forma para segundo y tercer estadio, en donde LAB, CNL y AGS no presentaron diferencias. Por último, en el quinto estadio LAB y AGS son estadísticamente iguales, diferentes a CNL y SLP (que presentaron medidas semejantes), En los estadios ninfales del 2do al 4to la población SLP presentó menor longitud siendo significativamente diferente al resto de las demás poblaciones.
Tabla 5 Morfometría de largo de huevo y ninfas de cuatro poblaciones B. cockerelli bajo condiciones de laboratorio a 25 ± 2 °C, 65 ± 5 % de H. R. y 14:10 h L: O.
| Estadio | Medidas de largo (mm) ± S. D. * | |||
|---|---|---|---|---|
| LAB | SLP | CNL | AGS | |
| Huevo | 0,279 ± 0,024 ab | 0,289 ± 0,025 a | 0,283 ± 0,017 ab | 0,269 ± 0,031 b |
| N 1er instar | 0,371 ± 0,037 a | 0,318 ± 0,033 c | 0,364 ± 0,034 b | 0,397 ± 0,048 a |
| N 2do instar | 0,612 ± 0,031 a | 0,555 ± 0,043 b | 0,591 ± 0,030 a | 0,606 ± 0,031 a |
| N 3er instar | 1,173 ± 0,020 a | 1,152 ± 0,024 b | 1,181 ± 0,24 a | 1,168 ± 0,018 a |
| N 4to instar | 1,663 ± 0,029 a | 1,605 ± 0,028 c | 1,636 ± 0,032 b | 1,677 ± 0,027 a |
| N 5to instar | 1,771 ± 0,024 a | 1,750 ± 0,032 b | 1,765 ± 0,044 b | 1,773 ± 0,022 a |
N: ninfa. S. D.: desviación estándar. * Las medias en las mismas filas con diferente letra son estadísticamente diferentes (α = 0,05).
Los patrones de medidas del ancho del cuerpo de los estadios ninfales, fueron diferente a lo reportado para la medida del largo de las ninfas (Tabla 6). En términos generales la población de AGS fue la que presentó los valores más altos para huevo y ninfa del primer estadio, mientras que para los estadios ninfales dos, tres y cuatro los resultados fueron muy variables. Para el estadio de ninfa cinco, las poblaciones no presentaron diferencias con significancia estadística.
Tabla 6 Morfometría de ancho de huevo y ninfas de cuatro poblaciones B. cockerelli bajo condiciones de laboratorio a 25 ± 2 °C, 65 ± 5 % de H. R. y 14:10 h L:O.
| Estadio | Medidas de ancho (mm) ± S. D. * | |||
|---|---|---|---|---|
| LAB | SLP | CNL | AGS | |
| Huevo | 0,114 ± 0,013 b | 0,111 ± 0,010 b | 0,127 ± 0,013 ab | 0,138 ± 0,065 a |
| N 1er instar | 0,181 ± 0,050 ab | 0,179 ± 0,047 ab | 0,170 ± 0,32 ba | 0,202 ± 0,040 a |
| N 2do instar | 0,389 ± 0,025 a | 0,356 ± 0,028 a | 0,376 ± 0,025 a | 0,387 ± 0,023 b |
| N 3er instar | 0,704 ± 0,037 ab | 0,690 ± 0,041 b | 0,717 ± 0,40 a | 0,706 ± 0,042 ab |
| N 4to instar | 1,150 ± 0,029 a | 1,113 ± 0,024 b | 1,135 ± 0,027 a | 1,140 ± 0,027 a |
| N 5to instar | 1,153 ± 0,024 a | 1,143 ± 0,025 a | 1,159 ± 0,030 a | 1,157 ± 0,026 a |
N: ninfa. S. D.: desviación estándar. * Las medias en las mismas filas con diferente letra son estadísticamente diferentes (α = 0,05).
Discusión
Para el tiempo de desarrollo Yang et al. (2010) mencionan que a 26 °C el desarrollo de los estadios inmaduros de B. cockerelli es precoz (en promedio 19,6 días) en condiciones de laboratorio, por su parte Abdullah (2008) registra un ciclo completo de 34,7 ± 2,76 días, resultados muy parecidos a los nuestros, debido a que están comprendidos dentro de estos rangos. Considerando que los insectos dependen de las condiciones del medio al no poder regular su temperatura, este es un factor determinante en el tiempo de desarrollo, a temperaturas entre los 16 a 21 °C las poblaciones aumentan con rapidez (Knowlton y Janes 1931), pero cuando son superiores a los 32 °C se detiene la oviposición, eclosión de huevos y disminuye la supervivencia de ninfas, arriba de 37 °C resultan letales tanto para huevos y ninfas en un transcurso de dos horas (Pavlista 2002).
Se ha observado que el tiempo de desarrollo también puede ser alterado mediante la tolerancia a ciertos insecticidas. En ausencia de presión de selección, los individuos que poseen genes de resistencia tienden a tener una esperanza de vida y una capacidad reproductiva diferentes a su contraparte susceptible (Roush y Daly 1990). En el caso de los neonicotinoides en Bemisia tabaci (Gennadius) (Hemiptera: Aleyrodidae) el tiempo empleado por estadios ninfales de la población resistente es significativamente mayor que el de las poblaciones susceptibles (Campuzano et al. 2010). Así mismo, este comportamiento puede estar ligado al sexo ya que estudios en mosquitos Culex quinquefasciatus Say (Diptera: Culicidae) las hembras susceptibles presentaron un menor tiempo de desarrollo de huevo a adulto y mayor tamaño corporal en comparación con la cepa resistente a piretroides (Hardstone et al. 2010). Esta alteración trae consigo efectos benéficos, tal es el caso en Cydia pomonella Linneo (Lepidoptera: Tortricidae) donde los individuos resistentes que presentan tiempos más largos de desarrollo, podrían aumentar el tiempo de exposición a los enemigos naturales disminuyendo así la densidad de individuos tolerantes y por lo tanto también los niveles de resistencia de la población (Konopka et al. 2012).
Otro factor que altera el tiempo de desarrollo es el tipo de hospedero, B. cockerelli presenta un amplio rango de ellos incluyendo varias especies en 20 familias, de las cuales tienen una preferencia muy fuerte a las especies de las solanáceas (Liu y Trumble 2007), según Yang y Liu (2009) registran diferencias significativas de este insecto al alimentarse de chile (Capsicum annum Linneo) y berenjena (Solanum melongena Linn.) siendo este último en donde se requirió menor tiempo para completar un ciclo completo, por lo que la elección de la variedad también debe ser importante dentro de un manejo integrado. Liu et al. (2006) reportan que en dos variedades de tomate “yellow pear” y “QualiT 21” los daños fueron irreparables, la primera a una densidad de 40 ninfas alimentándose durante 10 días, mientras que en la segunda variedad con 20 ninfas en cinco días, respectivamente.
En el caso de la supervivencia, Yang et al. (2010) registran entre 11,3 y 14,5 % de infertilidad en condiciones de campo y laboratorio, datos similares a nuestro estudio, donde encontramos entre 1,4 y 10 % de huevos no viables. Por su parte de Yang y Liu (2009) reportan una supervivencia de los estadios inmaduros de 34 % en condiciones controladas de laboratorio en el cultivo de pimiento, también reportaron variación significativa al cambiar de hospedero, probablemente se deba a los mecanismos de las plantas que desarrollan resistencia a infestaciones de B. cockerelli, ya que investigaciones de Casteel et al. (2006) mencionan que la supervivencia de huevo a adulto fue mayor en las plantas que carecen del gen de resistencia Mi-1.2 en comparación con las plantas resistentes entre un 55,4 % y 24 % de supervivencia de huevo a adulto respectivamente.
Por su parte Liu y Trumble (2007) sugieren que la supervivencia puede estar mediada según la diferenciación genética, debido a que reportan mayor supervivencia y menor tiempo de desarrollo en poblaciones nativas de Texas, EE.UU., en comparación con poblaciones de Baja California, México. Ambas poblaciones caracterizadas como dos biotipos diferentes, donde el biotipo invasor es menos susceptible a insecticidas al presentar valores de CL50 mayores que el biotipo nativo, esto puede ser un indicativo que la supervivencia en B. cockerelli pueda ser alterado por la tolerancia a insecticidas, ya que en Aedes albopictus Singh (Diptera: Culicidae) la tasa de supervivencia es menor en cepas resistentes a piretroides, cuyo principal mecanismo de resistencia implica al citocromo P450 monooxigenasa (Chan y Zairi 2013), caso contrario en Bemisia tabaci donde los individuos resistentes a neonicotinoides, la supervivencia es significativamente mayor en contraste con los susceptibles (Basit et al. 2012) siendo estos insecticidas los de mayor uso en las regiones productoras de solanáceas de nuestro estudio (Vega et al. 2008; Cerna et al. 2013).
Abdullah (2008) menciona que los altos valores de mortalidad ocurren en los primeros estadios ninfales, siendo en nuestros reportes hasta el segundo. Cuando esto sucede, probablemente se deba a que las condiciones en las que se estableció el experimento (25 ± 2 °C, 65 ± 5 % de H. R. y 14:10 h L:O) siendo óptimas para su desarrollo, dado que los resultados de la prueba de Bartlett muestran que, aun cuando los valores de error estadístico difieren entre sí, el procedimiento señala que es un efecto aleatorio y existe gran probabilidad de que las fuentes de variación sean las mismas, no interviniendo ningún otro factor externo en la supervivencia excepto la mortalidad natural. De lo anterior podemos deducir que la elevada supervivencia de huevos (Fig. 1), probablemente esté dada por la poca variación de la humedad relativa, ya que según Knowlton y Janes (1931) los huevos son puestos preferentemente sobre la yemas apicales más tiernas y, según Cranshaw (1989), con frecuencia en hilera en los bordes marginales o distribuidos en la superficie de las hojas. En campo estas ubicaciones permiten la rápida deshidratación de huevos reduciendo su viabilidad.
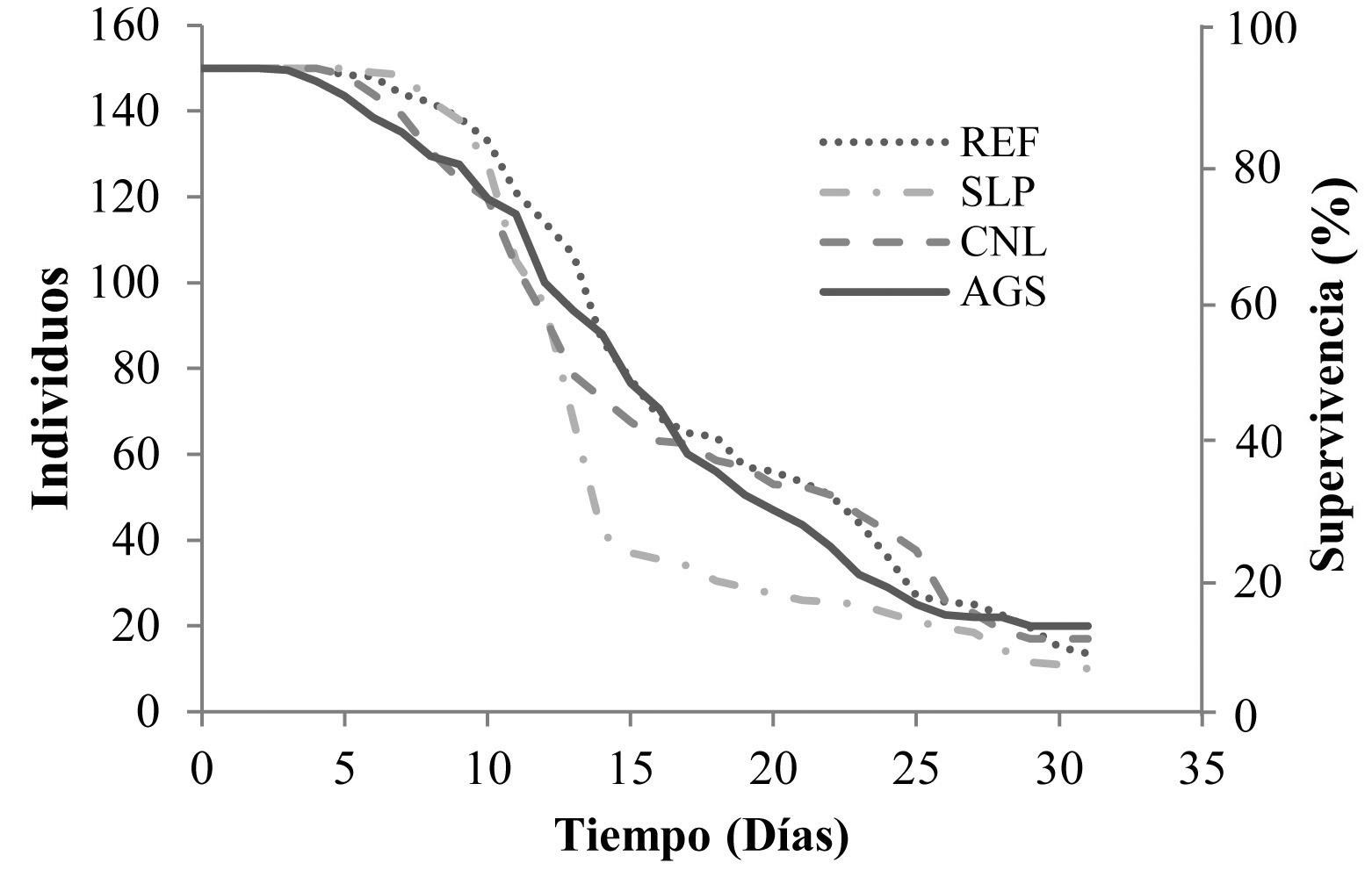
Figura 1 Curvas de supervivencia acumulada en estadios inmaduros de B. cockerelli de cuatro poblaciones distintas, bajo condiciones de laboratorio a 25 ± 2 °C, 65 ± 5 % de H. R. y 14:10 h L:O.
Yang y Liu (2009) reportan que el periodo de máxima fecundidad se encuentra entre los 8 y 9 días. En estudios similares las hembras de B. cockerelli alcanzan a poner de 196 a 267 huevos en tomate en condiciones controladas (Abdullah 2008), datos similares a nuestros resultados ya que en promedio las oviposturas fueron: 178,5, 162, 159, 156 para SLP, AGS, CNL y LAB respectivamente; Wallis (1955) menciona que depositan alrededor de 300 huevos, teniendo la capacidad de elevar rápidamente sus poblaciones ovipositando hasta 1.400 huevos por hembra (Liu et al. 2006), estas diferencias en las oviposturas no están relacionadas con la resistencia de las plantas a estos triózidos, ya que Casteel et al. (2006) reportan mayor número de oviposturas en variedades susceptibles pero no son significativas.
Relacionando la tolerancia a insecticidas con la fecundidad, en algunos insectos de la familia Thripidae, Bielza et al. (2008) registran que las hembras resistentes a spinosad fueron significativamente más fecundas (mayor número de oviposturas por hembra); Kumar et al. (2009) mencionan que en Aedes aegypti Linneo, las cepas resistentes a deltametrina tienden a reducir drásticamente su fecundidad hasta un 54 % y pueden reducir la fertilidad de huevos en un 49 %; en B. tabaci el número de huevos puestos por poblaciones resistentes a neonicotinoides fueron significativamente más bajos, pero que las proporciones de huevos eclosionados fueron significativamente mayor (Basit et al. 2012). Por su parte Liu et al. (2006) reportan un incremento de la fecundidad en un 33 % con la aplicación de dosis bajas de delta-fenotrina, el cual el efecto es reversible en las futuras generaciones. En nuestro estudio la viabilidad de los huevos se presentó de manera uniforme por lo que no se encontraron diferencias entre las poblaciones. Otros estudios mencionan que la disminución de la fecundidad, dada por exposición a plaguicidas se deba a que el químico afecta la movilidad y, probablemente, resulta un menor número de encuentros, conduciendo a tasas de cruzamiento reducidas (Lopes et al. 2008). Además a que machos resistentes engendran significativamente menos descendencia que los susceptibles debido a la reducción de esperma, mientras que machos susceptibles tienden a aparearse con más frecuencia (Higginson et al. 2005). Otro factor estudiado es la fecundidad y la supervivencia de las ninfas infectadas por la bacteria Ca. Liberibacter solanacearum, desconociendo si el nivel del patógeno se correlaciona con la reducción de la aptitud del vector, efecto negativo sobre la fecundidad (Nachappa et al. 2014).
Respecto a los parámetros poblacionales, investigaciones similares han registrado una tasa bruta de crecimiento de 68,3 en poblaciones de campo, siendo las condiciones de laboratorio las más favorables, ya que su Σm x incrementó en 246,8 (Yang et al. 2010), en comparación con nuestros resultados, estos se encuentran por encima de este rango, por lo que dichas tasas presentan un comportamiento similar, para el caso de R o y T, en diferentes hospederos como berenjena y chile no presentó diferencia significativa, en cuanto al tiempo de duplicación sus valores fueron muy similares a los nuestros de 6,3 a 7,8 (Yang y Liu 2009).
En relación a la morfometría, es una herramienta que ha demostrado ser efectiva para determinar la variación resultante de la fisiología de los individuos (variación del tamaño), propia de la población y producto probablemente del componente genético (variación de la forma) (Jaramillo et al. 2002), así como para la caracterización de poblaciones en cuanto a su estructura e infestación (Dujardin et al. 2014); la variación morfométrica se puede utilizar para discriminar "poblaciones fenotípicas," definidas como grupos con un crecimiento, mortalidad, y tasas de reproducción similares (Cadrin 2000). Actualmente existen pocos reportes de la morfometría de B. cockerelli y su relación con los parámetros de tablas de vida por lo que este estudio permite una mayor diferenciación y discriminación de poblaciones de la misma especie de diferentes localidades del noreste de México, ya que dentro de la investigación filogenética es muy común la discriminación de especies, basada en correlaciones morfométricas (Henni et al. 2014). Vargas et al. (2013) evaluaron, en condiciones de invernadero, el efecto de dos variedades de jitomate sobre la morfometría de B cockerelli. En el análisis de morfometría de huevos se consideraron las variables longitud de huevo, ancho de huevo y longitud de pedicelo. En ninfas largo de cuerpo, ancho y longitud de antena; en adultos longitud de cuerpo, ancho; longitud y ancho de ala. Se encontró que el efecto de las variedades de jitomate en la morfometría, no presentó diferencia significativa sobre longitud de huevos, aunque el ancho si resultó afectado por la variedad. Por su parte Carvalho y Hauser (1994) mencionan que los grupos con diferencias intraespecíficas en su ciclo de vida y morfometría deben ser identificados para modelar con precisión la dinámica poblacional, la evaluación de la población y manejo, independientemente de las diferencias o similitudes genéticas; ya que en algunas especies en donde se han realizado estudios de morfometría, se ha encontrado que las diferencias fenotípicas no siempre es el resultado de la divergencia genética, y los grupos definidos por las diferencias morfológicas no pueden indicar poblaciones reproductivamente aisladas (Swain y Foote 1999). Estos autores señalan que las diferencias morfométricas también pueden indicar diferentes ambientes o hábitats en una etapa crítica de su desarrollo. Otro caso a estudiar es la interacción entre tolerancia a insecticidas y el tamaño de los insectos. Georghiou y Taylor (1977) mencionan que el desarrollo de resistencia en poblaciones de campo como resultado del proceso de evolutivo, el cual está dado por factores genéticos, biológicos y de manejo, afecta ciclos biológicos, reproductivos, peso y tamaño de los individuos. Konopka et al. (2012) reportan en tortricidos un efecto negativo en las dimensiones de los individuos resistentes, ya que a mayor tolerancia menor masa pupal y tamaño del adulto, resultados similares a los reportados en nuestro estudio, donde las poblaciones que están menos expuestas a plaguicidas presentaron los valores más altos en largo y ancho del cuerpo (AGS y LAB). Por su parte, Guedes et al. (2006) en Sitophilus zeamais Motschulsky (Coleoptera: Curculionidae) asocian que a mayor masa corporal presentan mayores reservas de energía para el desarrollo, reproducción y resistencia a insecticidas, diferente a lo reportado por Hardstone et al. (2010) quienes mencionan que el menor tamaño corporal de las poblaciones de mosquito resistentes probablemente se deba a los costos asociados con el alelo de resistencia de desintoxicación mediada por P450, o como en el caso de lo reportado por Chareonviriyaphap et al. (2003) quienes registran una disminución en el tamaño, de las líneas susceptibles del mosquito A. minimus Theobald que estuvieron sujetas a presión de selección con deltametrina.
Conclusiones
La población LAB mostró los mejores resultados, siendo la que menor tiempo requirió para completar su ciclo biológico. AGS es la que mayor supervivencia presentó hasta la presencia de adultos con el mayor número de individuos supervivientes. Por su parte, SLP es la que más tiempo requiere para completar un ciclo biológico y menor supervivencia registró, siendo esta población la más fecunda. En cuanto al tamaño de largo y ancho del cuerpo en los diferentes estadios, las poblaciones de AGS y LAB presentaron los valores más altos.
Los datos demuestran que poblaciones expuestas a presión de selección por plaguicidas, cambian sus parámetros poblacionales, al incrementar el número de oviposturas como una respuesta fisiológica a la aplicación de pesticidas, como fue el caso de la población SLP; así mismo podemos mencionar que un menor tamaño también es reflejo del gasto de energía para la defensa contra pesticidas, no para el uso en otros procesos fisiológicos. Caso contrario con las poblaciones con una menor presión por pesticidas, que mostraron ciclos biológicos más cortos y un mayor tamaño (poblaciones LAB y AGS). Dando este tipo de estudios información sobre la biología y hábitos que nos permitan realizar controles más precisos.














