Introducción
La achira o sagú (Canna indica L.) (Cannaceae, Zingiberales) es una de las raíces y tubérculos andinos nativos de importancia económica y nutricional para los agricultores de Los Andes (CIP 2015). Esta especie se cultiva en los valles interandinos templados desde México hasta el norte de Argentina (Fries 2007). La achira es una planta herbácea de reproducción vegetativa de cuyos rizomas cosechados entre los 10 y 14 meses después de siembra se obtiene almidón. Este es extraído y utilizado, principalmente, como materia prima en la fabricación de bizcochos y de otros productos autóctonos de consumo local y regional como bizcochuelos, pan, coladas y natillas. El rendimiento de rizoma del cultivo varía entre 15 y 40 t / ha de materia fresca y un contenido de 10 a 17 % de almidón (Fries 2007). En Colombia, es considerada una planta para cultivo de minifundio y huerta familiar, con extensiones promedio inferiores a una hectárea. Básicamente, es un cultivo de subsistencia en varios departamentos (Caicedo et al. 2003a) aunque también se cultiva con fines comerciales en Cundinamarca, Huila y, en menor medida, en Nariño, Cauca, Caquetá, Meta y Boyacá (Caicedo et al. 2003a; Rodríguez et al. 2003; Ministerio de Agricultura y Desarrollo Rural 2017).
La achira se adapta a una diversidad de climas y existen gran cantidad de morfotipos, tal y como se destaca en una investigación llevada a cabo en el Centro de Investigación La Selva (Rionegro, Antioquia), de la Corporación colombiana de investigación agropecuaria (Agrosavia). En dicha investigación se realizó la evaluación de la colección colombiana de achira, C. indica, con caracterización de variables como color de hoja, tallos, pétalos, sépalos, frutos, semilla, rizoma, forma de la hoja, fruto, rizoma y longitud, diámetro y número de tallos, rizoma, hojas, semilla, flores y fruto, encontrando una gran variabilidad fenotípica (Lobo-Arias et al. 2017). El cultivo de la achira tiene una gran adaptabilidad climática y crece en varios pisos térmicos (0-2.650 msnm.), los cuales a su vez ofrecen una amplia gama de regímenes de lluvia, temperatura, humedad relativa y luminosidad en los que el cultivo presenta buen desarrollo. El cultivo de la achira está adaptado para crecer bajo regímenes de lluvia que van desde los 250 hasta 4.000 mm al año, temperaturas desde los 16 °C hasta 32 °C, humedad relativa óptima entre 65 % y 90 % con una mínima del 40 %. Además, requiere gran luminosidad para realizar la fotosíntesis y obtener buena producción de almidón (Rodríguez et al. 2003). Debido a su rusticidad, no precisa mayores cuidados, salvo el apoyo con riego en períodos de sequía prolongada y la siembra en suelos con buena cantidad de materia orgánica (Fries 2007). Históricamente no se han tenido reportes sobre plagas que afecten seriamente la producción, aunque hay registro de algunos enrolladores, filófagos y de virosis en Colombia o en otros países andinos (Torres 1999; Torres 2004; Fries 2007). Sin embargo, Caicedo (2004) reportó la presencia ocasional de insectos como el gusano tornillo, Castniomera humboldtti (Boisduval, 1875) (Lepidoptera: Castniidae), chizas de las especies Platycoelia valida (Burmeister, 1844), Podischnus agenor (Olivier, 1789), Anomala sp. (Coleoptera: Scarabaeidae) y del gusano cogollero, Spodoptera sp. (Lepidoptera: Noctuidae). Desde 2014, diferentes actores de la cadena de achira expresaron su preocupación por la aparición de insectos nocivos que pueden ser limitantes en la productividad del cultivo y generaron demandas de investigación en este campo (Ministerio de Agricultura y Desarrollo Rural 2018). Los agricultores señalan que existen varios insectos plaga a nivel de follaje que deben monitorearse en el campo por su efecto dañino para el cultivo. Así, el reconocimiento de las potenciales plagas del cultivo de achira permitirá proponer prácticas de manejo y evitar pérdidas económicas en este cultivo promisorio, importante en la agroindustria rural de pequeña escala y de seguridad alimentaria de las regiones productoras. Por lo tanto, el objetivo de este trabajo fue identificar la entomofauna asociada al cultivo de achira en las principales áreas de producción en Colombia, y para tal fin se evaluaron fincas productoras en los departamentos de Cundinamarca, Huila y Nariño.
Materiales y métodos
Localización
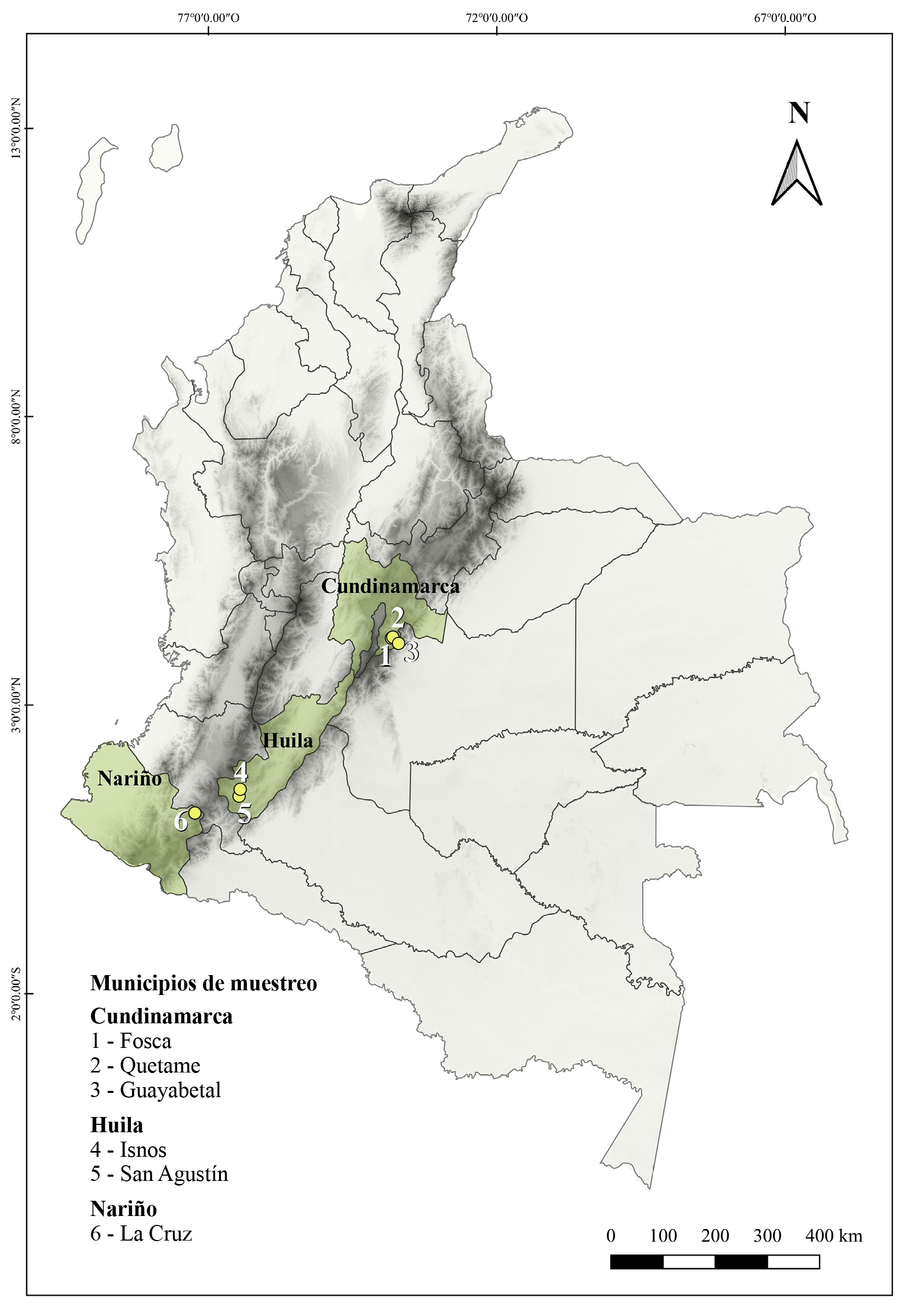
La fase de campo se llevó a cabo en 24 fincas de los municipios de Fosca (4º18’17”N 73º54’52”O), Quetame (4º19’N 73º54’O) y Guayabetal (4º13’N 73º49’O) en Cundinamarca; cuatro fincas de las veredas Silvania y Obando en el municipio de Isnos (1º58’02”N 76º15’2,8”O) y municipio de San Agustín (1º52’N 76º16’O) en Huila; y en las veredas Buena Vista, Cofradía, Escandoy, Las Aradas, La Cañada, La Vega Alto, Llano Grande, Praditos, San Antonio, San Francisco y San Gerardo del municipio de La Cruz, Nariño (1º36’N 76º57’O), entre noviembre de 2015 y junio de 2016 (Fig. 1).
Toma de muestras
Los lotes visitados presentaban extensiones promedio inferiores a una hectárea. Estos se examinaron con el permiso de los agricultores y en su interior se realizaron recorridos en zig-zag, patrón comúnmente usado para búsqueda de insectos (Radcliffe et al. 2008). Se recolectaron plantas con daños asociados a la presencia de insectos en hojas, cogollos y pseudotallos (Figs. 2B, 2C y 3). La recolección se realizó en plantas de achira en diferentes fases de crecimiento, a través de dos métodos de captura: barrido con jama y captura directa. El barrido con jama se hizo entre las 10:00-12:00 h y entre las 14:00-16:00 h, mediante 10 pases dobles durante un periodo aproximado de 30 min por lote. Posteriormente, los individuos recolectados se procesaron en una cámara letal con acetato de etilo y se trasladaron hasta el Laboratorio de Entomología del Centro de Investigación, Obonuco de Agrosavia (Nariño), para la fase preliminar de identificación. El segundo método usado para la recolecta de insectos fue captura directa sobre plantas y suelo, que consistió en buscar activamente los especímenes en el cultivo, sacudiendo las hojas sobre una superficie contrastante o en caso de encontrar daños en la planta asociados a presencia de insectos, removiendo la parte afectada de la planta, guardándola en frascos plásticos (180 cm3) diseñados para el transporte de insectos vivos y haciendo la respectiva rotulación de los recipientes. Los insectos recolectados en forma directa se transportaron vivos para ser criados como se explica a continuación.

Figura 2 Insectos nocivos asociados al cultivo de achira. A. Adulto de Glyphipterix sp. B. Larvas de Glyphipterix sp. alimentándose de hojas jóvenes de achira. C. Adulto de Spodoptera sp. D. Larva de Spodoptera sp. alimentándose de tallos de achira. E. Adulto de Ischnodemus sp. F. Huevos de Ischnodemus sp.
Cría de micro y macrolepidópteros
Los insectos provenientes de campo se mantuvieron bajo condiciones controladas ofrecidas por una cámara climática (Modelo MLR-352H, Panasonic Biomedical). Las condiciones establecidas en la cámara correspondieron a las observadas en campo para temperatura, humedad relativa y fotoperiodo (Tabla 1). Los individuos recolectados se individualizaron en frascos de vidrio (250 cm3) cubiertos con muselina, rotulados con el lugar de procedencia y fecha de recolección. Los insectos se alimentaron semanalmente con hojas frescas de achira colectadas en el módulo de agricultura urbana del C. I. Obonuco de Agrosavia (Nariño). El material vegetal se lavó previamente con agua destilada para evitar contaminación de los insectos. Para cada individuo se hizo registro fotográfico, se obtuvieron medidas morfológicas (longitud y ancho) y se registró el tiempo para cambio de estados. Varios especímenes del microlepidóptero en estado adulto se enviaron a la Colección Taxonómica Nacional de Insectos “Luis María Murillo” (CTNI), C. I. Tibaitatá, Agrosavia para su posterior identificación y conservación.
Tabla 1 Condiciones ofrecidas en la cámara climática para la cría de insectos plaga recolectados en campo.
| Hora | 6:00 | 8:00 | 10:00 | 12:00 | 18:00 | 5:00 |
|---|---|---|---|---|---|---|
| Temperatura (°C) | 18 | 19 | 22 | 25 | 18 | 18 |
| Humedad (% H. R.) | 60 | 50 | 50 | 50 | 60 | 60 |
| Luz (LS) a | 2 | 3 | 3 | 3 | 0 | 1 |
a. Luz: Corresponde a bombillas fluorescentes de 40 W, densidad fotosintética de flujo de fotones 150 µmol.m-2.s-1.
Cría de chinches (Hemiptera)
Los insectos se mantuvieron bajo las condiciones controladas descritas en la Tabla 1. Las chinches se ubicaron en cajas Petri con papel filtro humedecido con agua destilada, en grupos de tres adultos por caja (1 ♀, 2 ♂) alimentados con cogollos de achira cada tres días. Con un estereoscopio (SMZ 168 - TP, Motic, China) se realizó el correspondiente registro fotográfico de adultos e individuos inmaduros. Varios especímenes de la chinche en estado adulto se enviaron a la CTNI para su posterior identificación y conservación.
Reconocimiento de enemigos naturales
En una primera fase, larvas de microlepidópteros recolectadas en campo se colocaron en recipientes de plástico con capacidad de 250 cm3, para identificar potenciales parasitoides. Estos últimos, fueron conservados en alcohol al 96 % para su posterior identificación. Así mismo se hizo captura y conservación en alcohol (96 %) de la entomofauna asociada al cultivo para determinar posibles enemigos naturales.
Identificación y curaduría de entomofauna asociada al cultivo de achira
Se estableció la familia de los especímenes recolectados y se realizó el registro fotográfico de los identificados a nivel de género. Confirmada la identificación, los especímenes fueron montados según los estándares internacionales de Museos Entomológicos y reposan en la CTNI. Para validar su identificación, los insectos plaga (Glyphipterigidae y Blissidae) fueron procesados y enviados al Museo Entomológico UNAB, de la Universidad Nacional de Colombia, sede Bogotá.
Resultados y discusión
Insectos potencialmente nocivos asociados al cultivo de achira
A continuación se describen los insectos asociados al cultivo que fueron encontrados causando daños en diferentes órganos de la planta, por lo que se describen como potencialmente nocivos; sin embargo, el establecimiento de sus incidencias y niveles de daño económico para ser calificados como plaga deberán considerarse en estudios futuros.
Dentro de las muestras de achira recolectadas en las tres principales zonas productoras de Colombia (Fig. 1), se encontró una especie de microlepidóptero y varias de macrolepidópteros. El primero se identificó como Glyphipterix sp. (Fig. 2A) (No. Catal. CTNI 2082) insecto cuya familia forma parte de la superfamilia Yponomeutoidea que se divide en dos: Orthoteliinae y Glyphipteriginae (Heppner 2008). Estos microlepidópteros son comúnmente conocidos como polillas de juncos debido a que se encuentran generalmente cerca o sobre varias especies estas ciperáceas (Heppner 2008). Los adultos de estas micropolillas presentan un tamaño aproximado de 7-9 mm, con una amplitud alar de 1,2-1,5 cm (n = 10) de las larvas son de coloración café clara (longitud: 1,0 ± 0,10 cm; ancho 0,4 ± 0,12 cm; n = 24) son reconocidas por su hábito barrenador en semillas, brotes terminales, tallos, ramas y hojas de los hospedantes (Fig. 3C). La mayoría de estos insectos depositan los huevos sobre las superficies de las plantas o en las nervaduras de las hojas, ya que el ovipositor típico de las hembras no está especializado para perforar (Heppner 1985).
En campo, se observó que las larvas de Glyphipterix perforan las hojas más jóvenes de la planta de achira, generando con ello pudrición del tejido foliar (Fig. 3B). Estas larvas por su comportamiento barrenador, descienden a través de las hojas más jóvenes que envuelven el pseudotallo para continuar con su perforación y próximas a empupar salen de allí para la construcción de una cámara pupal cercana a la pared del pseudotallo y la base de las hojas (P. Sotelo, obs. pers. 2016). Este comportamiento coincide con lo reportado por Heppner (1985) en otras especies de Glyphipterigidae que son barrenadoras de tallo. Las pupas presentan coloración marrón oscuro (longitud: 1,1 ± 0,10 cm; ancho 0,35 ± 0,12 cm; n = 18) y tarda aproximadamente 14 días (rango = 11-19 días). No se obtuvieron posturas de los microlepidópteros adultos para estimar la duración total de los estados de desarrollo. La historia de vida de estas especies en zonas templadas en Europa y Norte América presenta una generación por año (Heppner 1985); sin embargo, observaciones sobre esta especie en achira sugieren un comportamiento multivoltino (P. Sotelo, obs. pers. 2016).
Hasta el momento, a nivel mundial los glypipterigidos no se han reconocido por ser plagas de importancia agrícola, salvo dos especies que afectan significativamente cultivos de pastos en Inglaterra y Nueva Zelanda (Heppner 1985). Además, algunos de los hospedantes reconocidos se encuentran dentro de los grupos de las familias Poaceae (Festuca sp., Luzula sp., Dactylis glomerata L., entre otras), Piperaceae (Piper aduncum L., P. auritum Kunth), Urticaceae (Urtica sp. y Boehmeria cylindrica (L.) Sw.) y Crassulaceae (Securigera sp., Sedum sp.) (Heppner 1985).
Por otro lado, entre las plagas que atacan el área foliar de la achira, se destacó el gusano cogollero, Spodoptera sp. (Fig. 2C), cuya presencia se vinculó principalmente al sistema de asocio de cultivos que caracteriza a los productores de achira, quienes, debido al prolongado ciclo de cultivo de la especie, con frecuencia realizan la siembra junto con otras de ciclo más corto como el maíz, lo cual coincide con los registros de Caicedo et al. (2003b). Las larvas de este género (Fig. 2D) se alimentan de 28 especies vegetales cultivadas, entre las cuales se destacan el maíz, sorgo, algodón, soya, higuerilla, tomate, caña de azúcar, arroz, maní, melón, girasol, entre otros. Cuando sus poblaciones logran altos niveles dentro de sus hospedantes y particularmente durante épocas de verano, este insecto puede moverse hacia otros cultivos (Posada 1989). También se registró la presencia de otras especies de macrolepidópteros, incluyendo a la larva conocida como achirera, Calpodes ethlius (Stoll, 1782) y la larva de Cobalus cannae (Herrich-Schäffer, 1869), como lo registran varios autores (Montaldo 1991; Caicedo et al. 2003b; Caicedo 2004). Estos insectos se caracterizan por tener un vuelo muy rápido y errático, generalmente se alimentan de plantas dicotiledóneas. También se observaron dos especies de polillas de la familia Erebidae (Arctiinae), Anycles sp. y Dinia mena (Hübner, 1827). Las larvas de esta subfamilia se caracterizan por ser polífagas y pocas especies son de importancia económica.
En el departamento de Nariño se registró la presencia masiva de las chinches Blissidae Ischnodemus sp. (No. Catal. CTNI 2075, Fig. 2E). Las fincas visitadas mostraron incidencia variable de estos hemípteros, sin una preferencia marcada por alguna variedad. Los miembros de este género se caracterizan por presentar cuerpo alargado, delgado y aplanado lo cual se considera una ventaja para los insectos que viven dentro de los tallos de las plantas hospedantes. Así mismo, presentan antenas cilíndricas y cavidades coxales cerradas (Slater 1976). Como sucede típicamente con otros hemípteros, si las ninfas o los adultos son perturbados, secretan un fuerte olor de las glándulas olfativas localizadas en el tórax y el abdomen (Díaz et al. 2008; 2009). Los huevos (Fig. 2F) se encontraron en la base del pseudotallo en la zona axial, comportamiento que coincide con el lugar de oviposición reportado por otros autores para I. variegatus (Signator, 1857) (Díaz 2008; Montemayor et al. 2010; Brambila y Santana 2004).
Los miembros de la subfamilia Blissinae son un grupo de importancia económica (Schuh y Slater 1995). Ya que se hospedan y se alimentan de la savia de plantas monocotiledóneas. Se reportan en Gramineae, Cyperaceae, Restionaceae, Zingiberaceae, Juncaceae, Sparganiaceae, Typhaceae y Haemodoraceae. Sin embargo, la mayor cantidad de información sobre hospedantes se encuentra para varias especies de Poaceae (Slater 1976). En los estudios realizados por Overholt y colegas (2004), en Hymenachne amplexicauli, la presencia de la chinche I. variegatus disminuye la asimilación de dióxido de carbono, la tasa de crecimiento, la capacidad fotosintética y la biomasa. También, existen registros de la presencia de la especie I. fulvipes (De Geer) sobre hospedantes dentro de la familia de la achira, específicamente sobre C. indica (Slater y Wilcox 1966; Slater 1976). Las especies de Ischnodemus pueden presentar en algunos casos especificidad de alimentación (Slater y Wilcox 1966; Harrington 1972; Slater 1976) y podrían ser un potencial factor de disminución de rendimiento en diferentes cultivos.
Enemigos naturales de insectos nocivos asociados al cultivo de achira
En larvas del microlepidóptero Glyphipterix transportadas al laboratorio, donde alcanzaron su desarrollo hasta el estado de pupa se observó la emergencia de adultos de una avispa parasitoide de la familia Ichneumonidae (Figs. 4D, 4E y 4F) que podría pertenecer al género Pristomerus, el cual contiene alrededor de 100 especies a nivel mundial, la mayoría tropicales. Sus hospedantes son pequeños lepidópteros que viven en túneles, hojas enrolladas, brotes y otros refugios (Yu et al. 2012).
Para el caso de la chinche Ischnodemus sp., se identificaron dos enemigos naturales: una avispa parasitoide de huevos (Hymenoptera: Chalcidoidea) (Figs. 4A y 4B) y el hongo entomopatógeno Beauveria bassiana (Deuteromycotina: Hyphomycetes) (Fig. 4C). Esta información coincide con la obtenida por Díaz y colegas (2009), quienes identificaron dos enemigos naturales para la especie I. variegatus en el Estado de la Florida (EE. UU.), el parasitoide de huevos Eumicrosoma sp. (Hymenoptera: Scelionidae) y el hongo entomopatógeno B. bassiana. Sin embargo, los estudios en campo por estos investigadores demostraron que el impacto de los enemigos naturales hacia las poblaciones de I. variegatus fue mínimo.

Figura 4 Enemigos naturales de insectos nocivos asociados al cultivo de achira. A. Avispa perteneciente a la familia Chalcidoidea, parasitoide de huevos de Ischnodemus sp. B. Huevos de Ischnodemus sp. parasitados por avispa Chalcidoidea. C. Muerte de Ischnodemus sp. por hongo Beauveria bassiana. D. Pupa de Glyphipterix sp. normal. E. Pupa de Glyphipterix sp. parasitada por Ichneumonidae. F. Adulto de Ichneumonidae posiblemente del género Pristomerus, parasitoide de Glyphipterix sp.
Otros insectos asociados al cultivo
Dentro de la entomofauna asociada a la achira se destaca la importancia de los insectos considerados benéficos. La reseña de los insectos aquí mencionados proviene de DeBach y Rosen (1991), Flint y Dreistadt (1998) y Hajak (2004). Por órdenes taxonómicos, se encontraron:
Coleoptera
Hippodamia convergens (Guërin-Mëneville, 1824) (Coccinellidae) (No. Catal. CTNI 136, Fig. 5A), una de las especies más comúnmente encontradas en el continente americano, cuya función principal como controlador biológico de artrópodos considerados plaga en varios cultivos (áfidos, insectos escama, ácaros, etc.) es ampliamente conocida.
Se identificaron además individuos del género Diabrotica (Chrysomelidae) (No. Catal. CTNI 137, Fig. 5E) el cual incluye 338 especies que, frecuentemente, provocan daños subterráneos en cultivos comerciales.
Otro género de Chrysomelidae identificado fue Aspicela sp. (Chrysomelidae) (No. Catal. CTNI 144, Fig. 5F) del cual algunas especies han sido reportadas en bosques de niebla peruanos (Juárez y González 2017) y en malezas de clima medio del departamento de Nariño (Bravo 1970).

Figura 5 Otros insectos asociados al cultivo de la achira en tres zonas productoras de Colombia. A. Hippodamia convergens. B. Zelus longipes C. Chrysoperla sp. D. Palpada sp. E. Diabrotica sp. F. Aspicela sp. G. Eumecosomyia sp. H. Chaetopsis sp. I. Lonchaea sp. J. Morellia sp. K. Clausicela sp. L. Dioxina sp.|
Hemiptera
Zelus longipes (Linnaeus, 1767) (Reduviidae) (No. Catal. CTNI 143, Fig. 5B), mejor conocidos como chinches asesinas. Dentro del género, varias especies son usadas como agentes de control biológico debido a su comportamiento depredador.
También se observaron individuos de Largus sp. (Largidae) (No. Catal. CTNI 146) género que incluye 61 especies, distribuidas desde el norte de EE. UU. hasta el centro de Argentina abarcando las Antillas (Stehlík y Kment 2010). Las especies de este género son de hábito fitófago y habitan generalmente el suelo, la hojarasca y plantas herbáceas, arbustos y árboles (Schuh y Slater 1995).
Se recolectaron individuos de dos especies de áfidos, uno reportado por Blackman y Eastop (2006) para C. indica: Macrosiphum euphorbiae (Thomas, 1878) (No. Catal. CTNI 2082) y una especie de Uroleucon sp. (No. Catal. CTNI 2083) sin registro previo para la familia Cannaceae.
Diptera
Se encontraron ejemplares de Palpada sp. (Syrphidae) (No. Catal. CTNI 145, Fig. 5D) que asemejan a las abejas o a las avispas. En estado larval son controladores biológicos, ya que depredan áfidos y otros insectos y como adultos se alimentan del néctar de flores.
Clausicella sp. (Tachinidae) (No. Catal. CTNI 2076, Fig. 5K) género de algunas especies que han desarrollado superparasitismos en plagas de importancia económica de cítricos como Ectomyelois ceratoniae (Lepidoptera: Phycitidae) y otras especies de interés (Kugler y Nitzan 1977).
Morellia sp. (Muscidae) (No. Catal. CTNI 2077, Fig. 5J) según Goto et al. (2012) este género es un eficiente polinizador de Thonningia sanguinea (Balanophoraceae), con la que ha coevolucionado en un sistema mutualista en el que la mosca oviposita y se alimenta de las inflorescencias masculinas en descomposición y no con anteras frescas, inflorescencias femeninas o frutos que son indispensables para la reproducción de la planta, por lo que el costo de la polinización es mínimo. También se ha reportado a Morellia como polinizador del género Heracleum sp. (Grace y Nelson 1981) (Apiaceaea).
Lonchaea sp. (Lonchaeidae) (No. Catal. CTNI 2078, Fig. 5I). Las especies de este género son de hábito saprofítico y pueden ser depredadoras de estados larvales de escarabajos xilófagos como Pissodes strobi (Peck, 1817) (Kovalev 1974; Alfaro y Borden 1980; Hulme 1990; Uchôa-Fernandes et al. 2003).
Dioxina sp. (Tephritidae) (No. Catal. CTNI 2079, Fig. 5L) del que se reportan algunas especies polinizadoras de orquídeas del género Schizochilus (Van der Niet et al. 2010).
Finalmente, se encontraron individuos de los géneros Eumecosomyia (No. Catal. CTNI 2080, Fig. 5G) y Chaetopsis (Diptera: Ulidiidae) (No. Catal. CTNI 2081, Fig. 5H), reconocidas plagas de cultivos de maíz alrededor del mundo (Goyal et al. 2010; Cortez et al. 2013).
Neuroptera
Chrysoperla sp. (Chrysopidae) (No. Catal. CTNI 138, Fig. 5C), de cuya familia, las especies se encuentran distribuidas en forma cosmopolita y tanto larvas como adultos son depredadores de otros artrópodos de cuerpo blando.
Conclusiones
Se identificaron dos insectos potencialmente nocivos para el cultivo de la achira en las zonas productoras de Cundinamarca, Huila y Nariño: el microlepidóptero Glyphipterix sp. por el daño barrenador que ocasiona en los pseudotallos y la consecuente pudrición del cogollo, y la chinche Ischnodemus sp., chupadores importantes dada su abundancia. Para estas dos especies es necesario realizar estudios de su impacto en el rendimiento de almidón, de las pérdidas económicas en el cultivo por su incidencia y del impacto de las emergentes prácticas de manejo químico. De otra parte, dentro de la entomofauna asociada se registraron insectos benéficos pertenecientes a las familias Ichneumonidae y Chalcidoidea y el hongo entomopatógeno B. bassiana, los cuales pueden ser investigados a futuro como alternativa de control biológico para el manejo de insectos plaga en el cultivo de achira. Con nuevos estudios, se espera obtener mayor información sobre aspectos de la biología, hábitos de los principales insectos nocivos e insectos benéficos, con el fin de generar recomendaciones de manejo.