Introducción
La entomología forense en general es aceptada como una herramienta esencial cuando se investigan casos de homicidios, (Magni et al. 2014). La entomología médico legal o médico criminal son términos adecuados para hacer referencia de los insectos y otros artrópodos de un individuo en estado de descomposición o cadáver y cuyo resultado del análisis puede ser usado como una evidencia o indicio en una investigación criminalística (Quiroz y Rodríguez 2015).
La muerte de una persona involucra cambios y transformaciones fisicoquímicas que producen con ello una comunidad de organismos necrófagos, necrófilos, omnívoros y accidentales asociados a los procesos de descomposición del cadáver (Sarmiento y Padilla 2014) siendo los artrópodos los más frecuentes, entre los que destacan los insectos (Smith 1986). Estos son atraídos rápidamente por el cadáver debido a los pronunciados olores emanados durante la descomposición de la materia orgánica, concurriendo principalmente del orden Diptera y Coleoptera (Oliva 2001) y en menor incidencia Hymenoptera y Lepidoptera (Arnaldos et al. 2005) seguidos de arácnidos y nematodos (Campobasso et al. 2001).
La ciencia forense reconoce y acepta cinco fases o estados de descomposición, estos corresponden al estado fresco o cromático, hinchado o enfisematoso, descomposición activa o colicuativa, descomposición avanzada y restos secos o esqueletización (Magaña 2001; Wolff et al. 2001). Por lo anterior, diversos estudios demuestran que el orden Diptera representado por las familias Calliphoridae, Sarcophagidae y Muscidae, es predominante en los procesos de sucesión en las fases de descomposición tempranas, sobre todo porque aprovechan los cadáveres como sustratos para la ovoposición y fuente de alimento de las larvas (Goff et al. 2004).
Con los métodos tradicionales de toxicología, los productos de envenenamiento se recuperan mediante muestras de órganos como hígado, pulmón, sangre y orina; sin embargo, en estados avanzados de descomposición esto no es posible (Introna et al. 2001). De ahí que los insectos puedan ser una alternativa en la detección de sustancias en un cuerpo en descomposición (Gosselin et al. 2011). La entomotoxicología, mediante el uso de artrópodos presentes en el cuerpo sin vida puede ayudar a identificar cualitativa y cuantitativamente de forma indirecta sustancias como drogas, metales pesados, fármacos y plaguicidas (Liu et al. 2009).
Los plaguicidas organofosforados son uno de los químicos más comúnmente utilizados para el control de insectos debido a su alta eficacia y amplio espectro de efectividad. El uso inapropiado e ilegal de ellos incrementa el riesgo de exposición humana (Wang et al. 2012). Con relación a lo anterior, es importante señalar que la intoxicación aguda con plaguicidas es un problema de salud pública mundial ya que, aproximadamente, se han documentado 300.000 muertes por año ocasionadas por estas sustancias. La mayoría de estos decesos ocurre por la exposición a compuestos organofosforados, organoclorados y al fósforo de aluminio (Goel y Aggarwal 2007).
En México se ha reportado que, debido a las intoxicaciones por xenobióticos, anualmente fallecen 1.400 personas (72 % de los casos son accidentales y 28 % corresponden a suicidios) (Pimentel et al. 2005). En este contexto, conviene señalar que recientes estudios realizados en el estado de Aguascalientes, los suicidios han aumentado de manera muy preocupante: en los últimos dos años ocurrieron 24, de los cuales 16 fueron por plaguicidas organofosforados (Martínez et al. 2009).
En su mayoría los estudios de entomotoxicología se enfocan a sustancias ilícitas como drogas (cocaína) y/o medicamentos (anfetaminas), pero en muy poca proporción se estudian los insecticidas, considerando que las intoxicaciones por estas sustancias son letales (Gunatilake y Goff 1989; Rumiza et al. 2008; Gosselin et al. 2011; Solís-Esquivel et al. 2016).
Los plaguicidas organofosforados, son sustancias que se relacionan de manera directa con asesinatos o suicidios, por tal motivo, en el presente estudio se optimizó un método analítico que permite la detección de malatión en larvas de mosca, como una herramienta indirecta para resolver posibles casos de homicidio.
Materiales y métodos
Lugar
La presente investigación fue realizada en el campo experimental de la Universidad Autónoma de Tamaulipas-Unidad Aztlán (26º3’45.49”N 98º19’17.84”O) en la Cd. de Reynosa, Tamaulipas, México en el verano de 2017.
Sustrato
Goff y Lord (2010) señalan que el cerdo es la especie que más se aproxima a los patrones de descomposición cadavérica humana, por ello en la presente investigación se utilizó carne de ese animal como sustrato. Se utilizaron cuatro trozos de músculo de carne de cerdo Sus scrofa (Linnaeus) fresca sin congelar usando un diseño experimental con un control y un tratamiento (por triplicado). La dosis letal (DL) en humanos de malatión es de 60 g/60 kg, la cual fue convertida a dosis letal y se inyectó a 100 g de tejido de cerdo, de acuerdo a Liu et al. (2009) ; la carne fue expuesta al ambiente inmediatamente después de la aplicación. Se emplearon jaulas de metal, con la finalidad de evitar cualquier perturbación por agentes externos. La formulación del malatión utilizada fue (2[(dimetoxifosforotioil) sulfanil] butanodioatodedietilo) (Delta®) al 83,80 % y 16,20 % de sus ingredientes inertes.
Matriz biológica
Al cuarto día de exposición se recolectaron larvas de tercer estadio las cuales previamente, se habían alimentado con carne tratada; posteriormente fueron sumergidas en agua caliente a 100 °C y, en seguida, lavadas con agua destilada. Se conservaron a -20 °C hasta su procesamiento (Solís-Esquivel et al. 2016). Para el testigo (i.e., larvas alimentadas en carne sin insectida) se procesaron de manera similar. Otro grupo de larvas fue conservado en alcohol al 75 %, para propósitos de identificación.
Extracción
1,5 g de material biológico (larvas de tercer estadio) se depositó dentro de un tubo eppendorf y una vez macerado se le agregó 1,2 mL de metanol (Tedia®)-agua (70/30). Se agitó en vortex por espacio de 5 min. Posteriormente, se centrifugó por 10 min a 10.000 rpm. Las muestras se filtraron en una membrana de 0,45 µ (Merk-Millipore®) y se transfirieron a viales de 2 ml (Agilent Technologies®).
Cromatografía
Se utilizó un equipo de cromatografía de líquidos de alta eficiencia HPLC (Agilent Serie 1100), la fase móvil fue (CH3OH): H2O (70:30) (Wang et al. 2012) se realizó la curva de calibración con estándar de malatión (Sigma®) a 500, 600, 700, 800, 900 y 1.000 partes por millón (ppm), a 30 °C, flujo de 1 mL/min y 220 nm, columna RP C18 (Beckman Ultrasphere®).
Análisis de datos
Se utilizó análisis de varianza entre los tratamientos utilizando el programa JMP 13 (SAS Institute Inc. 2017).
Resultados y discusión
Sucesión de artrópodos
Un total de 369 individuos se recolectaron, todos del orden Diptera pertenecientes a tres familias y tres géneros (Tabla 1). Se observó que en el sustrato control la colonización fue más rápida ya que comenzó a las seis horas de haber colocado los sustratos, mientras que en la carne tratada la colonización fue después de 24 horas. Lo anterior coincide con lo reportado por Rumiza et al. (2008) quienes observaron que las larvas del grupo control se desarrollaron más rápidamente que las alimentadas con hígado que contenía malatión. Wolff et al. (2004) mencionan que las ovoposiciones se retrasan en sustratos tratados con paratión y Carvalho et al. (2000) especifican que el número de taxones disminuye cuando un cuerpo o un cadáver ha sido tratado con algún insecticida.
Tabla 1 Diptera identificados en los sustratos de cerdo tratados con malatión.
| Familia | Género | Estado | Día | Muestra |
|---|---|---|---|---|
| Sarcophagidae | Sarcophaga sp. | - | 0-8 | Control |
| Calliphoridae | Chrysomya sp. | - | - | (Sin malatión) |
| Muscidae | Musca domestica L. | - | - | - |
| Sarcophagidae | Sarcophaga sp. | L3 | 4-8 | Tratamiento 1 |
| Calliphoridae | Chrysomya sp. | L3 | 4-8 | Tratamiento 2 |
| Muscidae | Musca domestica L. | L3 | 4-8 | Tratamiento 3 |
El proceso de estimación del intervalo post mortem podría ser erróneo si la presencia de malatión en las larvas no es considerado durante las primeras seis horas a 36 horas. Esto es apoyado para casos de intoxicaciones por malatión como fue reportado por Gunatilake y Goff (1989) .
Por otra parte, los resultados obtenidos de los análisis en el HPLC, muestran que el tiempo de retención para la detección del malatión es a los 4,1 min (Fig. 1); aunque no hay un antecedente que estime este tiempo de retención por HPLC para este insecticida, lo más cercano es lo reportado por Wolff et al. (2004) quienes al analizar muestras de larvas de dípteros por este mismo método detectaron un tiempo de retención para el organofosforado paratión de 12,8 min. Otros análisis para malatión y paratión se han realizado en CG-DCE (cromatografía de gases-detección de captura de electrones), CG-SM (cromatografía de gases-acoplado a espectrometría de masas) y LC-DAD (cromatografía líquida-detector de diodos) (Gosselin et al. 2011).
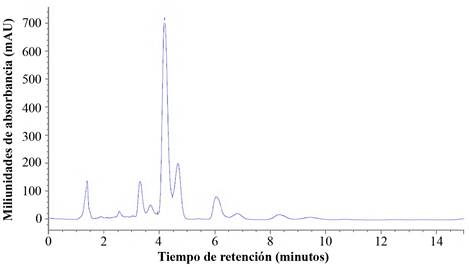
Figura 1 Cromatograma del estándar de malatión con un tiempo de retención de 4,1 usando una longitud de onda 220 nm.
Para la estimación de los resultados en las larvas, se realizó una curva de calibración usando un volumen de inyección de 20 μL y tiempo de corrida 10 min (Fig. 2). La línea de regresión obtenida para la determinación de la curva de calibración fue y = 9,124x + 30,886 y una R2 = 0,9937.
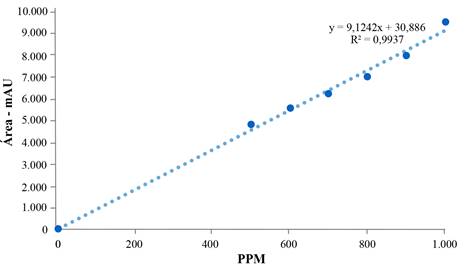
Figura 2 Curva de calibración desarrollada a partir de la información obtenida de las diferentes concentraciones de malatión que fueron analizadas por HPLC.
Los resultados del análisis por HPLC realizado a un grupo de larvas de tercer estadio para determinar el límite de detección (LDD) del insecticida concuerdan con lo obtenido por Mahat et al. (2012) quienes mencionan que la concentración de malatión incrementa gradualmente durante los estadios larvales encontrándose la máxima concentración en larvas de tercer estadio.
La concentración mínima de malatión fue calculada en 0,03010 ppm, en el caso del análisis por CG-EDC, Rumiza et al. (2008) encontraron 0,157, 0,22 y 0,045 µg/mg de malatión en larvas, pupas y adultos, respectivamente. Gunatilake y Goff (1989) reportaron en larvas de Chrysomia megacefala (Fabricius) y Chrysomia rufifacies (Macquart) una concentración de 2,050 µg/g. Mahat et al. (2012) reportaron 41,46 hasta 137,20 ng/g de concentración de malatión mientras que Liu et al. (2009) obtuvieron 8,53 hasta 28,90 ng/g de concentración de malatión en larvas de tercer estadio mientras que en pupas no fue detectado el compuesto. Lo anterior obedece a que de acuerdo con Silva et al. (2017) no existe una estandarización en este campo en cuanto a los métodos que se utilizan para llevar a cabo estas investigaciones, lo que ha llevado a la incapacidad de comparar los resultados entre los estudios.
Por otra parte, al realizar un análisis de la pérdida de malatión a través del tiempo, se tomó en cuenta la cantidad de insecticida con el cual las larvas estuvieron en contacto durante ocho días después de iniciado el tratamiento, siempre usando larvas de tercer estadio (96 horas de haber sido ovipositadas por la mosca) y que se alimentaron de la carne de cerdo tratada (Fig. 3). De estos datos se resalta que entre los días 4 y 7 se pierde el 50 % de la capacidad de detección del insecticida en la carne tratada.
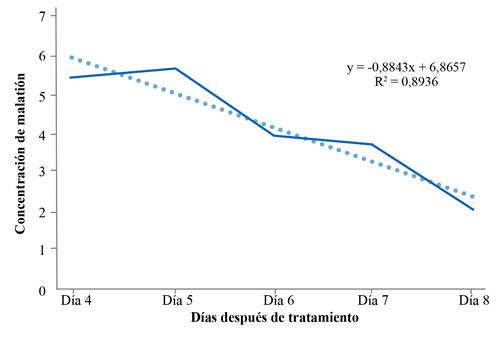
Figura 3 Línea de regresión de la velocidad de pérdida de malatión en larvas alimentadas con carne de cerdo tratada con insecticida.
Los resultados muestran que no hay diferencia significativa entre los tratamientos, similar a lo reportado por Liu et al. (2009) quienes al analizar la mortalidad de acuerdo a las tasas de desarrollo, no detectaron diferencias significativas para las dosis letales de malatión de 1,0 y 1,5. Tampoco encontraron diferencia significativa entre el tratamiento control y los expuestos a la dosis letal 0,5 veces de malatión y plantean que la concentración de malatión en los tejidos afecta la cantidad residual en larvas y pupas que se alimentan de estos. Lo anterior puede ser causa de que el organofosforado no se distribuye de manera homogénea dentro del tejido y a que las larvas al alimentarse pueden comer de zonas con alta concentración, muy poca o incluso sin el insecticida como fue observado en este trabajo.
Por otro lado, los resultados indican que se pudo detectar eficientemente malatión. Estudios previos como el de Introna et al. (2001) señalan que una toxina puede ser detectada en las larvas cuando su tasa de absorción excede la de eliminación, lo cual también es confirmado por Anderson y VanLaerhoven (1996) y Goff et al. (1997) quienes enfatizan que las larvas de mosca se pueden alimentar de cualquier tejido que contenga compuestos químicos de cadáver.
Finalmente, Wolff et al. (2004) señalan que la cromatografía de líquidos de alta eficiencia (HPLC) es una técnica eficaz para detectar y cuantificar paratión en tejidos, así como en artrópodos presentes desde la fase inicial hasta los estados finales de descomposición incluyendo restos secos, tal como fue detectado en este trabajo.
Conclusiones
Los resultados muestran que es posible usar la técnica del HPLC para la detección de residuos de malatión aún después de varios días después de la exposición al insecticida. Por lo que es fundamental el uso de este instrumento en futuras investigaciones, con la finalidad de utilizarlo en casos judiciales como una herramienta en procesos en los que se sospeche la intoxicación por algún organofosforado.















