Introducción
Haplaxius crudus (Van Duzee, 1907) (Hemiptera: Cixiidae) (= Myndus crudus Van Duzee, 1907) es un insecto chupador conocido comúnmente como “salta hojas de la palma” (Bustillo y Arango 2016) y es el principal vector de la enfermedad denominada amarillamiento letal del cocotero (Letal Yellowing LY) (Howard 1983) que ha causado grandes pérdidas en plantaciones de coco (Cocos nucifera L.) en la Florida (Harrison y Elliot 2019), además, podría estar involucrado en la transmisión del virus del decaimiento foliar del coco (CFDV) (Wilson 2005). En Colombia, H. crudus reviste importancia, dado que se considera que transmite la enfermedad conocida como Marchitez Letal (ML) (Arango et al. 2011). Esta enfermedad es una de las más limitantes en la Zona Oriental y ha alcanzado niveles epidémicos (Bustillo y Arango 2016). Se estima que entre el periodo 2013 y 2018 se han eliminado 3.299 hectáreas afectadas por la Marchitez letal (Tovar 2019).
Este insecto en su estado adulto se alimenta y aparea en el follaje de palmas y sus estados inmaduros se desarrollan en las raíces de gramíneas y ciperáceas. Los adultos de H. crudus han sido encontrados alimentándose en plantas de la familia Arecaceae: C. nucifera, Dypsis lutescens H. Wendl., Phoenix canariensis Hort. Ex Chabaud., Phoenix dactylifera L., Pritchardia pacifica Seem. & H. Wendl., Pritchardia thurstonii Muell. E. Drude, Pritchardia sp., Roystonea regia Kunth, Sabal palmetto Walter, Trachycarpus fortunei (Hook.) H.Wendl., Veitchia merrillii (Becc.) H.E.Moore., Washingtonia robusta H.Wendl., y Washingtonia sp., mientras las ninfas han sido encontradas en gramíneas (Poaceae Barnhart) y ciperáceas (Cyperaceae Juss.), a saber, Poaceae: Andropogon bicornis L., Andropogon virginicus L., Brachiaria decumbens Stapf., Brachiaria humidicola (Rendle) Schweick., Cenchrus ciliaris L., Chloris barbata Sw., Cynodon dactylon (L.) Pers., Cynodon nlemfuensis Vanderyst., Digitaria eriantha Steud., Digitaria sanguinalis (L.) Scop., Distichlis spicata (L.) Greene., Eleusine indica (L.) Gaertn., Eremochloa ophiuroides (Munro) Hack., Eustachys petraea Sw., Panicum maximum Jacq., Panicum bartowense Scribn. & Merr., Panicum purpurascens Raddi., Panicum fasciculatum Sw., Paspalum notatum Flugge., Paspalum virgatum L., Setaria viridis (L.) Beauv., Setaria sp. P.Beauv., Stenotaphrum secundatum (Walt.) Kuntze., y Zoysia sp. Willd.; Cyperaceae: Cyperus brevifolius (Rottb.) Hassk., Cyperus ferax (L.) Rich., Cyperus luzulae (L.) Rottb. ex Retz., Cyperus esculentus L. Cyperus sesquiflorus L. y Fimbristylis cymosa Vahl. (CABI 2020; Sierra et al. 2014). En Colombia se han encontrado adultos alimentándose en palma de aceite (E. guineensis) (Arango et al. 2011).
En el continente americano la distribución de H. crudus es bastante amplia, se ha registrado desde el sur de Estados Unidos (Florida, Misisipi y Texas), pasando por la Península de Yucatán, Tabasco (Méjico) y en toda América Central (Hill et al. 2018; Narváez et al. 2018; Ramos et al. 2018). En la zona del Caribe se encuentra en Bahamas, Cuba, Haití, Islas Caimán, Jamaica, Puerto Rico, República Dominicana y Trinidad y Tobago (CABI, 2020; Harrison y Elliott 2019). En Suramérica se encuentra en Colombia, Venezuela (Bustillo y Arango 2016) y recientemente ha sido reportada en Brasil (Silva et al. 2019).
En Colombia, se conoce muy poco sobre la distribución de H. crudus. Actualmente se cuenta con la información registrada por Bustillo y Arango (2016), en donde el insecto se encontró distribuido en plantaciones ubicadas en el departamento del Meta (municipios: Acacías, Cumaral, San Carlos de Guaroa y San Martín), departamento de Casanare (municipio: Villanueva), departamento de Cundinamarca (municipio: Paratebueno), departamento de Santander (municipio: Puerto Wilches), departamento del Cesar, y una plantación de palma de aceite del departamento del Magdalena. A pesar de su importancia económica, la distribución de H. crudus permanece desconocida en muchas de las zonas palmeras del país. El objetivo de esta investigación fue determinar la distribución de H. crudus en las diferentes zonas donde se cultiva la palma de aceite en Colombia.
Materiales y métodos
Detección de Haplaxius crudus en zonas palmeras.
El muestreo para detectar la presencia de H. crudus en las plantaciones se realizó en las cuatro zonas palmeras de Colombia (Central, Norte, Oriental y Suroccidental). Los muestreos en cada una de las zonas fueron realizados por asistentes técnicos de Cenipalma previamente capacitados para realizar el muestreo e identificación de los insectos. En 42 municipios se hicieron visitas a 190 plantaciones de palma de aceite (Fig. 1) en las cuales se contaba con permiso de acceso y muestreo. En cada plantación sin importar el área sembrada, se seleccionó un lote de una hectárea en donde se evaluó la presencia o ausencia de adultos en las palmas y de las ninfas en las gramíneas y ciperáceas; los municipios muestreados se detallan en la Tabla 1.

Figura 1 Ubicación de las zonas palmeras y plantaciones en donde se muestreo Haplaxius crudus. Zona Norte: área en morado. Zona Central: área en verde. Zona Oriental: área en naranja. Zona Suroccidental: área en amarillo. Los puntos azules corresponden a los sitios de muestreo.
Tabla 1 Municipios muestreados para evaluar la presencia de Haplaxius crudus.
| Zona palmera | Departamento | Municipios | Número de plantaciones visitadas |
|---|---|---|---|
| Central | Bolívar | San Pablo. | 1 |
| Cesar | San Alberto, San Martín. | 3 | |
| Norte de Santander | Tibú | 1 | |
| Santander | Barrancabermeja, Rionegro, Sabana de Torres, y Puerto Wilches. | 7 | |
| Norte | Antioquia | Chigorodó | 1 |
| Cesar | Agustín Codazzi, El Copey, Chiriguaná, y Tamalameque | 6 | |
| Córdoba | Cereté, Montería, y San Carlos. | 5 | |
| Magdalena | Algarrobo, Aracataca, y Zona Bananera | 5 | |
| Oriental | Casanare | Aguazul, Maní, Monterrey, Nunchía, Orocué, Tauramena, y Villanueva. | 30 |
| Cundinamarca | Paratebueno. | 2 | |
| Meta | Acacías, Barranca de Upía, Cabuyaro, Castilla La Nueva, Cumaral, Granada, Puerto Gaitán, Puerto López, Puerto Lleras, Puerto Rico, San Carlos de Guaroa, San Juan de Arama, San Martín, Villavicencio, y Vista Hermosa. | 123 | |
| Suroccidental | Nariño | San Andrés de Tumaco | 6 |
Se utilizaron diferentes métodos de muestreo para evaluar la presencia del insecto en cada una de las Zonas. En las zonas Central, Norte y Suroccidental en donde aún no se ha registrado la presencia de la enfermedad ML, se muestrearon solo adultos utilizando trampas de intersección y jama entomológica dependiendo de la altura de la palma, en la zona Oriental en donde está presente la enfermedad se hicieron muestreos tanto de adultos como de ninfas; los adultos se muestrearon usando jama entomológica y trampas de intersección dependiendo de la altura de la palma, mientras que las ninfas se muestrearon revisando raíces de gramíneas y ciperáceas dependiendo de la presencia de estas en el lote (Arango et al. 2012).
Muestreo de adultos con jama entomológica.
Para evaluar la presencia de adultos de H. crudus, en las plantaciones visitadas se seleccionó una hectárea y se llevó a cabo un muestreo cada cinco líneas y cada cinco palmas (Arango et al. 2012), para un total de 6 palmas por hectárea. Los adultos se colectaron usando una jama entomológica (diámetro del aro: 40cm, largo: 250 cm); en cada palma se hicieron tres pases dobles de jama en el follaje, en los niveles inferior y medio hasta rodear toda la planta (Fig. 2A), equivalentes a dos muestreos por punto cardinal de la planta, para un total de ocho muestreos por palma. Los insectos fueron capturados con un aspirador bucal para su identificación y luego liberados en el campo, en algunas ocasiones se conservaron especímenes que se encuentran depositados en las colecciones.
Muestreo de adultos con trampas de intersección.
Se instalaron trampas amarillas para captura de adultos; las trampas se elaboraron siguiendo la metodología propuesta por Arango et al. (2012), con cartón plástico (Cartónplast®) de 2 mm de grosor, 25 cm de alto por 35 cm de largo y se impregnaron con pegamento agrícola (Pegamosc®) por ambos lados. Las trampas se ubicaron en el borde e interior del lote (dos trampas/lote), en el borde del plato de la palma a 75 cm de altura (Fig. 2B) y se revisaron15 días después.
Muestreo de ninfas.
Para evaluar la presencia de ninfas de H. crudus, en el borde e interior de lotes se muestrearon macollas de las gramíneas y ciperáceas más abundantes (Bustillo y Arango 2016), a una profundidad de 15 cm usando una pala jardinera. Luego, se desagregó el suelo y se agitaron las raíces de las plantas sobre un plástico negro (Fig. 2C), para facilitar la visualización de las ninfas (Fig. 2D). Se evaluaron 20 macollas por cada especie de gramínea y ciperácea identificada en el lote.

Figura 2 Métodos de muestreo de Haplaxius crudus. A. Pases con jama entomológica en el follaje de la palma de aceite. B. Trampa amarilla en el borde del plato de la palma. C. Revisión de raíces de una macolla de gramínea sobre plástico negro. D. Ninfa de Haplaxius crudus (Fotos: C. Sendoya).
Identificación del insecto:
La identificación inicial de Haplaxius crudus se realizó en laboratorio utilizando un estereoscopio Olympus SZ-61 y claves dicotómicas para la familia Cixiidae publicada por Triplehorn y Johnson (2015) y para la especie publicada por Kramer (1979). Algunas características principales de H. crudus son: tamaño no mayor a 5 mm, cuerpo de color pajizo, abdomen de color verde claro, alas hialinas, alas anteriores que no se cubren en reposo (dispuestas en techo), protórax dividido longitudinalmente en cuatro secciones y ojos de color pajizo o negro (dependiendo de la luz). Las ninfas son fácilmente identificables por las siguientes características: color blanco cremoso en sus primeros instares y abdomen de color verde en su último instar, filamentos blancos algodonosos adheridos al dorso de los últimos segmentos abdominales, ojos de color rojo (Zenner De Polania y López Ávila 1977; Wilson y Tsai 1982). Los asistentes técnicos de Cenipalma se capacitaron para realizar la identificación del insecto en campo teniendo en cuenta estas características, para lo cual usaron aspiradores bucales y lupas de mano.
Identificación de plantas hospederas:
Se recolectaron dos ejemplares por cada especie de planta en donde se encontraron ninfas de H. crudus, los ejemplares se colectaron incluyendo raíces e inflorescencias, estas muestras se prensaron y alcoholizaron el mismo día de la recolecta para evitar su deterioro y posteriormente se enviaron al Instituto de Ciencias Naturales Herbario Nacional Colombiano (COL), Universidad Nacional de Colombia, sede Bogotá, D.C., para su determinación.
Repositorio de especímenes Boucher:
Los ejemplares de las plantas hospederas de ninfas de H. crudus se depositaron en el COL (Tabla 2). Algunos de los especímenes de adultos de H. crudus se depositaron en la Colección de Artrópodos Asociados al Cultivo de la Palma de Aceite de Cenipalma (CAACPA) en cada una de las zonas palmeras en donde se registró el insecto.
Tabla 2 Especímenes Boucher depositados en el COL.
| Nombre | Familia | No. COL | Colector | Determinó |
|---|---|---|---|---|
| Urochloa sp. | Poaceae | 604155 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
| Urochlola cf. brizantha (Hochst. ex A.Rich.) R.Webster. | Poaceae | 604156 | Estiben Caviedes | D. Giraldo Cañas/2018 |
| Paspalum arundinaceum Poir. | Poaceae | 604157 | Estiben Caviedes | D. Giraldo Cañas/2018 |
| Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs. | Poaceae | 604158 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
| Steinchisma laxa (Sw) Zuloaga. | Poaceae | 604159 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
| Eleusine indica (L.) Gaertn. | Poaceae | 604160 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
| Axonopus compressus (Sw.) P. Beauv. | Poaceae | 604161 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
| Paspalum conjugatum P.J. Bergius. | Poaceae | 604162 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
| Andropogon bicornis L. | Poaceae | 604164 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
| Kyllinga pumila Michx. | Cyperaceae | 604549 | Luis Sierra y Natalia Castillo | C. Parra-O/2018 |
| Cyperus luzulae (L.) Rottb. Ex Retz. | Cyperaceae | 604551 | Luis Sierra y Natalia Castillo | G. Aymard/2018 |
| Rhynchospora nervosa (Vahl) Boeckeler. | Cyperaceae | 604552 | Luis Sierra y Natalia Castillo | G. Aymard/2018 |
| Cyperus odoratus L. | Cyperaceae | 604543 | Luis Sierra y Natalia Castillo | D. Giraldo Cañas/2018 |
Resultados
Distribución de Haplaxius crudus.
De las 190 plantaciones visitadas en las cuatro zonas palmeras se detectaron ninfas y adultos de H. crudus asociados al cultivo de palma de aceite en 163 plantaciones (Fig. 3A). La especie se encontró en municipios con reportes de ML y municipios sin registro de la enfermedad. En la zona suroccidental no se encontró H. crudus.
Zona Central.
Se detectó la presencia de H. crudus en todas las plantaciones visitadas (Fig. 3B), los lotes en donde se instalaron las trampas estaban sembrados con cultivares híbridos interespecíficos OxG y E. guineensis. Las plantaciones visitadas no tenían reportes de casos de ML.
Zona Norte.
Se detectó la presencia de H. crudus en todas las plantaciones visitadas (Fig. 3C). Los lotes donde se instalaron las trampas estaban sembrados con cultivares de E. guineensis. Las plantaciones visitadas no tenían reportes de casos de ML.
Zona Oriental.
En esta zona se realizó el mayor número de visitas, teniendo en cuenta que es la única zona con reportes de ML. Se detectó la presencia de H. crudus en 134 plantaciones en 23 municipios, en 78 de estas plantaciones no se habían registrado casos de ML, las 56 plantaciones restantes registraron casos de ML y estaban distribuidas en 10 municipios (Fig. 3D). Los lotes en donde se realizaron los registros tenían palmas con edades desde los 4 hasta los 31 años de siembra. La mayor cantidad de H. crudus se encontró en lotes en donde predominaban las gramíneas, ya fuese dentro del lote o en los bordes. Las gramíneas que más predominaron dependiendo de la edad de cultivo fueron: P. virgatum, Megathyrsus maximus (Jacq.) B.K. Simon & S.W.L. Jacobs y D. sanguinalis.
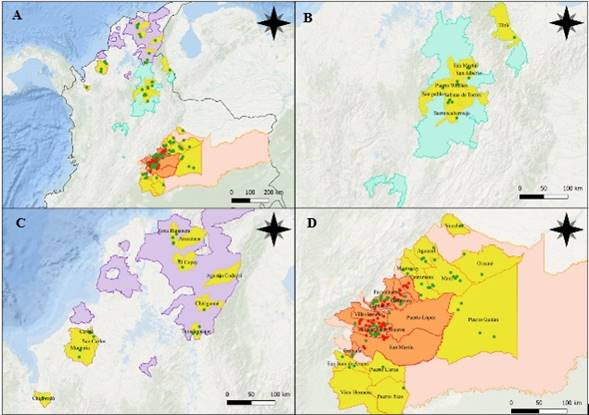
Figura 3 Detalle de la presencia de Haplaxius crudus en las zonas palmeras de Colombia. Municipios de color amarillo: sin registro de ML. Municipios de color naranja: con registro de ML. Puntos de color verde: presencia de H. crudus sin ML. Puntos de color rojo: presencia de H. crudus y ML. A. Presencia H. crudus en Colombia. B. Presencia H. crudus en Zona Central. C. Presencia H. crudus en Zona Norte. D. Presencia de H. crudus en Zona Oriental.
Cultivares con presencia de adultos de H. crudus .
El insecto se encontró en plantaciones de palma de aceite, tanto en cultivares de Elaeis guineensis como en híbridos interespecíficos (OxG), sin embargo, fue más frecuente encontrarlo en cultivares de E. guineensis. No obstante, aún no existe evidencia publicada de la preferencia de este insecto por determinados cultivares de palma de aceite. En Cenipalma se están iniciando los primeros trabajos para determinar si H. crudus muestra alguna preferencia por los cultivares híbridos interespecíficos.
Hospederos de ninfas de H. crudus .
Las ninfas, se encontraron en la base del tallo y la corona de gramíneas y ciperáceas, las especies de gramíneas fueron: A. bicornis, Axonopus compressus, E. indica, Megathyrsus maximus, Paspalum arundinaceum, Paspalum conjugatum, Steinchisma laxa, Urochloa cf. brizantha y Urochloa sp. Por otro lado, las ciperáceas fueron: Cyperus odoratus, Cyperus luzulae, Kyllinga pumila y Rhynchospora nervosa (Vahl) Boeckeler (Fig. 4), esta última es un nuevo registro de hospedero de la familia Cyperaceae albergando ninfas de H. crudus.
Discusión
Los resultados de este estudio muestran que la presencia de H. crudus en las zonas palmeras de Colombia, es más amplia que lo registrado en la literatura y que este insecto está presente en tres de las cuatro zonas muestreadas. Esto evidencia que la presencia de H. crudus no está limitada a la única zona (Oriental) en donde se tienen registros de la enfermedad ML. Estos resultados contrastan con lo registrado por Howard et al. (1983) quienes mencionaron que la distribución de H. crudus, vector del amarillamiento letal del cocotero (LY) en la Florida (USA), coincidía con la distribución conocida de esta enfermedad y enfermedades similares en las Américas.
La enfermedad LY afecta al menos a 36 especies de palmas, siendo C. nucifera la más asociada con esta enfermedad (Harrison y Elliot 2019) y H. crudus es considerado su principal vector. En Brasil, afecta plantaciones de C. nucifera (Bastos et al. 2019), en México afecta a P. pacifica (Dzido et al. 2020), C. nucifera y Thrinax radiata Lodd. ex Schult. & Schult. (Narváez et al. 2018). En Colombia H. crudus se considera que es el vector de la ML (Arango et al. 2011). El manejo de la enfermedad se realiza a través de censos semanales para la detección de palmas enfermas, erradicación de palmas enfermas, aplicación de insecticidas de síntesis química, control de gramíneas y monitoreo de adultos de H. crudus a través de trampas pegajosas amarillas y monitoreo de ninfas desenraizando macollas y revisando sus raíces (Bustillo y Arango 2016). Como parte del manejo de enfermedades transmitidas por vectores, el monitoreo de estos insectos es parte fundamental, ya que provee información acerca de la abundancia, distribución espacial y temporal del insecto en un área epidémica (Mou et al. 2020). En este sentido Howard (1980), encontró que H. crudus era 40 veces más abundante en zonas afectadas por el amarillamiento letal en comparación con zonas libres de la enfermedad, así mismo Mou et al. (2020), informaron que la abundancia de H. crudus fue 4,5 veces mayor en palmas enfermas en comparación con palmas sanas. En Colombia, actualmente se desconoce la abundancia de H. crudus en las zonas palmeras, por lo cual este trabajo puede servir como base para estudios posteriores en donde se determine la abundancia de este insecto en la zona donde se encuentra la enfermedad y en las zonas sin ML, como parte de una estrategia para controlar la enfermedad y detener su avance hacia nuevas zonas.
Conclusiones
La información de este estudio relaciona los lugares en que se encuentra la ML y también zonas libres de la enfermedad, en las cuáles H. crudus está presente. Esto es muy importante para el palmicultor, ya que les permite estar alerta sobre la posible diseminación de la ML, una vez que se detecte una palma enferma en zonas libres, pero que a la vez se encuentren poblaciones nativas de H. crudus.
















