Introducción
Colombia ocupa la tercera posición mundial en producción y área cosechada de aguacate (Persea americana Mill.; Lauraceae) cultivar Hass con 544.933 toneladas producidas en 2019, precedido por República Dominicana con 691.551 y México con 2,17 millones de toneladas (Sánchez, 2021). A pesar de las perspectivas de mercado y el potencial productivo del país, el cultivo de P. americana presenta limitantes fitosanitarios en la etapa productiva, las cuales ponen en riesgo el posicionamiento de la fruta en los mercados internos y de exportación. Los insectos plaga han sido reconocidos entre los factores bióticos que pueden ocasionar pérdidas superiores al 60 % en el rendimiento del cultivo (Carabalí, 2020; Kondo et al., 2020). Destacan por su importancia económica Stenoma catenifer Walsingham, 1912 (Lepidoptera: Elachistidae), Copturomimus hustacheiKissinger, 1957, Heilipus lauri Boheman, 1845, Heilipus trifasciatus (Fabricius, 1787) (Coleoptera: Curculionidae), Astaena pygidialis Kirsch, 1885 (Coleoptera: Scarabaeidae), Frankliniella gardeniae Moulton, 1948 (Thysanoptera: Thripidae) y Monalonion velezangeli Carvalho & Costa, 1988 (Hemiptera: Miridae) (Caicedo & Carabalí, 2020; Carabalí, 2020; Diaz et al., 2017; Kondo et al., 2020; Mariño, 1947).
La subfamilia Conoderinae Schöenherr (Coleoptera: Curculionidae) incluye, entre muchos otros géneros, a Copturomimus Heller, 1895 y Macrocopturus Heller, 1895, ambos conocidos por agrupar especies que ocasionan daños en cultivos de aguacate (Anzaldo, 2017; Kissinger, 1957). El género Copturomimus se distribuye en Brasil, Colombia, Costa Rica, Guatemala, Honduras, México y Panamá, y comprende algunas especies que en su estado larval barrenan tallos y ramas de aguacate (Alonso-Zarazaga & Lyal, 1999; Anzaldo, 2017). En Colombia, la especie asociada a este daño ha sido identificada tradicionalmente como Copturomimus perseae Hustache (Mariño, 1947). Sin embargo, es importante aclarar que el nombre válido de la especie es Copturomimus hustachei.
En el siglo XX, Günther (1935) describió Copturus perseae a partir de especímenes colectados en Costa Rica. Posteriormente, esta especie fue transferida al género Copturomimus (Kissinger,1957). No obstante, para ese momento ya existía una especie con el mismo nombre, Copturomimus perseae Hustache, 1947, un barrenador de ramas de aguacate descubierto en Colombia y descrito por el entomólogo Alphonse Hustache (Mariño, 1947). En atención al principio de prioridad, el nombre de Copturomimus perseae le correspondía a la especie de Costa Rica descrita por Günther (1935), razón por la cual Kissinger (1957) propuso un nuevo epíteto específico para la especie hallada en Colombia y la nombró Copturomimus hustachei. Cabe señalar que las especies asociadas al daño en tallos y ramas de aguacate son distintas en los tres países donde revisten importancia económica: C. hustachei en Colombia, C. perseae (Günther, 1935) en Costa Rica y Macrocopturus aguacatae (Kissinger, 1957) (Coleoptera: Curculionidae) en México (Anzaldo, 2017; Kissinger, 1957; Mariño, 1947; Muñiz, 1960).
En Colombia, el daño encontrado en tallos y ramas de P. americana se caracteriza por la presencia de pequeñas perforaciones circulares en la corteza (producidas por el adulto al momento de emerger), sumadas a coloraciones negruzcas sobre el área afectada y exudaciones blanquecinas y granulosas ( Caicedo &Carabalí, 2020; Mariño, 1947). Las poblaciones de C. hustachei presentan una distribución generalizada sobre diferentes variedades de aguacate, hospederos sobre los cuales pueden llegar a ocasionar pérdidas del 60 % y hasta del 100 % de los árboles, cuando no se establecen medidas de control (Caicedo & Carabalí, 2020). En el país, los estudios de este barrenador son escasos y hasta el momento sólo se dispone de dos publicaciones: una sobre aspectos biológicos (Mariño, 1947) y otra sobre la descripción del daño y estrategia de manejo (Caicedo & Carabalí, 2020). Mariño (1947) describió la biología de la especie y el daño que causa en tallos y ramas; sin embargo, no mencionó las condiciones de humedad y temperatura bajo las cuales determinó la duración del ciclo biológico, y describió de forma somera los estados inmaduros.
Por lo tanto, esta investigación se realizó con el objetivo de actualizar la información sobre el ciclo biológico y hábitos de C. hustachei, la cual puede ser útil para el desarrollo de programas de manejo de este curculiónido de importancia económica para los cultivos de aguacate en Colombia.
Materiales y métodos
Localización y condiciones ambientales.
El estudio se realizó durante los años 2018 y 2019 en el laboratorio de Entomología del Centro de Investigación Palmira de la Corporación Colombiana de Investigación Agropecuaria - AGROSAVIA, localizado a 1000 m s.n.m. en el municipio de Palmira, Valle del Cauca, Colombia (03°30′44″N, 76°18′54″O). El promedio de temperatura, humedad relativa y fotoperiodo en el laboratorio de entomología fue de 24,6 ± 1,8 °C, 76 ± 8 % y 12 horas luz, respectivamente.
Material vegetal e insectos.
Las poblaciones iniciales de adultos se obtuvieron a partir de un pie de cría establecido con tallos y ramas con síntomas de daño atribuidos a C. hustachei. El material vegetal afectado se obtuvo de cultivos comerciales de P. americana ubicados a 1166 m s.n.m en el municipio de Caicedonia, Valle del Cauca, Colombia (04°20′15″N, 75°50′22″O). Los tallos y ramas utilizados como sustrato de alimentación y oviposición no recibieron aplicaciones de insecticidas o fertilizantes.
Determinación taxonómica.
Se envió una muestra de 16 adultos emergidos de los tallos y ramas provenientes de campo al Laboratorio de Diagnóstico Fitosanitario del Instituto Colombiano Agropecuario (ICA), Seccional Valle del Cauca. La especie fue identificada como Copturomimus hustacheiKissinger, 1957.
Cría de Copturomimus hustachei. Adultos provenientes del pie de cría y los recién emergidos de las muestras de tallos y ramas obtenidas de campo se confinaron en cámaras de oviposición y alimentación constituidas por recipientes de vidrio (capacidad 7,5 l) con tapa, provistos de una toalla de papel en la base y una abertura circular en la tapa (80 % del área) cubierta con muselina blanca. Se suministraron tallos lignificados (diámetro, 2-4 cm; longitud, 30 cm) y brotes tiernos de P. americana como sustrato de oviposición y fuente de alimentación, respectivamente. Tallos y brotes se renovaron cada tres días, previa revisión de sus condiciones fitosanitarias y fenológicas (brotes jóvenes). Cada 24 horas se revisaron los tallos y se retiraron los huevos junto con fragmentos de la corteza que los rodeaba para evitar pérdidas al momento de la extracción; posteriormente, se individualizaron en placas de Petri acondicionadas con toalla de papel húmeda en el fondo. Las larvas neonatas se introdujeron en tallos de P. americana limpios, desinfectados, sellados con parafina en el extremo basal y provistos de una pequeña perforación realizada con un bisturí metálico de punta de lanza. Cada larva se introdujo en el orificio utilizando un pincel de pelo de marta (No. 000). Tallo y larva se ubicaron en un recipiente plástico esterilizado (13 cm x 11 cm x 5 cm), con tapa perforada y cubierta con muselina. Los adultos emergidos se confinaron en un recipiente de vidrio para su reproducción e incremento de la población.
Ciclo biológico. 400 adultos (200♀, 200♂) se seleccionaron de la cría establecida en AGROSAVIA. Grupos de 50 adultos entre machos y hembras se introdujeron en ocho cámaras de oviposición elaboradas en recipientes de vidrio (capacidad 7,5 l). Cada recipiente contenía 50 adultos, un brote vegetativo joven y tres tallos lignificados de P. americana como fuente de alimentación y sustrato de oviposición. Transcurridas 24 horas, se retiraron todos los tallos de las cámaras de oviposición y se extrajeron e individualizaron 203 huevos siguiendo el procedimiento descrito en el apartado anterior. Los huevos se revisaron cada 24 horas y se registró el número de larvas emergidas. Un total de 134 larvas recién emergidas (≤ 12 horas de edad) se utilizaron en la infestación artificial de tallos de P. americana cultivar Lorena (10-15 cm de longitud). En cada tallo se colocaron grupos de dos a cinco larvas; el conjunto larvas-tallo se ubicó en un recipiente plástico etiquetado con un número que identificó a los individuos durante todo el estudio. Transcurridos 25 días desde la infestación, se inició la evaluación de la supervivencia de cada larva; para ello, se construyó un orificio en el tallo mediante un bisturí metálico de punta de lanza a través del cual se realizaron las observaciones. Diariamente se revisaron los tallos bajo el estereomicroscopio y se registró la duración de los estados larval (todos los instares larvales juntos) y de pupa. El estado de pupa se consideró finalizado al observar el adulto teneral dentro del tallo. Por último, se registró la proporción de sexos sobre 86 individuos adultos emergidos de tallos infestados artificialmente.
Se llevaron registros diarios de la temperatura y humedad relativa en el laboratorio. Los datos de los tiempos de desarrollo de los diferentes estadios del insecto se ordenaron en una tabla estadística con los valores mínimos, máximos, rangos, promedios y desviación estándar.
Descripción de los estados de desarrollo. Se describieron las principales características externas de los estados de desarrollo de C. hustachei, visibles bajo un estereomicroscopio (Nikon SMZ 745T). Para las mediciones de cada uno de los estados biológicos se capturaron imágenes con una cámara Nikon DS-Fi2 adaptada a un estereomicroscopio Nikon SMZ 1500. Las imágenes digitalizadas se midieron con ayuda del software para microscopía NIS-Elements D versión 4.0, utilizando milímetros (mm) como unidad de medida. Se siguió fundamentalmente la terminología propuesta por Mariño (1947) para la descripción del huevo, Marvaldi (2003) para la larva, Vallejo et al. (2007) para la pupa, y Mariño (1947) y Marvaldi y Lanteri (2005) para el adulto. El número de muestras empleadas en cada caso se indica a continuación:
Huevo. Se utilizó una muestra de 45 huevos. De cada uno se determinó el ancho y el largo, referencia a partir de los puntos más externos de sus márgenes.
Larva. Para la descripción de las larvas de primer y último estadio, se tomó una muestra de 30 ejemplares en cada caso. Se registró la longitud total de la larva y el largo y ancho de la cápsula cefálica.
Pupa. Se determinó el largo y ancho en una muestra de 15 pupas.
Adulto. En una muestra de 60 adultos se registraron las siguientes medidas: longitud del cuerpo excluyendo el rostro, longitud del rostro, y largo y ancho de élitros y pronoto.
Estudio de la genitalia. Se utilizaron dos adultos de la especie (1♀, 1♂) para la descripción de las estructuras que conforman la genitalia interna. A cada espécimen se le separó el abdomen del resto del cuerpo y se sumergió en una solución de peróxido de hidrógeno al 70 % durante 10 minutos; enseguida se lavó con agua destilada durante 1 minuto. Este proceso se repitió dos veces. Posteriormente, el abdomen se llevó a una placa de Petri con alcohol etílico al 70 % para extraer la genitalia utilizando pinzas de punta fina. Las membranas excedentes se retiraron con ayuda de pinzas y pincel fino (No. 000). Para el registro fotográfico se realizaron montajes temporales en glicerina.
La observación y descripción de las estructuras, así como las mediciones y registro fotográfico, se realizaron en un estereomicroscopio Nikon SMZ 1500 adaptado con una cámara digital Nikon DS-Fi2; las imágenes digitalizadas se midieron con el software NIS-Elements D versión 4.0. Para la descripción se utilizó la terminología propuesta por Castañeda-Vildózola et al. (2007) y Muñiz y Ordóñez (2010).
Resultados
Hábitos. El perforador de tallos y ramas del aguacate, C. hustachei, tiene como hospederos conocidos para su alimentación y reproducción las variedades de P. americana. La selección del sitio de oviposición se inicia cuando la hembra grávida palpa en repetidas ocasiones los tallos jóvenes y lignificados de P. americana (Fig. 1a). Una vez identifica el sitio, consume parte del contenido vegetal hasta formar un pequeño orificio de forma ovalada y profundidad aproximada de 1 mm. Valiéndose de la forma curva y la extensión que caracteriza su rostro, las hembras construyen los sitios de oviposición (Fig. 1b). Para la construcción de la cámara de oviposición es frecuente que las hembras utilicen las aberturas naturales, grietas y raspaduras ocasionadas por daños mecánicos, así como tejidos expuestos resultado de daños anteriores producidos por otras hembras. Los huevos son depositados entre la epidermis y la corteza en forma horizontal o perpendicular; pueden estar dispuestos en dirección paralela o con un leve grado de inclinación con respecto a la superficie de la epidermis. En general, los huevos dispuestos de manera perpendicular se encontraron en tejidos no lignificados y horizontal en lignificados (Fig. 1c). La oviposición se considera regulada, debido a que la hembra deposita un solo huevo por cámara, el cual queda oculto por el recubrimiento del sitio que realiza la hembra con una sustancia mucilaginosa; posteriormente, la abertura es sellada con los residuos de la corteza. Las larvas recién emergidas barrenan la corteza desplazándose transversalmente y profundizando en el tejido, lográndose observar grupos de larvas de diferentes edades. No se observó canibalismo.
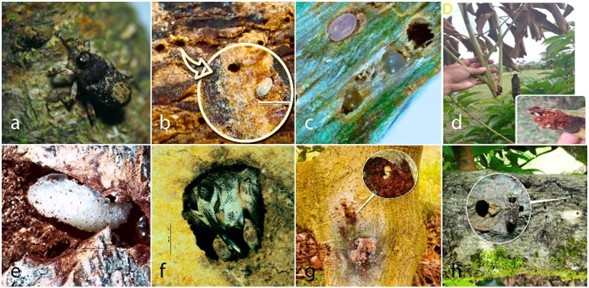
Figura 1 Descripción del daño y hábitos de Copturomimus hustachei. a. Hembra construyendo la cámara de oviposición. b. Cámara de oviposición. c. Huevos, colocados en forma horizontal y vertical. d. Muerte de rama. e. Cámara de pupación. f. Adulto emergiendo del tallo. g. Síntoma de daño de larva. h. Orificio de salida del adulto.

Figura 2 Desarrollo embrionario de Copturomimus hustachei. a. Huevo recién puesto. b. Huevo a los tres días. c. Huevo a los cuatro días. d. Huevo a los cinco días. e. Huevo a los siete días. f. Huevo a los nueve días. g-h. Larva saliendo del huevo. i. Larva recién emergida.
En plántulas de vivero o sobre tallos delgados (≤ 20 mm de diámetro), la larva profundiza hacia el interior del cilindro central y produce una sintomatología de debilitamiento o marchitez que llega a ocasionar su muerte (Fig. 1d). Próxima a pupar, la larva amplía el sitio donde se encuentra e inicia la construcción de la cámara pupal, donde permanece hasta finalizar el estado de pupa (Fig. 1e). El adulto formado utiliza el túnel y rastro de alimentación que dejó la larva para emerger del tallo (Fig. 1f). Los adultos son poco activos en horas de la mañana, siendo difícil su observación; sin embargo, su actividad aumenta bajo condiciones de mayor temperatura y luminosidad. Plantas con síntomas de daño se caracterizan por pérdida de vigor y marchitamiento de ramas terciarias con presencia de pequeñas perforaciones; usualmente se observan sustancias de consistencia grumosa y coloración variada en las perforaciones (Fig. 1g). Altas infestaciones provocan la muerte de ramas primarias y secundarias, las cuales presentan tejidos necrosados con pérdidas de corteza y perforaciones de mayor tamaño, correspondientes a los orificios de salida de los adultos (Fig. 1h).
Ciclo biológico. En condiciones de laboratorio (24,6 ± 1,8 °C; 76 ± 8 % HR; fotoperiodo 12:12) y utilizando ramas de P. americana cv. Lorena como fuente de alimentación de las larvas, el ciclo de vida de C. hustachei presentó un tiempo total de desarrollo desde huevo hasta la emergencia del adulto de 86,78 ± 7,34 días y un rango entre 72-113 días. Los resultados encontrados en el estudio fueron inferiores (6 días aproximadamente) comparados con los reportados por Mariño (1947) para la misma localidad (Palmira, Valle del Cauca, Colombia), quien indicó que el insecto invierte 93 días para su desarrollo, desde huevo hasta adulto, sobre materiales criollos de aguacate. Mariño (1947) subrayó la influencia de la temperatura en las variaciones entre los valores máximos y mínimos, aunque en el estudio no especificó las condiciones ambientales empleadas.
Huevo. El periodo de incubación promedio de los huevos fue de 9,29 ± 1,54 días (n = 103), con una variación entre 7 y 11 días. Este resultado es similar al reportado por Mariño (1947), quien registró un tiempo de incubación de 9 días (rango entre 8 y 11 días) sobre materiales criollos de P. americana. Los resultados del estudio pueden ser equiparables con los registrados por Coria et al. (2007) y Talavera y Padilla (2003) para la especie Copturus aguacatae, quienes encontraron un periodo de incubación de 10 y 12 días, respectivamente.
Viabilidad del huevo. El porcentaje de viabilidad de huevos de C. hustachei sobre ramas de P. americana cv. Lorena fue de 82,5 %, provenientes de una cohorte de 103 huevos.
Larva. El estado de larva (todos los estadios larvales juntos) tuvo una duración de 66,18 ± 10,86 días (n = 40), con un rango de variación entre 51 y 100 días. Los resultados encontrados en el estudio exceden en 26 días a los reportados por Mariño (1947) sobre materiales criollos de P. americana, y difieren en 62 días con los obtenidos por Coria et al. (2007) para C. aguacatae. En el presente estudio no se determinó el número de instares larvales de la especie. Con respecto a otros barrenadores de ramas de aguacate, Coria et al. (2007) reconocieron cinco estadios larvarios para la especie C. aguacatae.
Pupa. El estado de pupa registró una duración de 13,08 ± 3,99 días (n = 40), con un rango entre 7 y 20 días. Este resultado es similar al reportado por Mariño (1947), quien registró una duración de 16 días. En comparación con la especie C. aguacatae, los resultados obtenidos difieren en 8 y 13 días con los registrados por Coria et al. (2007) y Talavera y Padilla (2003), respectivamente.
Adulto. La longevidad del adulto, partiendo desde su emergencia del tallo hasta su muerte, fue de 25,88 ± 7,34 días (n = 40), con un rango entre 15 y 49 días. Este resultado es similar al encontrado por Mariño (1947), quien registró una duración de 28 días. No obstante, en comparación con la especie C. aguacatae, los resultados difieren en 31 y 17 días de los reportados por Coria et al. (2007) y Talavera y Padilla (2003), respectivamente.
Relación de sexos. Se encontró una proporción de hembras y machos de 1: 0,6, correspondientes a 53 hembras: 33 machos.
Descripción de los estados de desarrollo de C. hustachei
Huevo. Mide 0,62 ± 0,02 mm de largo (n = 45; rango 0,55 - 0,68 mm) y 0,39 ± 0,01 mm de ancho (n = 45; rango 0,36 - 0,43 mm). Es ovalado con el corión completamente liso y transparente. En las primeras 24 horas es hialino (Fig. 2a), y a medida que avanza su desarrollo adquiere un color blanco opaco (Figs. 2b-2e). En las fases iniciales de diferenciación, se forman dos puntos amarillos en los extremos del huevo, que marcan el inicio de la formación de la larva (Fig. 2c). Al final de su desarrollo se pueden observar a través del corión la cápsula cefálica y las mandíbulas de la larva (Figs. 2f-2g).
Larva neonata. La larva de primer estadio es similar a la larva madura en todos los caracteres morfológicos, excepto en el tamaño y la coloración del tórax, el cual es hialino (Figs. 2h-2i). En el pronoto se aprecian dos manchas amarillas apenas visibles. La larva de primer estadio mide 0,77 ± 0,02 mm de largo (n = 30; rango 0,75 - 0,83 mm) y 0,33 ± 0,02 mm de ancho (n = 30; rango 0,30 - 0,35 mm); la cápsula cefálica mide 0,23 ± 0,02 mm de largo (n = 30; rango 0,20 - 0,25 mm) y 0,18 ± 0,02 mm de ancho (n = 30; rango 0,15 - 0,21 mm).
Larva madura. La larva de último estadio mide 7,77 ± 0,46 mm de largo (n = 30; rango 6,66 - 8,61 mm) y 2,76 ± 0,31 mm de ancho (n = 30; rango 2,34 - 3,43 mm). Es ápoda y en estado de reposo adquiere forma de ‘C’ o media luna. Cuerpo de color blanco amarillento y con pliegues que le otorgan un aspecto ondulado (Figs. 3a-3b). Cabeza hipognata, fuertemente esclerotizada, retraída en el primer segmento torácico (Fig. 3a); los segmentos torácicos un poco más prominentes que los segmentos abdominales. Cápsula cefálica de color ámbar y forma ovalada (Figs. 3c, 4a, 4c); mide 1,4 ± 0,37 mm de largo (n = 30; rango 1,15 - 2,00 mm) y 1,16 ± 0,24 mm de ancho (n = 30; 1,03 - 2,00 mm) (Fig. 4a, 4c). Sutura epicraneal corta y sinuosa; suturas frontales prolongadas hasta la base de la mandíbula (Fig. 4a). Frente y área epicraneal con setas cortas y largas: una seta frontal alargada a cada lado, próxima a la unión con el clípeo; seis setas anteriores en grupos de dos, y 16 setas epicraneales alineadas a cada lado (Figs. 4b-4c). Clípeo de forma trapezoidal y con dos pares de setas medianas. Labro semicircular, de color ámbar y con abundantes setas centrales. Mandíbulas subtriangulares de color negro, ensanchadas en la base y ligeramente convexas (Fig. 4e). Maxilas grandes, robustas y de color ámbar, con dos setas en la base del estipe y otras en mayor número en el último tercio apical (Figs. 4c-4f). Palpo maxilar de dos segmentos: el primero, largo y ancho; el segundo, cónico, más estrecho y de color café oscuro (Fig. 4f). Antenas con el segmento basal membranoso y aplanado; sensorio antenal corto y angulado. Cada antena con dos setas externas cortas ubicadas lateralmente (Fig. 4b). Protórax con una sección dorsal esclerosada de color ámbar dividida por una hendidura longitudinal (Fig. 4a). Además, con un par de espiráculos bíforos laterales de color marrón, característicos de larvas de la familia Curculionidae (Fig. 3a, 3c). Abdomen formado por diez segmentos marcados transversalmente por pliegues, los cuales son más notorios en los segmentos I - VII (Fig. 3a, 3); estos pliegues forman constricciones que ayudan a la larva a movilizarse en el interior de las galerías (Fig. 3a). Los primeros ocho segmentos abdominales con un par de espiráculos más pequeños que los torácicos. La sección caudal es la parte proporcionalmente más reducida del cuerpo de la larva.
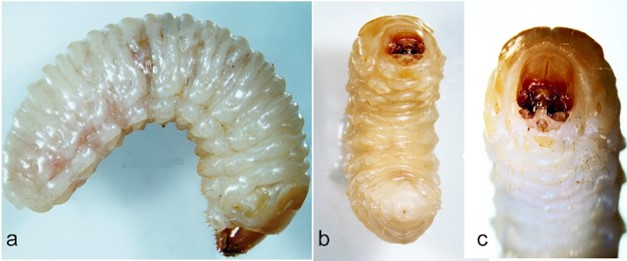
Figura 3 Larva de último estadio de Copturomimus hustachei. a. Vista lateral. b. Vista ventral. c. Cabeza y tórax.
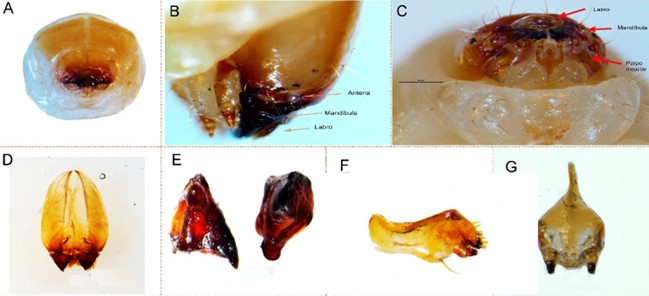
Figura 4 Larva de último estadio de Copturomimus hustachei. a. Cabeza y tórax. b. Partes de la cabeza en vista lateral (antena, mandíbula y labro). c. Partes de la cabeza en vista ventral (labro, mandíbulas y maxilas). d. Forma de la cabeza en vista ventral. e. Mandíbulas. f. Maxila y palpo maxilar. g. Labio.
Pupa. Mide 6,61 ± 0,35 mm de largo (n = 15; rango 5,98 - 7,02 mm) y 3,03 ± 0,22 mm de ancho (n = 15; rango 2,65 - 3,36 mm). Cuerpo con apéndices libres, subcilíndrico, liso y blanquecino; se torna castaño oscuro a medida que la pupa madura (Fig. 5). Cabeza redondeada. Ojos ovalados y grandes que ocupan más de la mitad de la cabeza y portan seis setas; son del mismo color del cuerpo al inicio de la etapa, pero gradualmente adquieren patrones de coloración entre marrón oscuro y negro (Fig. 5a). Rostro moderadamente largo y curvo; reposa en un canal prosternal extendido entre las coxas protorácicas y las mesotorácicas (Fig. 5a). Antenas hialinas, con el funículo y la maza visibles. Pronoto cuadrangular, más ancho en la base. Mesonoto y metanoto cuadrangulares, con dos pares de setas centrales pequeñas (Fig. 5b). El abdomen formado por diez segmentos y terminado en un par de proyecciones cónicas orientadas caudalmente. En vista dorsal, la pupa se caracteriza por presentar cuatro setas en la cabeza, 16 setas en el tórax y seis setas en cada segmento abdominal (Fig. 5b).
Adulto. Cuerpo ovoide, de 4,39 ± 0,28 mm de longitud (n = 60; rango 3,84 - 4,91 mm) y 1,93 ± 0,16 mm de ancho (n = 60; rango 1,65 - 2,32 mm) (Figs. 7a-7b). Élitros con variación en la coloración de las manchas, con patrones que van del marrón al gris (Fig. 6).

Figura 6 Variación intraespecífica en la coloración, forma del cuerpo y manchas en los élitros en adultos de Copturomimus hustachei criados en laboratorio.

Figura 7 Adulto de Copturomimus hustachei. a. Hembra en vista lateral. b. Macho en vista lateral. c. Rostro en vista frontal. d. Rostro en vista lateral. e. Ápice del rostro. f. Antena. g. Protórax (nótese el canal prosternal.). h. Protórax en vista lateral. i. mesosterno, metasterno y ventritos abdominales. j. Patas protorácicas. k. Patas mesotorácicas. l. Patas metatorácicas. m. Ventritos abdominales, hembra. n. Ventritos abdominales, macho. o. Élitros. p. Alas membranosas.
Cabeza hipognata y redondeada; ojos grandes y estrechamente separados, que ocupan gran parte de la cabeza (Figs. 7c-7d). Rostro largo, curvo (Figs. 7c-7d) y ubicado en el canal prosternal cuando el insecto está en reposo (Fig. 7g); mide 2,45 ± 0,15 mm de longitud (n = 60; rango 1,94 - 2,70 mm) y presenta escamas desde la base hasta la inserción antenal. Mandíbulas pequeñas, de forma subtriangular y simétricas (Fig. 7e). Antenas insertadas hacia la mitad del rostro (Figs. 7c-7d). Artejos funiculares I-IV alargados, los demás redondeados; segundo artejo funicular más largo que el primero (Fig. 7f). Protórax subtriangular, ligeramente más largo que ancho, curvado en el margen anterior y redondeado a los lados; margen posterior bisinuado. Mide 1,25 ± 0,11 mm de largo (n = 60; rango 1,09 - 1,65 mm) y 1,1 ± 0,12 mm de ancho (n = 60; rango 1,15 - 1,45 mm) (Figs. 7g-7h). Mesosterno rectangular, reducido en tamaño (Fig. 7i). Metasterno amplio, rectangular y cubierto de escamas (Fig. 7i). Élitros más largos que anchos, miden 2,54 ± 0,18 mm de largo (n = 60; rango 2,18 - 2,84 mm) y 1,23 ± 0,38 mm en su parte más ancha (n = 60; rango 0,72 - 2,18 mm); son amplios en la base y se estrechan ligeramente hacia el ápice. En las estrías e interestrías se alojan escamas de diferentes colores, las cuales otorgan el patrón de coloración general y forman una mancha grande, romboide y grisácea (a veces marrón-marrón oscuro), característica de C. hustachei (Figs. 6a-6i, 7o). Alas membranosas, hialinas y de venación sencilla (Fig. 7pp). Patas relativamente largas y delgadas. Fémures dentados en el margen interno y un poco más largos que las tibias. Tarsos de cinco tarsómeros y con dos uñas ampliamente separadas (Figs. 7j-7l).
Genitalia de C. hustachei
Macho. Lóbulo medio del edeago aplanado en vista ventral y ligeramente curvo en vista lateral; mide 1,17 mm de largo y 0,21 mm de ancho. Los lados son paralelos, simétricos y finalizan en un ápice subtriangular. Saco interno con cuatro escleritos (Figs. 8a-8c). Apodemas un poco más largos que el lóbulo medio y curvados en la mitad posterior (Figs. 8a, 8c). Tegmen con forma de horquilla; el manubrio de 0,33 mm de largo y los brazos separados por una distancia igual a 0,38 mm (Fig. 8d). La espícula gastral larga y delgada, de 0,99 mm de largo y 0,22 mm de ancho en el ápice (Fig. 8e).
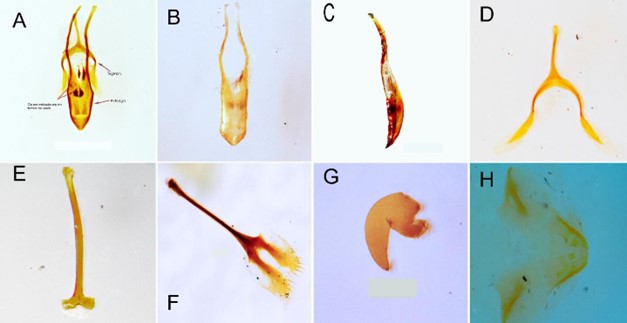
Figura 8 Genitalia masculina y femenina de Copturomimus hustachei. Macho: a. Lóbulo medio del edeago y tegmen, vista dorsal. b. Lóbulo medio del edeago, vista dorsal. c. Lóbulo medio del edeago, vista lateral. d. Tegmen. e. Espícula gastral. Hembra: f. Esternito VIII. g. Espermateca. h. Ubicación de los estilos en el coxito.
Hembra. Esternito VIII en forma de ‘Y’ invertida. La espícula ventral alargada (1,2 mm de largo) y levemente ensanchada en la base. Lóbulos apicales con unas cuantas cerdas largas y delgadas en el margen apical (Fig. 8f). Espermateca esclerosada y de forma arriñonada (Fig. 8g). Los coxitos miden 2,5 mm de longitud y 0,74 mm de ancho en la base. Estilos de 0,16 mm de largo y 0,09 mm de ancho; cortos, cilíndricos y más esclerosados que los coxitos (Fig. 8h).
Discusión
Copturomimus hustachei es una especie que barrena tallos y ramas de P. americana para su alimentación, oviposición y desarrollo de sus estados inmaduros. La madera y corteza constituye un refugio para huevos, larvas y pupas, protegiéndose así de la acción de depredadores, parasitoides y patógenos que pueden ejercer control natural sobre la plaga. Además, el hábito xilófago de la especie reduce la acción efectiva del control químico sobre los estados inmaduros, situación que genera altas tasas de crecimiento de las poblaciones en cortos periodos de tiempo y conduce a elevados niveles de daño. Los resultados encontrados en este estudio contribuyen al conocimiento de la biología y hábitos de C. hustachei, barrenador de tallos y ramas de aguacate en Colombia.
Conclusiones
Es importante comenzar a usar el nombre válido del barrenador de tallos y ramas de aguacate en Colombia, Copturomimus hustachei Kissinger, en futuras publicaciones sobre la especie.
Los resultados obtenidos constituyen información útil para la identificación de las poblaciones de C. hustachei que ocasionan daños en cultivos de aguacate en Colombia.
















