Introducción
Algunas especies de cochinillas harinosas (Hemiptera: Coccomorpha: Pseudococcidae, Putoidae y Rhizoecidae) son plagas que causan pérdidas en la agricultura, horticultura y silvicultura (Williams & Granara de Willink 1992); al alimentarse de la savia del floema, ocasionan debilitamiento, transmisión de patógenos y en casos severos muerte de la planta (Gullan & Martin 2009). En Colombia, las poblaciones de estas especies han aumentado en los últimos años en el cultivo del café Coffea arabica L.,1753 (Rubiaceae) (Gil et al. 2015). Caballero et al. (2019) reportaron 61 especies de insectos escama asociadas a las raíces de esta planta, de las cuales 20 eran nuevos registros en café y 15 nuevos registros para Colombia. Las especies de mayor presencia fueron Puto barberi (Cockerell, 1895) (Hemiptera: Putoidae), Geococcus coffeae Laing, 1925 y Rhizoecus colombiensis Ramos y Caballero, 2016 (Hemiptera: Rhizoecidae), complejo Dysmicoccus texensis (Tinsley, 1900) y Pseudococcus elisae Borchsenius, 1947 (Hemiptera: Pseudococcidae) (Caballero et al. 2019). El hábito críptico de estas especies dificulta el diagnóstico oportuno y la eficacia de los agentes de control (Santa-Cecília et al. 2007).
La literatura reporta como principales enemigos naturales de las cochinillas harinosas a los depredadores, parasitoides y patógenos. Dentro de los depredadores se destacan las familias Coccinellidae (Coleoptera), Chrysopidae y Hemerobiidae (Neuroptera), Syrphidae, Cecidomyiidae y Drosophilidae (Diptera) (Shylesja & Mani 2016). Dentro del grupo de los coccinélidos la especie Cryptolaemus montrouzieri Mulsant, 1853 (Coleoptera: Coccinellidae) ha sido ampliamente utilizada para el control de varias especies de insectos escama en todo el mundo. Otros géneros de coccinélidos importantes para el control de estos insectos son Aspidimerus, Brumus, Brumoides, Cleophora, Diomus, Exochomus, Harmonia, Hyperaspis, Nephus, Orcus, Parasidis, Pseudoscymnus, Sasajiscymnus, Sidis, Stictobura y Scymnus (Shylesja y Mani 2016).
En cuanto a los dípteros, las larvas de diversas especies de la familia Cecidomyiidae son depredadoras de las cochinillas harinosas, un ejemplo son Dicrodiplosis manihoti Harris, 1981, depredador de huevos de Phenacoccus manihoti y Diadiplosis pseudococci Felt, 1921, que ejerce un control significativo sobre Dysmicoccus brevipes (Cockerell, 1893) (Hemiptera: Pseudococcidae). En Colombia están reportadas las especies Diadiplosis coccidarum (Cockerell, 1892) y D. vaupedis (Harris, 1968) sobre Planococcus sp. (Hemiptera: Pseudococcidae) (Gagné & Jaschhof 2021). Más recientemente, Kondo et al. (2022) reportaron a Pseudiastata sp. (Diptera: Drosophilidae) como enemigo natural de Dysmicoccus brevipes (Cockerell) (Hemiptera: Pseudococcidae) en cultivos de piña, Ananas comosus (Bromeliaceae), en el Valle del Cauca, Colombia.
Las avispas parasitoides de las familias Aphelinidae, Braconidae, Encyrtidae, Eucoilidae, Eulophidae, Platygastridae, Pteromalidae y Signiphoridae son conocidas por controlar naturalmente las cochinillas harinosas; de estas se destacan Aphelinidae, Encyrtidae y Platygastridae (Shylesja & Mani 2016). Sin embargo, el mayor parasitismo lo ocasionan las avispas de la familia Encyrtidae (Noyes & Hayat 1994), generalmente como endoparasitoides, aunque existen casos de depredación sobre huevos. Para el Neotrópico, Noyes (1980) reportó 148 géneros de encírtidos y alrededor de 360 especies, la gran mayoría parasitan especies de insectos escama de las familias Coccidae, Pseudococcidae y Putoidae. En Colombia Gil et al. (2016) reportaron como parasitoides de Puto barberi a Hambletonia pseudococcinaCompere, 1936 y Aenasius bolowi Mercet, 1947 (Hymenoptera: Encyrtidae). Adicionalmente, Kondo et al. (2022) reportaron a Hambletonia pseudococcina Compere (Hymenoptera: Encyrtidae) como parasitoide de Dysmicoccus brevipes (Cockerell) (Hemiptera: Pseudococcidae) en cultivos de piña, Ananas comosus (Bromeliaceae), en el Valle del Cauca, Colombia.
En cuanto a los patógenos, de acuerdo con Shylesja y Mani (2016) solo los hongos entomopatógenos son reportados como causantes de infección natural en las cochinillas harinosas. Moore (1988) reportó 13 especies de hongos registrados en diferentes países, que incluyen el hongo Metarhizium anisopliae (Metschn.) Gongorá & Gil, 2004. Estas especies ejercen control sobre las cochinillas harinosas como D. brevipes, Ferrisia virgata (Cockerell, 1893), Planococcus citri Risso, 1813, P. lilacinus (Cockerell, 1905), y Planococcus sp. (Hemiptera: Pseudococcidae).
En relación con los enemigos naturales de las cochinillas presentes en el cultivo del café, en Brasil Rodrígues et al. (2017) reportaron como los principales factores de mortalidad de P. citri a los depredadores generalistas Harmonia axyridis (Pallas,1773), Cycloneda sanguinea (Linnaeus, 1763), Azya luteipes Mulsant, 1850, Diomus seminulus (Mulsant, 1850), Diomus sennen (Gordon, 1999), Cryptolaemus montrouzieri Mulsant, 1853, Cyra loricata (Mulsant, 1850), Hyperaspis festiva Mulsant, 1850 (Coleoptera: Coccinellidae); Chrysoperla genanigra de Freitas, 2003, Chrysoperla externa (Hagen, 1861) (Neuroptera: Chrysopidae); Allograpta sp., Ocyptamus sp. (Diptera: Syrphidae) y Condylostylus sp. (Diptera: Dolichopodidae). En la India Balakrishnan et al. (1991) reportaron como enemigos naturales de Ferrisia virgata (Cockerell, 1893) (Hemiptera: Pseudococcidae) a los parasitoides Aenasius advenaCompere, 1937, Anagyrus qadrii (Hayat, Alam & Agarwal, 1975) y Blepyrus insularis (Cameron, 1886) (Hymenoptera: Encyrtidae), también reportaron tres especies depredadores de un género cercano a Scymnus (Coleoptera: Coccinellidae); mientras tanto, para Colombia Gil et al. (2016) reportaron en el Valle del Cauca a las especies Hambletonia sp. y Aenasius sp. cercano a bolowi (Hymenoptera: Encyrtidae) como parasitoide de Puto barberi en raíces de café.
Es claro que los enemigos naturales juegan un papel importante en la supresión de las cochinillas harinosas; por lo tanto, el objetivo de esta investigación de tipo exploratoria fue identificar los principales enemigos naturales de las cochinillas harinosas de las familias Pseudococcidae y Putoidae de las raíces del café en Colombia.
Materiales y métodos
Esta investigación se desarrolló en 800 fincas de los departamentos cafeteros de Antioquia, Caldas, Cauca, Quindío, Norte de Santander, Risaralda, Tolima y Valle del Cauca (100 fincas por cada departamento), con lotes menores a dos años de edad. Con el fin que el diagnóstico fuera representativo para el departamento, la selección de las fincas fue aleatoria usando el Sistema de Información Cafetera (SICA). Para la recolección de las muestras de cochinillas harinosas se siguió la metodología descrita por Gil et al. (2016).
En cada finca se hizo un reconocimiento de síntomas (amarillamiento de hojas, marchitamiento de hojas, ramas y ramillas y muerte de árboles) y la recolección manual de las cochinillas harinosas presentes en las raíces de diez árboles afectados. Las muestras se depositaron y rotularon en viales de vidrio conteniendo etanol al 76%. En el laboratorio, por cada departamento y finca, se separaron y codificaron los individuos de las cochinillas harinosas que presentaron algún cambio de color y tamaño, los que contenían estructuras internas atípicas y larvas de insectos depredadores presentes en las muestras; estas observaciones se realizaron bajo un estereomicroscopio marca Nikon SMZ 1500. Las muestras de los parasitoides, larvas de depredadores, ninfas y adultos de las cochinillas harinosas se preservaron en etanol al 76 %.
Para la obtención de los adultos de los parasitoides y de los depredadores, se realizó un re-muestreo en las fincas donde se registraron enemigos naturales. En cada sitio se seleccionaron 100 árboles al azar y mediante un muestreo no destructivo, en los primeros cinco centímetros de la raíz de cada árbol, se realizó recolección de todas las ninfas y hembras adultas de Puto barberi y de individuos de Pseudococcidae. Las muestras recolectadas se trasladaron al Laboratorio de Entomología de Cenicafé, en cámaras de emergencia, las cuales consistieron en cajas de acrílico transparente de 21 cm de largo x 11 cm de ancho y 8 cm de alto, con dos orificios de ventilación en la tapa, forrados con tela muselina. En el laboratorio, las cochinillas harinosas recolectadas se separaron por morfoespecie y se mantuvieron en un cuarto de cría con condiciones controladas de temperatura (23 ± 1 °C), humedad relativa de 73% ± 10% y fotoperiodo de 12:12 horas luz/oscuridad.
Se realizaron observaciones diarias para registrar la emergencia de los enemigos naturales y la especie de cochinilla harinosa donde emergió, si transcurridos 20 días no se observaba emergencia, los individuos de las cochinillas harinosas se disecaron. Los estados biológicos de los enemigos naturales se preservaron en etanol al 76%.
La identificación de Aenasius caeruleus, Aenasius bolowi¸ Hambletonia pseudococcina y Zarhopalus putophilus la realizó el especialista en Encyrtidae, John S. Noyes del Museo de Historia Natural de Londres, por medio de fotografías en alta resolución de los caracteres morfológicos de cada una de los especímenes enviados para la identificación; las demás especies se identificaron siguiendo claves taxonómicas (i.e., Compere 1936, 1937; Bennett 1957; Noyes 1980; Noyes & Hayat 1994; Noyes & Ren 1995; Sharkov y Woolley 1997; Anga & Noyes 1999; Noyes & Triapitsyn 2018); la identificación de Cecidomyiidae (Diptera) se realizó siguiendo las claves taxonómicas de Gagné (1994) y Gagné & Jaschhof (2021).
Las cochinillas harinosas se montaron en láminas utilizando la metodología descrita por Sirisena et al. (2013) y se identificaron mediante las claves taxonómicas de Williams y Granara de Willink (1992), Granara de Willink (2009), y Caballero (2018). Las larvas de los coccinélidos se identificaron bajo observación directa con un estereomicroscopio marca Nikon SMZ 1500, se utilizaron las claves para larvas de Coccinellidae de Savoïskaya y Klausnitzer (1973). Los insectos aquí descritos se depositaron en el Museo Entomológico Marcial Benavides (MEMB), del Centro Nacional de Investigaciones de café, Cenicafé, Manizales, Caldas, Colombia.
Los hongos se aislaron de las raíces y se sembraron directamente en cajas Petri con medio de cultivo PDA más ácido láctico al 0,04%. Luego de sembradas, las cajas Petri se sellaron con vinipel y se incubaron a 25 ± 2 °C. Se observaron cada 24 horas para ver el crecimiento de las colonias y se replicaron sucesivamente hasta obtener las cepas puras. Posteriormente, se montaron en láminas y la identificación la realizó la Dra.
Carmenza Góngora, curadora de la Colección de Microorganismos del Centro Nacional de Investigaciones de café, Cenicafé, Manizales, Caldas, Colombia.
Por cada departamento se determinó el número de fincas con presencia de cochinillas harinosas, fincas con presencia de enemigos naturales, el porcentaje de fincas con cochinillas harinosas parasitadas, el número de individuos parasitados y se identificaron las especies de los enemigos naturales y su hospedante.
Resultados y discusión
De las 800 fincas seleccionadas, se evaluaron 726 y se recolectaron muestras de cochinillas harinosas en 520, de las cuales 41 tenían al menos un espécimen de cochinilla harinosa parasitada. Se recolectó un total de 120 individuos de cochinillas harinosas con algún estado biológico de parasitoides. Cinco fincas presentaron larvas de insectos depredadores de Coccinellidae (Coleoptera) y Cecidomyiidae (Diptera), y en una finca se encontró el hongo antagonístico Trichoderma sp. presente en raíces de café con cochinillas harinosas enquistadas. Algunas fincas tenían tanto cochinillas harinosas parasitadas como larvas de depredadores (Tabla 1).
Tabla 1 Ubicación de las fincas con presencia de enemigos naturales de las cochinillas harinosas en ocho departamentos cafeteros de Colombia.
| Departamento | Municipio | Vereda | Finca | E. N | Altitud (m) | Coordenadas | Remuestreo | |
|---|---|---|---|---|---|---|---|---|
| Antioquia | Angostura | Montañita | El Rubí | P | 1646 | N 6° 54′ 53,27″ | W 7° 20′ 2,87″ | |
| Antioquia | Barbosa | Platanito | Solenia | P | 1741 | N 6° 58′ 34,36″ | W 75° 23′ 41,32″ | R |
| Antioquia | Betulia | Pueblo Duro | Las Lechuzas | P | 1371 | N 6° 10′ 21,78″ | W 75° 56′ 29,49″ | R |
| Antioquia | Cañasgordas | Santo Cristo | La Divisa | P | 1415 | N 6° 46′ 33,55″ | W 76° 3′ 46,04″ | R |
| Antioquia | Gómez Plata | Cañaveral | Cañaveral | P | 1749 | N 6° 46′ 56,60″ | W 75° 12′ 21,45″ | R |
| Antioquia | Gómez Plata | Puente Ponce | El Coco | P | 1708 | Sin dato | Sin dato | R |
| Antioquia | Goméz Plata | La Region | El Mingo | P y D | 1853 | Sin dato | Sin dato | |
| Antioquia | Sabanalarga | El Llano de Oro | El Respaldo | P | 1733 | N 6° 57′ 28,03″ | W 75° 45′ 7,33″ | |
| Antioquia | Sopetrán | Guayabal | Las Cruces | P | 1428 | N 6° 30′ 21,57″ | W 75° 43′ 0,10″ | R |
| Antioquia | Venecia | Villa Silvia | El Llano | P | 1580 | N 5° 55′ 57,19″ | W 75° 44′ 59,02″ | R |
| Caldas | Aguadas | Colorados | La Orquídea | P | 1807 | Sin dato | Sin dato | |
| Caldas | Anserma | Villa Orozco | La Soledad | P | 1270 | N 5° 12′ 27,65″ | W 75° 47′ 59,57″ | R |
| Caldas | Aranzazu | Campoalegre | La Busaca | P | 1698 | N 5° 14′ 41,58″ | W 75° 31′ 45,89″ | R |
| Caldas | Marquetalia | El Porvenir | El Porvenir | P | 1592 | N 5° 19′ 4,38″ | W 75° 3′ 58,37″ | |
| Caldas | Neira | Aguacatal | La Alemana | P | 1363 | N 5° 11′ 49,35″ | W 75° 33′ 46,99″ | R |
| Caldas | Pensilvania | Villarazo Alto | El Porvenir | P | 1475 | N 5° 23′ 15,81″ | W 75° 3′ 35,66″ | R |
| Caldas | Pensilvania | Quebrada Negra | Los Medios | P | 1740 | N 5° 26′ 44,00″ | W 75° 10′ 35,00″ | R |
| Caldas | Pensilvania | La Torre | El Culumpio | P | 1562 | N 5° 29′ 25,37″ | W 75° 11′ 30,32″ | R |
| Caldas | Riosucio | Lomitas | Agua Salada | P | 1572 | N 5° 27′ 47,66″ | W 75° 42′ 32,75″ | |
| Caldas | Supía | Murillo | Buenos Aires | P | 1638 | N 5° 28′ 42,10″ | W 75° 39′ 42,77″ | |
| Caldas | Viterbo | La Arabia | La María | P | 1368 | N 5° 5′ 38,80″ | W 75° 54′ 27,50″ | |
| Cauca | La Argelia | Primavera | El Altillo | P | 1072 | N 2° 19′ 1,04″ | W 77° 14′ 7,45″ | |
| Cauca | El Tambo | Alto del Credo | El Toronjo | P | 1729 | N 2° 23′ 21,15″ | W 76° 45′ 57,00″ | |
| Cauca | Morales | Sta Rosa | El Mango | P | 1652 | N 2° 48′ 10,56″ | W 76° 39′ 34,97″ | |
| Cauca | Piendamó | Once de Noviembre | El Pinar | P | 1568 | N 2° 40′ 16,69″ | W 76° 36′ 54,98″ | |
| Cauca | Popayán | Punta Larga | Agroparque Las Villas | P | 1813 | N 2° 29′ 53,47″ | W 76° 34′ 54,98″ | R |
| Cauca | Toribio | La Mina | El Retiro | P | 1915 | N 2° 56′ 50,66″ | W 76° 15′ 58,15″ | |
| Cauca | Timbio | Barro Blanco | Las Estrellas | P | 1787 | N 2° 20′ 18,98″ | W 76° 42′ 16,28″ | R |
| Cauca | Timbio | Tunurca | La Providencia | P | 1695 | N 2° 25′ 44,25″ | W 76° 42′ 33,73″ | R |
| Quindío | Genova | Rio Gris | La Cascada | P | 2140 | N 4° 9′ 58,86″ | W 75° 46′ 23,90″ | R |
| Quindío | Quimbaya | El Laurel | La Esperanza | H | 1230 | Sin dato | Sin dato | |
| Norte de Santander | Cucutilla | Capira Sur | Miraflores | D | 1633 | N 7° 31′ 59,98″ | W 72° 45′ 42,62″ | |
| Risaralda | Dos quebradas | Santana | Renacer | P | 1526 | N 4° 50′ 49,12″ | W 75° 40′ 57,78″ | R |
| Risaralda | La Celia | La Sombra | El Porvenir | P | 1515 | N 4° 57′ 51,80″ | W 76° 0′ 59,51″ | |
| Risaralda | Mistrató | La Estrella | El Topacio | P | 1575 | N 5° 17′ 42,50″ | W 75° 52′ 13,90″ | |
| Tolima | Anzoátegui | La Camelia | Villamaria | P | 1549 | N 4° 37′ 50,02″ | W 75° 4′ 48,26″ | |
| Tolima | Anzoátegui | Riofrío | Jordania | P | 1519 | N 4° 36′ 53,26″ | W 75° 5′ 29,05″ | |
| Tolima | San Antonio | La Nutria | Rubí | P | 1914 | N 4° 5′ 22,63″ | W 75° 24′ 39,92″ | |
| Valle del Cauca | Bugalagrande | Alto Bonito | La Cumbre | D | 1603 | N 4° 07′ 50,41″ | W 75° 59′ 24,86″ | |
| Valle del Cauca | Cartago | Oriente | Dosquebradas | P | 1387 | N 4° 39′ 08,75″ | W 75° 52′ 56,49″ | |
| Valle del Cauca | Tulua | El Retiro | El Encanto | P y D | 1719 | N 4° 03′ 46,72″ | W 76° 04′ 3,58″ | |
| Valle del Cauca | Tuluá | Cascaajeros | Los Mangos | P y D | 1640 | N 4° 09′ 04,56″ | W 75° 58′ 07,21″ | R |
| Valle del Cauca | Viges | Rivera | La Esperanza | P | 1665 | N 3° 44′ 51,68″ | W 76° 29′ 28,96″ | |
| Valle del Cauca | Yumbo | Buitrera | El Bohio | P | 1438 | N 3° 34′ 46,20″ | W 76° 32′ 05,42″ | R |
Todos los departamentos evaluados presentaron al menos una finca con enemigos naturales de las cochinillas harinosas. Para el caso de los parasitoides, Norte de Santander fue el único departamento donde no se registraron cochinillas harinosas parasitadas; de los siete restantes, Caldas, Antioquia y Cauca fueron los de mayor porcentaje de fincas con parasitoides y Quindío el menor (Tabla 2).
Tabla 2 Porcentaje de fincas por departamento con insectos escama parasitados y número de individuos.
| Departamento | Fincas con cochinillas harinosas | Fincas con parasitoides (%) | N° individuos parasitados |
|---|---|---|---|
| Caldas | 72 | 15,3 | 37 |
| Antioquia | 71 | 14,1 | 25 |
| Cauca | 58 | 13,8 | 22 |
| Valle del Cauca | 48 | 10,4 | 21 |
| Risaralda | 80 | 3,8 | 8 |
| Tolima | 71 | 4,2 | 5 |
| Quindío | 83 | 1,2 | 2 |
| Norte de Santander | 37 | 0,0 | 0 |
En la familia Pseudococcidae, fue donde se encontró el mayor parasitismo con 87 individuos parasitados, presentes en siete departamentos; mientras que Puto barberi presentó el menor parasitismo con 33 individuos parasitados, siendo Valle del Cauca el departamento con mayor presencia y Risaralda el departamento con menor presencia; entre tanto, Tolima y Quindío no presentaron parasitoides para P. barberi (figura 1).
El mayor parasitismo en Pseudococcidae puede deberse a que es considerada la segunda familia más numerosa de los insectos escama (Hemiptera: Coccomorpha), con aproximadamente 2.012 especies descritas y más de 273 géneros distribuidos en todo el mundo (García Morales et al. 2021). En Colombia, Ramos y Serna (2004) registraron 70 especies de pseudocóccidos, y Kondo et al. (2008) reportaron 75 especies pseudocóccidos y 3 especies de putoideos en Colombia, las cuales representan el 26,6% del total (282) de las especies de pseudocóccidos reportados en Centro y Suramérica (Williams & Granara de Willink 1992). De igual manera, los mayores registros de parasitismo a nivel mundial son registrados sobre las especies de Pseudococcidae (Noyes & Hayat 1994). Para P. barberi (Putoidae) se conocen menos casos de parasitismo siendo A. bolowi, H. pseudococcina (Gil et al. 2016) y Zarhopalus putophilusBennett, 1957 (Hymenoptera: Encyrtidae) (Noyes 2019) los únicos registros conocidos para esta especie.
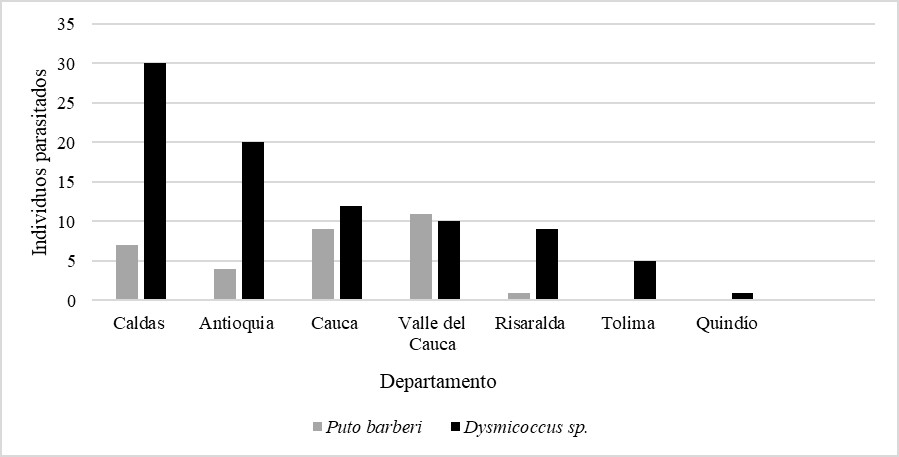
Figura 1 Número de cochinillas harinosas (Puto barberi y Dysmicoccus sp.) parasitadas por cada departamento.
Fue frecuente encontrar en una misma raíz de la planta de café, varios individuos parasitados del género Dysmicoccus (figura 2); aunque la mayoría de las especies de encírtidos son solitarias, se conocen casos de parasitismo gregario como Pseudaphycus maculipennis Mercet, 1923, parasitoide de Pseudococcus viburni (Signoret, 1875) (Hemiptera: Pseudococcidae) (Sandanayaka et al. 2009).
Tanto para P. barberi como para Dysmicoccus sp., las características que presentan cuando están parasitados son: escasa capa cerosa, inmóviles, coloración café o naranja (figura 3A), al examinar estos individuos con un estereomicroscopio se observa en el interior el estado biológico del parasitoide ya sea larva, pupa o inclusive el adulto (figura 4A-C), en algunas ocasiones se aprecia el orificio de salida del adulto del parasitoide (figura 3B).

Figura 3 A. Puto barberi parasitado, sin capa cerosa y de coloración naranja. B. Dysmicoccus sp. parasitado, se observa la poca capa cerosa y el orificio de salida.

Figura 4 Dysmicoccus sp. y P. barberi parasitados, se observa al interior: A. Adulto del parasitoide, B. Pupa del parasitoide. C. Pupa de un parasitoide extraída de un espécimen de P. barberi.
El re-muestreo para la obtención de adultos de los parasitoides y de los dípteros se concentró en 20 fincas de las 44 donde se encontraron enemigos naturales (Tabla 1). Sólo de cuatro fincas emergieron enemigos naturales de las cochinillas harinosas, distribuidos en 28 individuos de Encyrtidae (Hymenoptera) y cinco individuos de Cecidomyiidae (Diptera); los cuales se describen a continuación. La razón por lo cual no se obtuvieron enemigos naturales en las demás fincas pudo deberse al control químico que realizan los agricultores para el manejo de las cochinillas harinosas y otras especies de insectos escama, donde utilizan ingredientes activos de contacto como el Clorpirifos 75% WG, de acción sistémica como el Tiametoxam y de amplio espectro como la Lambdacihalotrina (Gil et al. 2015).
Enemigos naturales de las cochinillas harinosas de las raíces del café
Parasitoides (Hymenoptera: Encyrtidae)
Aenasius caeruleus Brues, 1910 (figura 5A-D).
Sinonimia: Aenasius personatus Kerrich, 1967.
Longitud hembra: 1,01-2,30 mm (Noyes & Ren 1995).
Distribución: Argentina, Belice, Brasil, Costa Rica, Cuba, Ecuador, México, Panamá, Perú, Puerto Rico, Trinidad y Tobago, Estados Unidos, Uruguay y Venezuela (Noyes 2019).
Hospedantes: Ferrisia virgata y Ferrisia sp. (Hemiptera: Pseudococcidae) (Noyes 2019); Puto barberi (presente estudio).
Material revisado: 2 ♀♀, COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 15-mar-2018, coll. Gil, Z. & Jiménez, M., det. John S. Noyes del Museo de Historia Natural de Londres. Está catalogada con el código MEMB 22640.
Comentarios: Aenasius caeruleus no estaba registrada en Colombia como parasitoide de insectos escama, este es un nuevo registro para la lista de hospedantes de esta especie. Fernández (1995) reportó la especie en el departamento del Atlántico y la región de la Orinoquia sin asociarlo a ningún hospedante. En este trabajo se encontró como parasitoide de Puto barberi.
Aenasius bolowiMercet, 1947 (figura 6A-D).
Sinonimia: Aenasius similis Kerrich, 1967.
Longitud macho: 0,88-1,78 mm (Noyes & Ren 1995).
Distribución: Afganistán, Belice, Costa Rica, Granada, Guatemala, Panamá, Perú, Trinidad y Tobago y Venezuela (Noyes 2019).
Hospedantes: Dysmicoccus sp. (presente estudio), Puto barberi (Hemiptera: Putoidae) (Gil et al. 2016).
Material revisado: 8 ♂♂ COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m, captura manual, 12-jun-2018, coll. Gil, Z. & Jiménez, M., det. John S. Noyes del Museo de Historia Natural de Londres; 1 ♂ COLOMBIA: Risaralda, Dosquebradas, Vereda Santana, Finca Renacer, 04°50′49″N, 75°40′58″O, 1526 m s.n.m., captura manual, 13-jun-2018, coll. Gil, Z. & Jiménez, M., det. John S. Noyes del Museo de Historia Natural de Londres. Está catalogada con el código MEMB 22642.
Comentarios: El único registro para Colombia es como parasitoide de Puto barberi (Gil et al. 2016). Sin embargo, en este trabajo se encontró parasitando a P. barberi y Dysmicoccus sp., fue la especie con mayor número de individuos, todos machos.
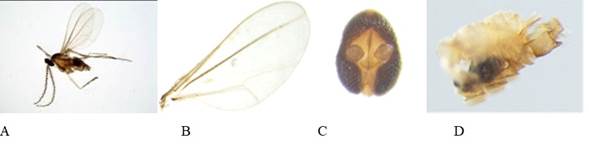
Aenasius tachigaliae (Brues, 1922) (figura 7A-H).
Sinonimias: Blepyrus tachigaliae Brues, 1922, Aenasius brasiliensis (Mercet, 1926), Chalcaspis brasiliensis Mercet, 1926, Aenasius cariocusCompere, 1937, Aenasius colombiensis Compere, 1937, Aenasius theobromae Kerrich, 1953.
Longitud hembra: 1,21-1,90 mm (Noyes & Ren 1995).
Longitud macho: 0,65-1,27 mm (Noyes & Ren 1995).
Distribución: Argentina, Bolivia, Brasil, Colombia, Costa Rica, Ecuador, Guyana, Hawái, México, Panamá, Perú, Trinidad y Tobago.
Hospedantes: Cataenococcus sp., Dysmicoccus brevipes, Dysmicoccus sp., Pseudococcus sp. (Hemiptera: Pseudococcidae) (Noyes 2015).
Material revisado: 1 ♀ COLOMBIA: Valle del Cauca. Tuluá. Vereda Cascajeros. Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 12-jun-2018, coll. Gil, Z. & Jiménez, M.; 1 ♂ COLOMBIA: Risaralda, Dosquebradas, Vereda Santana, Finca Renacer, 04°50′49″N, 75°40′58″O, 1526
m s.n.m., captura manual, 26-nov-2018, coll. Gómez, M., det. Luis M. Constantino y Zulma N. Gil de acuerdo con las claves de Noyes y Ren (1995). Está catalogada con el código MEMB 23627.
Comentarios: En Colombia fue reportado por Compere (1937) como Aenasius colombiensis descrito a partir de 17 hembras y 15 machos criados sobre Pseudococcus sp. por E.G. Salas en el municipio de Barbosa, departamento de Santander en el año 1935 (Compere 1937). En el presente estudio se encontró como parasitoide de Dysmicoccus sp.

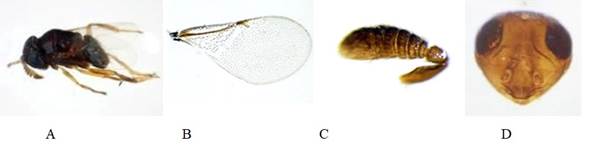
Figura 7 Aenasius tachigaliae ♀. A. Habitus. B. Ala anterior. C. Antena. D. Cabeza; ♂ E. Habitus. F. Ala anterior. G. Antena. H. Cabeza
Aenasius cf. mitchellae Noyes y Ren, 1995 (figura 8A-D).
Longitud hembra: 2,09-2,35 mm (Noyes & Ren 1995).
Distribución: Costa Rica.
Hospedantes: Dysmicoccus sp. (presente estudio).
Material revisado: 1 ♀ COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 12-jun-2018, coll. Gil, Z. & Jiménez, M., det. Luis M. Constantino y Zulma N. Gil de acuerdo con las claves de Noyes y Ren (1995). Está catalogada con el código MEMB 23628.
Comentarios: En este estudio se encontró parasitando a Dysmicoccus sp.
Zarhopalus putophilusBennett, 1957 (figura 9A-D).
Longitud hembra: 1,57 mm (Bennett 1957).
Distribución: Trinidad y Tobago.
Hospedantes: Puto barberi (Hemiptera: Putoidae).
Material revisado: 4 ♀♀ COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 23-agos-2018, coll. Gil, Z. & Jiménez, M., det. John S. Noyes del Museo de Historia Natural de Londres. Está catalogada con el código MEMB 22644.
Comentarios: Zarhopalus putophilus se describió a partir de especímenes criado sobre Puto barberi recolectados en Trinidad y Tobago durante los años 1952 y 1953 sobre Theobroma cacao L. Los especímenes adicionales han sido obtenidos de P. barberi, recolectados en Trinidad y Tobago en Lantana camara L. (Verbenaceae), Acalypha wilkesiana Müll. Arg. (Euphorbiaceae), Gliricidia sepium (Jacq.) Kunth ex Walp. (Fabaceae) y Coccoloba uvifera L. (Polygonaceae) (Bennett 1957).
En Colombia, Fernández (1995) reportó al género Zarhopalus en el departamento del Atlántico y la región del Pacífico, pero no se conocen registros de esta especie para Colombia, siendo este el primer registro documentado. En el presente estudio se encontró parasitando a P. barberi.
Hambletonia pseudococcinaCompere, 1936 (figura 10A-D).
Longitud hembra: 1,0-2,5 mm (Sharkov & Woolley 1997).
Distribución: Antillas, Argentina, Bermuda, Brasil, Colombia, Costa Rica, Dominica, República Dominicana, Ecuador, Ghana, Hawái, Jamaica, Japón, México, Puerto Rico, Taiwán, Trinidad y Tobago, Estados Unidos y Venezuela.
Hospedantes: Dysmicoccus brevipes y Planococcoides njalensis (Laing, 1929; Kondo et al. 2022) (Hemiptera: Pseudococcidae).
Material revisado: 5 ♀♀ COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 26-jul-2018, coll. Gil, Z. & Jiménez, M., det. John S. Noyes del Museo de Historia Natural de Londres. Está catalogada con el código MEMB 22646.
Comentarios: Los primeros registros de H. pseudococcina fueron en Brasil y Colombia como un parasitoide importante de D. brevipes y posteriormente fue introducida a Hawái, Puerto Rico y la Florida (Sharkov & Woolley 1997). En el presente estudio se encontró parasitando a Puto barberi y Dysmicoccus sp. Caballero et al. (2019) reportaron a Dysmicoccus brevipes asociada a las raíces del café, no se descarta que la especie de Dysmicoccus donde fue encontrada corresponda a D. brevipes.
cf. Hambletonia sp. ♂ (figura 11A-D).
Longitud macho: 1,0-1,7 mm (Sharkov & Woolley 1997).
Material revisado: 1 ♂ COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 26-jul-2018, coll. Gil, Z. & Jiménez, M., det. Luis M. Constantino y Zulma N. Gil de acuerdo con las claves de Sharkov y Woolley (1997). Está catalogada con el código MEMB 23629.
Comentarios: Los machos del género Hambletonia son poco conocidos y por lo tanto poco descritos. En el caso de Hambletonia pseudococcina la raza presente en Brasil es bisexual, sin embargo, la que está en Colombia y Venezuela la razón sexual macho/hembra es de 1:200 (Sharkov y Woolley 1997). En el presente estudio se registró en muestras de P. barberi.
Prochiloneurus cf. dactylopii (Howard, 1885) (figura 12A-D).
Longitud hembra: 1,12 - 1,82 mm (Noyes y Triapitsyn 2018).
Sinonimias: Chiloneurus dactylopii Howard, 1885, Achrysopophagus dactylopii (Howard, 1885), Prochiloneurus dactylopii (Howard, 1885), Achrysopophagus modestus Timberlake, 1924, Prochiloneurus modestus (Timberlake, 1924).
Distribución: Argentina, Barbados, Bolivia, Brasil, Islas del Caribe, Chile, Colombia, Dominica, Guayana Francesa, Guyana, México, región Neártica, Paraguay, Trinidad y Tobago, y Estados Unidos (Noyes 2015).
Hospedantes primarios: Coccus viridis (Green, 1889) (Hemiptera: Coccidae), Ferrisia virgata (Cockerell, 1893), Phenacoccus (Tereznikova, 1968), Phenacoccus herreni Cox & Williams, 1981, Phenacoccus manihoti, Phenacoccus solenopsis Tinsley, 1898, Phenacoccus sp., Planococcus citri (Risso, 1813), Pseudococcus comstocki (Kuwana, 1902), Pseudococcus maritimus (Ehrhorn, 1900) (Hemiptera: Pseudococcidae), Puto barberi (Hemiptera: Putoidae), Chrysopa sp. y Sympherobius sp. (Neuroptera: Chrysopidae y Sympherobiidae, respectivamente) (Noyes 2015).
Hiperparasitoide de: Anagyrus yuccae (Coquillet, 1890), Anagyrus diversicornis (Howard, 1894), Anagyrus lopezi (De Santis, 1964), Leptomastix dactylopii Howard, 1885, Zarhopalus corvinus (Girault, 1915) y Zarhopalus putophilus (Hymenoptera: Encyrtidae) (Noyes 2015).
Material revisado: 1 ♀ COLOMBIA: Cauca, Popayán, Vereda Punta larga, Finca Agroparque las Villas, 02°29′53″N, 76° 34′55″O, 1813 m s.n.m., captura manual, 1-sep-2015, coll. Velazco, F., det. Luis M. Constantino y Zulma N. Gil de acuerdo con las claves de Noyes y Triapitsyn (2018). Está catalogada con el código MEMB 23630.
Comentarios: En el presente estudio se registró en muestras de Dysmicoccus sp.
Leptomastix sp. (figura 13A-D).
Longitud hembra: 1,10-2,30 mm (Anga & Noyes 1999).
Material revisado: 1 ♀ COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 15-mar-2018, coll. Gil, Z. & Jiménez, M., det. Luis M. Constantino y Zulma N. Gil de acuerdo con las claves de Anga y Noyes (1999). Está catalogada con el código MEMB 23631.
Comentarios: El género Leptomastix Förster, 1856, contiene alrededor de 35 especies descritas, probablemente es un género del viejo mundo y la única especie representante del nuevo mundo es L. dactylopii, de origen Afrotropical e introducida a América del Sur (Anga & Noyes 1999). La mayoría de las especies del género Leptomastix son endoparasitoides primarios y solitarios de las cochinillas harinosas, aunque se conoce que L. dactylopii parasita a más de 20 especies. L. dactylopii Howard, 1885, L. flava Mercet, 1921, L. abyssinica Compere, 1931 y L. nigrocoxalis Compere, 1928, han sido utilizadas en programas exitosos de control biológico de insectos escama (Anga & Noyes 1999). En este estudio se encontró parasitando individuos de Dysmicoccus sp.
cf. Cicoencyrtus sp.Noyes, 1980 (figura 14A-D).
Longitud hembra: 1,33-149 mm (Noyes 1980).
Distribución: Brasil y México. Se registra en Colombia en el presente estudio.
Hospedante: Dysmicoccus sp. (presente estudio).
Material revisado: 2 ♀♀ COLOMBIA: Quindío, Génova, Vereda Río Gris, Finca la Cascada, 04°09′59″N, 75°46′24″O, 2140 m s.n.m., captura manual, 7-jul-2016, coll. Giraldo. J., det. Luis M. Constantino y Zulma N. Gil de acuerdo con las claves de Noyes (1980). Está catalogada con el código MEMB 23632.
Comentarios: En este trabajo se encontró como parasitoide de Dysmicoccus sp. (Hemiptera: Pseudococcidae).
Depredadores
En las muestras de insectos escama recolectadas en campo, se observó la presencia de larvas de insectos depredadores de las familias Coccinellidae y Cecidomyiidae. Estos depredadores se encontraron en las colonias de P. barberi hospedadas en las raíces de café.
Diptera: Cecidomyiidae
Diadiplosis cf. coccidarum (Cockerell, 1892) (figura 15A-D).
Longitud del ala: 1,0-1,5 mm (Gagné 1994).
Hospedantes: Planococcus sp. (Hemiptera: Pseudococcidae) (Gagné & Jaschhof 2021).
Material revisado: 5 individuos, indeterminado, COLOMBIA: Valle del Cauca, Tuluá, Vereda Cascajeros, Finca los Mangos, 04°09′05″N, 75°58′07″O, 1640 m s.n.m., captura manual, 15-mar-2018, coll. Gil, Z. & Jiménez, M., det. Luis M. Constantino y Zulma N. Gil de acuerdo con las claves de Gagné (1994). Está catalogada con el código MEMB 23633.
Comentarios: Se recolectaron en estado de larva sobre colonias de P. barberi asociados a raíces de café, se mantuvieron en cámaras de cría hasta la emergencia de los adultos.
Coleoptera: Coccinellidae sp. 1 (figura 16A-C).
Material revisado: 6 larvas. COLOMBIA: Antioquia, Gómez Plata, Vereda La Región, Finca El Mingo, 1633 m, captura manual, 29-oct-2015, coll. Tobón, Y.; 1 larva. COLOMBIA: Valle del Cauca, Tuluá, Vereda El Retiro, Finca El Encanto, 04°03′47″N, 76°04′04″O, 1719 m s.n.m., captura manual, 26-jun.2018, coll. Gil, Z., det. Zulma N. Gil. Está catalogada con los códigos MEMB 23634 y MEMB 23635.
Comentarios: Se encontró en raíces de plantas de café con presencia de P. barberi, en el campo las larvas de este coleóptero presentan capa cerosa similar a P. barberi y tienen hábitos gregarios. No fue posible identificar el género y la especie debido a que todos los individuos estaban en estado de larva y de pupa.
Coleoptera: Coccinellidae sp. 2 (figura 17A-B).
Material revisado: 7 larvas. COLOMBIA: Valle del Cauca, Bugalagrande, Vereda Alto Bonito, Finca La Cumbre, 04°07′50″N, 75°59′25″O, 1603 m s.n.m., captura manual, 27-jun-2018, coll. Gil, Z.; 1 larva. COLOMBIA: Norte de Santander, Cucutilla, Vereda Capira Sur, Finca Miraflores, 07°31′60″N, 72°45′43″O, 1633 m s.n.m., 6-agos-2018, coll. Gil, Z., det. Zulma N. Gil. Está catalogada con los códigos MEMB 23636 y MEMB 23637.
Comentarios: Se encontró en raíces de plantas de café con presencia de P. barberi, no fue posible identificar el género y la especie debido a que todos los individuos estaban en estado de larva.
Hongos antagonistas
Trichoderma Persoon, 1794 (figura 18).
Material revisado: Tres raíces de plantas de café infestadas con especies de Pseudococcidae asociadas con hongos basidiomecetos, recolectadas en COLOMBIA: Quindío, Quimbaya, Vereda El Laurel, Finca La Esperanza, 1230 m s.n.m., 28-nov-2019, coll. Gil, Z., det. Góngora, C. Los aislamientos están conservados en la Colección de Microorganismos del Centro Nacional de Investigaciones de café, Cenicafé, Manizales, Caldas, Colombia.
Comentarios: Trichoderma sp. se encontró sobre los hongos basidiomicetos que se asocian con especies de Pseudococcidae e inhibió el crecimiento del micelio de los basidiomicetos. De acuerdo con Bruce y Highley (1991)Trichoderma actúa como antagonista de hongos basidiomicetos al producir químicos volátiles y antibióticos antifungales que inhiben su crecimiento.

Figura 18 Trichoderma sp. A. Micelio del hongo sobre las estructuras del hongo basidiomiceto que se asocia con especies de Pseudococcidae. B. Individuo de Pseudococcidae en una raíz de café con presencia de hongo basidiomiceto y Trichoderma sp.
Pese a que las cochinillas harinosas de las raíces de las plantas están poco expuestas al control por enemigos naturales, en este estudio se registraron diez especies de parasitoides, tres especies de depredadores y un hongo entomopatógeno (Tabla 3). El parasitismo puede presentarse sobre los insectos que están más expuestos, es decir, los que se encuentran en el cuello de la raíz y en los primeros centímetros de profundidad. De estos hallazgos se puede decir que existen varias especies de enemigos naturales que están ejerciendo en campo control natural sobre las cochinillas harinosas de las raíces del café, pero se deben explorar alternativas de control biológico por conservación y aumentación.
Tabla 3 Enemigos naturales de cochinillas harinosas (Hemiptera: Coccomorpha: Pseudococcidae y Putoidae) asociadas con las raíces del café.
| Enemigo natural | Especie o familia de Coccomorpha | Asociación |
|---|---|---|
| Aenasius bolowi | P. barberi y Dysmicoccus sp. | Parasitoide |
| Aenasius caeruleus | P. barberi | Parasitoide |
| Aenasius cf. mitchellae | Dysmicoccus sp. | Parasitoide |
| Aenasius tachigaliae | Dysmicoccus sp. | Parasitoide |
| cf. Cicoencyrtus sp. | Dysmicoccus sp. | Parasitoide |
| cf. Hambletonia sp. | P. barberi | Parasitoide |
| Leptomastix sp. | Dysmicoccus sp. | Parasitoide |
| Prochiloneurus cf. dactylopii | Dysmicoccus sp. | Parasitoide |
| Diadiplosis cf. coccidarum | P. barberi | Depredador |
| Coccinellidae sp1. | P. barberi | Depredador |
| Coccinellidae sp2. | P. barberi | Depredador |
| Trichoderma sp. | Pseudococcidae | Antagonista |
Con el hallazgo de A. caeruleus, A. bolowi, H. pseudococcina, cf. Hambletonia sp. y Z. putophilus, se incrementan los registros de parasitoides de P. barberi para Colombia, completando así cinco especies. Se registra por primera vez para Colombia a A. caeruleus y Z. putophilus.
Se registró el hongo Trichoderma sp. como un antagonista de los hongos basidiomicetos que se asocian con especies de Pseudococcidae, por lo que se convierte en un buen candidato para posteriores estudios donde se determine su eficacia y pueda ser incorporado dentro de la estrategia de manejo integrado de las especies de Pseudococcidae que enquistan raíces del café.