Introducción
El gusano cogollero del maíz Spodoptera frugiperda (J. E. Smith, 1797) (Lepidoptera: Noctuidae) y el gusano del fruto del tomate Heliothis virescens Fabricius, 1777 (Lepidoptera: Noctuidae) son insectos plaga que atacan cultivos de importancia económica en México (Blanco et al. 2007; Suris Campos et al. 2013; Nunes-Lemes et al. 2014). El método más utilizado para combatir a las plagas agrícolas es el control químico, aún con los daños que ocasiona en el ambiente (Mahmood et al. 2016), por lo que es necesario contar con métodos alternativos de control biológico como los hongos entomopatógenos. Las especies más utilizadas en el control de insectos son Metarhizium robertsii (Metschnikoff) Sorokin, 1883 (antes M. anisopliae) (Hypocreales: Clavicipitaceae) y Beauveria bassiana (Balsamo-Crivelli) Vuillemin, 1912 (Hypocreales: Clavicipitaceae) (Alatorre-Rosas 2007; Yehia et al. 2022). Sin embargo, se sabe que la capacidad patogénica de estos hongos disminuye cuando se mantienen por tiempos prolongados en el mismo medio de cultivo (González García et al. 2001; Polovinko 2013; Keyhani 2018), por lo que es necesario contar con el medio de cultivo óptimo que contenga las sustancias nutritivas que requiere el hongo para su crecimiento y le confiera virulencia a las cepas durante la infección a insectos (González García et al. 2001; Cañedo & Ames 2004; Ishak et al. 2020; Rajula et al. 2021).
Los medios de cultivo de hongos entomopatógenos deben contener nitrógeno, carbono y vitaminas, para un desarrollo óptimo y reproducción, un pH de 6 a 6,3, así como antibióticos para evitar el crecimiento de bacterias saprofitas (Cañedo & Ames 2004). De estos, los más comunes son PDA, Agar Agua (AA), Sabouraud Dextrosa Agar (SDA), Sabouraud Dextrosa Agar con extracto de levadura (SDAY) y Agar Melaza levadura (AML). Al respecto, se han llevado a cabo estudios para determinar el crecimiento radial de los hongos M. robertsii y B. bassiana bajo diferentes condiciones de crecimiento (García-Gutiérrez et al. 2020), y otros con la finalidad de inducir su patogenicidad al usar suplementos de integumento de algunos insectos diana (González García et al. 2001; Sharapova 2019; Sapna Bai et al. 2020), así como para conocer su potencial en la inducción de la actividad enzimática dinámica y caracterización bioquímica de B. bassiana (Peteira et al. 2011). Los hongos tienen diferentes atributos que determinan su virulencia frente a sus hospedantes, tales como la producción de enzimas hidrolíticas como proteasas, lipasas y quitinasas (Zibaee & Bandani, 2009; Batool et al. 2020). Este mecanismo enzimático puede lograr una alta mortalidad de insectos plaga ocasionada por los hongos, si a éstos se les provee el sustrato necesario para su desarrollo y se promueve la inducción de las enzimas involucradas en la patogenicidad (González García et al. 2001). Debido a esto, la virulencia de un hongo es considerada una característica importante en el control de las plagas.
El objetivo fue evaluar el crecimiento radial de cepas de B. bassiana y M. robertsii en medio suplementado con polvo de S. frugiperda y H. virescens y determinar la patogenicidad que M. robertsii induce sobre larvas de S. frugiperda.
Materiales y métodos
Producción del suplemento a base de los insectos Spodoptera frugiperda y Heliothis virescens
Cría de insectos. En los ciclos agrícolas primavera-verano y otoño-invierno de 2018 se recolectaron larvas de S. frugiperda (Sf) en cultivos de maíz y larvas de H. virescens (Hv) en cultivos de garbanzo en el municipio de Guasave, Sinaloa, México, para establecer una cría axénica en laboratorio. Las larvas se alimentaron con dieta artificial (elaborada con harina de maíz, salvado de trigo, levadura de cerveza, vitaminas, sales y metil-paraben como bacteriostático, solidificado en agar) (Acuña Jiménez et al. 2015).
Obtención del suplemento de insectos. Se siguió el procedimiento descrito por García-Gutiérrez et al. (2020). Se usaron pupas de la generación F3 de la cría axénica; se secaron en horno (Riossa®) a 50 °C durante tres días, se molieron en un mortero manual de porcelana hasta obtener un polvo, el cual se llevó a peso constante. Se almacenó en frascos de vidrio con boca ancha con capacidad de 118 mL a temperatura ambiente hasta su utilización.
Análisis proximal del suplemento. Al polvo se le realizó un análisis proximal por los métodos respaldados por la Asociación de químicos analíticos oficiales (A.O.A.C., por sus siglas en inglés) (Ramos Elorduy et al. 2002), para conocer el contenido de humedad por diferencia de peso a 105 °C/4 h y determinación de la energía, mediante factores de conversión propuestos por Heras et al. (1998), las proteínas por el método de Kjeldahl (1883) , grasas por el método de Soxhlet (1879), cenizas por diferencia de peso: calcinación 600 °C/5 h, fibra cruda por hidrólisis sucesiva: ácido/base) y extracto libre de nitrógeno (ELN) con la ecuación:
En la ecuación ELN es el % de extracto libre de nitrógeno, cen de ceniza, prot de proteína, gra de grasa y fib de fibra.
Evaluación del crecimiento radial de B. bassiana y M. robertsii en medios suplementados
Selección de cepas. Se utilizaron cepas de B. bassiana (B1- CIDSB01) y M. robertsii (M1- CIDSM01) provenientes del cepario del laboratorio de Bioinsecticidas del CIIDIR-Sinaloa. Las cepas tienen las claves de acceso GenBank KR998503 para B1 y KR998522 para M1. Después de realizar resiembras de las cepas en cajas Petri con PDA, se seleccionaron las de mayor velocidad de crecimiento con las características morfológicas de cada especie (García-Gutiérrez et al. 2020).
Preparación de medios de cultivo. El medio PDA se usó como control, para su preparación se siguieron las instrucciones del fabricante. A los medios de cultivo PDA suplementados se les agregó el polvo de los dos insectos a concentraciones de 0,25 %; 0,5 % y 1 %. Los medios esterilizados se vaciaron en cajas Petri en una campana de flujo laminar (Cobeal HLV) y se almacenaron hasta su uso.
Crecimiento radial de los hongos entomopatógenos. Las cajas Petri con medio de cultivo PDA con y sin suplemento de insecto se inocularon con discos de 6 mm con micelio cortados con un sacabocados estéril (Hernández Mansilla et al. 2005), esto se llevó a cabo en una campana de bioseguridad (Telstar bio-11-A). Las cajas inoculadas se colocaron en una cámara bioclimática marca Scorpion Scientific a 28 °C y 80 % de HR durante 15 días para su desarrollo. Cada 24 h se realizó la medición del crecimiento radial en milímetros con una regla graduada. Para el análisis de los datos se realizó un diseño estadístico completamente al azar con cuatro repeticiones por tratamiento, se llevó a cabo un análisis de varianza (ANDEVA) y una prueba de comparación múltiple de Tukey a un nivel de significancia α = 0,05 utilizando el paquete estadístico SAS® versión 9,0.
Evaluación de la patogenicidad de M. robertsii inducido sobre S. frugiperda
Determinación de la concentración y viabilidad de esporas. Para esta prueba se utilizó la cepa de M. robertsii Hv 1 % con mayor crecimiento radial, las esporas se cosecharon al raspar la superficie de la placa con un asa bacteriológica estéril, tanto del medio control como de los medios suplementados y se disolvieron en 15 mL de solución estéril de Tween 80 al 0,01 %. Una vez obtenida la suspensión madre se hicieron diluciones seriadas para determinar su concentración, de las cuales se tomaron 10 µL y se depositaron en una cámara de Neubauer (LAREN®) para posteriormente contar las esporas en un microscopio óptico (Zeiss) a una ampliación de 40X. En la prueba de viabilidad se tomaron 100 µL de las diluciones y se depositaron en el centro de una caja Petri con medio PDA, se distribuyó uniformemente el contenido con una varilla estéril, las cajas se incubaron a 28 °C por 16 h en cámara bioclimática (Scorpion Scientific). Se cortó 1 cm2 del medio y se colocó en un portaobjetos para su observación con un microscopio óptico (Zeiss), se contaron esporas germinadas (mayor al 90 %) con un tamaño de dos o más veces mayor al diámetro de la espora para considerarse como viable (Inglis et al. 2012).
Bioensayos. Se empleó una suspensión de M. robertsii a una concentración de 108 esporas/mL y se utilizaron larvas del tercer estadio de S. frugiperda, por ser más activas y manipulables. Se evaluaron tres tratamientos, los cuales consistieron en utilizar el hongo M. robertsii proveniente de los medios suplementados con S. frugiperda (M1 Sf) y H. virescens (M1 Hv), además de un control (M1 Ctl) (sin suplemento de insecto). Se hicieron tres réplicas por tratamiento con ocho larvas cada una (las larvas respondieron a la infección del patógeno en prueba preliminar). Las larvas se colocaron en cajas Petri de cinco cm de diámetro y se les proporcionó una porción de dieta artificial, cada larva fue inoculada con 300 µL de la suspensión de esporas con una micropipeta de 500 µL marca LABMATE. Las cajas de cada tratamiento se incubaron a 28 °C y HR de 80 % en una cámara bioclimática marca Scorpion Scientific. Cada 24 h se contaron las larvas muertas y vivas durante siete días. Las larvas muertas permanecieron tres días más en cámara húmeda para observar la esporulación total del hongo sobre los insectos. Para el análisis de los datos se usó un diseño estadístico completamente al azar, se realizó un análisis de varianza (ANDEVA) y una prueba de comparación múltiple de Tukey a un nivel de significancia α = 0,05, se utilizó el paquete estadístico SAS® versión 9,0.
Resultados
Composición del suplemento de Spodoptera frugiperda y Heliothis virescens
El análisis proximal realizado al integumento en polvo de los dos insectos se presentan en la tabla 1.
Tabla 1 Análisis proximal del polvo de H. virescens y S. frugiperda
| Insecto | Humedad (%) | Proteína (%) | Extracto etéreo (%) | Fibra cruda (%) | Cenizas (%) | ELN* (%) | Energía (Kcal/g) |
|---|---|---|---|---|---|---|---|
| H. virescens | 0,91 | 13,51 | 41,94 | 8,34 | 4,17 | 32,04 | 493,73 |
| S. frugiperda | 2,70 | 15,78 | 49,90 | 8,57 | 4,37 | 21,39 | 517,87 |
*Extracto libre de nitrógeno
Crecimiento radial de M. robertsii y B. bassiana en medio PDA suplementado con H. virescens y S. frugiperda
El crecimiento radial de M. robertsii suplementado con S. frugiperda al 1 % fue de 75,5 mm y con H. virescens de 74,2 mm, con diferencias estadísticas respecto al control (60 mm). El crecimiento de B. bassiana suplementado con H. virescens al 0,5 % fue 55 mm y con S. frugiperda al 0,25 %, 50 mm, con diferencias estadísticas con el control 33,25 mm (α = 0,05) (figura 1).
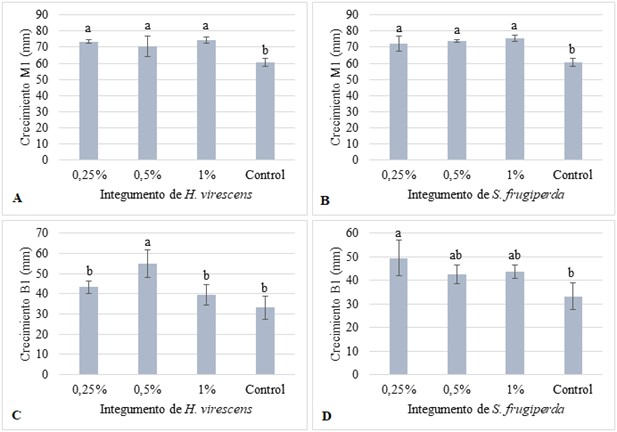
Figura 1 Crecimiento radial de los hongos en PDA: M. robertsii: A) Suplementado con H. virescens, B) Suplementado con S. frugiperda; B. bassiana, C) Suplementado con H. virescens, D) Suplementado con S. frugiperda.
En la figura 2 se observa el mayor halo de crecimiento de la cepa M1 suplementados con Hv y Sf al 1 %, la colonia es de una coloración verde oliva característica de este hongo, y en la cepa B1 suplementada con Hv al 0,5 % y Sf al 0,25 % aparece un halo de menor diámetro de color blanco típica en B. bassiana. En ambos casos la cepa en el medio control tuvo menor diámetro en mm, que los hongos crecidos en medios suplementados con polvo de pupas durante 15 días.
Patogenicidad de M. robertsii inducido sobre larvas de S. frugiperda
La viabilidad de las conidias de la cepa M1 de M. robertsii utilizada en este estudio fue superior al 90 % de esporas germinadas a las 16 h.
Bioensayo. La cepa M1 de M. robertsii crecida en medio suplementado con Sf causó 12,5 % de mortalidad de larvas a las 24 h post inoculación, aumentó en las siguientes horas. Se observaron diferencias estadísticas en la mortalidad de larvas de S. frugiperda a las 168 h, entre los tratamientos de M. robertsii Sf (91,6 %), Hv (80 %) y el Ctl (66,6 %), mientras que en el control (agua y Tween 80), no hubo mortalidad de larvas (α = 0,05) (Figura 3).
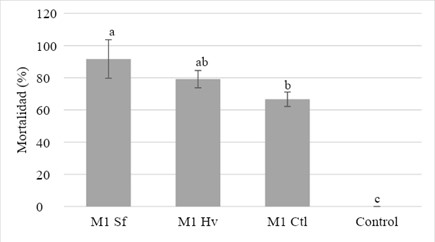
Figura 3 Mortalidad de larvas de S. frugiperda causada por la cepa M1 a las 168 h. Tratamientos: M1 Sf = Hongo desarrollado en medio con S. frugiperda, M1 Hv = hongo desarrollado en medio con H. virescens, M1 Ctl = hongo desarrollado en medio sin insecto, Control = agua y Tween 80 como control negativo.
Discusión
El análisis proximal del polvo indicó que el mayor nutrimento en S. frugiperda y H. virescens son las grasas, valores superiores a los de Rodríguez-Ortega et al. (2016) en pupas del gusano de seda Bombyx mori Linnaeus, 1758 (Lepidoptera: Bombycidae) (20,63 %). El contenido de ELN de H. virescens fue 10 veces mayor a la reportado en B. mori (3,92 %) por Rodríguez-Ortega et al. (2016) y similar a lo reportado por Ramos-Elorduy et al. (1998) en Heliothis zea (Boddie, 1850) (Lepidoptera: Noctuidae) con 21%. Con relación a las proteínas, los resultados fueron inferiores a los obtenidos por Rodríguez-Ortega et al. (2016) en B. mori (64,31%) y por Ramos Elorduy et al. (1998) en H. zea (41,98 %). Lo anterior es importante, al considerar que los hongos requieren fuente de carbono y de nitrógeno para su crecimiento y desarrollo, los cuales son aportados como suplemento al medio de cultivo PDA, además de la fuente de energía libre disponible para la realización de los procesos metabólicos de estos hongos.
El crecimiento radial de las cepas de M. robertsii y B. bassiana durante 15 días fue mayor en el medio suplementado con H. virescens y S. frugiperda, y estos fueron superiores a lo reportado por García-Gutiérrez et al. (2020) con los dos hongos (2,46 y 2,63 mm/día) respectivamente, inducido con cutícula de S. frugiperda, mientras que Vejar-Cota et al. (2017) reportaron crecimiento de 2,05-2,62 mm/d con B. bassiana en medio PDA y con M. robertsii 2,70-3,03 mm/d. Las diferencias en el crecimiento de estos hongos se deben a la adición de nutrientes del suplemento en las concentraciones aplicadas.
La patogenicidad de M. robertsii en medio suplementado con S. frugiperda alcanzó 91,6 % de mortalidad de larvas. En otros estudios donde el hongo se aisló de cadáveres de este insecto, la mortalidad máxima fue 88 % (Ullah et al. 2022) en larvas de S. frigiperda y del 100 % en huevos y larvas neonatas del mismo insecto con M. robertsii (Cruz-Avalos et al. 2019). Por otro lado, se reportó patogenicidad de B. bassiana con eficiencia del 96,6 % (García-Gutiérrez et al. 2011). Otros estudios consignan patogenicidad de M. robertsii y B. bassiana del 33 %-100 % (Gutiérrez-Cárdenas et al. 2019).
Los resultados sugieren que M. robertsii alcanzó una mayor patogenicidad en larvas de S. frugiperda, debido a que el hongo se cultivó en medio suplementado con polvo del insecto diana. Lo anterior coincide con lo reportado por González-García et al. (2001) quienes observaron una mayor mortalidad de Hypothenemus hampei (Ferrari, 1867) (Coleoptera: Curculionidae) por acción de B. bassiana después de cultivarlo en medio con integumento del insecto hospedero. Se sugiere también que los componentes del polvo favorecieron la producción de enzimas que el hongo necesita para infectar al insecto, lo cual coincide con Gato-Cárdenas et al. (2017) quienes relacionan la rápida mortalidad con altos niveles de enzimas. En relación con la virulencia de M. robertsii, se sabe que está asociada a la actividad de enzimas extracelulares como quitinasa, lipasa y proteasa (Gebremariam et al. 2022), a su vez relacionada a los genes mad1, mad2 y gmact presentes en M. robertsii (Cruz-Avalos et al. 2019). De esta forma, la virulencia y efectividad de M. robertsii en el control de S. frugiperda es evidenciada, por lo que este hongo y B. bassiana pueden ser usados como alternativa a los insecticidas químicos tradicionales (Montecalvo et al. 2021).
Conclusiones
Los resultados demostraron que los medios de cultivo suplementados con polvo de pupas de los insectos S. frugiperda y H. virescens, inducen el crecimiento de los hongos entomopatógenos B. bassiana y M. robertsii. También se incrementó la patogenicidad de M robertsii sobre larvas de S. frugiperda. El uso del suplemento a base de estos insectos podría mejorar la producción masiva de hongos entomopatógenos en laboratorio.
















