Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Latinoamericana de Psicología
versão impressa ISSN 0120-0534
rev.latinoam.psicol. v.42 n.2 Bogotá maio/ago. 2010
Estrés neonatal y frustración
Neonatal stress and frustration
Eliana Ruetti
Nadia Justel
Alba Mustaca
Laboratorio de Psicología Experimental y Aplicada (PSEA). Instituto de Investigaciones Médicas (IDIM) CONICET-UBA
Mariana Torrecilla
Adriana Gonzalez Jatúff
Instituto de Biología y Medicina Experimental (IMBECU) - CONICETUniversidad Nacional de Cuyo
Reconocimiento: Este trabajo fue parcialmente financiado por CONICET, por la Agencia de Promoción Científica y Tecnológica, PICT 25.335, UBACYT, 2008-2010, PS002 y por CECYTME, UNCuyo 2005.
A María del Carmen Torres Bares y a Mauricio Papini por sus valiosos comentarios.
Correspondencia: sobre el artículo se puede enviar a A. E. Mustaca, IDIM "A. Lanari"-Psicología Experimental y Aplicada, Combatientes de Malvinas 3150 (1426) Buenos Aires, Argentina (albamustaca@gmail.com).
Recibido: 30 de Julio de 2009 Aceptado: 29 de Abril de 2010
Resumen
El estrés neonatal altera la respuesta emocional de ratas adultas. En una de sus formas, el estrés crónico neonatal aleatorio, produce una reducción comportamental, neurofisiológica y hormonal en respuesta a presentaciones de estímulos aversivos. La devaluación u omisión de los reforzadores esperados por aprendizajes previos provoca respuestas similares al dolor, al miedo y a la ansiedad, y esta reacción se denomina frustración. En este trabajo se presentan dos experimentos en los cuales las ratas sometidas a un estrés neonatal aleatorio y sus controles sin tratamiento se expusieron a dos procedimientos experimentales de frustración: el contraste sucesivo negativo consumatorio (CSNc, Experimento1) y la extinción consumatoria (Ec, Experimento 2). En el CSNc, la respuesta del tiempo de bebedero de animales que pasan de recibir una solución azucarada del 32% al 4%, se compara con el desempeño de animales que siempre recibieron solución al 4%. En la Ec, los animales reciben durante la adquisición la solución al 4% y luego se les presenta el bebedero vacío. Los resultados obtenidos señalan que en el CSNc los animales expuestos a estrés neonatal presentaron una respuesta atenuada de frustración y en la Ec, una extinción más acelerada, en relación con sus controles sin tratamiento neonatal. Estos hallazgos extienden los efectos del estrés neonatal hacia respuestas provocadas por situaciones de pérdida o decremento de incentivos.
Palabras clave: frustración, estrés neonatal, Contraste Sucesivo Negativo Consumatorio, Extinción Consumatoria, ratas.
Abstract
Emotional neonatal stress alters the emotional response in adult rats. In one of its forms, the chronic random neonatal stress, produces behavioral, neurophysiological and hormonal reductions, in response to aversive stimuli. Devaluation or omission of expected reinforcers for acquired skills provokes responses similar to pain, fear and anxiety and this reaction is known as frustration. In this paper we will present, two different experiments in which, both, rats that were subjected to random neonatal stress and the no-treatment condition, were exposed to two procedures of experimental frustration: the consummatory negative successive contrast (CSNc, experiment 1) and the consummatory extinction (EC, experiment 2). In the CSNc, the response time to drinking a glucose solution of 32% to 4%, compares to the performance of animals that always received a 4% solution. In the EC, the animals received the 4% solution during acquisition and were presented with the empty water source.
The obtained results show that in CSNc, the animals exposed to neonatal stress presented an adecuate response to frustration and in the EC, an accelerated extinction, in relation to controls without neonatal treatment. These findings extend the effects of neonatal stress to provoked responses to situations of loss or decrease of incentives.
Key words: frustration, neonatal chronic stress, Consummatory Successive Negative contrast, consummatory Extinction, rats.
La exposición al estrés durante la infancia puede producir en la adultez mayor o menor vulnerabilidad ante situaciones que involucran la presentación de estímulos aversivos o la anticipación de ellos. Por ejemplo, la separación diaria de las crías de sus madres durante periodos prolongados (i.e. 180 min.) provoca una mayor respuesta del eje hipotalámico-pituitario-adrenal (HPA), mayores respuestas comportamentales y alteraciones cognoscitivas ante estresores que animales no expuestos a esa situación en la infancia (e.g. Aisa, Tordera, Lasheras, Del Río & Ramírez, 2008). En oposición a esos resultados, otros estudios muestran que las ratas infantes separadas por breves períodos de sus camadas y manipuladas durante varios días o expuestas a estímulos aversivos moderados y aleatorios, son emocionalmente menos reactivas cuando son adultas (Toth, Avital, Leshem, Richter-Levin & Braun, 2008). En comparación con animales sin tratamiento, las ratas manipuladas en la infancia presentan más ambulación y menos defecación en una prueba de campo abierto; menos activación del eje HPA; más respuestas de exploración ante un estímulo novedoso, y menor miedo condicionado en un condicionamiento de aversión gustativa (e.g., Ader, 1970; Denenberg & Grotta, 1964; Levine, 1956). Otros estudios que incluyen manipulaciones repetidas, exposición al frío y al estrés aleatorio parecen ser aún más efectivos en inducir una respuesta comportamental y hormonal reducida frente a estímulos aversivos cuando los animales son adultos (González, Rodríguez, Cabrera & Fóscolo, 1994).
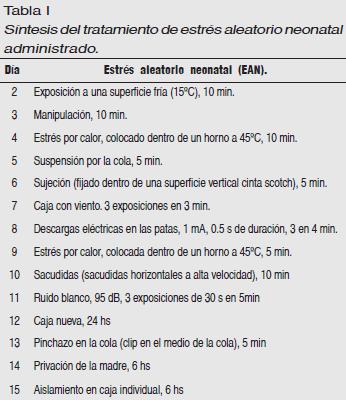
El estrés aleatorio neonatal (EAN, Tabla 1) consiste en estimulaciones impredecibles y repetitivas de las crías durante los primeros días de vida (González, Rodríguez, Cabrera & Fóscolo, 1990). Estos autores compararon el estrés aleatorio neonatal, la manipulación de las crías durante los días 2 a 15, y los controles no estresados en varias respuestas emocionales en su vida adulta. Los resultados de este trabajo sugieren que el EAN produce mayor estabilidad emocional en la vida adulta que la manipulación sola y que la ausencia de tratamiento neonatal. Por ejemplo, el EAN atenuó el aumento de prolactina y de corticosterona, y mejoró el déficit en el desempeño en una prueba de natación forzada después que los animales estuvieron expuestos al frío o a descargas eléctricas impredecibles e incontrolables durante dos semanas, comparados con sujetos que sólo fueron manipulados y controles no tratados. Además, la manipulación neonatal fue menos efectiva que el EAN en reducir el déficit comportamental observado en la prueba de natación forzada, y menos eficaz en evitar las alteraciones que provocaron las descargas eléctricas impredecibles en el ciclo estral de las ratas hembras (González, Rodríguez, Cabrera & Fóscolo, 1991).
Existen pocas investigaciones acerca del efecto del estrés neonatal sobre la respuesta de frustración, que en este contexto se define como un estado provocado cuando se disminuye u omite un reforzador apetitivo en presencia de una expectativa de obtener reforzadores de mayor magnitud (e.g. Amsel, 1958, 1992; Papini & Dudley, 1997). Existen muchas líneas de investigación que apoyan la hipótesis que la frustración tiene propiedades similares al miedo (Amsel, 1958; Gray, 1987; Konorsky, 1964), y que puede usarse como un modelo animal de ansiedad (Rosas, Callejas-Aguilera, Escarabajal, Gómez, Torre, Agüero & Torres, 2007). Por ejemplo, los niveles plasmáticos de corticosterona aumentan en diferentes situaciones de devaluación del incentivo (Davis, Memmott, MacFadden & Levine, 1976). Por otra parte, en procedimientos de contraste sucesivo negativo consumatorio (CSNc), en cual se devalúa el reforzador del 32% de solución azucarada al 4% ó al 2% de la misma solución, se encontraron alteraciones inmunológicas (Mustaca, 1999), correlaciones entre la percepción del dolor físico y la intensidad de la respuesta de frustración (Mustaca & Papini, 2005) y diferencias en la reacción de frustración luego de la administración de agonistas o antagonistas del sistema opioide (Wood, Norris, Daniel & Papini, 2008). Estos últimos resultados sugieren que la frustración también puede tener componentes neurofisiológicos semejantes al dolor físico, constituyéndose en un posible modelo animal de dolor psicológico (Mustaca, Bentosela, Pellegrini, Ruetti, Kameninsky & Cuello, 2005).
Dado que la frustración provoca estados semejantes a la presentación de estímulos aversivos, se puede hipotetizar que la experiencia neonatal de los animales podría modular la reacción emocional desencadenada por la devaluación o pérdida de una recompensa apetitiva esperada. Se realizaron pocos estudios para evaluar esta posibilidad, pero todos ellos evidenciaron resultados negativos. Meinrath y Flaherty (1987) encontraron que la manipulación de las crías de ratas no tuvo efecto sobre la frustración en un procedimiento de CSNc, aunque Daly y Rosenberg (1973) obtuvieron los mismos resultados cuando se devaluó la cantidad del reforzador obtenido en la caja meta de un corredor recto, utilizando un procedimiento de contraste sucesivo negativo instrumental (CSNi). Los resultados de los trabajos descritos sugerirían que el tipo de tratamiento neonatal utilizado no fue suficiente para alterar las respuestas de los sujetos ante la devaluación de los reforzadores.
Los siguientes experimentos se diseñaron para evaluar si el EAN regula la respuesta ante el estrés provocado por la devaluación u omisión de un reforzador apetitivo en ratas adultas. Para ello, se analizó el tiempo contacto con el bebedero de los animales que recibieron EAN, en procedimiento de CSNc (Experimento 1) y de extinción consumatoria (Ec, Experimento 2), en el cual se omitió completamente el reforzador.
Experimento 1
En el CSNc un grupo de animales recibe una solución azucarada al 32% en 10 sesiones de 5 minutos cada una (fase de precambio), y luego se le presenta una solución al 4% durante 5 sesiones (fase de postcambio). En esta segunda fase, el consumo de la solución al 4% es significativamente menor que el de aquellos animales que en ambas fases recibieron la solución al 4% (efecto de CSNc o efecto de frustración). La respuesta de estos animales gradualmente alcanza los niveles de consumo del grupo control entre la tercera y la quinta sesión posterior al cambio del reforzador. En el CSNc se hallaron resultados que evidencian la existencia de estados emocionales de ansiedad. Por ejemplo, la administración de drogas ansiolíticas como las benzodiacepinas y el acceso a hembras receptivas antes de la devaluación del refuerzo, reduce la respuesta de frustración (Gray, 1977, 1982; Flaherty, Becker & Pohorecky, 1985; Freidin, Kamenetzky & Mustaca, 2005; Mustaca, Bentosela & Papini, 2000). Además, se hallaron alteraciones en las respuestas agonísticas (Mustaca & Martínez, 2000), y la administración de corticosterona después de la devaluación del reforzador, aumentó la memoria de la frustración (Bentosela, Ruetti, Muzio, Mustaca & Papini, 2006).
De acuerdo con estos antecedentes, se espera que los animales con EAN exhiban una menor reacción ante la devaluación del reforzador en el CSNc (recuperación más rápida).
Método
Sujetos. Se utilizaron ratas hembras (cepa derivada Holtzman) de 5 meses de edad del Instituto de Medicina y Biología Experimental de Cuyo (IMBECU, CONICET - Univesidad de Cuyo, Mendoza). Se colocaron en grupos de 4 hembras y un macho en una jaula-hogar de metal (40 x 27 x 20 cm), y se mantuvieron en una sala a temperatura constante (22 °C) con un ciclo de luz-oscuridad de 12 h (luz desde las 7 h). Los animales se alimentaron con pellets (Cargill) y agua ad libitum. La preñez de las hembras se evaluó por la presencia de espermatozoides en el flujo vaginal. Uno o dos días antes del parto, las ratas hembras se colocaron en jaulas individuales. El nacimiento de las crías se consideró como día 0. A los dos días de edad, las crías se asignaron aleatoriamente a los grupos y se alojaron de manera grupal en función del tratamiento neonatal que iban a recibir:
- Grupo EAN: Las ratas de este grupo se expusieron diariamente (del día 2 al 15) a estresores físicos aleatorios de intensidad media de acuerdo al protocolo de González y otros (1990, 1999). Este procedimiento se encuentra sintetizado en la Tabla 1.
- Grupo C: Los animales de este grupo control no recibieron tratamiento y no fueron perturbados, excepto para la limpieza y la provisión de agua y comida diaria.
A los dos meses de edad, las ratas macho de ambos grupos (n = 28) se trasladaron vía aérea del laboratorio de origen al Bioterio del Instituto de Investigaciones Médicas A. Lanari, Universidad de Buenos Aires, para realizar los experimentos que se presentan en este trabajo. Los animales estuvieron alojados en grupos y separados en función del tratamiento neonatal recibido, en jaulas-hogar de aluminio (45 x 31 x 22 cm). A los 3 meses de edad, se transfirieron a jaulas individuales (27.5 x 25 x 22 cm) con libre acceso a agua y alimento. El peso promedio ad libitum del grupo EAN fue de 383 g (rango: 347-450 gr), y del grupo C, de 366 g (rango: 275-453 gr). Un Análisis de Varianza no arrojó diferencias significativas en el peso de los dos grupos de animales, F (1, 26) = 1.02, n.s. Se fue disminuyendo gradualmente la cantidad diaria de alimento que recibía cada animal, hasta que llegaron al 85% de su peso ad libitum. Durante los experimentos, las ratas se alimentaron diariamente después de al menos 20 minutos de finalizado el entrenamiento. Los animales estuvieron expuestos a un ciclo diario de luz/oscuridad de 12 h (luz desde las 7 h). El entrenamiento se realizó entre las 10 y 15 h. La sala en la que se encontraban los animales y el cuarto experimental se mantuvo a temperatura (22 °C) y humedad (60-70% HR) constantes a lo largo de los experimentos.
Todos los procedimientos experimentales fueron aprobados por el Comité de Ética de la Universidad de Cuyo, Mendoza, y de la Universidad de Buenos Aires.
Aparatos. Para el entrenamiento se utilizaron 4 cajas de condicionamiento MED Associates, de 30 cm de frente, 24 cm de profundidad y 24 cm de alto de piso a techo, cuyas medidas eran 21 cm de alto del techo a la rejilla de barras de aluminio de 0.4 cm de diámetro, separadas unas de otras por un espacio de 1.1 cm. Sobre una pared lateral, se encuentra un hueco de 5 cm de ancho, 5 cm de alto y 3.5 cm de profundidad, ubicado 1 cm por encima del piso de barras. El bebedero se insertaba en el orificio desde fuera de la caja, y los sujetos debían introducir su cabeza en el hueco para consumir el reforzador. Al alcanzar el bebedero, los animales interrumpían un haz de luz de un par de celdas fotoeléctricas. El software de la computadora permitió registrar el tiempo que los animales permanecían en contacto con el bebedero (medido en unidades de 0.01 s). La duración máxima de cada ensayo fue de 5 minutos. Investigaciones previas mostraron correlaciones positivas significativas entre el tiempo de contacto con el bebedero y la cantidad de solución azucarada consumida bajo las mismas condiciones que las utilizadas en este experimento (Mustaca, Freidin & Papini, 2002). Como reforzadores, se utilizaron soluciones azucaradas al 32% y al 4% (p/v), preparadas con azúcar comercial diluida en agua a temperatura ambiente. Las soluciones azucaradas al 32% y al 4%, se prepararon disolviendo 320 g y 40 gr de azúcar en 1 l de agua, respectivamente.
Procedimiento
Los animales EAN y C se aparearon en función del peso y cada miembro del par se asignó al azar a uno de los grupos siguientes: EAN/32 (n = 6); EAN/4 (n = 6); C/32 (n = 8) y C/4 (n = 8); que variaban en el tratamiento neonatal que habían recibido y en la magnitud del reforzador al que tenían acceso durante los ensayos 1 a 10 de la fase de precambio (solución azucarada al 32% ó al 4%). Durante la fase de postcambio (ensayos 11 al 17), todos los animales tuvieron acceso a la solución al 4%. Se realizó un ensayo diario de 5 minutos, medido desde la primera interrupción de la fotocelda. Un día antes de comenzar el entrenamiento, las ratas tuvieron acceso en sus jaulas-vivienda a la solución azucarada que recibirían en la fase de precambio (32% ó 4%) durante 40 minutos. Esta exposición al reforzador se realizó para evitar el desarrollo de neofobia durante los primeros ensayos de la fase de precambio. Los animales se entrenaron en grupos de 4. El orden del entrenamiento de esos grupos fue aleatorio durante los días, pero siempre se entrenaban juntos cada grupo de 4 animales. Después de cada ensayo, las cajas de condicionamiento se limpiaban con una toalla húmeda.
Se utilizó un análisis de varianza (ANOVA) para evaluar los resultados del tiempo de contacto con el bebedero (s), y se realizaron comparaciones múltiples a posteriori con la prueba LSD de Fisher cuando se encontraron efectos significativos en los factores principales o de interacción. El valor de alfa se estableció en p < 0.05.
Resultados y discusión
La Figura 1 (derecha e izquierda) muestra el promedio de tiempo de contacto con el bebedero de todos los grupos a lo largo de los ensayos del entrenamiento.
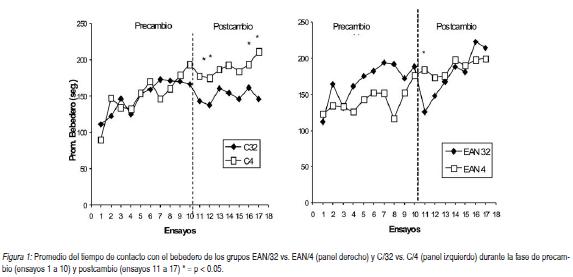
En esta figura se puede observar que, durante la fase de precambio, todos los grupos aumentaron el tiempo de contacto con el bebedero a lo largo de los ensayos, y esa tendencia fue mayor en los grupos que recibieron la solución azucarada al 32% que en los que recibieron la solución al 4%. Se realizó un ANOVA mixto de dos factores independientes: Contraste (32%, 4%) x Tratamiento (EAN, C) x un factor intrasujeto: Ensayo (1 a 10). Se encontraron efectos significativos en el factor Ensayo, F (9, 207) = 16.21, p < 0.0001; en la interacción Contraste x Ensayo, F (9,207) = 2.11, p < 0.03, y en la triple interacción Contraste x Tratamiento x Ensayo, F (9,207) = 1.96, p < 0.04. Para evaluar la fuente de la significación de las interacciones se realizó ANOVA para cada ensayo, lo cual mostró efectos significativos en los ensayos 7 y 8. Las comparaciones de pares con la prueba LSD de Fisher indicaron que, durante ambos ensayos, el grupo C/32 presentó un mayor tiempo de contacto con el bebedero que el grupo EAN/4 (p < 0.02). Además, en el ensayo 8, el grupo EAN/32 tuvo un mayor tiempo de contacto con el bebedero que el grupo C/4 (p < 0.004). Ningún otro efecto alcanzó significación estadística.
En conjunto, los resultados de la fase de precambio indican que los sujetos aumentaron gradualmente su respuesta de acercamiento al bebedero y aprendieron a ser más eficientes para consumir el incentivo, y que en algunos ensayos los grupos 32 consumieron más solución azucarada que los grupos 4, lo que evidencia una preferencia por el reforzador de mayor magnitud.
La Figura 1 también muestra los resultados de los 7 ensayos de la fase de postcambio. Se observa una disminución abrupta del tiempo de contacto con el bebedero de los grupos que recibieron la devaluación del reforzador, EAN/32 y C/32. Sin embargo, también puede observarse una recuperación más rápida del contraste en los animales del grupo EAN/32 que en los del grupo C/32, a pesar de que la curva de recuperación de este último grupo es distinta a la que se observa con mayor frecuencia en la literatura. Los análisis estadísticos confirman estas observaciones. Un ANOVA mixto de Contraste x Tratamiento x Ensayo (11 a 17), mostró efectos significativos de Contraste, F (1, 23) = 7.03, p < 0.01; de Ensayo, F (6,138) = 9.02, p < 0.01; de Tratamiento x Ensayo, F (6,138) = 2.32, p < 0.04 y de la triple interacción Contraste x Tratamiento x Ensayo, F (6,138) = 2.82, p < 0.0001. Para establecer la fuente de las interacciones significativas, se realizó ANOVA para cada ensayo. Los ensayos 11, 12, 15, 16 y 17 arrojaron diferencias significativas (p < 0.001). Los principales resultados significativos de los test de comparación de pares con la prueba LSD de Fisher de cada ensayo, fueron los siguientes. Ensayo 11: C/32 vs. C/4, EAN/32 vs. EAN/4; p < 0.001. Ensayo 12: las diferencias se hallaron solamente entre C/32 vs. C/4; p < 0.03. Ensayo 15: C/32 vs. C/4, EAN/32 vs. C/32; p < 0.02. Ensayo 16: EAN/32 vs. C/32; p < 0.002. Ensayo 17: EAN/32 vs. C/32, C/32 vs. C/4; p < 0.02.
En resumen, los resultados obtenidos en este experimento indican que los animales del grupo que tuvieron un tratamiento con estrés neonatal aleatorio se recuperaron más rápidamente luego de la devaluación del reforzador, en comparación con los animales que no recibieron tratamiento. Específicamente, respecto de sus grupos controles, el grupo EAN/32 exhibió un efecto de contraste solamente durante el primer ensayo de la fase de postcambio (ensayo 11), mientras que el C/32 mostró el mismo efecto durante 4 ensayos (ensayos 11,12, 15 y 17). Además, también se hallaron diferencias entre EAN/32 y C/32 durante tres ensayos (15,16 y 17). La ausencia de diferencias significativas entre los grupos que recibieron la solución azucarada al 4%, a excepción del ensayo 17, fortalece la idea que las diferencias entre los animales EAN y los controles se deben al tratamiento neonatal utilizado y a un estado emocional más atenuado en las ratas que recibieron el estrés neonatal.
Experimento 2
En la extinción apetitiva se eliminó completamente el reforzador, situación que provoca frustración y respuestas emocionales semejantes al miedo y a la ansiedad. La extinción instrumental está asociada a un aumento de los niveles plasmáticos de corticosterona y de la hormona adrenocorticotrópica (Davis & otros, 1976; Lyons, Fong, Schrieken & Levine, 2000), mientras que la administración de corticosterona facilita la extinción instrumental (Tomie, Tirado, Yu & Pohorecky, 2004) y consumatoria (Ruetti, Justel, Mustaca & Papini, 2008). Aunque no hay información acerca del aumento plasmático de corticosterona en la Ec, estos niveles se encuentran elevados en una situación de CSNc, como se mencionó anteriormente (Flaherty & otros, 1985; Mitchell & Flaherty, 1998). La Ec, al igual que el CSNc, provoca una reducción del comportamiento agresivo de las rata macho (Mustaca, Martínez & Papini, 2000; Mustaca & Martínez, 2000). Por otro lado, las benzodiacepinas (diazepan, chlordiazepoxido y lorazepan) atenúan la Ec (Bialik, Pappas & Pusztay, 1982; Flaherty, 1990; Soubrie, Thiebot, Simon & Boissier, 1978), pero también se hallaron efectos opuestos (Miczek & Lau, 1975). Por otra parte, Kamenetzky, Mustaca y Papini (en consideración) encontraron que inyecciones previas de etanol, un agente con propiedades ansiolíticas, aceleraban la Ec, y Mustaca y cols., (en prensa) encontraron el mismo resultado utilizando diacepan, una droga ansiolítica. En conjunto, estos resultados sugieren, en primer lugar, que el CSNc y la Ec comparten mecanismos neurofisiológicos análogos, y en segundo lugar, que los efectos de los ansiolíticos en la Ec producen resultados contradictorios (Flaherty, 1990, Mustaca y cols., en prensa).
El objetivo del experimento fue evaluar a los animales con EAN en un procedimiento de Ec. Si los animales con EAN tienen una menor respuesta de ansiedad ante situaciones aversivas, esperamos que ante una Ec tengan una respuesta diferencial respecto de animales no perturbados, aunque, por lo comentado anteriormente, no podemos predecir si de aceleración o de persistencia de la extinción.
Método
Sujetos, aparatos y procedimiento. Se entrenaron 5 sujetos con EAN y 8 controles sin tratamiento, los mismos utilizados como EAN/4 y C/4 en el experimento anterior, debido a que no habían tenido experiencia previa en situaciones de frustración. Las condiciones de mantenimiento y las cajas utilizadas fueron las mismas que en el experimento 1.
Después de 7 días de terminado el experimento anterior, los sujetos seleccionados recibieron 5 ensayos de acceso diario a una solución azucarada al 4% de (adquisición) y 5 ensayos en los que se les presentó el bebedero vacío (extinción). Los demás aspectos del procedimiento fueron iguales al del experimento 1.
Resultados y discusión
La Figura 2 muestra el promedio de tiempo de contacto con el bebedero de los grupos EAN y C en las fases de adquisición y de extinción.
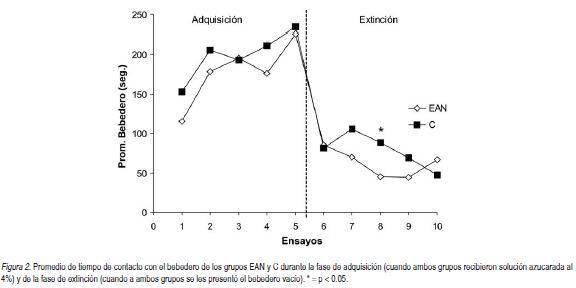
En la figura se observa que el tiempo de contacto con el bebedero aumenta gradualmente durante la adquisición y tiene una caída abrupta en la fase de extinción, pero las ratas que recibieron el tratamiento neonatal exhibieron una caída más intensa que los controles sin tratamiento. Un ANOVA de la fase de adquisición arrojó los siguientes resultados. Se encontró un efecto significativo de Ensayo, F(4, 44) = 15.07, p < 0.0001, pero no se hallaron diferencias significativas entre los grupos EAN y C, ni en la interacción Tratamiento x Ensayo (ps > 0.05).
Durante la fase de extinción, un ANOVA mostró efectos significativos en el factor Ensayo, F (4, 44) = 5.12, p < 0.002, y en la interacción Ensayo x Tratamiento, F (4, 44) = 5.18, p < 0.002. Para determinar el origen de la interacción significativa se realizó un ANOVA para cada ensayo. Sólo el ensayo 8 mostró que el grupo EAN tenía una disminución significativa del tiempo de contacto con el bebedero en comparación con el grupo C, F (1, 11) = 8.26, p < 0.02. En resumen, los animales del grupo EAN tuvieron una tendencia a una extinción más rápida en todos los ensayos de extinción que los animales del grupo C, aunque la significación aparece en un solo ensayo.
Discusión ganeral
Los experimentos presentados muestran, por primera vez, diferencias en la respuesta de los animales expuestos a estrés neonatal sometidos a dos modelos de frustración en la adultez. Específicamente, en el CSNc, las ratas con EAN exhibieron una disminución del consumo de la solución devaluada del 32% al 4% solamente durante el primer ensayo de la fase de postcambio, en comparación con 4 ensayos del grupo sin tratamiento neonatal y una Ec acelerada, respecto de sus controles. Los resultados previos mostraron ausencia de diferencias en un CSNc y en un CSNi cuando el tratamiento neonatal consistió en la manipulación de crías (ver Introducción). Estos hallazgos sugieren que, para obtener un efecto del tratamiento neonatal en procedimientos de frustración, es necesario emplear una intervención de estrés neonatal más intenso, como el EAN.
Es interesante notar que en el Experimento 1 los animales del grupo EAN/32 y C/32 exhibieron una reacción idéntica durante la primera exposición a la devaluación del reforzador, para diferenciarse a partir del segundo ensayo de postcambio. Este dato es semejante a los efectos de los ansiolíticos en el CSNc. Tanto las drogas ansiolíticas, como las benzodiacepinas y el etanol, así como la eyaculación previa de ratas macho, tienen efecto sobre el CSNc si se presentan antes del segundo ensayo de postcambio, pero no si se aplican antes del primero (Flaherty, Becker & Pohorecky, 1985; Freidin & otros, 2005; Mustaca & otros, 2000). Por otro lado, Flaherty y otros (1985) y Mitchell y Flaherty (1998) mostraron que los niveles plasmáticos de corticosterona aumentaban antes y después del segundo ensayo de postcambio, pero no después del primero. Estos resultados son coherentes con las respuestas fisiológicas y hormonales obtenidas por Gónzalez y otros (1990) con el mismo tratamiento neonatal. Estos autores encontraron que el EAN provoca en los animales adultos una respuesta fisiológica de estrés disminuida, por ejemplo, niveles menores de corticosterona y descenso de esta hormona a los niveles basales después de la exposición a estímulos aversivos, en comparación con animales controles no tratados. Se puede conjeturar entonces que la recuperación rápida de las ratas EAN/32 en el experimento presentado se deba al desarrollo de una menor activación del eje HPA, tal cual ocurre con ratas tratadas con ansiolíticos en el CSNc. Los estudios futuros deberán dar cuenta de esta predicción midiendo los niveles plasmáticos de corticosterona en los animales EAN durante el CSNc.
Por otra parte, los animales del grupo C/32 exhibieron una conducta poco frecuente en estos diseños, ya que mostraron un efecto de contraste durante los dos primeros y los dos últimos ensayos de la fase de postcambio. En nuestro laboratorio tuvimos algunos resultados análogos con ratas Wistar, por lo cual no es probable que este efecto sea debido a la cepa utilizada en este experimento.
Los resultados de la Ec concuerdan con los obtenidos en nuestro laboratorio con ratas Wistar que recibieron drogas y agentes ansiolíticos, como el etanol (Kamenetzky & otros, en consideración) y diacepan (Mustaca y cols., en prensa) y son opuestos a lo que predice la teoría de la frustración y de la persistencia de Amsel (1958, 1992). Ella sugiere que los animales menos emocionales tendrían que mostrar mayor persistencia en paradigmas de extinción, ya que adquirirían un menor conflicto ante una situación aversiva, en este caso, ante la presencia de un bebedero vacío que contendría solución azucarada. Una posible explicación de estos resultados es que la teoría de Amsel se formuló para las respuestas anticipatorias, y no para las consumatorias. De hecho, en la Ec, a diferencia de la extinción instrumental, las ratas muestran efectos invertidos en un programa de reforzamiento parcial, de magnitud del reforzamiento y de sobreaprendizaje en la Ec. Esto significa que los animales en una Ec extinguen más rápido su acercamiento al bebedero en un programa de reforzamiento parcial comparado con uno continuo, cuando reciben 32% de solución azucarada comparada con 2% (Mustaca & otros, 2002), y después de 36 ensayos de adquisición comparado con 108 (Freidin, Trejo & Mustaca, 2005). Estos resultados son consistentes con otras evidencias que sugieren que las conductas consumatorias e instrumentales, que ocurren en situaciones que involucran devaluaciones u omisiones sorpresivas del incentivo, están regidas por principios diferentes (Norris, Daniel & Papini, 2008). La baja persistencia de las ratas con EAN en la Ec podría ser otro ejemplo de divergencia entre respuestas instrumentales y consumatorias.
Debido a que el estrés neonatal produce resultados opuestos según el tipo de tratamiento empleado, los resultados de estos experimentos alientan a probar otras clases de tratamientos neonatales y sus efectos sobre la frustración. En este caso, el tratamiento de EAN probó ser efectivo para estimular el desarrollo de respuestas fisiológicas, hormonales, neuroquímicas y comportamentales atenuadas ante estímulos aversivos. Los hallazgos que se presentan en este trabajo extienden el efecto a manipulaciones que no implican estrés causado por presentación de estímulos físicos sino psicológicos, como la disminución o pérdida de incentivos. En todos los casos, el EAN usado en estos experimentos sugiere que produce un ajuste más rápido a los cambios negativos del medio ambiente.
Finalmente, dado que los humanos están expuestos a situaciones de pérdida que no implican dolor físico, es necesario explorar qué factores pueden provocar una mayor resistencia y un mejor ajuste a ellos. Detectar cuáles son los factores protectores de los efectos ansiogénicos de la frustración contribuirá a establecer, con más precisión, acciones preventivas y de tratamiento en casos de baja tolerancia a la frustración o alta vulnerabilidad emocional.
Referencias
Ader, R. (1970). The effect of early experience on the adrenalcortical response to different magnitudes of stimulation. Physiology & Behavior, 5, 837-859. [ Links ]
Aisa, B., Tordera, R., Lasheras, B., del Río, J. & Ramírez, M. J. (2008). Effects of maternal separation on hypothalamic-pituitary-adrenal responses, cognition and vulnerability to stress in adult female rats. Neuroscience, 154, 1218-1226. [ Links ]
Amsel, A. (1958). The role of frustative nonreward in noncontinuous reward situations. Psychological Bulletin, 55, 102-119. [ Links ]
Amsel, A. (1992). Frustration theory: An analysis of dispositional learning and memory. New York: Cambridge University Press. [ Links ]
Bentosela, M., Ruetti, E., Muzio, R. N., Mustaca, A. E. & Papini, M. R. (2006). Administration of corticosterone after the first downshift trial enhances consummatory successive negative contrast. Behavioral Neuroscience, 120 (2), 371-376. [ Links ]
Bialik, R. J., Pappas, B. A. & Pusztay, W. (1982). Chlordiazepoxide-induced released responding in extinction and punishment-conflict procedures is not altered by neonatal forebrain norepinephrine depletion. Pharmacology, Biochemistry & Behavior, 16, 279-283. [ Links ]
Daly, H. B. & Rosenberg, K. M. (1973). Infantile stimulation and its effects on frustration and fear-motivated behavior in rats. Learning & Motivation, 4, 381- 396. [ Links ]
Davis, H., Memmott, J., MacFadden, L. & Levine, S. (1976). Pituitary-adrenal activity under different appetitive extinction procedures. Physiological Behavior, 17, 687-690. [ Links ]
Denenberg, V. H. & Grotta, L. J. (1964). Social-seeking and novelty - seeking behavior as function of differential rearing histories. Journal of Abnormal and Social Psychology, 69, 453-456. [ Links ]
Flaherty, C. F. (1990). Effect of anxiolytics and antidepressants on extinction and negative contrast. Pharmacology & Therapeutics, 46, 309-320. [ Links ]
Flaherty, C. F., Becker, H. C. & Pohorecky, L. (1985). Correlation of corticosterone elevation and negative contrast varies as a function of postshift day. Animal Learning & Behavior, 13, 309-314. [ Links ]
Freidin, E., Kamenetzky, G. & Mustaca, A. E. (2005). Anxiolytic-like effect of ejaculation upon frustration. Learning and Behavior, 33 (3), 277-286. [ Links ]
Freidin, E., Trejo, M. E. & Mustaca, A. E. (2005). Efecto del sobre aprendizaje en la extinción y restablecimiento de la respuesta consumatoria. Revista Latinoamericana de Psicología, 37, 167-180. [ Links ]
González Jatuff, A. S., Rodríguez Echandía, R., Cabrera, R. & Fóscolo, R. (1990). Neonatal chronic stress induces subsensitivity to chronic stress in adult rats: I. Effects on forced swim behavior and endocrine responses. Physiology & Behavior, 47, 735-741. [ Links ]
González Jatuff, A. S., Rodríguez Echandía, R., Cabrera, R. & Fóscolo, R. (1991). Neonatal chronic stress induces subsensitivity to chronic stress in adult rats: II. Effects on estrous cycle in females. Physiology & Behavior, 56 (3), 591-595. [ Links ]
González Jatuff, A. S., Rodríguez Echandía, R., Cabrera, R. & Fóscolo, R. (1994). Neonatal chronic stress induces subsensitivity to chronic stress in adult rats: II. Effects on estrous cycle in females. Physiology & Behavior, 56 (3), 591-595. [ Links ]
González Jatuff, A. S., Berástegui, M, Rodríguez, C. I. & Rodríguez Echandía, E. L. (1999). Permanent and transient effects of repeated preweaning stress on social and sexual behaviors of rats. Stress (Hardwood Academic Publishers, U.S.A.), 3 (2), 97-106. [ Links ] [ Links ]
Gray, J. A. (1982). The neuropsychology of anxiety: an enquiry into the function of the Septo-Hippocampal System. Oxford: Oxford University Press. [ Links ]
Gray, J. A. (1987). The psychology of fear and stress. Cambridge University Press. [ Links ]
Kamenetzky, G. V., Mustaca, A. E. & Papini, M. R. (2008). An Analysis of the Anxiolytic Effects of Ethanol on Consummatory Successive Negative Contrast. Avances en Psicología Latinoamericana, 26 (2), 135-144. [ Links ]
Konorsky, J. (1964). Integrative activity of the brain. Chicago: University of Chicago Press. Levine, E. (1956). A further study of infantile handling and adult avoidance learning. Journal of Personality, 25, 70-80. [ Links ]
Lyons, D. M., Fong, K. D., Schrieken, N. & Levine, S. (2000). Frustrative nonreward and pituitary-adrenal activity in squirrel monkeys. Physiology & Behavior, 71 (5), 559-563. [ Links ]
Meinrath, A. B. & Flaherty, C. F. (1987). Preweanling handling influences open-field behavior, but not negative contrast or sucrose "neophobia". Animal Learning & Behavior, 15, 83-92. [ Links ]
Micczek, A. & Lau, P. (1975). Effects of scopolamine, physostigmine and chlordiazepoxide on punished and extinguished water consumption in rats. Psychopharmacology, 42, 263-269. [ Links ]
Mitchell, C. & Flaherty, C. H. (1998). Temporal dynamics of corticosterone elevation in successive negative contrast. Physiology & Behavior, 64 (3), 287-292. [ Links ]
Mustaca, A. E. (1999). Respuestas rápidas bifásicas inmunológicas por frustración y euforia. Revista Latinoamericana de Psicología, 31 (1), 90-110. [ Links ]
Mustaca, A. E. & Martínez, C. (2000). Respuestas agonísticas en ratas sometidas a frustración. Revista Latinoamericana de Psicología, 32, 485-504. [ Links ]
Mustaca, A. E. & Papini, M. (2005). Consummatory successive negative contrast induces hypoalgesia. International Journal of Comparative Psychology, 18, 333-339. [ Links ]
Mustaca, A. E., Bentosela, M. & Papini, M. (2000). Consummatory successive negative contrast in mice. Learning and Motivation, 31, 272-282. [ Links ]
Mustaca, A. E., Freidin, E. & Papini, M. (2002). Extinction of consummatory behavior in rats. International Journal of Comparative Psychology, 1, 1-10. [ Links ]
Mustaca, A. E.; Martínez, C. & Papini, M. (2000). Surprising nonreward reduces agressive behavior in rats. International Journal of Comparative Psychology, 13, 91-100. [ Links ]
Mustaca, A., Bentosela, M., Pellegrini, S., Ruetti, E., Kameninsky, G. & Cuello, M. (2005). Aportes para la comprensión de la frustración. En: Las Ciencias del Comportamiento en los albores del Siglo XXI", págs. 313- 322. Compilación: Jorge Vivas. Editorial Universidad Nacional de Mar del Plata. Argentina. [ Links ]
Mustaca, A.E; Bentosela, M.; Ruetti, E.; Kamenetzky, G.; Cuenya, L. & Justel, N. m. (en prensa). En: Recientes Avances Iberoamericanos en Investigación en Ciencias del Comportamiento. Editores: M. C. Richaud de Minzi y Eduardo Moreno. Ediciones CIIPME-CONICET. [ Links ]
Norris, J. N., Daniel, A. M. & Papini, M. R. (2008). Spontaneous recovery of consummatory behavior, but not of consummatory successive negative contrast. Learning and Motivation (en prensa). [ Links ]
Papini, M. & Dudley, R. T. (1997). Consequences of surprising reward omissions. Review of General Psychology, 3, 275-285. [ Links ]
Rosas, J. M., Callejas-Aguilera J. E., Escarabajal, M. D., Gómez, M. J., Torre, L. & Agüero A. (2007). Successive negative contrast effect in instrumental runway behaviour: A study with Roman high- (RHA) and Roman low- (RLA) avoidance rats. Behavioral Brain Research, 185, 1-8. [ Links ]
Soubrie, P., Thiebot P., Simon, P. & Boissier, J. R. (1978). Benzodiazepines and behavioral effects of reward (water) omission in the rat. Psychopharmacology, 59, 95-100. [ Links ]
Tomie, A., Tirado, A., Yu, L. & Pohorecky, L. (2004). Pavlovian autoshaping procedures increase plasma corticosterone and levels of norepinephrine and serotonin in prefrontal cortex in rats. Behavioral Brain Research, 153, 97-105. [ Links ]
Toth, E.; Avital, A; Leshem, M.; Richter-Levin, G.; & Braun, C. (2008). Neonatal and juvenile stress induces changes in adult social behavior without affecting cognitive function. Behavioural Brain Research, 190, 135-139. [ Links ]
Wood, M. D., Norris, J. N., Daniel, A. M. & Papini, M. R. (2008).Trial-selective effects of U50, 488H, a -opioid receptor agonist, on consummatory successive negative contrast. Behavioural Brain Research, 193, 28-36. [ Links ]














