Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.18 no.1 Medellín Jan./Apr. 2005
Aspectos generales de la crioconservación espermática en peces teleósteos
Víctor M Medina Robles1, MVZ, Asp MSc; Yohana M Velasco Santamaría1, MV; Pablo E Cruz Casallas1, MVZ, MSc, PhD.
1Semillero de Investigación sobre Conservación de Gametos, Instituto de Acuicultura de los Llanos, Facultad de Ciencias Agropecuarias
y Recursos Naturales, Universidad de los Llanos, AA 2430, Villavicencio, Colombia
(Recibido: 2 marzo, 2004; aceptado: 26 enero, 2005)
Los protocolos actuales para la crioconservación de semen de peces aún muestran muchas deficiencias para lograr óptimas tasas de fertilidad, observándose gran variación dentro y entre especies. Pocos eventos celulares y moleculares han sido descubiertos a partir de los resultados encontrados por los investigadores. Los procesos de formación de cristales de hielo a nivel intracelular, el efecto tóxico de los crioprotectores y la recristalización se muestran como los aspectos de mayor relevancia en el criodaño. Hipótesis como la transición de fases de los lípidos en la membrana plasmática y la ruptura de la misma por el influjo rápido del agua, han sido propuestas para explicar el daño celular durante el proceso de crioconservación.
Palabras clave: crioconservación, descongelación, espermatozoide, pajilla, peces, semen.
Introducción
El desarrollo de la inseminación artificial basada en gametos crioconservados ha permitido cambios trascendentales en la industria pecuaria. El semen congelado es usado mundialmente como una herramienta esencial en los programas de mejoramiento animal. En principio, beneficios similares pueden ser esperados de su aplicación en la industria piscícola. El uso de semen congelado es un medio práctico para aumentar el tamaño genéticamente efectivo de las poblaciones y mantener su diversidad genética, especialmente de aquellas mantenidas en cautiverio (45). Además, aumenta la posibilidad de reproducción por fuera de la estación reproductiva, facilita el movimiento e intercambio de material genético entre productores, mejora la eficiencia en la utilización de los parentales y contribuye a disminuir la presión sobre las poblaciones silvestres ejercida por los piscicultores en procura de nuevos sementales.
Los procesos de crioconservación de semen de peces han sido estudiados ampliamente, teniendo como sujetos experimentales especialmente a los salmónidos
y ciprínidos (28, 35, 59); sin embargo, la mayoría de resultados difieren con respecto a los diferentes protocolos de congelación utilizados. Los intereses de investigación han sido dirigidos principalmente a tres tópicos: la estandarización de los protocolos de congelación que permitan alcanzar tasas de fertilización cercanas a las obtenidas con semen fresco; la evaluación de sustancias crioprotectoras que disminuyan los efectos tóxicos y de criodaño sobre la célula espermática y la extrapolación de resultados entre las diferentes especies ícticas para encontrar puntos de similitud.
El efecto de variables tales como volumen de la pajilla y la temperatura de descongelación, sobre los porcentajes de fertilidad alcanzados, no ha sido evaluado metodológicamente, no existiendo suficiente información sobre lo que sucede a nivel celular. En consecuencia, el propósito de esta revisión es recopilar información sobre aspectos generales de la crioconservación de semen en algunos peces teleósteos y discutir las causas del daño espermático causado por el proceso de crioconservación.
Principios biofísicos de la crioconservación e hipótesis del criodaño en la célula espermáticaEfecto de la temperatura y la osmolaridad en el ambiente celular
El proceso de crioconservación de semen involucra diferentes cambios intracelulares que pueden originar una disminución en la sobrevivencia espermática. El control de la velocidad de cambio de la temperatura, la osmolaridad y la formación de cristales de hielo en el medio intra y extracelular son los aspectos más relevantes para optimizar la viabilidad celular.
Durante el proceso de enfriamiento y congelación, el espermatozoide está sujeto a cambios drásticos en su medio físico y químico. Uno de estos cambios toma lugar intracelularmente cuando el agua en fase líquida pasa a sólida en forma de cristales. La aparición espontánea del primer núcleo de hielo o nucleación, ocurre cuando la solución llega a temperaturas entre -5 y -15 oC (58, 63). Este núcleo, de forma hexagonal, adhiere moléculas de agua por medio de interacciones electrostáticas promoviendo la formación de núcleos de mayor tamaño, y a medida que avanza la formación de cristales de hielo se libera energía calorífica (calor latente) (58), lo que produce un pico transitorio de ascenso en la temperatura que puede ser letal para la célula.
El medio externo también cambia a forma sólida, lo que conlleva a que la concentración de solutos en los canales residuales no congelados aumente progresivamente, mostrándolo hiperosmótico con respecto a la célula. Esto induce la salida del agua de la célula y su congelamiento externo, concentrando solutos intracelulares (36). Si la deshidratación celular es excesiva, la osmolaridad puede ser muy alta, intoxicando la célula, o la deshidratación puede no permitir a la membrana plasmática recuperar su forma en el proceso de descongelación (36).
La velocidad de enfriamiento juega un papel importante en este sentido. Si la congelación es suficientemente lenta el equilibrio es alcanzado a través del eflujo de agua, pero si la congelación es muy rápida, la célula no puede perder agua lo suficientemente rápido para alcanzar el potencial de equilibrio, congelándose intracelularmente (36, 58, 61).
La congelación intracelular es letal para la célula dependiendo particularmente del tamaño y de la cantidad de cristales de hielo formados en el citoplasma. Normalmente, altas velocidades de enfriamiento producen cristales intracelulares pequeños que pueden llegar a ser inocuos, pero estos pueden unirse y crecer durante la descongelación por medio de un proceso denominado recristalización (23, 36). Este proceso es promovido por una inapropiada velocidad de descongelación, la cual debe corresponder con la velocidad de congelamiento empleada (38); sin embargo, los procesos de recristalización pueden suceder aún durante la congelación, favorecidos por las regiones no congeladas que permiten interactuar a los cristales de hielo ya formados.
El tamaño de los cristales de hielo formados durante la congelación está directamente relacionado con la velocidad de enfriamiento y el grado de hidratación intracelular. En el caso de los embriones, cuando éstos son enfriados rápidamente de -30 a -40 oC, seguido por inmersión en nitrógeno líquido (NL), es necesario un protocolo rápido de descongelamiento de 200-500 oC/min para prevenir la fusión de los pequeños cristales de hielo que formarían grandes cristales. Cuando la velocidad lenta de enfriamiento se continúa por debajo de -60oC, son necesarias velocidades de descongelamiento lentas menores de 25 ºC/min, con el fin de prevenir el choque osmótico debido a la alta deshidratación celular (38). El daño celular por choque osmótico resulta como consecuencia del flujo rápido de líquidos extracelulares hacia el interior (38).
Efecto solución
Cuando las células son enfriadas lentamente, la deshidratación puede avanzar hasta lograr el punto de equilibrio osmótico. La deshidratación conduce al aumento en la osmolaridad de las células, exponiéndolas a un largo y continuo incremento de la concentración de solutos en la fracción no congelada externamente, lo cual puede causar el así llamado “efecto solución” (17, 58), que hace referencia específicamente a las modificaciones de las propiedades de la solución en la cual las células están suspendidas (36).
El hielo se separa de la solución acuosa durante la congelación y su proporción incrementa progresivamente a medida que decrece la temperatura. En medios que no contienen criopreservantes, la fracción de agua no congelada en la célula decrece a medida que disminuye la temperatura, como resultado de la deshidratación y concentración de solutos intracelulares. Si el medio contiene un criopreservante, la respuesta de la célula depende entonces de la permeabilidad de éste. Si no es permeable, aumenta la osmolaridad fuera de la célula, pero si penetró totalmente, reemplaza el agua intracelular y decrece la fracción congelada, evitando la concentración de solutos (36). A velocidades de congelación lentas la posibilidad de formación de cristales de hielo intracelular es poca; sin embargo, las células podrían morir por el efecto solución (36).
Efecto del diluyente y del crioprotector sobre el ambiente celular
Tanto los diluyentes como los crioprotectores cumplen funciones específicas dentro del proceso de crioconservación, teniendo como fin general mantener la viabilidad celular durante un periodo determinado. Estas sustancias cumplen funciones como incrementar el volumen del eyaculado, proteger al espermatozoide de la acción tóxica de los productos del metabolismo celular y de los cambios bruscos de temperatura. Los diluyentes utilizados en peces han sido formulados simulando la composición y osmolaridad del plasma seminal de cada especie, con el propósito de no activar la movilidad, ya que soluciones no isosmóticas conducen a cambios iónicos membranales produciendo la activación espermática.
De otro lado, la acción de los crioprotectores puede ser clasificada en dos grupos según la permeabilidad de la membrana a la sustancia. En el primer grupo se encuentran las sustancias que poseen bajos pesos moleculares (38) y que, por lo tanto, penetran al citoplasma celular (23), tales como glicerol, metanol, etilenglicol, 1,2-propanodiol, butanediol, acetamida y el dimetil sulfóxido (DMSO). El segundo grupo reúne aquellas sustancias que no penetran la membrana celular debido a su alto peso molecular como el polivinil alcohol (PVA), hialuronato de sodio y la albúmina (38).
Los crioprotectores no permeables son usados para remover osmóticamente el agua intracelular, remplazándola por los crioprotectores permeables durante el enfriamiento y adicionalmente para prevenir el choque osmótico por medio del control de la rehidratación intracelular durante la descongelación (38).
Una vez los crioprotectores ingresan al citoplasma en favor del gradiente de concentración, el fluido intracelular puede ser superenfriado a temperaturas entre -5 y -15 oC, sin que ocurra la formación de cristales de hielo, debido a que estas sustancias disminuyen el punto de congelación por medio de la reducción en la interacción entre las moléculas de agua (56); a estos rangos de temperaturas los cristales de hielo comienzan a formarse en el medio externo. Cuando las temperaturas descienden por debajo de estos rangos, se inicia la formación de cristales de hielo intracelular (38).
La temperatura a la cual deben ser incorporados los crioprotectores a la solución de semen y el tiempo de exposición celular, dependen del grado de toxicidad del crioprotector y de su velocidad de difusión a través de la membrana plasmática. Esta difusión puede verse afectada por el descenso de la temperatura, ya que durante este proceso la membrana celular aumenta la proporción de colesterol con el propósito de lograr mayor estabilidad mecánica; sin embargo, este aumento del colesterol también disminuye la permeabilidad de la membrana a pequeñas moléculas, pudiendo afectar la penetración del crioprotector en la célula de una manera efectiva (51).
Mecanismo de acción de los crioprotectores sobre la célula
Los mecanismos de acción específicos de los agentes crioprotectores a nivel celular no están aún muy bien dilucidados. Las referencias sobre este particular han sido realizadas principalmente en aquellos de mayor utilización, tal como el DMSO. Por ejemplo, se ha sugerido que existe una interacción electrostática entre el grupo sulfóxido polar del DMSO y la bicapa de fosfolípidos de la membrana plasmática. Esta interacción podría darse entre la molécula de colina de los grupos cabeza de la fosfatidilcolina o por una interacción entre el oxígeno sulfóxido del DMSO y un grupo fosfato de la cabeza de fosfolípidos por medio de un enlace de hidrógeno con una molécula de agua (1). Sin embargo, durante el proceso de crioconservación no sólo es importante establecer como interactúa el crioprotector con la célula, sino que también se hace necesario determinar el efecto tóxico de éstos, que es finalmente el evento de mayor importancia a controlar durante la exposición de los espermatozoides a estas sustancias.
Aparentemente, la toxicidad del DMSO esta dirigida al estado bioenergético del espermatozoide, interfiriendo con el balance entre síntesis y utilización de ATP. Frente a una deficiencia de ATP, por ejemplo durante la congelación, el control metabólico sobre los procesos celulares dependientes de iones podría verse afectado, ocasionando una inapropiada activación de fosfolipasas y proteasas y un daño celular irreversible (23). También ha sido postulado que los criopreservantes, como el glicerol, tienen la capacidad de modificar la bicapa lipídica por su habilidad de insertarse entre los fosfolípidos, llegando a afectar las vías de metabolismo intermedio; de igual manera se ha asociado su acción sobre el citoesqueleto y las proteínas microtubulares (22).
Hipótesis del criodaño
Los protocolos de crioconservación tienen un número de daños potenciales sobre las células ocasionados por el choque térmico, el estrés tóxico y osmótico originado por la exposición a crioprotectores (hiperosmolaridad) y la formación y disolución de cristales en el ambiente intra y extracelular (61).
A través de los años, varias teorías han sido propuestas para explicar el daño causado por el proceso de crioconservación. Lovelock (34) atribuye el daño como resultado de una alta concentración de solutos en el fluido extracelular, causado por la formación de cristales de hielo fuera de la solución. De otro lado, Meryman (37) ha atribuido el daño a la contracción de la célula por debajo del volumen mínimo tolerable.
Quinn (46), propuso la teoría de la ruptura de la membrana basada en la transición de fase termo trópica de los lípidos. De acuerdo con esta teoría, la sobrevivencia depende del tiempo permitido para que ocurra el evento de separación de fases durante la congelación. Si este no ocurre se pueden crear orificios en la membrana por fallas en el agrupamiento de los lípidos durante la descongelación. Muldrew y McGann (40), proponen la teoría en la cual la ruptura de la membrana sería causada por la fricción del agua al pasar rápidamente a través de ella, excediendo la capacidad de la membrana de conducirla.
Finalmente Watson (61), basado en la alta sensibilidad de la membrana plasmática, propone al estrés osmótico como el factor clave en la optimización de la velocidad de enfriamiento, no por la permeabilidad al agua, sino por la tasa de desplazamiento requerida por la membrana plasmática para acomodarse al cambio de volumen, pudiendo estar relacionado con la tensión de la adhesión del citoesqueleto.
Proceso de crioconservación en peces teleósteosEl valor del almacenamiento de gametos por periodos indefinidos, como medio para la conservación de varias especies de peces en peligro de extinción, ha sido ampliamente reconocido, ya que el semen congelado de tales poblaciones puede colectarse para el establecimiento de bancos de germoplasma (6, 53, 62).
En general, los efectos benéficos de la conservación de gametos en teleósteos incluyen (35):
1. Gran potencial en la selección de reproductores a través del almacenamiento de gametos de individuos genéticamente mejorados.
2. Incremento de la protección sanitaria, permitiendo la introducción de nuevas líneas genéticas con reducción del peligro de transmisión de patógenos desconocidos en los cultivos de peces.
3. Suministro permanente de gametos para la óptima utilización en criaderos o en investigación.
4. Economía para el mantenimiento de criaderos proporcionando un resguardo por pérdida de líneas genéticas.
5. Facilidad de transporte de material genético entre criaderos realizando protección genética con gametos y embriones crioconservados.
Los procesos de crioconservación aplicados comúnmente en peces comprenden la extracción del semen, dilución, envasado en pajillas o pellets, congelación a diferentes velocidades de enfriamiento y descongelación. El ciclo de crioconservación es un proceso completo de la preparación y dilución espermática encaminadas al mantenimiento post descongelación de la capacidad funcional por un periodo amplio (60).
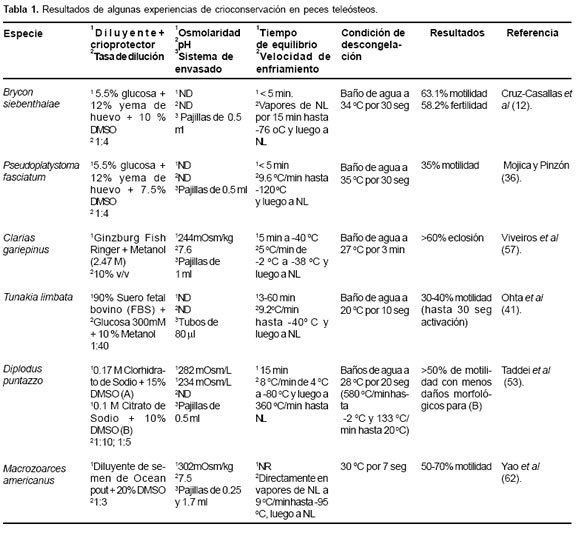
Varios procedimientos para crioconservación de espermatozoides han sido desarrollados durante los últimos 20 años (32, 43, 50). Los resultados son altamente variables, indicando que la sensibilidad a los procesos depende de factores misceláneos (45). Los resultados experimentales sugieren que, en la mayoría de los casos, son necesarios ajustes especie específicos a los protocolos existentes (12, 14, 21). La elección del criopreservante ha sido un asunto de ensayo y error en la mayoría de las investigaciones, quizás porque aún no existe una explicación satisfactoria para la acción de los mismos sobre la célula espermática (23). La tabla 1 muestra los resultados de experiencias de crioconservación en algunos peces teleósteos.
Colección espermática
La obtención de muestras de semen en peces para conducto espermático con sondas plásticas a través congelación se realiza por medio de presión abdominal de la papila genital. En salmónidos como Thymallus en sentido cráneo caudal o por cateterización del thymallus y Hucho hucho la colección espermática
ha sido realizada por medio de presión abdominal previo vaciamiento de la vejiga urinaria (30); igual procedimiento se ha implementado en especies como Cyprinus carpio (32), Xyrauchen texanus (54) y Clarias gariepinus (58). En muchas especies de peces, la contaminación del semen por orina durante el estrujamiento es casi inevitable debido a la proximidad entre el ducto espermático y el uréter, esta contaminación frecuentemente causa alteración de la calidad del semen y puede ser responsable de las variaciones en la calidad espermática (15) y posiblemente puede incidir sobre los resultados de la crioconservación. Tal es el caso del pez marino Psetta maxima, donde la contaminación del semen con orina artificial, produjo disminución en el inicio de la movilidad espermática y en las reservas endógenas de ATP (15).
Diluyentes
Diferentes diluyentes se han usado para la crioconservación de semen en teleósteos, entre éstos se destacan el medio kurokura, el diluyente Ocean Pout, la solución salina de inhibición de movilidad espermática tamponada, solución salina balanceada Hanks libre de calcio (CF-HBSS) y el diluyente de Stein y Bayrle. Estas soluciones generalmente son suplementadas con albúmina sérica, leche en polvo, suero fetal bovino o yema de huevo de gallina (véase Tabla 1). Esta última posee acción termoprotectora, la cual es ejercida por la fracción lipídica compuesta por lecitina y cefalina y una acción conservadora, dada por la fracción lipoproteíca. Los azúcares como la glucosa y fructosa suministran energía a los espermatozoides para los procesos vitales y aportan sustitutos de electrolitos para el mantenimiento de la presión osmótica (47).
En Piaractus brachypomus la utilización de DMSO al 10% con diluyente basado en yema de huevo y metanol al 10% con leche en polvo, fueron las soluciones que mejor conservaron las características seminales, mostrando porcentajes de fertilidad aceptables. El etilenglicol a concentración del 5% con leche en polvo, presentó el mejor índice de fertilidad (41). Lo anterior indica que los efectos ejercidos por los diluyentes pueden ser muy variables aun cuando son utilizados con los mismos crioprotectores.
Crioprotectores
El DMSO, comparado con otros crioprotectores, parece ser el más utilizado en teleósteos; sin embargo, los resultados aun muestran gran variabilidad. Esta sustancia ha mostrado gran eficiencia en el proceso de crioconservación de semen en especies como Thymallus thymallus (30), Chalcalburnus chalcoides (31), Brycon siebenthalae (14), entre otras; sin embargo, se han reportado resultados no satisfactorios en algunas especies como Acipenser fulvescens (11).
Al parecer en algunas especies como Oncorrhynchus mykiss, la utilización de DMSO o dimetil acetamida (DMA), permiten obtener resultados satisfactorios (5, 6, 52). La combinación de DMSO con otros crioprotectores también ha sido evaluada. Cortés (13) realizó la caracterización y crioconservación de semen de P. brachypomus, donde los crioprotectores que mostraron los mejores resultados fueron el DMSO y la mezcla de glicerol con DMSO. A diferencia de los buenos resultados obtenidos con DMSO en P. brachypomus, otros autores realizaron la caracterización del semen de Prochilodus reticulatus y evaluaron la movilidad después de la conservación en frío, se observó que el metanol como crioprotector mantuvo porcentajes de movilidad superiores al 80% en comparación a los obtenidos con DMSO (8).
En segundo lugar de utilización para la crioconservación espermática en teleósteos lo ocupa el metanol. Este alcohol ha sido utilizado en especies como Hucho hucho (30), Ictalurus furcatus (7), Clarias gariepinus (58) y Tunakia limbata (43), pero los resultados obtenidos han sido menos homogéneos que los observados con DMSO en otras especies, con rangos entre 0 y 91% de fertilidad.
Al parecer el metanol suele ser menos tóxico en unas especies que en otras y su efecto puede ser atribuido a su capacidad de salir y entrar más rápidamente de la célula que otros criopreservantes (54), o su acción puede verse potenciada al combinarse con otras sustancias como suero fetal bovino, puesto que éste produce cierto nivel de protección, tal vez como amortiguador del choque osmótico al cual es sometida la célula durante la congelación, y puede de igual forma facilitar la más rápida penetración del metanol en la célula, lo cual podría conducir a un menor daño de la membrana espermática por formación de cristales de hielo (54).
Osmolaridad
En O. mykiss se observó un aumento significativo en el daño espermático de muestras de semen utilizando DMSO (1625 a 1778 mOsm/kg) y expuestas a soluciones hipoosmóticas de activación, aún cuando después de la crioconservación, la viabilidad celular no pareció haber sido afectada. Las tasas de fertilidad alcanzadas en este mismo estudio son consistentes con el incremento observado en la susceptibilidad al choque hipoosmótico, pero no con la proporción de células vivas medidas antes de la exposición hipotónica, demostrando esto que el criodaño subletal no es detectado por los procedimientos estándares de viabilidad espermática (10). Lo anterior podría explicar las bajas tasas de fertilidad obtenidas con muestras de semen congelado en las cuales se han determinado previamente porcentajes de viabilidad altos.
Dzuba y Kopeika (17), proponen la hipótesis que los espermatozoides de peces marinos son más resistentes a la crioconservación debido a su capacidad de resistencia a cambios en el volumen celular durante la activación, en condiciones no isotónicas. Espermatozoides de Mugil soluy B., fueron sucesivamente activados a través de un amplio rango de presiones osmóticas (0-2000 mOsmol/l), teniendo un porcentaje de movilidad después de la congelación de 90%, mientras que espermatozoides de Cyprinus carpio sólo respondieron a la activación dentro de un rango más estricto (0-300 mOsmol/l), con espermatozoides móviles solo en un 30% después de la congelación (17).
La resistencia a los cambios osmóticos en los espermatozoides de peces marinos puede radicar en la composición bioquímica de la membrana plasmática, ya que en estas especies existe una mayor relación de colesterol/fosfolípidos en comparación con peces de agua dulce (17). Además, la disponibilidad de colesterol en la membrana puede permitirle una mayor estabilidad en los procesos de extensión y contracción a la cual se ve sometida durante la crioconservación y posterior descongelación. Lo anterior contradice lo reportado por Labbé y Maisse (25), donde la baja relación de colesterol/fosfolípidos y proteínas de membrana es utilizada para explicar la crioresistencia en espermatozoides de trucha arco iris.
Velocidad de congelación
La congelación espermática en vapores de NL es tal vez la técnica más utilizada en peces (33, 53, 62). No obstante, la congelación directa en hielo seco a -79 ºC y luego la inmersión en NL a -196 ºC, también es utilizada, aunque con menos frecuencia y casi siempre acompañada del método de envasado en pellets (4, 6).
Aunque la velocidad de congelación es una de los factores más críticos en el proceso de crioconservación de semen, esta es la variable menos estandarizada en los estudios de crioconservación seminal en peces (48). El semen de Ctenopharyngodo idella sometido a una velocidad de congelamiento lenta de 8 ºC/min produjo mayor movilidad postdescongelación al ser comparada con el semen de Hypophtalmichthys molitrix bajo las mismas condiciones (31). Mejores porcentajes de fertilidad se obtuvieron en semen de los salmónidos Thymallus thymallus y H. hucho al ser sometido a congelación con una velocidad de enfriamiento rápida (30). En la congelación de semen de Brycon siebenthalae, se observó 69% de movilidad espermática postdescongelación, al ser utilizada una curva de congelación lenta o de descenso gradual de temperatura (44).
Velocidad de descongelación
La descongelación de pajillas se realiza por inmersión en baños de agua; la combinación de tiempos y temperaturas, puede ayudar a disminuir el efecto de recristalización presentado por las células espermáticas y el efecto térmico sobre la membrana plasmática.
El rango de temperaturas de descongelación en semen crioconservado en peces es muy amplio, variando desde temperaturas cercanas a las de refrigeración de 4 ºC hasta temperaturas por encima de los 80 ºC (23). Tiersch (54), evaluó la descongelación de semen de Xyrauchen texanus utilizando 20 ºC por 9 seg, 30 ºC por 8 seg y 40 ºC por 7 seg; los resultados no revelaron diferencias significativas entre los tratamientos al evaluar la movilidad postdescongelación, pero sí cuando se utilizó 18 ºC por 390 seg, donde la movilidad se vió significativamente disminuida. Lo anterior podría sugerir que temperaturas más altas de descongelación son viables, dentro de un rango de tiempo corto, lo que coincide con una velocidad de descongelación rápida, que puede evitar que procesos dinámicos dentro de la membrana espermática aumenten su fragilidad.
La descongelación muestra ser uno de los parámetros más sensibles durante la crioconservación de semen. En salmónidos, como el Esox lucius, ligeras desviaciones de las condiciones óptimas, reducen significativamente las tasas de fertilización (29).
Los rangos de temperaturas de descongelación son diferentes dentro y entre especies. Es probable que las temperaturas óptimas puedan estar relacionadas directamente con las temperaturas del agua en la cual los peces desovan; es decir, temperaturas de descongelación más bajas para peces de agua fría y más altas para peces de agua cálida, lo que podría estar además influenciado por las características de distribución de los fosfolípidos en la membrana espermática. Vladic y Jarvi (59), observaron en Salmo salar y en S. trutta que la duración de la movilidad espermática en el momento de la fertilización fue máxima cuando se descongeló a 2 º C.
Estudios del criodaño sobre espermatozoides en pecesDebido a su heterogeneidad, los espermatozoides de los peces ocupan un sitio especial en la historia de la criobiología. La diversidad evolutiva y las grandes diferencias en alimentación, naturaleza física y química de su hábitat, han conducido a diferencias considerables entre la fisiología, la bioquímica y las propiedades morfológicas de los espermatozoides de diferentes especies (16). Actualmente varias investigaciones dirigidas a evaluar el criodaño sobre las células espermáticas, esclarecen algunos efectos.
Efectos sobre la bicapa lipídica
Los fosfolípidos hacen parte del 65-70% del total de la membrana, los cuales le pueden conferir fluidez, pero también mayor inestabilidad, que es contrarrestada por las cantidades variables de colesterol. Los fosfolípidos adoptan configuraciones inusuales, con una alta proporción de plasmalógenos, que contienen enlaces éter en los ácidos grasos en vez de enlaces éster. (23).
Se ha sugerido que el estrés térmico sobre la membrana plasmática durante el enfriamiento resulta en la transición de la fase líquida a una fase de gel en los fosfolípidos de membrana. Como resultado de esta transición, las proteínas integrales de membrana pueden ser excluidas de dominios de lípidos de fase de gel y son agrupadas, algunas veces de forma irreversible. La actividad de muchas enzimas asociadas a membrana se reduce, así como la tasa de difusión de proteínas por lateralización dentro del plano de la bicapa, reduciendo de este modo la eficiencia de los procesos relacionados con difusión (26).
Durante la exposición al frío se ha observado reducción en la proporción de ácidos grasos saturados e incremento en la proporción de ácidos grasos insaturados. Cuando aumenta la temperatura, la relación de fosfatidilcolina/fosfatidiletanolamina y los contenidos de colesterol se correlacionan positivamente; estos cambios originan una reorganización de la membrana, lo que ayuda a la célula a sobrevivir a las nuevas temperaturas (25). Se ha reportado que las membranas de los espermatozoides de peces marinos son más resistentes a la congelación que los de agua dulce, debido al alto contenido de fosfolípidos y al bajo contenido de ácidos grasos poliinsaturados (53).
En O. mykiss se demostró que un largo período de aclimatación térmica induce algunas modificaciones de los patrones de ácidos grasos de los fosfolípidos de la membrana plasmática de los espermatozoides (24), pero no se explicó cómo estas modificaciones podrían alterar la calidad espermática. Sin embargo, esto podría ser el resultado del cambio fisiológico que sufren los animales poiquilotermos para mantener la fluidez de la membrana, donde la composición de los ácidos grasos y la proporción de moléculas de colesterol con respecto a los fosfolípidos y esfingolípidos se modifica en función de la temperatura del ambiente (51).
En estudios con trucha arco iris mantenidas en agua a 18 ºC y transferidas a 13 ºC, luego de 42 días, se observó una mejor resistencia a la crioconservación, los espermatozoides mantuvieron bajos contenidos de colesterol en la membrana plasmática, esta baja cantidad de colesterol se correlacionó con una mejor capacidad de fertilización de los espermatozoides después de la crioconservación, de igual forma se estableció una correlación negativa significativa entre el porcentaje de fertilización después de la crioconservación y la correspondiente relación molar colesterol/fosfolípidos (25).
Experimentos empleando microscopía electrónica de criofractura en espermatozoides de O. mykiss y Salmo trutta, mostraron en espermatozoides no sometidos a congelación, una distribución homogénea de partículas sobre la superficie protoplásmica, en algunos casos agregaciones de partículas en la región del cuello y una banda longitudinal consistente de partículas en la cola. A diferencia de lo anterior, en espermatozoides sometidos a congelación, se observaron partículas que fueron agrupadas dentro de clusters o grupos en la superficie protoplásmica de la cabeza y la cola. La crioconservación induce una fase de transición en los lípidos de la membrana citoplasmática de la célula y se da una redistribución espacial de sus componentes, por el proceso de separación lateral de lípidos y la agregación de proteínas de membrana (16, 53).
Los cambios que ocurren en la membrana plasmática de espermatozoides de O. mykiss pueden afectar probablemente su integridad fisiológica después de la descongelación, aunque esto puede ser reversible. La extensión del daño en la membrana y la probabilidad de su recuperación después del descongelamiento, pueden depender de la distancia recorrida por las partículas desde su sitio fisiológico normal hasta el lugar de formación de los grupos (16).
El daño en áreas de la superficie celular, donde no se forman grupos, aparentemente es debido a una pobre diferenciación de la membrana, en la cual no ocurre el proceso de difusión lateral de moléculas, conllevando a su deformación y daño celular, comparado con los espermatozoides con alta diferenciación de membrana que sí permiten la formación de grupos (16). Con lo anterior se podría pensar que el proceso de difusión lateral de moléculas (lípidos y proteínas), permite una estabilización transitoria de la membrana plasmática durante el proceso de crioconservación, donde la distribución homogénea de partículas y la relación de fosfolípidos y proteínas hacen posible la reversión exitosa de la célula espermática para conservar su capacidad fertilizadora.
Efectos sobre la integridad mitocondrial
Ogier de Baulny et al (42) propusieron, que aparte de los problemas sobre la integridad celular durante el ciclo congelación - descongelación, las alteraciones de la membrana plasmática pueden también afectar su viabilidad para fusionarse con la membrana del oocito, de igual manera, se ve afectada la organización mitocondrial pudiendo conllevar a la disminución de la movilidad espermática.
La integridad mitocondrial juega un papel importante en la activación espermática, ya que esta suministra la energía en forma de ATP necesaria para un prolongado tiempo de activación. Procedimientos de congelación - descongelación de espermatozoides de trucha arco iris inducen disminución en la producción de ATP, la cual varía con el crioprotector utilizado. Esta disminución puede resultar del estrés osmótico durante la adición del crioprotector o el congelamiento del agua externa. Las diferencias entonces en la capacidad entre el glicerol y el metanol para prevenir la disminución en la síntesis de ATP, pueden ser parcialmente explicadas por el hecho de que el medio de congelación con glicerol permite los más altos valores de osmolaridad y con el metanol los más bajos (42).
En O. mykiss se evaluó la integridad de la membrana plasmática del espermatozoide y la función mitocondrial por medio de citometría de flujo al ser expuestas a congelación con diferentes crioprotectores. El mejor crioprotector para mantener la integridad de membrana y la función mitocondrial fue el DMSO a una concentración de 5 y 10% con un 45% de espermatozoides con membrana intacta y 18% de espermatozoides con membrana y función mitocondrial intacta, la variabilidad en las respuestas a los criopreservantes puede estar dada por el nivel de toxicidad de cada uno sobre la célula (42).
Cambios morfológicos determinados por microscopía electrónica de barrido, revelan daño en la pieza media del espermatozoide post descongelación, conllevando la formación de protuberancias o ensanchamientos de la membrana en esta zona como resultado de la pérdida de la envoltura densa de las mitocondrias (62). La formación de protuberancias también ha sido determinada en el flagelo y la cabeza del espermatozoide, con pérdida de cromatina nuclear (53), dándose una pérdida de la funcionalidad mitocondrial y una disminución de las reservas de energía necesarias para el movimiento flagelar del espermatozoide, comprometiendo la osmoregulación celular.
Efecto sobre el material genómico
Además del estudio de los efectos sobre las membranas plasmática, nuclear y sobre las mitocondrias, el daño producido por la crioconservación en el material genómico debe empezar a ser considerado para encontrar posibles correlaciones entre el desarrollo de los primeros estados embrionarios, las tasas de fertilidad, la sobrevivencia y el desempeño larval.
La técnica de electroforesis alcalina en gel de células individuales, ha sido utilizada en espermatozoides de O. mykiss sometidos a congelación para determinar la fragmentación del ADN. En estos estudios, el porcentaje de núcleos espermáticos crioconservados con ADN alterado, estuvo relacionado inversamente con la tasa de fertilización; sin embargo, a esta alteración no puede atribuírsele absolutamente la disminución en la capacidad de fertilización de los espermatozoides (27).
El incremento en la proporción de células con ADN alterado después de la crioconservación, puede llegar a ser más bajo que el incremento en la proporción de espermatozoides reportados con daño en membrana y daño en mitocondria (42). El daño entonces en el ADN podría ser solamente un componente menor del daño causado a las células por crioconservación (27). Aunque son variados los efectos del proceso de crioconservación sobre la célula espermática, éstos no pueden ser considerados como únicos e independientes y, en una mayor proporción, la combinación de ellos implica un aumento o disminución de la capacidad fertilizante del espermatozoide.
Expectativas de investigaciónLa emergencia alimenticia a la cual se ha visto sometida la población mundial por el incremento de la tasa de natalidad, especialmente en los países en vía de desarrollo, ubican a la piscicultura como una herramienta para suplir la demanda de proteína requerida para las necesidades nutricionales de la población (19).
Una ventaja adicional, es nuestra riqueza íctica, especialmente en aquellas especies promisorias para cultivo comercial y que han mostrado tener excelentes conversiones alimenticias en pequeños periodos, como por ejemplo la cachama blanca (P. brachypomus) y el yamú (B. siebenthalae), en los Llanos Orientales colombianos (2, 3).
Actualmente nos vemos sometidos a ciclos estacionarios de reproducción, lo que limita la disponibilidad de semilla (alevinos) durante todo el año, de aquí surge la necesidad de implementar investigaciones ya sea ampliando los ciclos reproductivos por medio de su manipulación en cautiverio (domesticación) y el uso de inductores hormonales y la crioconservación de gametos, que puede perfilarse como la mejor herramienta a más corto plazo.
Sin embargo, la implementación de herramientas biotecnológicas como la crioconservación, involucran la necesidad de investigación sobre la biología reproductiva y especialmente sobre las características seminales de las especies. Por tal razón se hace prioritario esfuerzos sobre el conocimiento de las características seminales de nuestras especies nativas, con el objetivo de adecuar las condiciones óptimas para los procesos de crioconservación. Recientemente se esta empezando a trabajar en especies de la Orinoquía que pueden representar un alto valor genético y comercial. Dentro de estas cabe destacar a la barbilla (Rhamdia sebae c.f.), en la cual la determinación realizada sobre sus características seminales (55) permitirá empezar a evaluar el potencial para su crioconservación.
En cuanto a crioconservación, actualmente se hace necesario identificar y precisar varios aspectos como son los mecanismos de interacción entre los crioprotectores y la membrana espermática y su relación con la osmolaridad seminal, las curvas de congelación, las concentraciones de crioprotectores, la optimización del uso de macropajillas y sus temperaturas de descongelación para su utilización a corto tiempo a nivel comercial y la relación eficiente de espermatozoide - huevo.
Las investigaciones a nivel celular, pueden aportar información que mejore significativamente la estandarización de los protocolos de congelación en semen de peces, sin embargo, la implementación de investigaciones de campo puede permitir un desarrollo mayor de estas herramientas en un tiempo más corto.
Agradecimientos
Este trabajo contó con el apoyo financiero de COLCIENCIAS proyectos Códigos: 1220912396 y 1122-02-13360 y del Instituto de Investigaciones de la Orinoquia Colombiana (IIOC) -Universidad de los Llanos. Los autores agradecen las correcciones y contribuciones de lasProfesoras Dra. Martha Olivera Ángel y Mónica Botero, durante la preparación del manuscrito.
Summary
General aspects of the spermatic cryopreservation in teleosts
The current protocols for cryopreservation of fish semen show many deficiencies in the optimization of fertility rate, and the inter and intra species variations are very high. Few cellular and molecular events have been discovered from the results found by the investigators. The processes of ice crystals formation on an intracellular level, the toxic effect of the cryopreservation and the recrystallization are shown as the aspects of most relevance in the cryoinjury. Hypothesis like the transition of phases of the lipids in the plasmatic membrane and the rupture of the latter for the rapid influx of the water are proposed to explain the cellular injury during the cryopreservation process.
Key words: cryopreservation, fish, semen, spermatozoa, straw, unfreezing.
Referencias
1. Anchordoguy TJ, et al. Insights into the cryoprotective mechanism of dimethyl sulfoxide for phospholipid bilayers. Cryobiology 1991; 28:467-473. [ Links ]
2. Arias, CJA. Contribución al conocimiento biológicos de los peces de los Llanos; yamú (Brycon siebenthale) y Sapuara (Semaprochilodus iaticep), con fines de cultivo. Informe final. Universidad de los Llanos, COLCIENCIAS. 1995. 30 p. [ Links ]
3. Arias CJA. Avances en la nutrición y alimentación del yamú. Memorias VII jornada de Acuicultura. Tercera reunión regional del género Brycon. IALL Unillanos, Villavicencio. 2001. p 4- 8. [ Links ]
4. Babiak I, et al. The effect of egg yolk, low density lipoproteins, methylxanthines and fertilization diluent on cryopreservation efficiency of Northern pike (Esox lucius) spermatozoa. Theriogenology 1999; 52:473-479. [ Links ]
5. Babiak I, et al. Effect of extender composition and equilibration time on fertilization ability and enzymatic activity of Rainbow trout cryopreserved spermatozoa. Theriogenology 2001; 56:177-192. [ Links ]
6. Babiak I, et al. Semen from rainbow trout produced using cryopreserved spermatozoa is more suitable for cryopreservation. J Fish Biol 2002; 60:561-570. [ Links ]
7. Bart AN, Wolfe DF, Dunham RA. Cryopreservation of blue catfish spermatozoa and subsequent fertilization of Channel catfish eggs. Trans Am Fish Soc 1998; 127:819- 824. [ Links ]
8. Bernal W, Contreras P, Uribe M. Caracterización del semen de bocachico (Prochylodus reticulatus, Steindachner, 1878) y evaluación de la motilidad después de la conservación en frío. Memorias VIII Congreso Latinoamericano de Acuicultura. V Seminario Nacional de Acuicultura. La acuicultura y el desarrollo sostenible. Santa Féde Bogotá, 1994. p 286-291. [ Links ]
9. Bromage NR, Roberts RJ. Broodstock management end egg and larval quality. Instituto de Acuacultura. Oxford : Editorial Osney Mead; 1999. 51p. [ Links ]
10. Cabrita E, et al. Sublethal damage during cryopreservation of Rainbow Trout sperm. Cryobiology 1998; 37:245-253. [ Links ]
11. Ciereszko A. Effects of extenders and time of storage before freezing on motility and fertilization of cryopreserved Muskellunge spermatozoa. Trans Am Fish Soc 1999; 128:542- 548. [ Links ]
12. Ciereszko A, Dabrowski K. Estimation of sperm concentration of rainbow trout, whitefish and yellow perch using a spectriphotometric technique. Aquaculture 1993; 109:367-373. [ Links ]
13. Cortés G. Análisis y Criopreservación de semen de cachama (Piaractus brachypomum) (CUVIER, 1918). Inderena (Llanos Orientales) Universidad Javeriana. Memorias IV Reunión Red Nacional de Acuicultura. 1991. p 147-153. [ Links ]
14. Cruz-Casallas PE, et al. Cryopreservation of Yamú Brycon siebenthalae Milt. J World Aquaculture Soc. (En revisión) [ Links ]
15. Dreanno C, et al. Effect of urine on semen quality in turbot (Psetta maxima). Aquaculture 1998; 169:247-262. [ Links ]
16. Drokin S, Stein H, Bartscherer H. Effect of cryopreservation on the fine structure of spermatozoa of Rainbow Trout (Oncorhynchus mykiss) and Brown Trout (Salmo trutta F. Fario). Cryobiology 1998; 37:263-270. [ Links ]
17. Dzuba BB, Kopeika EF. Relationship between the changes in cellular volume of fish spermatozoa and their cryoresistance. CryoLetters 2002; 23:353-360. [ Links ]
18. Fabbrocini A, et al. Cryopreservation of Seabream (Sparus aurata) spermatozoa. Cryobiology 1999; 40:46-53. [ Links ]
19. FAO. Muchos peces y tantos intereses 2003; URL: http://www.fao.org/docrep/003/w4493s/w4493s06.htm [ Links ]
20. Fogli da Silveira, et al. Avaliaçao espermática, preservaçao criogénica e fertilidade do sémen do Pacu Piaractus mesopotamicus (Holmberg, 1887), proveniente de reproduçao induzida. Brasil Inst Pesca 1990; 17:1-13. [ Links ]
21. Gow JC, Kurokura H, Hirano R. Cryopreservation of spermatozoa from rainbow trout, common carp, and Marine Puffer. Nippon suisan Gakkaishi Bull Jap Soc Sci Fish. 1993; 59:777-782. [ Links ]
22. Hammerstedt RH, Graham JK. Cryopreservation of poultry sperm: the enigma of glycerol. Cryobiology 1992; 29:26-38. [ Links ]
23. Holt WV. Basic aspects of frozen storage of semen. Anim Reprod Sci 2000; 62:3-22. [ Links ]
24. Labbé C, et al. Thermal acclimation and dietary lipids alter the composition, but no fluidity, of trout sperm plasma membrane. Lipids 1995; 30:23-33. [ Links ]
25. Labbé C, Maisse G. Influence of rainbow trout thermal acclimation on sperm cryopreservation: relation to change in the lipid composition of the plasma membrane. Aquaculture 1996; 145:281-294. [ Links ]
26. Labbé C, Crowe LM, Crowet JH. Stability of the lipid component of Trout sperm plasma membrane during freeze - thawing. Criobiology 1997; 34:176-182. [ Links ]
27. Labbé C, et al. Effects of sperm cryopreservation on sperm DNA stability and progeny development in Rainbow Trout. Mol Reprod Develop 2001; 60:397-404. [ Links ]
28. Lahnsteiner F. Semen cryopreservation in the Salmonidae and in the Northern pike. Aquaculture Res 2000; 31:245-258. [ Links ]
29. Lahnsteiner F, Weismann T, Patzner R. A uniform method for cryopreservation of semen of the salmonid fishes (Oncorhynchus mykiss Salmo trutta fario., Salmo trutta lacustris, Coregonus sp). Aquaculture Res 1995; 26:801-807. [ Links ]
30. Lahnsteiner F, Weismann T, Patzner R. Cryopreservation of semen of the grayling (Thymallus thymallus) and the Danube salmon (Hucho hucho). Aquaculture 1996; 144:265-274. [ Links ]
31. Lahnsteiner F, Berger B, Horvarth A, Urbanyi B, Weismann T. Criopreservation of spermatozoa in cyprinid fishes. Theriogenology 2000; 54:1477-1498. [ Links ]
32. Leung LK, Jamieson BG. Live preservation of fish gametes. In: Jamiesson BGM. editor. Fish evolution and systematics: Evidence from spermatozoa. ambridge : Cambridge University Press; 1991. p. 245-269. [ Links ]
33. Linhart O, Rodina M, Cosson J. Cryopreservation of sperm in common carp Cyprinus carpio: sperm motility and hatching success of embryos. Cryobiology 2000; 41:241-250. [ Links ]
34. Lovelock JE. The haemolysis of human red blood cells by freezing and thawing. Biochim Biophys Acta 1953; 10:414- 426. [ Links ]
35. Lubzens E, et al. Carp (Cyprinus carpio L.) spermatozoa criobanks - strategies in research an application. Aquaculture 1997; 155:13-30. [ Links ]
36. Mazur P. Fundamental aspects of the freezing of cells, whit emphasis on mammalian ova and embryos. En: 9th International congress on animal reproduction and artificial insemination. Madrid, España, 1980. p. 99-114. [ Links ]
37. Meryman HT. Freezing injury and its prevention in living cells. Ann Rev Biophysics 1974; 3:341-363. [ Links ]
38. Mizukami A, Carrell DT, Peterson CM. Cryopreservation of embryos. En: Encyclopedia of reproduction. vol 1. Utah : Academic Press; 1999. p. 765-772. [ Links ]
39. Mojica JE, Pinzón SM. Ensayos preliminares de crioconservación de semen de bagre rayado (Pseudoplatystoma fasciatum Linnaeus 1766). Trabajo de grado, Facultad de Ciencias Agrarias y Recursos Naturales. Escuela de Medicina Veterinaria y Zootecnia, Universidad de los Llanos, Villavicencio, Colombia, 2002. 42 p. [ Links ]
40. Muldrew K, McGann LE. Mechanisms of intracellular ice formation. Biophys J 1990; 57:525-532. [ Links ]
41. Navarro O. Evaluación de cinco crioprotectores para la crioconservación de semen de cachama blanca (Piaractus brachypomus). Trabajo de grado, Facultad de Ciencias Agropecuarias. Programa de Medicina Veterinaria y Zootecnia, Universidad de Caldas, Manizales, Colombia, 2001. 53 p. [ Links ]
42. Ogier de Baulny B, et al. Flow cytometric evaluation of mitochondrial activity and membrane integrity in fresh and cryopreserved Rainbow trout (Oncorhynchus mykiss) spermatozoa. Cryobiology 1997; 34:141-149. [ Links ]
43. Ohta H, et al. Cryopreservation of the sperm of the Japanese bitterling. J Fish Biol 2001; 58:670-681. [ Links ]
44. Pardo J. Congelación de semen de yamú (Brycon siebenthalae). Trabajo de grado, Facultad de Ciencias Agropecuarias y Recursos Naturales, Escuela de Medicina Veterinaria y Zootecnia, Universidad de los Llanos, Villavicencio, Colombia, 2000. 61 p. [ Links ]
45. Phronen J. Composition and cryopreservation of sperm from some Finnish teleost fish. Finnish Fish Res 1994; 15:27-48. [ Links ]
46. Quinn PJA. Lipid-phase separation model of low temperature damage to biological membrane. Cryobiology 1985; 22:128- 146. [ Links ]
47. Ramos S. Anotaciones sobre inseminación artificial. Facultad de Medicina Veterinaria. Universidad de la Salle, Santafé de Bogota, Colombia, 1986. 22 p. [ Links ]
48. Rana K. Cryopreservation of aquatic gametes and embryos: recent advances and applications. Proceedings of the fifth International Symposium on the Reproductive Physiology of Fish. University of Texas at Austin, 1995; 147 p. [ Links ]
49. Richardson GF, Wilson CE, Crim LW, Yao XZ. Cryopreservation of yellowtail flounder (Pleuronectes ferrugineus) semen in large straws. Aquaculture 1999; 174:89- 94. [ Links ]
50. Ritar AJ, Campet M. Sperm survival during short-term storage and after cryopreservation of semen from Striped Trumpeter (Latris lineata). Theriogenology 2000; 54:467-480. [ Links ]
51. Spinel C. Biología molecular de la célula eucariótica animal. 1 ed. Medellín (Colombia) : Fondo editorial Biogénesis; 2002. p. 31-68. [ Links ]
52. Steinberg H, Hedder A, Baulain R, Holtz W. Cryopreservation of rainbow trout (Oncorhynchus mykiss) semen in straws. Proceedings of the fifth International Symposium on the Reproductive Physiology of Fish. University of Texas at Austin. 1995; 147p. [ Links ]
53. Taddei AR, et al. Is cryopreservation a homogeneous process? Ultrastructure and motility of untreated, prefreezing, and postthawed spermatozoa of Diplodus puntazzo (Cetti). Cryobiology 2001; 244-255. [ Links ]
54. Tiersch TR, et al. Cryopreservation of sperm of the endangered Razorback sucker. Trans Am Fish Soc 1998; 127:95-104. [ Links ]
55. Velasco YM, Arias JA, Cruz PE. Efecto de la inducción hormonal con extracto de hipófisis de carpa (EHC) sobre algunas características seminales de Rhamdia sebae c.f. Memorias II Congreso colombiano de acuicultura. X Jornada de acuicultura IALL. Villavicencio, Colombia, 2004. p. 116- 117. [ Links ]
56. Vincent C, Pruliere G, Pajot-Augy E, Campion E, Douzou P. Biophysical chemical aspects of cellular cryobehavior. Biophysical Chemistry 1998; 29:161-169. [ Links ]
57. Viveiros AT, So N, Komen J. Sperm cryopreservation of African catfish, Clarias gariepinus: cryoprotectans, freezing rates and sperm: egg dilution ratio. Theriogenology 2000; 54:1395-1408. [ Links ]
58. Viveiros AT, et al. Influence of cooling rates and plunging temperatures in an interrupted slow-freezing procedure for semen of the African catfish, Clarias gariepinus. Cryobiology 2001; 43:276-287. [ Links ]
59. Vladic T, Jarvi T. Sperm motility and fertilization time span in Atlantic salmon and Brown trout - the effect of water temperature. J Fish Biol 1997; 50:1088-1093. [ Links ]
60. Watson PF. Recent developments and concepts in the cryopreservation of spermatozoa and the assessment of their post-thawing function. Reprod Fertil Dev 1995; 7:871-891 [ Links ]
61. Watson PF. The causes of reduced fertility with cryopreserved semen. Anim Reprod Sci 2000; 60-61:481-492. [ Links ]
62. Yao Z, et al. Motility, fertility and ultrastructural changes of ocean pout (Macrozoarces americanus L.) sperm after cryopreservation. Aquaculture 2000; 181:361-375. [ Links ]
63. Zachariassen KE, Kristiansen E. Ice nucleation and antinucleation in nature. Cryobiology 2000; 41:257-279. [ Links ]