Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.18 no.1 Medellín Jan./Apr. 2005
Prevención y control de la rinoneumonitis equina
Julián Ruiz Sáenz1, MV
1Investigador Asociado Grupo Inmunovirología - BIOGÉNESIS, Universidad de Antioquia, AA 1226, Medellín, Colombia.
(Recibido: 1 febrero, 2004; aceptado: 13 diciembre, 2004)
Resumen
La rinoneumonitis equina es una enfermedad devastadora, que puede provocar grandes pérdidas económicas en un criadero de caballos y en general en la economía nacional. Esta enfermedad ya ha sido reportada en el país y por esto, realizar un diagnóstico epidemiológico certero es primordial; también es importante, conocer cuales son las estrategias de prevención existentes a escala mundial, las cuales se enfocan principalmente al establecimiento y mantenimiento de los programas de vacunación, que van desde la inmunización con antígenos virales hasta el uso de las vacunas de DNA; a la división y mantenimiento de los caballos en grupos aislados y a impedir la entrada o diseminación del virus en los criaderos. Para los casos en los cuales la prevención no es suficiente, se hace necesario tomar medidas de control adecuadas, como lo son el diagnóstico oportuno, las medidas de aislamiento, cuarentena y desinfección; y el tratamiento terapéutico de los casos individuales. El objetivo, por lo tanto, del presente artículo, es ampliar el conocimiento acerca de estas estrategias para adaptarlas a nuestro medio con el fin de minimizar la diseminación del virus en el país y la posible presentación de epizootias a nivel nacional.
Palabras clave: aborto, herpesvirus equino, tratamiento, vacunación.
Introducción
La rinoneumonitis equina o aborto viral equino, es una de las enfermedades de distribución mundial más graves que pueden padecer los equinos; la enfermedad
es causada por los Herpesvirus equinos tipos 1 y 4 (EHV-1 y EHV-4). Ambos herpesvirus son potenciales factores de riesgo de enfermedad para caballos de
todas las edades y categorías, especialmente para los potros (5).
En Colombia en el año 2001, Ramírez et al (19) de la Universidad Nacional de Colombia lograron por primera vez un aislamiento del EHV. Dicho aislamiento
fue realizado a partir de muestras tomadas de un feto abortado, proveniente de un criadero de equinos, con historia de importación de animales. El EHV-4 y El EHV-1 son Alfaherpesvirus de doble cadena entremezclada de DNA (dsDNA). El genoma completo del EHV-1 se encuentra secuenciado; este posee 150.223 pb, las cuales codifican para proteínas. Se estima que EHV-4 posee cinco kpb menos que EHV-1 (145 kpb). Su reconocimiento como virus distintos se dió en 1981 cuando se demostró que poseían diferentes patrones de restricción de ADN (2,5).
La infección por EHV-1 y EHV-4 se caracteriza por una infección inicial en el tracto respiratorio, que varía de moderada a severa según el estado inmunológico del animal infectado. Los signos característicos son: fiebre, letargia, anorexia, linfadenopatía submandibular y descarga nasal profusa, la cual puede llegar a ser mucopurulenta (2). La infección por EHV-1 particularmente, puede diseminarse a través de la mucosa respiratoria y llegar a causar aborto en los últimos meses de gestación, debido a una viremia asociada a células (linfocitos), resultando en una infección placentaria e infección del feto con subsecuente aborto; muerte perinatal de potros, los cuales presentan una neumonitis con disminución y/o degeneración de los linfocitos del timo y del bazo, la cual facilita las letales infecciones bacterianas secundarias y en algunas ocasiones, sintomatología nerviosa diagnosticada como mieloencefalitis en los animales que sobreviven (5).
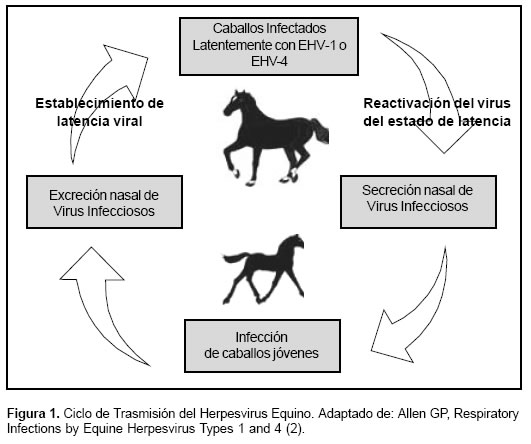
En la mayoría de los casos, la infección primaria por EHV-1 y EHV-4 esta seguida por un estado de latencia viral, en el cual los caballos se encuentran clínicamente sanos. Luego de una situación de estrés (transporte, cambio de medio, preñez etc.) el virus puede reactivarse en estos animales infectados e infectar a otros caballos sanos; llegando a ser enzoóticos en muchas poblaciones de caballos domésticos del mundo, en los cuales se desenvuelven en un ciclo ecológico, el cual se desarrolla dentro del caballo (2) (véase Figura 1).
Para la identificación de los animales infectados existen gran cantidad de técnicas, siendo la más apropiada el aislamiento viral, seguida de una confirmación serológica de la entidad. El virus se puede aislar de secreciones nasales, durante la infección en el tracto respiratorio; también de muestras de hígado, pulmón, bazo o timo de los fetos abortados y de una simple muestra de sangre tomada al animal en la fase aguda de la enfermedad (1,6).
Prevención y Control de BrotesLas medidas más efectivas para prevenir la infección EHV en una población de caballos, son todas aquellas que minimicen el contacto de los animales con los reservorios biológicos conocidos del virus, los cuales pueden servir como fuente directa de infección natural para caballos susceptibles; entre estos reservorios están los caballos infectados activos, los cuales liberan progenie viral en las secreciones nasales, los fetos, membranas fetales o secreciones del tracto reproductivo de una yegua, luego de esta haber abortado por EHV (3).
Las estrategias, por consiguiente, están dirigidas a:
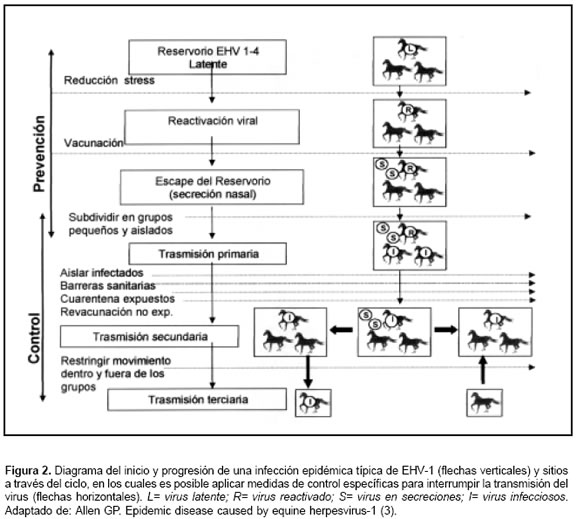
1) mantener la vacunación, logrando un nivel eficaz de resistencia inmunomediada a la infección por EHV, 2) subdividir y mantener la población equina en pequeños grupos de caballos, física y epidemiológicamente aislados, 3) minimizar los riesgos de introducción exógena de la infección a los grupos de caballos ya establecidos y 4) reducir las prácticas asociadas con el riesgo de reactivación del virus en el portador latente, inducida por una condición de estrés en un caballo dentro de un grupo aislado (3,24) (véase Figura 2). Estas estrategias serán discutidas más adelante.
Inmunización Profiláctica
Grandes brotes de aborto, muerte perinatal de potros y mieloencefalitis asociada a EHV pueden ocurrir después de una rigurosa y regular vacunación
con preparaciones comerciales de vacunas anti-EHV. Tales brotes posvacunales pueden ser atribuidos a la exposición a una cantidad de inóculo viral suficiente para sobrepasar la inmunidad vacunal existente, a la exposición a una cepa particularmente agresiva del virus (Cepa Hipervirulenta) o al funcionamiento subóptimo de la actual generación de vacunas contra EHV. Sin importar la causa, el potencial presente de falla en la vacunación contra EHV debe estar integrado a los programas de control de la infección en los hatos, los cuales no son sólo dependientes de los beneficios de la vacunación para prevenir la infección (3).
Según Foote et al (7) en un estudio realizado en el año 2000, sólo un 29% de las yeguas y un 47% de los potros vacunados con una vacuna comercial a virus inactivado contra EHV-1 y EHV-4 (Duvaxyn®), respondieron luego de una vacunación en New South Wales, Australia. Este estudio sugiere un conocimiento del estatus de anticuerpos de la población de caballos a vacunar para direccionar una estrategia de vacunación más selectiva, llevando a menores perdidas económicas en la industria, representadas en la falta de respuesta a la vacunación en los animales persistentemente infectados, los cuales pueden llegar a ser el 17% de la población y en los animales con anticuerpos circulantes, los cuales disminuyen su respuesta inmune (7). Resultados similares reportaron Mumford et al (15), demostrando solo un 35% de seroconversión en un hato centinela en Colorado, luego de una vacunación contra EHV.
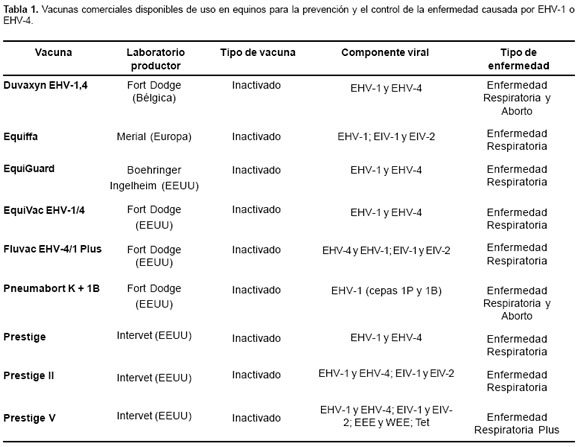
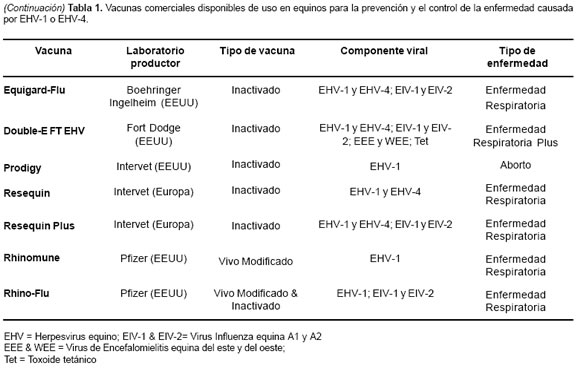
A pesar de la reconocida falta de eficacia en las vacunas de hoy en día contra EHV, la estimulación regular del sistema inmune del caballo por inmunización con antígenos virales, permanece siendo el mayor componente de defensa contra la enfermedad (3) (véase Tabla 1). La vacunación debe de iniciarse a los 5 a 6 meses de edad del potro que es la edad más susceptible de infección (2), ya que la presencia de altos niveles de anticuerpos maternales antes de esta edad puede inhibir la respuesta a la vacunación (28). Un sistema efectivo de vacunación incluye dos dosis intramusculares de la vacuna, con un intervalo de tres semanas entre estas; iniciando el esquema antes del destete y realizando revacunaciones cada 6 meses (2). Las yeguas se deben vacunar a los 5, 7 y 9 meses de gestación con la vacuna indicada, la cual debe ser con virus inactivado. Este plan ha demostrado ser efectivo y presenta grandes beneficios en la disminución de abortos (26). Actualmente ninguna vacuna protege contra las manifestaciones de la infección en el sistema nervioso central (2).
Actuales estrategias vacunales
Actualmente se encuentra bajo estudio una vacuna a virus vivo modificado, con base en el clon C147 de la cepa M8 de un aislamiento alemán; este clon es común a EHV-1 y EHV-4 y ha logrado niveles de protección mayores del 80% contra el aborto causado por EHV-1 con una sola vacunación intranasal, luego de un reto experimental entre 4 y 6 meses posvacunación (17). Además, proporciona protección contra la enfermedad respiratoria causada por EHV-1 y EHV-4 en grupos de caballos adultos susceptibles, vacunados intranasalmente y protege potros con niveles altos de anticuerpos maternos para EHV-1 y EHV-4 contra enfermedad respiratoria febril causada por EHV-1 luego de una sola dosis intranasal, lo que la postula como una buena alternativa para inmunizar grupos mixtos de caballos y especialmente de potros (18).
Los objetivos de esta industria manufacturera de vacunas contra EHV-1, siguen siendo: 1) la estimulación de una efectiva inmunidad celular (células T citotóxicas), la cual no se logra con las vacunas de “virus muerto” (14,22) y 2) el desarrollo de anticuerpos neutralizantes en las superficies mucosas del tracto respiratorio y anticuerpos neutralizantes a nivel sistémico (28). El actual desarrollo de vacunas de ADN provee una gran alternativa en el desarrollo de una fuerte inmunidad contre EHV, debido a la facilidad para utilizar fragmentos virales altamente inmunogénicos y con posibilidad de lograr los objetivos planteados (22,23).
Se ha estudiado en particular, el potencial de vacunas a partir de las glicoproteínas de envoltura de EHV-1, usando un modelo murino de enfermedad respiratoria causada por EHV-1. De las glicoproteínas analizadas, la glicoproteína D de EHV-1 (gD EHV-1) es la que proporciona los niveles más altos de protección en los modelos murinos evaluados (28). Ruitenberg et al (21), evaluaron el potencial de la inmunización mediada por DNA que codifica para la gD de EHV-1 inyectando ratones, los cuales desarrollaron anticuerpos neutralizantes tipo IgG y respuesta de linfocitos T (Th1), produciendo una respuesta protectora ante un reto experimental con el virus (21). Luego Walker et al (27), al inmunizar ratones BALB/c con DNA que codificaba para esta glicoproteína de EHV-1, encontraron que la gD de EHV-1 tenía un gran potencial como posible vacuna para prevenir el aborto causado por EHV-1. Una estrategia de una primoinmunización con DNA codificante para la gD de EHV-1 seguido por una revacunación con una gD recombinante como proteína, lleva a un aumento en los títulos de anticuerpos neutralizantes y a una liberación más rápida de la infección experimental que con alguna de las dos (la glicoproteína recombinante o la gD DNA) individualmente (20,28).
Los resultados indican que este antígeno y la estrategia de primovacunación pueden ser usados para generar inmunidad protectora contra EHV-1 en caballos; pero aún existen pocos reportes del uso y evaluación de esas proteínas recombinantes en caballos. En 1999, Whalley et al (28) reportaron el uso de un Canarypoxvirus que expresaba gB, gC y gD de EHV-1 (Cepa Kentucky D) en caballos, logrando una disminución en la excreción de virus luego de un reto experimental; estudios previos in Vitro, habían demostrado que cerca del 50% de los caballos adultos con anticuerpos preexistentes anti-EHV-1 y anti-EHV-4 al ser inoculados intramuscularmente con DNA que codifica para la gD de EHV-1, obtienen un aumento importante en los títulos de anticuerpos neutralizantes y de ELISA (20).
Esta respuesta, aún en presencia de anticuerpos circulantes, apoya la idea de que la vacunación con DNA es capaz de estimular la respuesta inmune en etapas tempranas de vida (20, 28). Esto puede ser muy ventajoso debido a que sabe que los potros pueden infectarse a tempranas edades (10,11), cuando las cuales poseen altos niveles de anticuerpos maternales, los cuales impiden una respuesta adecuada con la vacunación comercial (20). Un estudio comparativo entre la respuesta inmune generada por la gD EHV y una vacuna comercial a virus inactivado (Duvaxyn®), mostró en la evaluación con el test de ELISA y la neutralización de anticuerpos, que la gD de EHV producía un mayor incremento en la respuesta de los anticuerpos que la vacuna comercial (28).
El uso de subunidades recombinantes de proteínas provee una mayor flexibilidad en la formulación de vacunas, con la posibilidad de usar mezclas de antígenos de uno o varios virus, o aún otros tipos de patógenos. Pueden diseñarse cocteles complejos para optimizar la respuesta de las diferentes armas del sistema inmune, con la ventaja de poder distinguir anticuerpos vacunales de anticuerpos posinfección.
Además, puesto que los anticuerpos para gD de EHV-1 también neutralizan EHV-4, es posible que alguna respuesta protectora de la gD contra EHV-1 tenga efecto también sobre EHV-4 (28).
Recientemente, Holznagel et al (12), utilizaron la tecnología de Inmunización Epidermal en Polvo (EPI), la cual libera antígeno vacunal inactivado intradérmicamente unido a partículas de azúcares, utilizando una “pistola de Helio”, para inmunizar caballos contra la enfermedad respiratoria causada por EHV-1. Los caballos fueron inmunizados en la región inguinal, y el antígeno preparado a partir la cepa Army 183 de EHV-1; esta estrategia no ha logrado demostrar una eficacia superior al 20% pero permanece en estudio como una posible técnica vacunal, la cual ha logrado previamente inducir altos niveles de anticuerpos sistémicos específicos contra EHV-1 en ratones (12). Resultados similares reportaron Kondo et al (13), los cuales usando la misma técnica en la piel abdominal de ratones y una doble inmunización, logran alcanzar niveles de protección contra el reto con el virus silvestre equivalentes o superiores a los obtenidos en ratones inmunizados con otros tipos de vacunas, incluyendo vacunas de gD DNA y las vacunas comerciales inactivadas de uso intramuscular o intranasal.
Implementación de prácticas preventivas de manejo en los hatos
Pequeños grupos de caballos física y epidemiológicamente aislados. Esta estrategia ha resultado ser la más eficiente para controlar los brotes de la enfermedad. El potencial de pérdidas durante un brote de EHV está directamente relacionado con el tamaño del hato. Para una máxima protección, los grupos deben de ser tan pequeños como las instalaciones físicas lo permitan, manteniendo cada grupo dentro de condiciones que limiten la transmisión del virus entre los grupos establecidos. En ausencia de la transmisión viral entre los grupos de caballos, se limita la transmisión de la enfermedad.
Los caballos, de ser posible, deben ser segregados en grupos semejantes que eviten la mezcla de potros con animales adultos, de yeguas en gestación con yeguas vacías, de caballos con burros y mulas, entre otros. En los grupos de yeguas gestantes es importante que los grupos de yeguas a parir se establezcan desde tempranos estados de gestación para facilitar el establecimiento de jerarquías sociales antes del incremento en la vulnerabilidad al aborto por EHV en el último tercio de la gestación; que estos grupos se formen con base en las fechas esperadas de parto y no combinar yeguas primerizas con yeguas reproductoras de mas partos (3,26).
Prevención de la introducción exógena de la infección a los grupos aislados. El contacto con otros caballos infectados es la fuente de infección para iniciar un brote de la enfermedad en un grupo cerrado. El procedimiento debe estar enfocado a prevenir cualquier contacto con caballos de fuera del grupo epidemiológico. El riesgo de infección exógena por EHV se reduce usando barreras de espacio entre los potreros. Este espacio es suficiente para prevenir la transmisión por aerosoles entre grupos.
El mayor riesgo para la infección exógena es la introducción de nuevos caballos en los grupos ya establecidos, particularmente los que han tenido posibilidad de estar expuestos a la infección (exposiciones, ferias, carreras, entrenamientos externos, etc.). Todos los caballos, aún los que no presenten signos clínicos de la enfermedad, deben considerarse posibles portadores del EHV, con potencial para diseminar el virus. La adición de nuevos animales en los grupos ya establecidos, deberá estar precedida por un período de cuarentena de 21 días. Un caballo que sea temporalmente removido de su grupo para propósitos que involucren transporte prolongado o estar en contacto con otros caballos (reproducción, exhibición, entrenamiento, cuidados veterinarios, ventas etc.) deberá también entrar en un período de cuarentena de 21 días antes de retornar a su grupo de residencia (3,26).
Prevención de la introducción endógena de la infección por EHV en grupos aislados. Debido a la endemicidad de EHV, es frecuente la ocurrencia de la enfermedad clínica en grupos cerrados de caballos, los cuales no han tenido contacto con animales de fuera. Muchos caballos portadores latentes, pueden reclutar a los potros como nuevos hospederos dentro del ciclo biológico de la entidad. La alta prevalencia de portadores latentes imposibilita la práctica de identificar y separar los portadores latentes del hato. Las medidas de prevención están enfocadas a minimizar las situaciones de estrés experimentado por los caballos (3,26)
Las tres medidas de prevención, no son medidas aisladas, cada una es una parte esencial dentro del proceso de prevención y control. La omisión de uno de los procesos interrelacionados puede comprometer todos los demás. La puesta en práctica de tales medidas de prevención agrega un valor financiero y cargas de trabajo a las operaciones de manejo, el implementar las precauciones necesarias depende de cada hato, al igual que el rigor de las políticas del control del EHV. Estas deben ser un compromiso entre el deseo de reducir el riesgo y la factibilidad y viabilidad económica que se tenga para realizar dichos procedimientos (3).
Manejo y control durante brotes
Las prioridades para el manejo de un brote de la enfermedad son:
Establecimiento de un diagnóstico temprano. EHV se disemina rápidamente y requiere intervención inmediata. La identificación temprana del agente es necesaria para la rápida ejecución de medidas de control apropiadas. Además, el éxito de tales medidas es mayor cuando la intervención es realizada de manera temprana en la curva epidémica.
El diagnóstico puede ser logrado por aislamiento viral en el laboratorio a partir de muestras de: 1) exudados nasofaríngeos colectados en una esponja de dacrón y mantenidos en un medio de transporte líquido o en gel; 2) 15-20 ml de sangre venosa colectada con anticoagulante (EDTA, citrato, heparina). Ambos especímenes deben ser tomados en tempranos estados de la enfermedad y transportados inmediatamente al laboratorio en refrigeración (1,3). El serodiagnóstico retrospectivo de infección por EHV puede ser demostrado con un aumento de mínimo cuatro veces en los títulos virales, en muestras de suero de la fase aguda y la fase convaleciente determinados por medio de un test de ELISA, fijación del complemento o neutralización viral (1); o por medio de los modernos test de ELISA o PCR los cuales son rápidos y sensibles (6,25), y algunos se encuentran comercialmente disponibles (4,30).
Prevención de la dispersión del virus. Del caballo infectado a los demás caballos del grupo o a caballos de otros grupos, ambos dentro y fuera del predio afectado, por medio de prácticas de desinfección, aislamiento y cuarentena de animales. Para aislar el foco de la infección, los fetos abortados y los mortinatos deben ser colocados en bolsas plásticas selladas y trasportados al laboratorio de manera que se evite la posible contaminación del medio con el virus. En casos de brotes, algunos animales pueden presentar pirexia, secreciones nasales o anormalidades al paso, estos animales deben aislarse físicamente, lejos del resto de la población. Los espacios físicos donde estuvo el foco original de la infección también deben ser puestos en aislamiento y desinfectados (3).
Interrupción de las rutas de transmisión. Establecer barreras de espacio y barreras sanitarias alrededor del foco de la infección, son importantes para controlar la transmisión indirecta del virus por transmisión aérea y por objetos inanimados. También es recomendable el uso de desinfectantes químicos para inactivar el virus que se encuentre en el medio, o en objetos inanimados como guantes, botas, instrumentos de aseo de los animales, comederos, bebederos, etc., los cuales sirven como vehículos de diseminación al virus. Después de un aborto causado por EHV, se debe desinfectar la pesebrera, desinfectar y cambiar la “cama” del animal, además los genitales externos de la yegua deben ser lavados y desinfectados antes de ponerla en cuarentena.
De ser posible el personal debe usar guantes desechables de látex y botas de caucho, que sean posibles de desinfectar. La viruta de la “cama” del animal infectado debe ser rociada con desinfectantes y descartada en bolsas plásticas. Se debe evitar el tránsito innecesario del personal, vehículos etc., a la zona de cuarentena. Todos los caballos expuestos al animal infectado se deben de considerar como posibles infectados y por tanto deben permanecer dentro de una cuarentena de movimiento restringido. Se les debe observar diariamente para detectar posibles signos de enfermedad para proceder a un aislamiento del caso individual. Esta cuarentena debe durar hasta controlar el brote. Las yeguas que han abortado pueden ser servidas de nuevo el segundo estro luego del aborto (3).
Minimizar el número de caballos susceptibles a la enfermedad. La restricción del transporte de animales, tanto dentro como fuera del grupo de animales afectados, puede minimizar el número de animales en riesgo de enfermar. Los potros huérfanos de yeguas que mueren como resultado de la infección por EHV no deben ser enviados a otros grupos. Crear un “cordón inmune” alrededor del foco de la infección puede ayudar a reducir el número de caballos susceptibles; este se logra mediante la administración de la vacuna a las yeguas sin vacunar, expuestas y no expuestas, además de revacunaciones en las gestantes. Debido a la posibilidad de exacerbación de los signos neurológicos causada por la vacunación, no se recomienda revacunar cohortes de animales afectados por mieloencefalopatía causada por EHV (3) (véase Figura 2).
Tratamiento terapéutico de los casos clínicos individuales. Las estrategias terapéuticas para el manejo de la infección por EHV deben enfocarse a cada paciente, guiados por la severidad y rango de los signos clínicos, además de las expectativas del propietario. Los objetivos de la terapia están dirigidos a: disminuir los signos clínicos de la infección viral; mantenimiento de la hidratación y aporte diario de las necesidades calóricas de los animales afectados; y minimizar las complicaciones, producto de las infecciones bacterianas secundarias y de la dispersión sistémica del virus (2).
Dos terapias de mantenimiento para animales con rinoneumonitis equina sin complicaciones son: Usar antipiréticos para reducir la fiebre y antiinflamatorios no esteroideos para disminuir la inflamación del tracto respiratorio. Estos dos requerimientos pueden ser suministrados con la aplicación de un medicamento que posea ambas propiedades farmacológicas (p.e. Fenilbutazona 3 mg/kg PO cada 12 a 24 horas o Flunixin meglumine 1.1 mg/kg IM cada 12 a 24 horas) (2).
Cuando el epitelio respiratorio se encuentra lesionado por la replicación de EHV-1 o EHV-4 ocurren casos de rinofaringitis bacteriana la cual se puede tratar con una solución de Trimetoprim/Sulfa (30 mg/kg PO cada 24 horas) administrada durante 7 - 10 días. Esta es una excelente terapia antibacterial de amplio espectro de primera opción debido a su facilidad de administración con solo una dosis diaria (2).
En potros (neonatos) infectados congénitamente o en caballos jóvenes, en los cuales los signos clínicos de la infección bacteriana son severos, progresivos o involucran las vías aéreas inferiores, los antimicrobiales opcionales para realizar el tratamiento incluyen: Amikacina (20 mg/kg, IM cada 24 horas), Penicilina G procaínica (20.000 UI/kg, IM cada 12 horas), Ceftiofur (2.2 mg/kg, IM cada 12 horas), Ticarcilín (44 mg/kg, IV cada 8 horas), y Ceftazidine (25 mg/kg, IV cada 8 horas) (2).
Las manifestaciones extrapulmonares de la infección, presentan mayores retos para el manejo terapéutico. Los caballos incapaces de comer o beber pueden requerir una terapia de reemplazo de fluidos y electrolitos, con soluciones isotónicas que contengan dextrosa, administradas intravenosamente. En potros recién nacidos que presenten disfunción respiratoria e hipoxemia, está bien indicada una terapia intranasal con oxígeno humidificado. El tratamiento estándar para caballos con parálisis asociada a EHV-1 incluye la administración de Dimetil Sulfóxido (3 ml/kg, cada 24 horas) vía nasogástrica, junto con la administración parenteral de un corticosteroide (Dexametasona 0.1 mg/kg, IV cada 24 horas). Los caballos con parálisis de la pared o el esfínter de la vejiga, asociada con mieloencefalitis por EHV-1 requieren generalmente cateterización urinaria, una vez cateterizada, lavar la vejiga con una solución de Yodopovidona y realizar tratamiento antibiótico para cistitis. Los caballos que presentan recumbencia por enfermedad neurológica debida a EHV-1 requieren cuidados intensivos y vigilancia las 24 horas del día, ligera sedación, una cama gruesa y frecuente reubicación del lado recumbente, limpieza diaria y cuidado tópico de las ulceras decúbito y el escaldado producido por la orina. La ayuda con cinchas mecánicas por cortos períodos de tiempo, puede ayudar en algunos casos (2,3).
La eutanasia debe ser considerada en caballos recumbentes laterales, en animales que no muestran mejoría en pocos días a pesar de la ayuda mecánica o en animales que desarrollen complicaciones sistémicas severas, debidas a la recumbencia (2).
En algunos casos (Infección neonatal por EHV-1, estados tempranos de un brote de aborto o mieloencefalitis etc.), las drogas antivirales ofrecen un nuevo y relativamente inexplorado, pero potencialmente promisorio, modo de tratamiento para casos individuales o para limitar la dispersión de la infección epizoótica (3,8,16), usado a dosis de 10 mg/ kg vía oral, 5 veces al día por un periodo de 3-4 días (29).
En caballos en entrenamiento, caballos de trabajo y en general, es necesario tener en cuenta que una importante ayuda para el tratamiento activo es el descanso temporal (2).
Otra alternativa para el tratamiento la ofrece el Dr. Gaggl (9), el cual presenta el uso de la acupuntura como terapia en casos de infección crónica por herpesvirus en equinos (9), aunque esta requiera de un entrenamiento previo.
Manejo posbroteLas medidas a tomar luego de finalizado un brote de infección por EHV incluyen: 1) liberación de la cuarentena, 2) dispersión de los caballos afectados, 3) descontaminación final de los predios y 4) volver a las prácticas de manejo preventivo para evitar la recurrencia (3).
El tiempo adecuado para la cuarentena debe de ser tres veces el tiempo usual de dispersión del virus en un caballo adulto (3 x 7 días = 21 días) una vez que no haya ningún suceso posible de enfermedad (3).
Para la desinfección terminal de los sitios se deben usar los desinfectantes de tipo fenólicos o yodóforos. Los instrumentos que requieren desinfección final incluyen las pesebreras, establos, “cama” usada, comederos y bebederos, botas y ropas, utensilios para realizar tratamientos y de limpieza de los animales, y el interior de los vehículos de transporte de los caballos. La inactivación de los sitios contaminados puede ocurrir naturalmente con el paso del tiempo, para esta un período de 21 días sin la presencia de animales, se puede considerar seguro para la repoblación sin riesgo de infección (3).
Permanencia de las medidas de controlExisten tres importantes aspectos que no se deben descuidar luego de un brote epizoótico de enfermedad por EHV: 1) análisis y evaluación pos-epizootia de la eficacia de las medidas de control tomadas durante la presentación, 2) implementación de medidas preventivas en los predios afectados, con el objetivo de evitar que se repitan los brotes de la infección (véase Figura 2) y 3) reportar la presencia de la enfermedad y la experiencia obtenida en su manejo y control, con el fin de beneficiar a otros colegas, criadores, propietarios etc. (3).
Esta información debe servir como base de trabajo, tanto como para clínicos, como para criadores, entes oficiales etc., los cuales deberán permanecer alertas ante cualquier presentación de casos, para así tomar las medidas más adecuadas, siempre pensando en la rentabilidad de la industria equina colombiana. Además, se realiza un llamado a los entes nacionales de cría y apoyen la investigación epidemiológica de la producción equina (Asociaciones de criadores, enfermedad y los programas de prevención y control criaderos, hipódromos etc.) para que fomenten y que oportunamente se promulguen.
Agradecimientos
El autor quiere agradecer al Grupo de Inmunovirología - Biogénesis por la formación y el apoyo brindado y al Grupo de Estudio Sobre Equinos (G.E.S.E.) de la Universidad de Antioquia por el respaldo incondicional.
Summary
Prevention and control of equine rhinopneumonitis
Equine rhinopneumonitis is a devastating disease, that can cause great economic lost in a horse’s farm and general in the national economy. This disease already has been reported in Colombia and it is fundamental to make an epidemiological diagnosis. It is also very Important to know which are the existing prevention and control strategies on a world wide basis, which principally are in focus on the vaccination programs, on the division and segregation of the horses in isolate group and diminish the entrance and the dissemination of the virus in the farms. For cases in which prevention strategies are not sufficient, it is necessary took right measures as an opportune diagnosis, isolation, quarantine and desinfection and the therapeutic management of individual cases.
By this, the objective of the present article is to extend the knowledge about this strategies to adapt them to our means, to diminish the dissemination of the virus around the country and the possible presentation of an epidemy at a national level.
Key words: abortion, equine herpesvirus, treatment, vaccination.
Referencias
1. Allen GP, Equine Rhinoneumonitis en: Truszczynski M, Pearson JE, Edwards S and Schmitt B, (eds). OIE Manual of standars for diagnostic test and vaccines, 4th ed, OIE press, Paris 2000; 565-75.
[ Links ]2. Allen GP, Respiratory Infections by Equine Herpesvirus Types 1 and 4, In: Equine Respiratory Diseases, Lekeux P. (Eds) International Veterinary Information Service, Ithaca NY, 2002; En: http://www.ivis.org/special_books/ Lekeux/allen/IVIS.pdf (revisado en 2004).
[ Links ]3. Allen GP. Epidemic disease caused by equine herpesvirus-1: recommendations for prevention and control. Equine Vet Educ 2002; 14:136-42.
[ Links ]4. Crabb BS, MacPherson CM, reubel GH, Browning GF, Studdert MJ, et al. A type-specific serological test to distiguish antibodies to equine herpesvirus 4 and 1. Arch Virol 1995; 140:245-58.
[ Links ]5. Crabb BS, Studdert MJ. Equine Rhinoneumonitis (equine Herpesvirus 4) and Equine Abortion (equine Herpesvirus 1) En: Studdert MJ (ed.) Virus Infections of Equines. Holanda ELSEVIER 1996; 356 p.
[ Links ]6. Daly P, Doyle S. The development of a competitive PCRELISA for the detection of equine herpesvirus-1. J Virol Methods 2003; 107:237-44.
[ Links ]7. Foote CE, Love DN, Gilkerson JR, Whalley JM. Serological responses of mares and weanlings following vaccination with an inactivated whole virus equine herpesvirus 1 and equine herpesvirus 4 vaccine. Vet Microbiol 2002; 88:13-25.
[ Links ]8. Friday PA, Scarratt WK, Elvinger F, Timoney PJ, Bonda A. Ataxia and paresis with equine herpesvirus type 1 infection in a herd of riding school horses. J Vet Intern Med 2000; 14:197-201.
[ Links ]9. Gaggl G. Equine Herpesvirus infection. Acase report. Komvet 1998; 2.
[ Links ]10. Gilkerson JR, Love DN, Drummer HE, Studdert MJ, Whalley JM. Seroprevalencce of equine herpesvirus 1 in Thoroughbred foals before and after weaning. Aust Vet J 1998; 76:677-82.
[ Links ]11. Gilkerson JR, Whalley JM, Drummer HE, Studdert MJ, Love DN. Epidemiology of EHV-1 and EHV-4 in the mare and foal populations on a Hunter Valley study farm: are the mares the source of EHV-1 for unweaned foals. Vet Microbiol 1999; 65:27-34.
[ Links ]12. Holznagel D, Lunn DP, Breathnach C. Immune response to an inactivated equine herpesvirus-1 vaccine by epidermal powder immunization. SRP Biology 2002:39-42; En: http://www.wisc.edu/cbe/srp-bio/pdf/holznagel_compressed.pdf (revisado en 2004)
[ Links ]13. Kondo T, McGregor M, Chu Q, Chen D, Horimoto T, et al. A protective effect of epidermal powder immunization in a mouse model of equine herpesvirus-1 infection. Virol 2004; 318: 414- 19.
[ Links ]14. Kydd JH, Wattrang E, Hannant D. Pre-infection frequencies of equine herpesvirus-1 specific, cytotoxic T lymphocytes correlate with protection against abortion following experimental infection of pregnant mares. Vet Immunol Immunopathol 2003; 96:207-17.
[ Links ]15. Mumford EL, Traub-Dargatz JL, Carman J, Callan RJ, Collins JK, Goltz KL, et al. Occurrence of infectious upper respiratory tract disease and response to vaccination in horses on six sentinel premises in northern Colorado. Equine Vet J 2003; 35:72-7.
[ Links ]16. Murray MJ, Del Piero F, Jeffrey SC, Davis MS, Furr MO, et al. Neonatal equine herpesvirus type 1 infection on a thoroughbred-breeding farm. J Vet Intern Med 1998; 12: 36-41.
[ Links ]17. Patel JR, Bateman H, Williams J, Didlick S. Derivation and characterization of a live equid herpes virus-1 (EHV-1) vaccine to protect against abortion and respiratory disease due to EHV-1. Vet Microbiol 2003; 91:23-39.
[ Links ]18. Patel JR, Foldi J, Bateman H, Williams J, Didlick S, et al. Equid herpes virus-1 (EHV-1) live vaccine strain C147: efficacy against respiratory diseases following EHV 1 and 4 challenges. Vet Microbiol 2003; 92:1-17.
[ Links ]19. Ramírez GC, Chaparro JJ, Vera VJ, Villamil LC, Romero JR. Primer aislamiento de herpesvirus equino en Colombia. Rev Col Cienc Pec 2001; 14, sup: 71.
[ Links ]20. Ruitenberg KM, Love DN, Gilkerson JR, Wellington JE, Whalley JM. Equine herpesvirus 1 (EHV-1) glycoprotein D DNA inoculation in horses with pre-existing EHV-1/EHV-4 antibody. Vet Microbiol 2000; 76:117-27.
[ Links ]21. Ruitenberg KM, Walker C, Wellington JE, Love DN, Whalley JM. Potencial of DNA-mediated vaccination for equine herpesvirus 1. Vet Microbiol 1999; 68:35-48.
[ Links ]22. Slater J, Duncan H. Equine immunity to viruses. Vet Clin of North Am: equine practice 2000; 15:49-66.
[ Links ]23. Soboll G, Whalley JM, Koen MT, Allen GP, Fraser DG, et al. Identification of equine herpesvirus-1 antigens recognized by cytotoxic T lymphocytes. J Gen Virol 2003; 84:2625-34.
[ Links ]24. University of Pennsylvania School of Veterinary Medicine. Equine Pregnancy Losses in Pennsylvania. Bellwether 2001; 51:8-9.
[ Links ]25. Varrasso A, Dynon K, Ficorilli N, Hartley CA, Studdert MJ, et al. Identification of equine herpesviruses 1 and 4 by polymerase chain reaction. Aust Vet J 2001; 79:563-69.
[ Links ]26. Vickers ML, Powel DG. Equine Herpes Virus abortions. Equine Diseases Quarterly 2001; 10: 3.
[ Links ]27. Walker C, Ruitenberg K, Love DN, Whalley JM. Inmunization of BALB/c mice with DNA encoding equine herpesvirus 1 (EHV-1) glycoprotein D affords partial protection in a model of EHV-1 -induced abortion. Vet Microbiol 2000; 76:211-20.
[ Links ]28. Whalley JM, Love DN. Improved vaccine strategies for management of equine herpesviruses. Rural Industries Research and Development Corporation. Sydney, 2002; 28p.
[ Links ]29. Wilkins PA, Henninger H, Reed SM and F. Del Piero. Acyclovir as Treatment for EHV-1 Myeloencephalopathy. In: Proceedings of 49th Annual Convention of the American Association of Equine Practitioners, 2003, New Orleans, Louisiana, (Ed.); En: http://www.ivis.org/proceedings/AAEP/2003/wilkins/IVIS.pdf (revisado en 2004).
[ Links ]30. Yasunaga S, Maeda K, Matsumura T, Kai K, Iwata H, et al. Diagnosis and sero-epizootiology of equine Herpesvirus type 1 and type 4 infections in Japan using a type specific ELISA. J Vet Med Sci 1998; 60:1133-37.
[ Links ]