Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.18 no.2 Medellín July/Sep. 2005
Efecto de la heparina y de la concentración espermática sobre el porcentaje de fertilización de oocitos bovinos in vitro
Roger D Salgado1,3 , MVZ,MSc; Clara C Rugeles2,3, MVZ,MSc; Jaime Alvarez1,3 , MVZ, Esp
1 2 Programa de Reproducción animal Programa de morfofisiología
3 Facultad de Medicina Veterinaria y Zootecnia, Universidad de Córdoba
(Recibido: 21 octubre, 2004; aceptado: 9 junio, 2005)
Resumen
El objetivo de este estudio fue evaluar el efecto de diferentes concentraciones de heparina y de semen en el medio de fertilización sobre el porcentaje de oocitos bovinos fertilizados in vitro. En el experimento uno, los oocitos obtenidos de ovarios de matadero fueron madurados in vitro y distribuidos al azar en seis tratamientos para fertilización in vitro, de acuerdo a las concentraciones de heparina (2, 4, 8, 10, 16, 20 µg/ml). En el experimento dos, una vez seleccionada la concentración de heparina en experimento 1, se evaluaron tres dosis de espermatozoides en el medio de fertilización (0.5x106 espermatozoides/ml, 1x106espermatozoides/ml y 2x106espermatozoides/ml). En cada experimento se utilizó un diseño completamente al azar y los datos fueron analizados por ANAVA. La concentración de heparina tuvo efecto (p<0.05) en el porcentaje de oocitos fertilizados encontrándose los mejores resultados en la concentración de 10 µg/ml, con una tasa de penetración del 67%. La concentración espermática afecta la fertilización, encontrándose la mayor proporción de oocitos con fertilización normal (74%) al utilizar concentración 2x106 espermatozoides/ml. Sin embargo, no fue significativamente diferente a la concentración de 1x106 (p>0.05). Los resultados indican que la tasa de fertilización guarda relación directa con la dosis de heparina y la concentración espermática.
Palabras clave: bovino, fertilización in vitro, heparina, swim up.
Introducción
Los espermatozoides mamíferos no son capaces espermatozoides a través del tracto reproductivo de fertilizar oocitos inmediatamente después que son femenino y la reacción acrosómica cuando los depositados en el tracto reproductivo femenino; espermatozoides se unen a la zona pelúcida (14,15), ellos primero tienen que sufrir un periodo de mientras que in vitro, una de las formas preparación llamado capacitación. Durante la ampliamente utilizadas consiste en la exposición del capacitación se dá la alteración de la membrana semen a la heparina para que puede adquirir la plasmática para permitir al espermatozoide realizar capacidad fertilizante. De esta manera, el objetivo la fusión de la membrana plasmática y membrana de este trabajo fue evaluar diferentes acrosomal externa, denominada reacción concentraciones de heparina y número variable de acrosómica. In vivo, la capacitación espermática células espermáticas para alcanzar óptimos es adquirida durante la migración de los resultados en fertilización de oocitos bovinos in vitro.
Materiales y métodos
Los ovarios fueron obtenidos de vacas sacrificadas en matadero, colocados en solución salina 9% a una temperatura de 30-35ºC. y transportados al laboratorio en un tiempo de 30 minutos. La colección de oocitos y la maduración in vitro (IVM) fueron realizadas por el método previamente descrito por Chacón y Estrada (3). El medio de maduración consistió en: medio-199 con 0.026M de bicarbonato de sodio, pH 7.4; suplementado con 10% (v/v) de suero de vaca en estro recolectado el primer día del estro e inactivado a 56ºC por 30 minutos.; 0.2mM piruvato de sodio, 50mg/ml gentamicina, 80UI/ml HCG, 1mg/ml de 17-β estradiol, y 45mg/ml de FSH porcina. Todos los cultivos fueron realizados con una tensión de 5% CO2 en aire, a 39ºC y humedad relativa del 90%.
De los oocitos seleccionados como buenos (complejo cumulus-oocito no expandido y citoplasma granulado y homogéneo) se seleccionaron grupos de 10-12 oocitos al azar, los cuales fueron transferidos dentro de gotas de 50ml en discos de cultivo estériles 60 x 15mm cubiertas con 10 ml de aceite mineral previa estabilización de las gotas mínimo 2 horas y cultivados en una incubadora por 24 horas a 39 ºC en una atmósfera de aire con 5% de CO2 y una humedad relativa del 90 %.
Después de la maduración los oocitos fueron transferidos al medio de fertilización donde fueron divididos aleatoriamente en seis tratamientos de acuerdo a la concentración de heparina en el medio de fertilización (4, 8, 10, 16 y 20 mg de heparina/ml). Se realizaron tres réplicas por tratamiento con un número de oocitos alrededor de 20 por réplica y en cada réplica la concentración de esperma fue 1x106 / ml. Después de 18 horas de fertilización los oocitos fueron fijados en una solución de una parte de ácido acético y tres de metanol, por 24 horas, después fueron teñidos con orceina al 2% para evaluación de fertilización. La concentración de heparina que se seleccionó fue aquella que produjo el mayor porcentaje de fertilización (oocitos con dos o más pronúcleos). La evaluación de fertilización se realizó teniendo en cuenta la descripción de los estados de desarrollo pronuclear realizada por Xu y Greve (20).
La técnica utilizada para preparar los espermatozoos bovinos para (fertilización in vitro) IVF y aumentar el porcentaje de células espermáticas móviles fue el método conocido como Swim-up previamente descrito por Parrish et al (13).
Una vez seleccionada la concentración de heparina en la primera parte, se evaluaron tres dosis de espermatozoides del eyaculado de un toro de raza holstein (0.5x106 espermatozoides/ml, 1x106 espermatozoides/ml y 2x106 espermatozoides/ml). A las 18 horas pos- fertilización los oocitos fueron fijados en una solución 1:3 de ácido acético y metanol, respectivamente, durante 24 horas. Luego fueron teñidos con una solución de orceína al 2% para evaluar la fertilización. La concentración de espermatozoides seleccionada fue aquella que produjo la máxima fertilización con el mínimo de polispermia. Se realizaron un total de tres réplicas por tratamiento.
Resultados
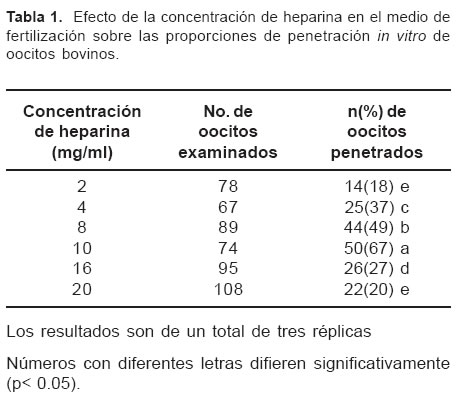
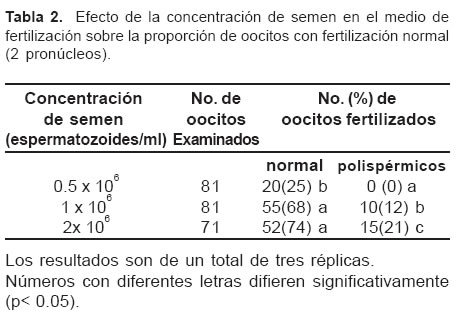
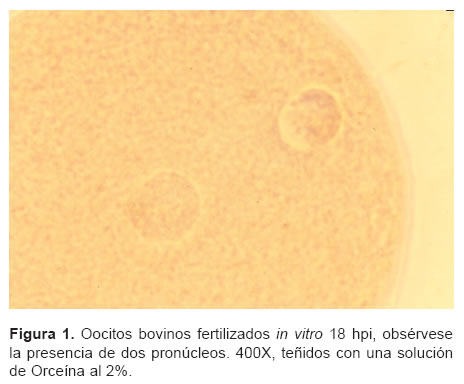
En las tablas 1 y 2 se observan la evaluación de la capacidad fertilizante del semen según la concentración de heparina y la concentración espermática. El mayor porcentaje de oocitos penetrados, 67% se presentó cuando el medio de fertilización fue suplementado con una concentración 10 mg/ml de heparina (p< 0.05). La mayor proporción de oocitos fertilizados 68% (n=55), con la menor presentación de poliespermia, 12%, se obtuvo con dosis seminales de 1 x 106 espermatozoides. En la figura 1 se observa la presencia de pronúcleos en Oocitos bovinos fertilizados in vitro y teñidos con una solución de Orceína al 2%.
Discusión
La proporción de penetración (67%) que se obtuvo con una concentración de 10 mg/ml es similar al valor reportado en la literatura, el cual oscila entre 2- 100 mg/ml, siendo la concentración de 10 g/ml la más comúnmente usada (19). Estas diferencias se deben a que el efecto de la heparina es dosis dependiente y varía para cada toro, como lo demuestran Parrish et al (13,14), Saeki et al (18) y Niwa y Ohgoda (11), y además puede estar relacionado con la mayor producción de proteínas fijadoras de heparina en el semen. De acuerdo con Kim (7), la presencia de proteínas fijadoras de heparina se relaciona con porcentajes de fertilidad de 67 a 87% y su funcionamiento es afectado por la osmolalidad del medio empleado.
La mayor proporción de oocitos con fertilización normal (74%) fue obtenida con una concentración de 2x106 espermatozoides/ml, pero al mismo tiempo produjo el mayor porcentaje de polispermia. Entretanto esta concentración de esperma no fue significativamente diferente a la de 1x106 (p> 0.05). Estos resultados concuerdan con los reportados por Hernández -ledezma et al (6); Saeki et al (18); Van Inzen et al (21); Lu KH, Seidel GE Jr. (10), los cuales encontraron que la concentración óptima de semen fue de 1x106 espermatozoides/ml y además reportaron que a medida que se aumentaba la concentración de espermatozoides en el medio de fertilización se incrementaba la incidencia de poliespermia, contrario a lo reportado por Kurtu et al (8) quienes no encontraron este efecto (p< 0.05) al aumentar la dosis seminales por encima de 0.5x106 espermatozoides/ml, cuando utilizaron el mismo toro. Por otro lado la incidencia de poliesperrmia, según Saeki et al (18), podría relacionarse con la presencia de proteínas séricas al suplementar el medio con suero de vaca en estro.
Saeki et al (18), Van Inzen et al (21), Lu KH, Seidel GE Jr (10), reportan concentraciones fertilizantes de por lo menos 1x106 espermatozoides/ml, si consideramos que trabamos con gotas de 50 ul para grupos de 10 a 12 oocitos, la concentración de la dosis final sería de 50.000 espermatozoides /gota.
Otros autores como Pinyopummintr y Bavister (16), Ferry et al (5), Rieger et al (17), Leven K et al (9) y Camargo et al (1, 2) trabajaron con una concentración espermática superior, de 1.8 y de 2x106, sin reportar el alto grado de polispermia. Camargo (2) con sistema de co-cultivo reporta un 87% de oocitos divididos y 37.5% de blastocitos eclosionados, con dosis espermática de 1.8 x106, sin embargo recomienda el uso de dosis fertilizante de concentraciones a partir de 1 x106.
De acuerdo a los resultados encontrados en este estudio podemos concluir que las concentraciones de heparina de 10 ug/ml y de semen de 1x106 esp./ml arrojaron las mejores tasas de penetración de oocitos bovinos in vitro, cuando se utiliza la técnica de swim up. Por lo tanto se recomienda el uso de esta concentración de heparina en la suplementación del medio de fertilización y de esta dosis inseminante, para alcanzar buenas tasas de fertilización con bajos porcentajes de poliespermia.
Summary
Heparin and spermatic concentration effect over the percentage of in vitro fertilization of bovine oocites.
The objective of this study was to evaluate the effect of different heparin concentrations and of the semen in the percentage of bovine oocytes in fertilization medium. In the experiment 1, the obtained oocytes of slaughterhouse ovaries were matured in vitro and distributed at random in six treatments for fertilization in vitro, according to the heparin concentration (2, 4, 8, 10, 16, 20 µg/ ml). In the experiment 2, once selected the heparin concentration from experiment 1, three sperms doses were evaluated in fertilization medium (0.5x106 espermatozoas/ml, 1x06 espermatozoas/ml and 2x06 espermatozoas/ml). In each experiment totally randomized design was used and data were analyzed by ANAVA. The concentration of heparin (p<0.05) affected the percentage of fertilized oocytes being the best results in the concentration of 10 µg/ml, with a rate of penetration of 67%. The spermatic concentration affects the fertilization, the biggest oocytes proportion with normal fertilization (74%) when using concentration 2x106 spermatozoas/ml. However, it was not significantly different to the concentration of 1x 106 (p>0.05). The results indicate that the fertilization rate keeps direct relationship with the heparine dose and the spermatic concentration.
Keywords: bovine, fertilization in vitro, heparin, swim up.
Referencias
1. Camargo LS, Sá W, Ferreira AM, Viana JH. Efeito de sistema de cultivo, célula somática e soro em co-cultura sobre o desenvolvimento de embrioes bovinos fecundados in vitro. Arq Bras Med Vet Zootec 2001; 23:78-83.
[ Links ]2. Camargo LS, Sá W, Ferreira AM, Viana JH, Freitas C. Concentracão espermática na fecundacão in vitro, com semen de touro da raca Guzará. Arq Bras Med Vet Zootec 2000; 52:59-64.
[ Links ]3. Chacon LJ, Estrada JL. Evaluación de diferentes compuestos en la estandarización de la técnica de fertilización in vitro en bovinos. Tesis para Msc. Universidad Nacional Colombia (1997).
[ Links ]4. Eyestone W, First N. Co-culture of early cattle embryos to the blastocyst stage with oviductal tissue or in conditioned medium. J Reprod Fertil 1989; 85:715-720.
[ Links ]5. Ferry L, Mermillod P, Massip A, Dessy F. Bovine embryos culture in serum-poor oviduct-conditioned medium need cooperation to reach the blastocist stage. Theriogenology 1994; 42: 445-453.
[ Links ]6. Hernández Ledezma JJ, Villanueva C, Sikes JD, Roberts RM. Effects of CZB versus mediuim 199 and of conditioning cultura media with either bovine oviductal epithelial cells or buffalo rat liver cells on the development of bovine zygotes derived by in vitro maduretion-in vitro fertilization procedures. Theriogenology 1993; 39:1267-1277.
[ Links ]7. Kim BK, Lee SC, Lee KS, Lee BK, Kim JH. Effect of medium milieu on sperm penetration and pronuclear formation of bovine oocitos matured in vitro.Theriogenology. 2002; 57:2093 -104.
[ Links ]8. Kurtu JM, Ambrose JD, Rajamahendran R. Cleavage rata of bovine oocytes in-vitro is affected by bulls but not sperm concentrations. Theriogenoloy 1996; 45:257 - 265.
[ Links ]9. Leven K, Clay A, Burnley A, Benjamin G. Production of viable bovine blastocysts in defined in vitro conditions. Biology of reproduction 1995; 52:1410 - 1417.
[ Links ]10. Lu KH, Seidel GE Jr. Effects of heparin and sperm concentration on cleavage and blastocyst development rates of bovine oocytes inseminated with flow cytometricallysorted sperm. Theriogenology 2004; 62:819-30.
[ Links ]11. Niwa, K, Ohgoda, O. Synergistic effect of caffein and heparin on in-vitro fertilization of cattle oocytes matured in culture. Theriogenology 1988; 30:733-741.
[ Links ]12. Parrish JJ, Susko-Parrish, First NL. Effect of heparin and chondroitin sulfate on the acrosome reaction and fertility of bovine sperm in vitro. Theriogenology. 1985; 24: 537- 549.
[ Links ]13. Parrish JJ, Susko-Parrish JL, Leibfried Rufledge ML, Crister EJ Eyestone EH, First NL. Bovine in-vitro fertilization with frozen-thawed semen. Theriogenoloy 1986; 25:591-600.
[ Links ]14. Parrish JJ, Susko-Parrish MA, Winer A, First NL. Capacitation of bovine sperm by heparin. Biol Reprod 1988; 38:1171-1180.
[ Links ]15. Parrish JJ, Susko Parrish JL, Handrow RR, Sims MM and First NL. Capacitation of bovine spermatozoa by oviduct fluid. Biol Reprod 1989; 40:1020-1025.
[ Links ]16. Pinyopummintr T. and Bavister B. In vitro- matured/in vitro- fertilized bovine oocytes can develop into morulae/blastocists in chemically defined, protein- free culture media. Biol Reprod 1991; 45: 736-742.
[ Links ]17. Rieger D, Grisart B, Semple E, Van Langendonckt A, Betteridge KJ, et al. Comparison of the effects of oviductal cell co-culture and oviductal cell-conditioned medium on the development and metabolic activity of cattle embryos. J Reprod Fertil 1995; 105: 91-98.
[ Links ]18. Saeki K, Nagao Y, Hoshi M and Nagai M. Effect of heparin, sperm concentration and bull variation on in vitro fertilization of bovine oocytes in a protein-free medium. Theriogenology 1995; 43:751-759.
[ Links ]19. Shamsuddin M, Niwa K, Larsson B, Rodriguez-Martinez H. In vitro maturation and fertilization of bovine oocytes. Reprod Dom Anim 1996; 31:613-622.
[ Links ]20. Xu KP, Greve T. A detailed analysis of early events during in-vitro fertilization of bovine folicular oocytes. J Reprod Fertil 1988; 82:127-134.
[ Links ]21. Van Inzen WG, Van Stekelenburg-Hamers AE, Weima SM, Kruip TA, Bevers MM, et al. Culture of bovine embryos to the blastocist stage using buffalo rat liver (BRL) cells. Theriogenology 1995; 43:723-738.
[ Links ]