Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.18 no.3 Medellín July/Sept. 2005
Síndrome multisistémico de desmejoramiento posdestete (SMDP) en cerdos criados al aire libre en una granja situada en Argentina
Arnaldo Ambrogi1 MV, MSc; Silvia Romanini1 MV, Dr; Alicia Carranza1 MV; Bibiana Pelliza1 MV; Gabriel Di Cola1 MV; Pedro Sánchez-Cordón Dr2.
1.Dpto. Patología Animal. Facultad de Agronomía y Veterinaria. Universidad Nacional de Río Cuarto. Argentina.2.Dpto. de Anatomía Patológica Comparada. Universidad de Córdoba. España.
(Recibido: 19 enero, 2005; aceptado: 8 agosto, 2005)
Resumen
Se realizó un estudio clínico-patológico en cerdos criados al aire libre, estos presentaron signos de desmejoramiento y muerte entre los 40 a 90 días de vida. Durante un periodo determinado se registraron los índices de mortalidad en las categorías de recría y levante. A un grupo de animales con signos de desmejoramiento se les extrajo sangre y se les realizó la necropsia. Se tomaron muestras de tejidos para la realización de análisis histopatológicos, inmunohistoquímicos, bacteriológicos, parasitológicos y virológicos. Los índices de mortalidad estuvieron incrementados en la primera parte del período estudiado. Los signos clínicos observados fueron: retardo en el crecimiento, pérdida de peso y muerte. A la necropsia se observó palidez de mucosas, ganglios linfáticos megálicos y friables, edema de pericardio y de cavidad abdominal. En pulmón se observó neumonía intersticial. El riñón se mostró con áreas blanquecinas en corteza y edema en pelvis. Las lesiones observadas microscópicamente fueron: depleción linfocitaria en órganos linfoides, infiltración de histiocitos, presencia de células gigantes, cuerpos de inclusión intra citoplasmáticos y necrosis multifocales. Además, tanto las células gigantes, los cuerpos de inclusión y los macrófagos de las áreas foliculares de los tejidos linfoides, se manifestaron como inmunorreactivos en la técnica del complejo abidina biotina (ABC) frente al anticuerpo monoclonal del circovirus porcino tipo II (CVP2). Estos hallazgos confirman la presencia de Síndrome de Multisistémico de Desmejoramiento Posdestete (SMDP) en cerdos criados al aire libre con cuadros clínicos patológicos similares a los descriptos en sistemas confinados.
Palabras clave: células gigantes, circovirus, cuerpos de inclusión, depleción linfoide, desmejoramiento.
Introducción
En el año 1997 el circovirus porcino fue asociado a una enfermedad conocida como SMDP (5). Si bien esta enfermedad ya era conocida desde en el año 1991 (10), en diferentes estudios se observaron lesiones microscópicas únicas no identificadas hasta ese momento en ninguna otra enfermedad en los cerdos, a las cuales se encontró asociado un agente viral; el circovirus porcino, tipo II (CVP2) (5, 7).
La sintomatología clínica observada se caracteriza por pérdida de peso, palidez marcada en las mucosas, emaciación, alteraciones respiratorias, ictericia, alta
letalidad, entre un 80 y 100%, y una mortalidad entre 4 y 10 % (7). Afecta especialmente a los cerdos a partir de las seis y ocho semanas de edad y rara vez a cerdos lactantes (9). Si bien, no es frecuente que se presente en etapa de terminación, si el criadero ha sido afectado, la mortalidad de estos animales se ve incrementada (10).
El SMDP se describió inicialmente en granjas con estrictos manejos sanitarios en Canadá (7), pero la enfermedad se observó con manejos productivos
diversos, afectando en forma similar a grandes o pequeñas explotaciones (7). Además, los casos estudiados de SMDP en Canadá, España, Estados
Unidos e Italia (10,11,18) lo describen como una enfermedad emergente en sistemas confinados, tanto en granjas de ciclo cerrado con flujo continuo o granjas
de engorde con múltiples orígenes. Su aparición, se asocia a agentes bacterianos y virales, especialmente al Síndrome Respiratorio y Reproductivo Porcino
(PRRS) (6,14,16), como también a la alta densidad de animales, problemas en el manejo del sistema todo adentro-todo afuera, fallas en la ventilación y la mezcla de animales de diferentes edades (4, 8).
Entre las lesiones macroscópicas mas frecuentemente observadas se destacan: neumonía intersticial, hipertrofia renal con petequias en su superficie y una linfoadenopatía más marcada en nódulos linfáticos inguinales (5, 6). Las principales lesiones histopatológicas que caracterizan al SMDP se encuentran en órganos linfoides. Dichas lesiones se caracterizan por: depleción linfocitaria, infiltración inflamatoria histiocitaria, presencia de cuerpos de inclusión, presencia de células sincitiales y necrosis multifocales (1, 3, 19)
El diagnóstico del SDPD se basa en: la sintomatología clínica compatible con la enfermedad, la presencia de lesiones microscópicas en los órganos linfoides y la detección del CVP2 en los tejidos que presentan lesiones (9, 22).
La Inmunohistoquímica (IH) es una técnica utilizada para detectar antígeno de CVP2 en tejidos fijados en formol e incluidos en parafina (8, 18) y se considera
de alta sensibilidad, económica y sencilla, especialmente a partir del desarrollo de anticuerpos monoclonales y policlonales frente a CVP2 que hacen de esta una técnica de gran utilidad en estudios de patogenia del SDPD (17).
Dada la importancia que reviste la presencia del circovirus en las granjas porcinas de varios países, el objetivo de este trabajo fue estudiar un caso de
desmejoramiento y muerte en lechones, de 40 a 90 días de vida, criados al aire libre en una granja situada en la Provincia de Córdoba de Argentina.
Materiales y métodos
Este trabajo se realizó en un criadero de cerdos con sistema al aire libre (SAL) de ciclo completo con 240 madres y seis machos, provistos por empresas
genéticas desde hace cuatro años. El último macho ingresó al establecimiento en el mes de agosto de 2000. Los servicios se realizaron a campo por inseminación artificial y se programaron para obtener nueve partos semanales. Cinco días antes del parto las madres fueron ubicadas en piquetes de 0.2 ha con parideras“tipo arco”, donde permanecieron hasta el destete.
En este establecimiento se consideraron animales de la categoría recría desde los 25 a los 70 días de vida y categoría de levante desde los 70 a los 100 días.
El promedio de animales destetados fue de 81 lechones por semana a los 25 días de edad, a partir de ese momento se trasladaban a parcelas de tierra de
20x50 m, con refugios de chapas de 3x2 m. Allí permanecieron hasta la venta con 180 días de vida y aproximadamente 100 kg de peso.
Al alimento suministrado “ad libitum” se le realizaban controles periódicos para la determinación de micotoxinas. El agua de bebida se ofrecía con chupetes. En la ración ofrecida a los cerdos en recría se utilizaba de rutina antibióticos como: enrofloxacinas y amoxicilinas.
El establecimiento poseía antecedentes de enfermedades como salmonelosis y estreptococosis. Las madres fueron vacunadas de rutina contra Peste Porcina Clásica (PPC), leptospirosis y parvovirosis. Mientras que, a los lechones se les vacunó contra PPC.
A partir del mes de mayo de 2001 los animales de 40 a 90 días de edad presentaron sintomatología de desmejoramiento, disnea, palidez y muerte. El índice de mortalidad en este establecimiento entre abril de 2000 y abril de 2001 fue de 1.1% en el destete, con un mínimo de uno y un máximo de 2.3%. Mientras que,
para la recría fue de 0.5%, con un mínimo de 0.2% y un máximo de 1.1%. Este estudio se realizó durante los meses de mayo de 2001 hasta febrero de 2002,
registrándose los índices de mortalidad en las categorías de recría y levante.
Se seleccionaron 16 cerdos con estas particularidades, a los cuales se les extrajo sangre para serología y, mediante la técnica de ELISA, sedeterminaron los anticuerpos para PRRS y la Enfermedad de Aujeszky.
Posteriormente se realizó la necropsia de los 16 animales y de cada uno de ellos se tomaron muestras de ganglios linfáticos (inguinales, mesentéricos y
retrofaríngeos), bazo, hígado, riñón, intestino y pulmón. Los tejidos fueron fijados en formol al 10%, la tinción se realizó con hematoxilina y eosina (H/E) para el estudio histopatológico y para la detección antigénica por inmunohistoquímica (IHQ) se usó la técnica del complejo avidina-biotina peroxidasa (ABC) y un
anticuerpo monoclonal desarrollado frente a circovirus porcino tipo 2 (F-217 B6, Dpt. of Agriculture for Northern Ireland, Veterinary Science Division, Belfast, UK).
Además, sobre las muestras de tejido de tonsilas, ganglios linfáticos, bazo y pulmón se realizó la técnica de inmunofluorescencia directa (IFD) para la detección
del virus de la PPC, para lo cual se utilizó un conjugado policlonal marcado con Isotiocianato de Fluoresceína (FITC Ceditest, Lelystad).
Se tomaron muestras para estudios bacteriológicos, la siembra se realizó en medios de Agar Sangre y Agar Mc Conkey, donde los aislamientos fueron clasificados bioquímicamente. También, se tomaron muestras de materia fecal extraídas de la última porción del colón, utilizando la técnica de flotación en azúcar y Teuscher para el diagnóstico parasitológico. Así mismo, las muestras de materia fecal, se utilizaron para el diagnóstico virológico por microscopía electrónica (ME).
Resultados
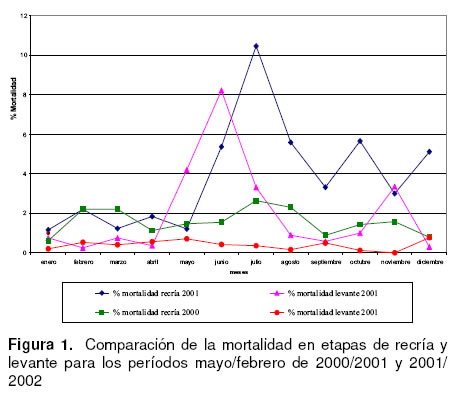
En el tiempo en que se desarrolló este estudio las mortalidades en la etapa de recría y levante se comportaron según lo muestra figura 1, llegando al 4%
en mayo y al 8.8% en junio en la etapa de levante. Mientras que, en la etapa del recría la mortalidad fue del 5.4% en junio y del 11.4% en julio. A partir del mes de agosto de 2001, el porcentaje de mortalidad en ambas categorías disminuyó y se estabilizó, pero se mantuvo incrementado en comparación con los índices del año anterior.
Los animales que enfermaron y sobrevivieron sufrieron una marcada disminución de crecimiento y pérdida de peso sin alcanzar el estado corporal de sus
contemporáneos.
Los signos clínicos más destacados en los animales que enfermaron fueron: retardo en el crecimiento, pérdida de peso y muerte, presentando algunos cerdos
además, diarrea y tos seca. Los cerdos con esta sintomatología fueron tratados con antibióticos, sin obtener respuesta al tratamiento.
En los análisis bacteriológicos realizados se aisló en los ganglios mesentéricos de dos animales E. coli y de un animal S. suis. Así como también, en cuatro
cerdos, se observó al microscopio electrónico la presencia de partículas virales tipo rotavirus en materia fecal.
La técnica de IFD resultó negativa a PPC, así como también fue negativa la serología para la detección de anticuerpos frente al virus de PRRS y Enfermedad de Aujeszky.
En el mes de mayo se detectó la presencia de aflatoxinas y zearalenona en altas concentraciones (700 y 350ppm respectivamente) en pellet de soja
administrado a las categorías de recría y levante, este alimento fue reemplazado en los 15 días posteriores.
En el estudio parasitológico realizado no se observaron huevos de helmintos y/o protozoarios. A la necropsia se observó palidez de mucosas (16/ 16), los ganglios linfáticos se mostraron megálicos y friables (8/16), edema de pericardio (10/16) y de cavidad abdominal (9/16). En pulmón se observó neumonía intersticial (10/16). El riñón se mostró conáreas blanquecinas en corteza renal (7/16) y edema en pelvis renal (3/16).
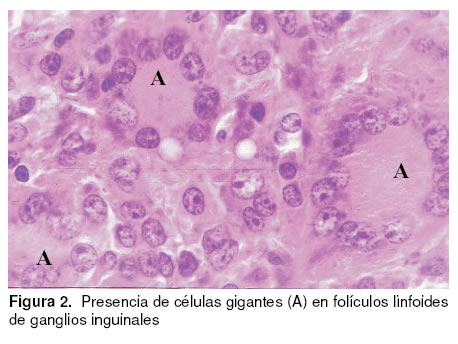
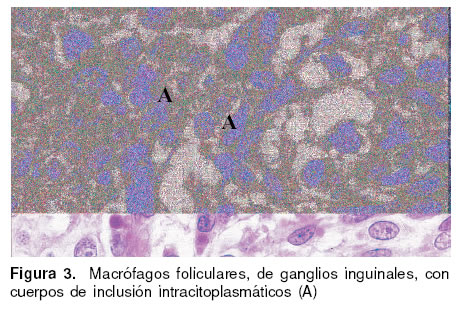
Las lesiones microscópicas encontradas comprometieron a folículos linfoides de tonsila, bazo, ganglios y placas de Peyer caracterizándose por depleción linfocitaria, infiltración inflamatoria de células mononucleares y linfohistiocitaria, presencia de células sincitiales o células gigantes (véase Figura 2), cuerpos
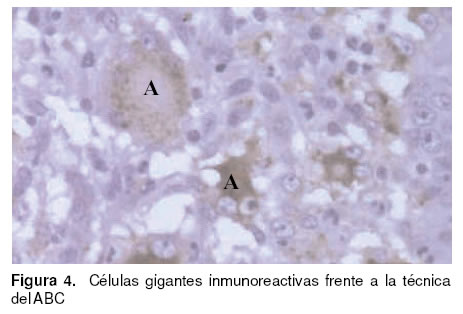
de inclusión intracitoplasmáticos (véase Figura 3) y necrosis multifocales. Tanto las células gigantes, los cuerpos de inclusión y los macrófagos de las áreas
foliculares de los tejidos linfoides, se manifestaron como inmunorreactivos en la técnica del ABC frente al anticuerpo monoclonal del CVP2 (véase Figura 4).
Discusión
La mortalidad en la etapa de recría y levante se comportó de manera similar a lo descripto por Ellis et al (7) cuando señala que el curso de PWMS puede
permanecer desde 6 a 18 meses en los establecimientos infectados.
Las características de morbilidad y mortalidad, observadas, son similares a las halladas en los sistemas confinados (13, 14) en donde se describe una tasa de
mortalidad entre el 8 a 12% y una letalidad que varía de 70 a 100%. Las que no parecieron estar influenciados por la densidad animal y el número de
animales (81 animales en 1000 m2) (4,9 ).
En el establecimiento, en coincidencia con lo señalado por Ellis et al (7) y Segales, et al (17), los animales que enfermaron y sobrevivieron, mostraron con una marcada disminución de crecimiento y pérdida de peso sin alcanzar el estado corporal de sus compañeros de camada.
Sin embargo, en la etapa de terminación, se observó que los valores históricos de mortalidad se mantuvieron constantes en el 0.5%, en diferencia de lo manifestado por Allan et al (1) en trabajos realizados en establecimientos en confinamiento donde se menciona que la mayor mortalidad se manifiesta en etapas de recría, pero que también en la etapa de terminación los índices de mortalidad se ven incrementados.
Los signos clínicos más destacados fueron similares a los descriptos por Clark (5). Los tratamientos con antibióticos no dieron respuesta, tal como lo describen Harding and Clark (10).
El aislamiento de E. coli, S. suis y la presencia de partículas tipo rotavirus reafirman las hipótesis planteadas Ellis et al (7) y Kyriakis et al (13) sobre las características inmunosupresoras del CVP y la posibilidad de que los animales con PMWS posean patologías secundarias.
La ausencia de anticuerpos de PPC, PRRS y Enfermedad de Aujeszky, descartaría a estos agentes como inmunoestimuladores e iniciadores del PMWS,
como lo proponen Hines and Lukert (11).
La presencia de micotoxinas, como zearalenone y aflatoxinas, podrían haber producido el efecto inicial para la manifestación del CVP2, ya que como lo planteaKrakowka et al (12), este agente se ha diagnosticado asociado a otros capaces de inducir inmunosupresión en el organismo.
Los hallazgos a la necropsia e histopatológicos revelaron ser idénticos a los descritos como patognomónicos del PMWS (18, 19). Además, tal como lo describen Balasch et al (3) tanto las células gigantes, los cuerpos de inclusión y los macrófagos de las áreas foliculares de los tejidos linfoides, se
manifestaron como inmunorreactivos en la técnica del ABC frente al anticuerpo monoclonal del CVP2 (véase Figura 4).
Los hallazgos clínico-patológicos encontrados y la detección del CVP2 en los tejidos confirman la existencia del PMWS en cerdos criados en SAL en
Argentina.
Summary
Postweaning Multisystemic Wasting Syndrome (PMWS) in pigs reared in an outdoor system in the farm in Argentina.
To carry out a clinical and pathological study in pigs reared in an outdoor system farm showing signs of wasting and witch then died between 40 and 90 days of life.The study was carried out between May, 2001 and February, 2002. Mortality was registered in animals in both weaning and postweaning periods. Sixteen animals with obvious signs of wasting were selected. Blood samples were extracted and necropsies were performed. Tissue samples were fixed in formaldehyde at 10%, stained with H/E and analyzed with inmunohistochemical techniques. Bacteriological, parasitological and viral studies were also carried out. Mortality was higher during first part of the period studied in weaning and postweaning. The animals that survived, showed decreased growth rate and weight loss, not being able to reach the same body size as their contemporaries. Clinical signs observed included growth retardation, weight loss, respiratory distiess and death. Necropsy revealed mucosal paleness, enlarged and brittle lymph nodes, pericardial and abdominal edema. Both bronchointerstitial and interstitial pulmonary pneumonia were observed in the lungs. The kidneys showed whitish areas in the renal cortex and renal pelvis edema. The lesions observed microscopically were: lymphoid depletion in lymph tissues, infiltration of histyocites, presence of giant cells, intracytoplasmic inclusion bodies, and focal necrosis. Giant cells, inclusion bodies and the macrophages of the follicular areas of the lymphoid tissues were inmunoreactive to the ABC technique in the presence of CVP2 monoclonal antibody. These findings confirm the presence of PMWS in pigs reared in an outdoor system farm. The animals showed clinical pathological symptoms similar to those described for animals in stall fed systems.
Key words: circovirus,, inclusion bodies, giant cells, lymph depletion, pigs, wasting.
Referencias
1. Allan GM, Kennedy S, McNeilly F, Foster JC, Ellis J, Krakowka S, Meehan B, Adair B. Experimental reproduction of wasting diseases and death by co-infection of piglets with porcine circovirus and porcine parvovirus. J Comp. Pathology. 1999. 121(1):1-11 [ Links ]
2. Ambrogi A. Monitoreo de Enfermedades Pulmonares y su Relación con Parámetros Productivos en Cerdos Criados al Aire Libre. Tesis de Maestría en Salud y Producción Porcina. Universidad Nacional de Río Cuarto. 2002, 83-85. [ Links ]
3. Balasch M, Segales J, Rosell C, Domingo M, Mankertz A, Urquiza A and Plana Duran J. Experimental Inoculation of Conventional Pigs with Tissue Homogenate from Pigs with Posweaning Multisystemic Wasting Sindrome. J. Comp. Pathology. 1999., 121:139-148. [ Links ]
4. Choi C and Chae C. Porcine Posweaning Multisystemic Wasting Sindrome in Korean Pig. 16 IPVS. Australia. 2000, 17-20 sep. Pág. 638. [ Links ]
5. Clark EG. Porcine Posweaning Multisystemic Wasting Sindrome. Proceedings of the American Association of Swine Practitioners. 1997, 28:499-501 [ Links ]
6. Daft B, Nordhausen R, Latimer K and Niagro F. Interstitial pneumonia and lymphadenopathy associated with circoviral infection in a six week-old pig. Proceedings of the 39th Annual Meetingof the American Association of Veterinary Diagnostic Laboratories. 1996, 39: 32-34. [ Links ]
7. Ellis J, Hassard L, Clark E, Harding J, Allan G, Wilson P, Strokappe J, Martín K., McNeilly F, Meeham B, Todd D,Haines D. Isolation of circovirus form lesions of pigs with posweaning multisystemic wasting sindrome. Vet. Journal 1998, 39:44-51. [ Links ]
8. Ellis J, Krakowka S, Lairmore M, Haines D, Bratanich A, Clark E, Allan G, Konoby C, Hassard L, Meehan B, Martin K, Harding J, Kennedy S and McNeilly F. Reproduction of lesions of posweaning multisystemic wasting sindrome in gnotobiotic piglets. J. Vet. Diagnostic Investigation. 1999, 11:3-14. [ Links ]
9. Harding JC. “Post-weaning multisystemic wasting syndrome (PMWS): preliminary epidemiology and clinical presentation”. Proceedings of the American Association of Swine Practitioners. 1997, 28:503. [ Links ]
10. Harding JC and Clark EG. Recognizing and diagnosing postweaning multisystemic wasting syndrome (PMWS). Swine Health and Production. 1997, 5:201-203. [ Links ]
11. Hines R and Lukert P. Porcine circovirus: a serological survey of swine in the United States. Swine Health and Production. 1995, 3:71-74. [ Links ]
12. Krakowka S, Ellis J, Rings M, Allan G, McNeilly F and Meehan B. Porcine circovirus infection: reproduction of Postweaning Multisystemic Wasting Síndrome (PMWS). Proceedings of the American Association of Swine Practitioners. 1999, 30:417-422. [ Links ]
13. Kyriakis SC, Saoulidis K, Lekkas S, Miliotis ChC, Papoutsis PA, Kennedy S. The effects of immuno-modulation on the clinical and pathological expression of postweaning multisystemic wasting syndrome. J Comp Pathol. 2002 Jan;126(1):38-46. [ Links ]
14. Lukert PD and Allan GM. Circovirus Porcino. In Disease of Swine. 8th edition. Edts. Iowa State University Press. Ames. 2000. [ Links ]
15. Martelli P, Terreni M, Bonatti L and Mannelli A. Haematology and Biochemical Serum Parameters in Grower Pigs Affected by Postweaning Multisystemic Wasting Syndrome (PMWS). 16 IPVS. Australia. 2000. 17-20 Sep. Pag.635-636 [ Links ]
16. Martelli P, Terreni M, Amenna H, Morvan S and Cavirani S. Involvement of PCV2 an Outbreak of Postweaning Multisystemic Wasting Syndrome (PMWS) in Italy. 16 IPVS. Australia. 2000. 17-20 Sep. Pág. 634. [ Links ]
17. McNeilly F, Kennedy S, Moffett D, Meehan BM, Foster JC, Clarke EG, Ellis JA, Haines DM, Adair BM, Allan GM. A comparison of in situ hybridization and immunohistochemistry for the detection of a new porcine circovirus in formalin-fixed tissues from pigs with postweaning multisystemic wasting syndrome (PMWS). J Virol Methods. 1999 Jul;80(2):123-8. [ Links ]
18. Pogranichniy RM, Yoon KJ, Harms PA, Sorden SD, Daniels M. Case-control study on the association of porcine circovirus type 2 and other swine viral pathogens with PMWS. Journal Vet. Diag. Invest. 2002. 14:449-456. [ Links ]
19. Segalés J. Patología de la Circovirosis Porcina. Jornadas de Circovirus y Circovirosis Porcina (PMWS). 1999. 12-16. [ Links ]
20. Segales J, Pastor J, Cuenca R and Domingo M. Haematological parameters in postweaning multisystemic wasting syndromeaffected pigs. 2000. Vet Rec. Jun 3;146(23):675-6. [ Links ]
21. Segales J and Domingo M. Postweaning Multisystemic Wasting Syndrome (PMWS) in Pigs. A review. Vet Q. 2002, 24:109-124. [ Links ]
22. Stevenson G, Kiupel M, Choi J, Latimer K, Kanitz C and Mittal S. Production of Clinical disease end Lesions Typical of Postweaning Multisystemic Wasting Syndrome (PMWS) in Experimentally Inoculated Gnotobiotic Pigs. 16 IPVS. Australia. 2000, 17-20 sep. Pág. 575-576 [ Links ]
23. Sorden SD, Kerr RW, Janzen ED. Interstitial pneumonia in feedlot cattle: concurrent lesions and lack of immunohistochemical evidence for bovine respiratory syncytial virus infection. 2000. J Vet Diagn Invest. Nov;12(6):510-7. [ Links ]