Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Pecuarias
versão impressa ISSN 0120-0690versão On-line ISSN 2256-2958
Rev Colom Cienc Pecua v.19 n.1 Medellín jan./mar. 2006
Tricoticenos macrocíclicos: toxinas hasta ahora no reconocidas en Colombia
María C Lozano A1, MV, MSc; Gonzalo J Díaz G2, MV, MSC, PhD
1Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá
2Laboratorio de Toxicología, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, sede Bogotá
(Recibido: 8 agosto, 2005; aceptado: 1 diciembre 2005)
Resumen
Dentro de las micotoxinas, los tricoticenos han sido consideradas sustancias con potencial tóxico suficiente para alterar los procesos productivos en los animales. Los más conocidos son la T-2 toxina, la HT-2 toxina, el diascetoxiscirpenol y el deoxinovalenol, todos pertenecientes al grupo de los tricoticenos simples. Sin embargo, existe otro grupo de tricoticenos, los macrocíclicos, hasta ahora no caracterizados en Colombia y que tienen un potencial tóxico mayor. Los tricoticenos macrocíclicos más estudiados han sido las roridinas, verrucarinas, satratoxinas y baccarinas. En la naturaleza estos compuestos se encuentran como micotoxinas, producidos principalmente por los hongos Stachybotrys atra (=chartarum) y Myrothecium sp. y también como fitotoxinas en plantas del género Baccharis sp.
El principal mecanismo de acción de estas toxinas es la inhibición de la síntesis de proteínas, afectando principalmente células de división activa y manifestándose clínicamente con una extrema irritación en piel y en membranas mucosas; otros efectos tóxicos que pueden generar son: la inhibición de sistemas enzimáticos y la inmunotoxicidad. El hongo celulolítico S. atra, contamina heno o paja que esté formando parte de la cama de los animales o de su dieta; los tricoticenos producidos por este hongo causan la estaquibotritoxicosis en equinos, bovinos, ovinos y porcinos, enfermedad descrita en Europa Oriental. El S. atra puede crecer en material de construcción rico en celulosa en edificaciones con alto grado de humedad y liberar esporas que contienen tricoticenos macrocíclicos. Los humanos al inhalar estas esporas pueden presentar hemorragias pulmonares. En Brasil, Uruguay, Paraguay y Argentina el consumo de plantas Baccharis sp. por animales causa hemorragias gastrointestinales, alteración de órganos hematopoyéticos y alopecia. Aunque en Colombia no ha sido demostrada la presencia de estas toxinas, es necesario reconocer las principales fuentes y efectos tóxicos que pueden producir y de esta manera poder caracterizar su posible ocurrencia en el país.
Palabras clave: baccarinas, Baccharis sp, estaquibotritoxicosis, roridinas, Stachybotris atra, verrucarinas
Introducción
Los tricoticenos son micotoxinas producidas por varias especies de hongos toxigénicos; de acuerdo a su estructura química pueden dividirse en simples y macrocíclicos (34). Los principales tricoticenos simples (TS) que ocasionan alteraciones en la salud animal y por lo tanto pérdidas en la producción pecuaria son el deoxinivalenol, el nivalenol, el diacetoxiscirpenol, la T-2 toxina y la HT-2 toxina (34). Estas toxinas son principalmente producidas, bajo condiciones ambientales apropiadas, por hongos del género Fusarium, género que se reporta ampliamente como contaminante de alimento, infectando varios cereales en campo (37). Los tricoticenos macrocíclicos (TM) tienen una distribución mundial menor que los TS, sin embargo son más tóxicos debido a que poseen un anillo exacíclico alrededor del núcleo que incrementa su efecto biológico (41). Los TM más estudiados han sido las roridinas, verrucarinas, satratoxinas y baccarinas (55). En la naturaleza estos compuestos pueden ser producidos por los hongos Stachybotrys atra (25), Myrothecium roridum y M. verrucaria (1, 2) y también por plantas del género Baccharis (B. coridifolia, B. megapotamica y B. artemisoides) (27, 39).
La presencia de TS en alimentos terminados para animales y en materias primas para la elaboración de los mismos, ha sido reconocida en Colombia por el Laboratorio de Toxicología de la Facultad de Medicina Veterinaria y de Zootecnia de la Universidad Nacional de Colombia. Sin embargo, se desconoce la existencia de los TM en el país. Igualmente, en Colombia la atención en torno a las micotoxinas ha sido enfocada hacia otras sustancias y los efectos de toxinas con potencial presencia, como los TM, no son muy conocidos. La presente revisión está orientada a describir la química, la ocurrencia natural, la toxicocinética, la toxicodinámica y la toxicidad de los TM; así como los signos clínicos, las lesiones, el tratamiento y prevención de las enfermedades que puedan ocasionar.
Química y ocurrencia natural
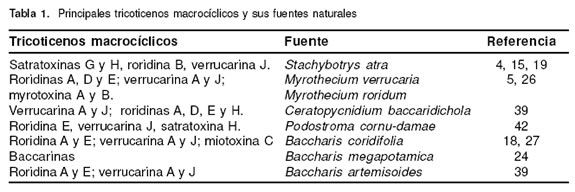
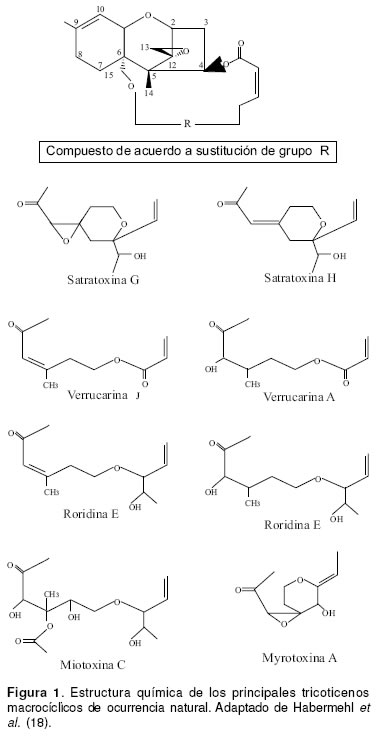
Los tricoticenos (TCT) se caracterizan por tener un anillo tetracíclico 12,13-epoxi-tricotic-9-eno en su estructura química. Los TM presentan puentes exocíclicos entre las posiciones C15 y C4 (55), más de 60 TM han sido identificados en la naturaleza, perteneciendo a diferentes grupos, entre los cuales se destacan las satratoxinas, roridinas, verrucarinas, baccarinas, miotoxinas y myrotoxinas, entre otros (20, 27, 26). La estructura de los principales TM se presenta en la figura 1. Estas toxinas son producidas por diversos géneros y especies de hongos como Stachybotrys atra, Myrothecium verrucaria, M. roridum (2, 25), incluyendo setas como Podostroma cornu-damae (42) y también por plantas del género Baccharis sp (27, 39). La tabla 1 señala los principales TM encontrados en la naturaleza y el origen de los mismos.
Producción fúngica de los tricoticenos macrocíclicos
El Stachybotrys atra (=S. chartarum) de distribución mundial, puede crecer en zonas con temperatura entre 2 y 40°C (35), sin embargo, las condiciones ideales para que este hongo produzca toxinas son temperaturas entre 20 y 26°C (4, 25) y humedades relativas superiores al 70% (35).
A diferencia de otros hongos toxigénicos que tienen como sustrato granos almacenados o por cosechar, el S. atra debido a su habilidad para descomponer la celulosa, contamina materiales ricos en este carbohidrato y, es a través de heno o paja que el hongo y sus toxinas entran en contacto con los animales (19), produciendo la enfermedad conocida como estaquibotritoxicosis principalmente descrita en Europa Oriental y que afecta especialmente equinos, ovinos, bovinos y porcinos (6). Esta enfermedad ha sido también reportada en Francia afectando cabras, vacas, caballos y venados (32). Los TM producidos por el S. atra, asociados con la presentación de estaquibotritoxicosis, son las satratoxinas G y H, la roridina B y la verrucarina J (4, 15, 32). El S. atra y sus toxinas han sido aislados de materiales de construcción ricos en celulosa (papel de colgadura, madera, etc.) presentes en edificaciones con problemas de humedad y se han asociado a enfermedades respiratorias en humanos, representando un riesgo para la salud pública (49, 57, 58). Además, del efecto tóxico causado por los TM en el tracto respiratorio, también es importante la inflamación y hemorragia pulmonar producida por proteínas estructurales presentes en S. atra (52). Otros hongos del mismo género con menor capacidad para producir TM son S. albipes, S. kampalensis y S. microspora (14).
Algunos hongos del género Myrothecium, principalmente M. verrucaria y M. roridum han sido descritos como productores de TM; son habitantes frecuentes del suelo, siendo patógenos tóxicos para varias especies de plantas (1, 3, 18). Las micotoxinas que estos hongos producen son roridinas A, D y E, verrucarinas A y J (5) y myrotoxinas A y B (26).
La acción fitotóxica del M. verrucaria ha sido comprobada en plantas consideradas malezas, confiriendo al hongo el potencial de constituirse en método de control biológico ya que las plantas tratadas con éste, no presentan toxinas residuales ni sus extractos son citotóxicos para células de mamíferos (1, 2, 3). Sin embargo, plantas tóxicas del género Baccharis sp. infectadas con Myrothecium sí presentan TM en su estructura (27); para explicar la clara interacción que sucede entre este hongo y las plantas del género Baccharis sp. se postulan varios mecanismos que se explican más adelante.
En Argentina el hongo Ceratopycnidium baccaridichola ha sido aislado de plantas del género Baccharis y se ha reportado como productor de TM, aunque en menor proporción que Myrothecium sp. (39).
Saikawa et al. (42), han reportado que algunas especies de setas presentan la capacidad de producir TM, tal es el caso de la Podostroma cornu-damae consumida en Japón que ha ocasionado la muerte de varias personas; los principios tóxicos aislados de esta seta son roridina E, verrucarina J y satratoxina H (42).
Producción de los tricoticenos macrocíclicos por parte de plantas del género Baccharis sp.
Existen cerca de 400 especies de plantas del género Baccharis todas ellas presentes en el continente americano, principalmente en las áreas intertropicales y subtropicales habitando gran diversidad de condiciones ecológicas (12). Las especies de Baccharis acumuladoras de TM son B. coridifolia, B. megapotamica y B. artemisoides; estas son endémicas del sur de Brasil, Uruguay, Paraguay y Argentina (27, 39). Los TM encontrados en éstas son roridinas A y E, verrucarinas A y J, miotoxina C (cuyo nombre se deriva del “mio-mio”, nombre común de estas plantas en Brasil) (5, 27) y baccarinas. Estasúltimas, únicamente reconocidas en B. megapotamica, planta en la que se presume, han sido oxidadas a partir de las roridinas (24).
Las partes más tóxicas de la planta son las flores y semillas, seguidas por hojas, tallo y raíces. Existe también diferencia en la capacidad tóxica de las plantas de acuerdo a su sexo. En B. coridifolia las plantas femeninas son más tóxicas que las masculinas, pues acumulan más TM, especialmente en las flores. Esta diferencia no es apreciable en B. megapotamica. También de un año para otro, la cantidad de TM presentes en una misma planta puede variar (18, 40, 50). La acumulación de TM en plantas Baccharis ha sido asociada a la presencia, en raíces y suelo, del hongo M. verrucaria. A pesar de que se desconoce con exactitud el tipo de interacción que ocurre entre el hongo y la planta, es reconocido que existe una relación entre estos dos organismos, puesto que la cantidad de TM almacenados por Baccharis, se relaciona directamente con la población del hongo en el suelo, a tal punto que plantas que crecen en suelos desprovistos del hongo no almacenan toxinas (24, 40). En la producción de baccarinas por B. megapotamica es descrito otro vínculo con el M. verrucaria, en este caso el hongo aporta los TM (roridinas) que la planta transforma in vivo a baccarinas (24).
Habermehl et al. sugieren que el potencial tóxico de B. coridifolia se debe a su habilidad de absorber las toxinas producidas por M. verrucaria presente en el suelo (18), sin embargo, la población del hongo asociada a la planta es mínima en comparación con la concentración de TM que Baccharis sp. puede contener (27). Se sospecha entonces, que las plantas de este género pueden adquirir la capacidad genética de producir toxinas a partir de los hongos que las infectan (2).
El clima es otro factor que parece estar relacionado con la toxicidad de la planta; Rodríguez y Tokarnia en 1995 demostraron que la B. coridifolia es más tóxica cuando crece en puntos geográficos más meridionales. La acumulación de TM en estas plantas es mayor al sur de Brasil y en Uruguay (40).
En Colombia han sido registradas 38 especies de Baccharis (nombre común = ”chilco”) de las cuales 14 son endémicas (12, 13). La mayoría son representativas de páramos, subpáramos y nivel superior de bosques andinos, las pocas especies de tierra caliente se encuentran en lugares abiertos o en playas ribereñas (12). Las más estudiadas debido a su poder medicinal han sido B. decussata y B. latifolia. Su composición química consiste en esteroles, triterpenos, flavonoides, compuestos fenólicos y alcaloides (10, 51). La principal actividad atribuida a estas plantas es la antiinflamatoria. Además, B. latifolia ha sido reportada como antioxidante y B. decussata como cardiotónica (8, 10, 17). De las especies descritas en el país, ninguna corresponde a las reconocidas como acumuladoras de TM.
Toxicocinética
Contrario a lo que sucede con los TS, la literatura científica no reporta de manera detallada la toxicocinética de los TM, la mayoría de estudios de este tipo han sido desarrollados con TS (T-2 toxina, HT-2 toxina, diacetoxiscirpenol y deoxinivalenol). Sin embargo, teniendo en cuenta que todos los TCT comparten el anillo tetracíclico 12,13-epoxi-tricotic-9-eno, la toxicocinética de estas micotoxinas ha sido descrita de manera general, sin importar a qué grupo pertenezcan. Las reacciones metabólicas que pueden marcar la diferencia para el caso de los TM, son las que suceden en el anillo exacíclico (C4 – C15),únicamente presente en éstos. Al igual que con los demás xenobióticos, la toxicocinética de los TCT está determinada por la biodisponibilidad, el metabolismo, la distribución tisular y la excreción (37).
Absorción y exposición tisular
Las vías de exposición naturales más comunes a los TM son la oral y la aérea. En la intoxicación con B. coridifolia y la estaquibotritoxicosis, los animales ingieren las toxinas y pueden absorberlas a través del tracto gastrointestinal (19, 50). Sin embargo, los TM producidos por el S. atra pueden estar contenidos en las esporas del hongo y también ser absorbidos a través del tracto respiratorio (36), tal como ha sido descrito en humanos con enfermedad pulmonar asociada a construcciones húmedas con presencia del hongo (28). Los TM producidos por el S. atra, podrían también ser absorbidos por piel, especialmente en humanos. Wannenmacher y Wiener, relacionan la naturaleza lipofílica de los TCT con una fácil absorción a través de piel, intestino y mucosa pulmonar (53).
La absorción de los TM puede ser más rápida que la de los TS, una hora después que animales experimentales entran en contacto vía oral o dérmica con T-2 toxina, se alcanzan picos máximos en sangre (53). Con los TM la tasa de penetración de la verrucarina A a través de piel es mayor que la de T-2 toxina (30).
Distribución
Aunque estudios específicos sobre la distribución de los TM no se reportan en la literatura, a partir de investigaciones desarrolladas con TS, puede concluirse que de manera general los TCT absorbidos del tracto digestivo son distribuidos en muchos tejidos, sin una acumulación significativa en órganos específicos.
Después de 18 y 72 horas de haber sido expuestos cerdos y bovinos respectivamente, a T-2 toxina radiomarcada, casi todo el compuesto había sido eliminado. La toxina que aún permanecía en estas dos especies, estaba distribuida en hígado, riñón, músculo y grasa (55). Este patrón de distribución concuerda con el papel que desempeñan el hígado y el riñón en el metabolismo y eliminación de los TCT (53).
Biotransformación
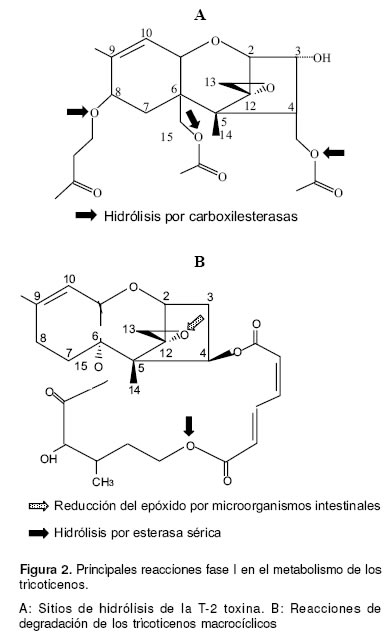
Las reacciones de biotransformación, a diferencia de lo que sucede con otras micotoxinas como las aflatoxinas, no brindan activación metabólica a los TCT para que ejerzan su acción biológica. Estos compuestos tienen la capacidad molecular de reaccionar directamente con los componentes celulares (53), las principales reacciones en el metabolismo de los TCT han sido estudiadas con la T-2 toxina, de manera in vitro se ha demostrado, en diferentes especies, que durante la biotransformación hepática fase I ocurre hidrólisis de la toxina en las posiciones C4, C8 y C15 (véase Figura 2A); los metabolitos resultantes tienen siempre menor toxicidad que el compuesto original (55).
En sistemas enzimáticos de humanos y ratones puede ocurrir deacetilación en el anillo exacíclico de la verrucarina A a través de una esterasa sérica, lo que le confiere menor estabilidad a esta toxina (véase Figura 2B) (46). Otra reacción útil en el proceso de detoxificación de los TCT es la reducción intestinal del epóxido (remoción del oxígeno del anillo epóxido en la posición C12 - C13 para producir una doble unión carbono –carbono) que otorga 400 veces menor toxicidad al compuesto (46). La reducción del epóxido ha sido estudiada en TS, sin embargo dado que todos los TCT tienen el epóxido entre C12 – C13, es muy probable que esta reacción ocurra también con los TM (véase Figura 2B).
La única reacción que se ha comprobado sucede en la biotransformación fase II es la glucuronidación de TS como el deoxinivalenol. Esta sucede eficiente y rápidamente después de la administración del tóxico (55).
Eliminación
Los TCT pueden excretarse a través de su conjugación con ácido glucurónico, se eliminan por orina y heces en una relación 3:1 (53). También puede ocurrir excreción de T-2 toxina en huevos de gallinas que reciben el compuesto en la dieta, acumulándose esta principalmente en la clara. En vacas lactantes los TCT pueden ser eliminados en la leche (4). En la literatura consultada no se reporta conocimiento específico sobre la eliminación de TM.
Toxicodinámica
Dentro de los TCT, son los macrocíclicos los que generan mayor efecto tóxico, seguidos por la T-2 toxina y el diacetoxiscirpenol. Los TM más estudiados son la roridina A y la verrucarina A, a diferencia de las satratoxinas, cuya acción ha sido escasamente evaluada. Varios efectos ocasionados por los TCT han sido determinados, el más estudiado ha sido la inhibición en la síntesis de proteínas (53), sin embargo se ha establecido que los TM pueden perjudicar sistemas enzimáticos (38), afectar la polaridad de las membranas celulares y ser inmunotóxicos (22). Adicionalmente, la toxicodinámica de los TM ha sido aprovechada para evaluar su potencial actividad anticancerígena, fungistática y viricida (16, 29, 55).
Relación estructura – actividad
Dentro de los rasgos estructurales que afectan la actividad biológica de los TCT están, la presencia de la doble insaturación entre C9 y C10, la integridad del anillo 12-13-epoxi, la sustitución de hidroxilos u otros grupos funcionales en posiciones apropiadas del núcleo tricoticeno y la estructura y posición de las cadenas laterales (41). Estas características que afectan el tamaño, polaridad o conformación de los TCT, pueden influir en su ingreso a las células y en su posterior unión e interferencia con moléculas (47).
Inhibición de la síntesis de proteínas
Estos compuestos químicos de bajo peso molecular se mueven libremente a través de la membrana celular y se unen a la subunidad 60S de las proteínas ribosomales de eucariotas, resultando en inhibición de la síntesis proteica y en citotoxicidad (54). Los TCT actúan inhibiendo los procesos de iniciación o elongación de la traducción, interfiriendo con la actividad de la peptidil transferasa. La inhibición en la síntesis de RNA y DNA es secundaria a la inhibición en la síntesis de proteínas, de esta manera el efecto primario de los TCT es causado por sus propiedades como potente inhibidor de la síntesis de proteínas (53), que resulta ser mayor con TM que con TS (58).
Intervención en sistemas enzimáticos
Además de tener el potencial de interferir sistemas enzimáticos a través de la inhibición en la síntesis de proteínas, los TM pueden destruir coenzimas. Lo anterior ha sido demostrado en cultivos de levaduras (Saccharomyces cerevisiae) cuyo crecimiento puede ser inhibido con verrucarina A; sin embargo, al adicionar vitaminas del complejo B, esta inhibición se revierte (56). Otros efectos que pueden ocasionar los TM en levaduras son la inactivación enzimática durante la glicólisis (31) y la inhibición de enzimas deshidrogenasa atribuida a su interacción con residuos -SH (38).
Efectos tóxicos
A partir de ensayos in vitro se ha reconocido que los TCT con mayor efecto tóxico son la verrucarina A y la roridina A, seguidos por la satratoxina G y finalmente la satratoxina H. En este mismo tipo de ensayos se ha demostrado que las dosis necesarias de verrucarina A y roridina A para inducir efecto tóxico, son inferiores a las de T-2 toxina, considerado uno de los TS más potentes (31). De acuerdo a la fuerte tendencia de los TCT de inhibir la síntesis proteica, estas toxinas se consideran extremadamente irritantes para la piel y las membranas mucosas (53).
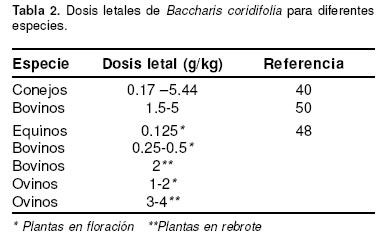
Las investigaciones desarrolladas para evaluar el potencial tóxico de la planta B. coridifolia han empleando partes de la planta que se sabe contiene principalmente roridina A y E. Las concentraciones de estos compuestos varían según el sexo de la planta y su estado de desarrollo (40). Cuando las plantas femeninas, que son las que más acumulan TM, pasan a su estado de floración, la concentración de las toxinas puede aumentar de 1000 ppm a 4000 ppm. Además la toxicidad de una misma planta puede variar hasta cuatro veces de un año para otro (50). De las especies animales estudiadas, las más susceptibles a la intoxicación con B. coridifolia son en su orden equinos, bovinos, conejos y ovinos (véase Tabla 2).
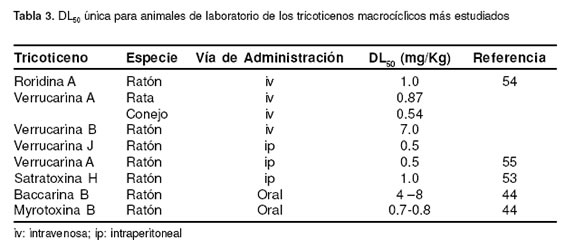
Los ensayos in vivo han sido principalmente desarrollados con animales de laboratorio (ratones, ratas y conejos), salvo algunas excepciones en las que se ha evaluado el potencial tóxico de la planta B. coridifolia empleando equinos, bovinos y ovinos. Así mismo, las principales rutas de administración han sido la intraperitoneal y la intravenosa. Pocos investigadores reportan toxicidad en animales por TM purificados cuya administración haya sido la oral. Sin embargo, Schiefer et al, extrapolan la DL50 oral de acuerdo a la administrada por otras vías, considerando que para la mayoría de TM es menor o igual a 1 mg/kg (44). Con respecto a la exposición aérea, se ha demostrado que 1X106 esporas de S. atra, conduce a la letalidad del 50% de la población de ratones experimentales (36). La tabla 3 señala las DL50 para diferentes especies animales de los compuestos más estudiados.
Citotoxicidad y actividad antimicrobiana
A través de estudios de citotoxicidad en diferentes líneas celulares han sido caracterizados gran parte de los efectos de los TM, estos se han evaluado también en líneas de células tumorales, siendo considerados como una posibilidad en terapias anticancerígenas (29). La roridina A, por ejemplo, induce la diferenciación de células leucémicas a granulocitos y macrófagos, efecto que se relaciona con supresión del crecimiento celular y citotoxicidad (43).
La respuesta fitotóxica de los TM producidos por el M. verrucaria, ha sido igualmente evaluada en plantas consideradas malezas, sugiriendo al hongo como una potencial medida de control biológico (2), a estas toxinas también se les ha comprobado actividad antimicrobiana y fungistáticos, siendo la verrucarina A particularmente potente (55). Inhiben también el crecimiento del Plasmodium falciparum (59) y la replicación de algunos virus (16). Posiblemente el efecto citotóxico y antimicrobiano de estas toxinas obedezca a la capacidad que tienen para inducir canales iónicos en las membranas biológicas, esto se relaciona con una más rápida penetración celular de los TM con respecto a los TS y por lo tanto con una mayor toxicidad (56).
Inmunotoxicidad
Los TCT poseen importantes propiedades inmunomoduladoras siendo las células T más susceptibles que las B a los TM, estas toxinas estimulan la actividad de los macrófagos (9) al igual que la respuesta mitogénica de linfocitos T e incrementan la producción de anticuerpos específicos (22). Los TM tienen mayor prelación por células T del timo que por linfocitos del bazo y son menos tóxicos en este último órgano que los TS, estas diferencias pueden ser explicadas por la presencia de células adherentes en el bazo (macrófagos o células dendríticas) que pueden tener enzimas con mayor poder para metabolizar TM (45).
Evaluando la inmunotoxicidad in vitro, Lee et al. (33), reportan que las concentraciones de TM necesarias para inducir anormalidades en la expresión de IL-2, son 100 veces menores a las requeridas con TS, demostrando la mayor toxicidad que pueden generar los primeros.
Al ser los TM fuertes inhibidores de síntesis proteica, pueden interrumpir la traducción de citocinas, éstas son importantes proteínas que median la respuesta inmune. Varias proteínas de este tipo pueden ser afectadas por TM, entre ellas la interleucina –2 (IL-2) y la proteína inflamatoria de macrófagos (MIP) (33, 54).
La IL-2, producida por los linfocitos T cooperadores, juega un papel fundamental en el crecimiento y diferenciación de células T y B, la roridina A y la verrucarina A son potentes moduladores de la respuesta de la IL-2 con efectos estimulatorios o supresivos según la dosis. Un aumento inicial en esta citocina puede suceder porque se afecta la síntesis de proteínas esenciales para detener su transcripción o porque se reduce su consumo al no sintetizarse suficientes receptores. La inhibición de IL-2 es un efecto directo en la intervención de su síntesis por parte de los TM (33); de otro lado, la expresión de MIP puede ser inducida por satratoxina G estimulando la migración de neutrófilos (54).
Signos clínicos
La estaquibotritoxicosis ha sido descrita en equinos, bovinos, ovinos, porcinos (11) y en animales herbívoros que consumen B. coridifolia, B. artemisoides y B. megapotamica en el sur de Brasil, Uruguay, Paraguay y Argentina (39, 40). Las principales manifestaciones clínicas en estos animales son debilidad, anorexia, diarrea (en ocasiones sanguinolenta), pérdida de pelo (incluso total), atonía ruminal y leve timpanismo (19, 50). En la intoxicación con B. coridifolia han sido descritos síntomas nerviosos caracterizados por alteraciones en el comportamiento, inquietud, cambio constante de posición, trémores, contorsiones musculares, inestabilidad de miembros posteriores, pedaleo y finalmente sobreviene la muerte (50).
La estaquibotritoxicosis leve en equinos se caracteriza por hiperestesia, rinitis, conjuntivitis y leve descamación de los labios, en casos más severos puede ocurrir necrosis de la mucosa oral y hemorragia pulmonar (32). Estos síntomas pueden presentarse por el ingreso de las esporas del S. atra al tracto respiratorio, ocurriendo además descarga nasal sanguinolenta (19); los TM se consideran también generadores de arritmias cardiacas (7).
En humanos la enfermedad resultante de la exposición a TM puede ocurrir por la presencia del hongo S. atra y sus toxinas en edificaciones con alto grado de humedad y material de construcción rico en celulosa. La sintomatología de personas que padecen esta enfermedad se caracteriza por irritación de membranas mucosas, tos, fatiga, dolor de cabeza, presión en el pecho, fiebre, disnea crónica y dolor generalizado (21). Particularmente en niños se ha descrito hemorragia pulmonar asociada con el S. atra. En Cleveland - Ohio (Estados Unidos) los casos reportados en los cuales se diagnosticó esta condición entre 1993 y 1999, resultaron en una tasa de mortalidad del 30% (57).
En seres humanos que se han intoxicado accidentalmente por el consumo de setas Podostroma cornu-damae en Japón, se han presentado desórdenes gastrointestinales, percepción errónea, problemas cutáneos, pérdida del cabello, impedimento en el diálogo y dificultad en los movimientos voluntarios (42).
Lesiones
Las lesiones post-mortem en ovejas con estaquibotritoxicos son hemorragias en subdermis, en superficies mucosas y bajo membranas serosas; pérdida del vellón y heno en el contenido ruminal (19). En rumiantes que ingieren B. coridifolia ocurre desprendimiento espontáneo del epitelio de los preestómagos y emaciación y enrojecimiento de placas de Peyer. En estos animales los órganos más afectados son los preestómagos y en equinos y conejos son el estómago, el ciego y el colon (40).
Las lesiones microscópicas se observan especialmente en el sistema hematopoyético y en el tracto gastrointestinal. En conejos que han consumido B. coridifolia puede apreciarse, edema acentuado en la submucosa de la pared estomacal con moderada necrosis de las células parietales (50). En los preestómagos de rumiantes que han consumido la planta ocurre necrosis caracterizada por picnosis, cariorrexia y cariolisis con discreto infiltrado de células mononucleares en lámina propia (40). El consumo de heno contaminado con S. atra puede producir enteritis hemorrágica con ulceración necrótica de piel (11). En animales de laboratorio intoxicados experimentalmente se encuentran células picnóticas en duodeno, íleon distendido y atrofia de vellosidades, dilatación de criptas intestinales y acumulación de células mononucleares y polimorfonucleares (44).
En el sistema hematopoyético pueden observarse diferentes grados de necrosis en los linfocitos de timo y bazo y necrosis de ganglios linfáticos (44, 50), en hígado se ha observado tumefacción periportal de hepatocitos y vacuolización y necrosis de coagulación en algunas de estas células (40).
Al exponer ratones vía nasal con esporas de S. atra de cepas altamente toxigénicas se aprecia inflamación intra alveolar e intersticial con exudado hemorrágico en luz alveolar y consecuente obliteración de alvéolos y bronquiolos con agregación focal de células inflamatorias (neutrófilos y macrófagos); a menudo se aprecian esporas fúngicas y necrosis de células pulmonares (36).
Tratamiento y prevención
No existe un tratamiento específico para las intoxicaciones ocasionadas por TM. Sin embargo, se reporta que algunas medidas pueden ser útiles para animales intoxicados con estos compuestos. Yagen y Halev, sugieren la administración de vitaminas del complejo B que harían disponibles coenzimas afectadas por las toxinas (56). Hunder et al, tras administrar vía intravenosa dosis letales de roridina A a ratas, demostraron que suministrar vía oral carbón activado y dexametasona intravenosa, aumentan la tasa de sobrevivencia de los animales (23). Lo más indicado es desarrollar un tratamiento sintomático y de soporte, considerando el uso de antibióticos de amplio espectro. Los individuos vacunados durante la toxicosis deberían ser revacunados ya que el sistema inmune de los animales afectados usualmente está comprometido (11).
Las medidas preventivas son más útiles en el momento de controlar toxicosis inducidas por TM. Así, para el caso de intoxicaciones generadas por consumo de B. coridifolia evitar en lo posible el contacto de animales con la planta, podría ser una medida efectiva de control. Puesto que los animales que proceden de zonas libres de B. coridifolia y entran en contacto con la planta, son los más susceptibles a la intoxicación (27), debe tenerse especial cuidado cuando los semovientes son trasladados a regiones en las que esté presente la planta.
Para evitar riesgos de intoxicación en humanos Hodgson et al, sugieren la adecuada aplicación de los códigos de construcción de viviendas y oficinas en países donde pueda presentarse este evento (21).
Conclusiones y recomendaciones
Los TM aunque son de menor ocurrencia que los TS son más potentes, resultando en efectos adversos más severos. Además, los organismos capacitados para producir estas toxinas no son exclusivamente los hongos, sino que también esta facultad puede presentarse en plantas y setas. Su alta toxicidad y la capacidad de ser producidas por hongos y plantas, hacen de los TM toxinas altamente dispuestas a afectar la salud del hombre y de los animales.
Los TM han sido estudiados como potenciales agentes antimicrobianos (antibióticos, fungistáticos antimaláricos, antivirales) y anticancerígenos. Además el hongo M. verrucaria, reconocido por ser productor de estas toxinas, ha sido evaluado como medida de control biológico contra plantas consideradas malezas. Puesto que se sugiere que entre este hongo y el género Baccharis sp., ocurre una relación que capacita a estas plantas para producir TM, especial cuidado debería tenerse en caso de que el M. verrucaria sea empleado para contrarrestar malezas, ya que podría entrar en contacto con otras plantas que puedan adquirir esta capacidad.
La hemorragia pulmonar y la estaquibotritoxicosis, enfermedades descritas en humanos y animales respectivamente y en las que el agente etiológico es el S. atra y sus toxinas, han sido reportadasúnicamente en Europa Oriental, Francia y Estados Unidos. Sin embargo, dado que S. atra es un hongo de distribución mundial que crece en amplios rangos de temperatura, no debe descartarse su ocurrencia en otros países incluyendo Colombia. Es necesario mantener informados a los habitantes de viviendas construidas con material rico en celulosa, sobre el potencial riesgo de no controlar adecuadamente la humedad en este tipo de construcciones.
A pesar de que en Colombia se han descrito 38 especies de plantas del género Baccharis, ninguna de ellas pertenece a las que han sido reportadas como productoras de TM (B. coridifolia, B. megapotamica y B. artemisoides). Sin embargo, la introducción de estas plantas provenientes de otros países puede ocurrir, presentándose riesgo en animales que lleguen a consumirlas. Además, de las 400 especies de Baccharis descritas en América, únicamente cerca de 25 han sido evaluadas en cuanto a su contenido de TM. No debe descartarse la posibilidad que otras especies de Baccharis presentes en el país y hasta ahora no caracterizadas químicamente, puedan también contener estas toxinas.
Es necesario conocer los efectos generados por los TM y las condiciones bajo las cuales estas toxinas ocasionan enfermedad, de esta manera podría lograrse un diagnóstico satisfactorio dado que en Colombia u otros países en donde la enfermedad no haya sido reportada, ocurran estos eventos.
Summary
Macrocyclic trichothecenes: unrecognized toxins in Colombia at the moment Trichothecenes are mycotoxins that alter animal production. The most known trichothecenes are T-2 toxin, HT-2 toxin, diascetoxiscirpenol and deoxinivalenol, all these belonging to simple trihothecenes. However there are others more toxic trichothecenes that have not been characterized in Colombia, they are the macrocyclics. The most studied macrocyclic trichothecenes are roridines, verrucarines, satratroxines and baccarines. On nature these substances could be present like both, mycotoxins (mainly produced by Stachybotrys atra (=chartarum) and Myrothecium sp) or phytotoxins present on Baccharis sp. The main action of these toxins is protein synthesis disruption. They alter cells with a high rate of division like epithelial ones. Therefore among clinical manifestations is skin and mucous membranes irritation. Others toxic effects produced by macrocyclic trichothecenes are enzymatic systems inhibition and immunotoxicity. S. atra is a cellulolytic fungus that can contaminate either straw for animals bedding or fed rich in cellulose. This contaminated material produces stachybotrytoxicosis that have been described on equines, bovines, ovines and porcines from East Europe. Besides, S. atra is commonly found in rich cellulose material present in water damaged buildings whose habitants could inhale fungus spores with macrocyclic trichothecenes and develop lung hemorrhages. On Brazil, Uruguay, Paraguay and Argentine herbivores that consume Baccharis sp present gastrointestinal hemorrhages, hematopoietic organs alteration and lost of hair. Although in Colombia presence of macrocyclic trichothecenes have not been demonstrated, it is necessary to recognize their main sources and toxic effects in order to characterize its possible presence in this country.
Key words: baccarines, Baccharis sp, stachybotrytoxicosis, roridines, Stachybotris atra, verrucarines.
Referencias
1. Abbas HK, Jonson BB, Shier WT, Tak H, Jarvis BB, et al. Phytotoxicity and mammalian cytotoxicity of macrocyclic trichothecene mycotoxyns from Myrothecium verrucaria. Phytochemistry 2002; 59:309-313. [ Links ]
2. Abbas HK, Tak H, Shier WT, Boyette CD, Jarvis BB. Macrocyclic trichothecene are undetectable in kudzu (Pueraria montana) plants treated with high-producing isolate of Myrothecium verrucaria. Phytochemistry 2001; 58:269-276. [ Links ]
3. Andolfi A, Boari A, Evidente A, Vurro M. Metabolites inhibiting germination of Orobanche ramosa seeds produced by Myrothecium verrucaria and Fusarium compactum. J Agric Food Chem 2005; 53:1598-603. [ Links ]
4. Bata A, Harrach B, Ujszaszi K, Kis-Tamas A, Lasztity R. Macrocyclic trichothecene toxins produced by Stachybotrys atra strains isolated in middle Europe. Appl Environ Microbiol 1985; 49:678-681. [ Links ]
5. Bean GA, Jarvis BB, Aboul-Nasr MB. A biological assay for the detection of Myrothecium spp. produced macrocyclic trichothecenes. Mycopathologia 1992; 119:175-180. [ Links ]
6. Blood DC, Radostits OM. Medicina Veterinaria. 2° ed. Madrid: Mc Graw Hill; 1992. [ Links ]
7. Bubien JK, Woods WT. Direct and reflex cardiovascular effects of trichothecene mycotoxins. Toxicon 1987; 25:325-331. [ Links ]
8. Cardozo C. Estudios in vitro – in vivo de la actividad antioxidante de plantas medicinales. Tesis Químico Farmacéutico, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. 2003. [ Links ]
9. Chung YJ, Yang GH, Islam Z, Petska J. Up – regulation of macrophage inflammatory protein-2 and complement by trichothecenes deoxynivalenol and satratoxin G. Toxicology 2003; 186:51-65. [ Links ]
10. Contreras C, Maldonado L. Estudio fitoquímico y farmacológico preliminar de los frutos de Sechium edule y las hojas de Baccharis decussata. Tesis Químico Farmacéutico, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, 1984. [ Links ]
11. Coppock R, Dziwenka M. Stachybotrytoxins. In: Plumlee K editor. Clinical Veterinary. Toxicology. 1° ed. St Louis: Mosby; 2005. p. 268-70. [ Links ]
12. Cuatrecasas J. Revisión de las especies colombianas del género Baccharis. Rev Acad Colomb Cienc 1967; 13:5-102. [ Links ]
13. Díaz S, Cuatrecasas J. Nueva especie de Baccharis (asteraceae) de Colombia. Rev Acad Colomb Cienc 1991; 23:127-29. [ Links ]
14. El-Magharaby OM, Bean GA, Jarvis BB, Aboul-Nasr MB. Macrocyclic trichothecenes produced by Stachybotrys isolated from Egypt and Eastern Europe. Mycopathologia 1991; 113:109-15. [ Links ]
15. Eppley RM, Bailey W. 12,13 Epoxy-9-trichothecenes as the probable mycotoxins responsible for stachybotrytoxicosis. Science 1973; 181: 758-60. [ Links ]
16. García CC, Rosso ML, Bertoni MD, Maier MS, Damonte EB. Evaluation of the antiviral against junin virus of macrocyclic trichothecenes produced by the hypocrealean epibiont of Baccharis coridifolia. Planta Med 2002; 68:209-12. [ Links ]
17. González MC. Estudio de la actividad antiinflamatoria de sustancias de origen natural de plantas colombianas. Tesis Maestría en Farmacología, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, 2002. [ Links ]
18. Habermehl GG, Busam L, Heydel P, Mebs D, Tokarnia CH, et al. Macrocyclic trichothecenes: cause of livestock poisoning by the brazilian plant Baccharis coridifolia. Toxicon 1985; 23:731-45. [ Links ]
19. Harrach B, Bata A, Bajmocy E, Benko M. Isolation of satratoxins from bedding straw of a sheep flock with fatal stachybotryotoxicosis. Appl Environ Microbiol 1983; 45:1419-22. [ Links ]
20. Harrach B, Mirocha CJ, Pathre SV, Palyusik M. Macrocyclic trichothecene toxins produced by a strain of Stachybotrys atra from Hungary. Appl Environ Microbiol 1981; 41:1428-32. [ Links ]
21. Hodgson M, Morey P, Leung WY, Morrow L, Miller D, et al. Building: associated pulmonary disease from exposure to Stachybotrys chartarum and Aspergillus versicolor. J Ocupp Environ Med 1998; 40:241-49. [ Links ]
22. Hughes BJ, Taylor MJ, Sharma RP. Effects of verrucarin A and roridin A macrocyclic trichothecenes mycotoxins on murine immune system. Immunopharmacology. 1988; 16:79-87. [ Links ]
23. Hunder G, Fichtl B, Forth W. Influence of glucocorticoids and activated charcoal on the lethality of rats after acute poisoning with T-2 toxin, diacetoxyscirpenol or roridin A. Nat Toxins 1994; 2:120-23. [ Links ]
24. Jarvis BB, Midiwo JO, Tuthill D, Bean GA, Interaction between the antibiotic trichothecenes and the higher plant Baccharis megapotamica. Science 1981; 214:460-62. [ Links ]
25. Jarvis BB, Lee YW, Comezoglu SN, Yatawara CS..Trichothecenes produced by Stachybotrys atra from Eastern Europe. Appl Environ Microbiol 1986; 51:915-18. [ Links ]
26. Jarvis BB, Lee YW, Yatawara CS, Bruns D, Flippen J., et al. 7-Hydroxytrichodermol, a New Trichothecene from Myrothecium roridum. Appl Environ Microbiol 1985; 50:1225-28. [ Links ]
27. Jarvis BB, Mokhtari-Rejali N, Schenkel EP, Barros C, Matzenbachers NI. Trichothecene mycotoxins from Brazilian Baccharis species. Phytochemistry 1991; 30:789-97. [ Links ]
28. Jarvis BB, Sorenson WG, Hintikka E, Nikulin M, Zhou Y. et al. Study of toxin production by isolates of Stachybotrys chartarum and Memnoniella echinata isolated during a study of pulmonary hemosiderosis in infants. Appl Environ Microbiol 1998; 64:3620-25. [ Links ]
29. Jarvis BB, Stahly P, Panavasasivam G. Antileukemic compounds derived from the chemical modification of macrocyclic trichothecenes. 1 derivatives of verrucarin A. J Med Chem 1980; 23:1054-58. [ Links ]
30. Kemppainen BW, Riley RT, Biles-Thurlow S. Comparison of metabolism and penetration of [3H]verrucarin A and [3H] T-2 toxin in skin. Food Chem Toxicol 1987; 25:379-86. [ Links ]
31. Kohinsky HA, Hannan PJ, Khachatourians GG. HT-2 toxin, roridin A, T-2 toxin and verrucarin A mycotoxins inhibit carbon dioxide production by Kluyveromyces marxianus. Can J Microbiol 1991; 37:933-38. [ Links ]
32. Le Bars J, Le Bars P. Recent acute and subacute mycotoxicoses recognized in France. Vet Res 1996; 27:383-94. [ Links ]
33. Lee MJ, Li S, Jarvis BB, Petska JJ. Effects of satratoxins and other macrocyclic trichothecenes on IL-2 production and viability of EL-4 thymoma cells. J Toxicol Environ Health 1999; 57:459-74. [ Links ]
34. Leeson S, Díaz GJ, Summers JD. Poultry Metabolic Disorders and Mycotoxins. Guelph, Ontario: University Books;1995. [ Links ]
35. Nikulin M, Pasanen AL, Berg S, Hintikka EL. Stachybotrys atra growth and toxin production in some building materials and fodder under different relative humidities. Appl Environ Microbiol 1994; 60:3421-24. [ Links ]
36. Nikulin M, Reijula K, Jarvis BB, Hintikka EL. Experimental lung mycotoxicosis in mice induced by Stachybotrys atra. Int J Exp Pathol 1996; 77:213-18. [ Links ]
37. Osweiller, G.D. Toxicology. Philadelphia Williams y Wilkins. 1996. [ Links ]
38. Reiss J. Influence of Fusarium and Myrothecium jycotoxins on deshydrogenase activity of Saccharomyces cerevisiae. Mycopathologia 1983; 81:187-9. [ Links ]
39. Rizzo I, Varsavky E, Haidukowski M, Frade H. Macrocyclic trichothecenes in Baccharis coridifolia plants and endophytes and Baccharis artemisoides plants. Toxicon 1997; 35:753-7. [ Links ]
40. Rodríguez RL, Tokarnia H. Fatores que influenciam a toxidez de Baccharis coridifolia (Compositae): um estudo experimental em coelhos. Pesq Vet Bras 1995; 15:51-69. [ Links ]
41. Rotter BA, Prelusky DB, Petska J. Toxicology of deoxinivalenol (vomitoxin). J Toxicol Environ Health 1996; 48:1-34. [ Links ]
42. Saikawa Y, Okamoto H, Inui T, Makabe M., Okuno T, et al. Toxic principles of a poisonus mushroom Podostroma cornudamae. Tetrahedron. 2001; 57:8277-81. [ Links ]
43. Samara A, Yagen B, Agranat I, Rachmilewitz EA, Fibach E. Induction of differentiation in human myeloid leukemic cells by T-2 toxin and other trichothecenes. Toxicol Appl Pharmacol 1987; 89:418-28. [ Links ]
44. Schieffer HB, Hancock DS, Jarvis BB. Toxicology of novel trichothecenes, baccharinoid B4, myrotoxin B, and roritoxin B. J Vet Med 1989; 36:152-60. [ Links ]
45. Sugita Konishi Y, Kumagai S, Mizouchi T. The citotoxicity of macrocyclic trichothecenes, roridin A and verrucarin A, on murine T-cells is reduced by Ia-negative splenic adherent cells. Toxicon 1994; 32:1051-7. [ Links ]
46. Swanson SP, Helaszek C, Buck WB, Rood HD, Hascheck WM. The role of intestinal microflora in the metabolism of trichothecene mycotoxins. Food Chem Toxicol 1988; 26:823-9. [ Links ]
47. Thompson W, Wannenmacher RW. Structure-function relationships of 12,13-epoxytrichothecene mycotoxins in cell culture: comparison to whole animal lethality. Toxicon 1986; 24:985-94. [ Links ]
48. Tokarnia CH, Dobereiner J. Intoxicacao experimentalem bovinos por “mio-mio”, Baccharis coridifolia. Pesq Vet Bras 1975; 10:79-97. [ Links ]
49. Tuoni T, Saarinen L, Reijula K. Detection of polar and macrocyclic trichothecene mycotoxins from indoor environments. Analyst 1998; 123:1835-41. [ Links ]
50. Varaschin MS, Barros CL, Jarvis BB. Intoxicacao experimental por Baccharis coridifolia (Compositae) em bovinos. Pesq Vet Bras 1998; 18:69-75. [ Links ]
51. Vargas LD, González AL. Estudio fitoquímico y antimicrobiano de diferentes fracciones del extracto alcohólico de las hojas de Baccharis. Tesis Químico Farmacéutico, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, 1991. [ Links ]
52. Vesper SJ, Dearborn DG, Yike I, Sorenson WG, Haugland RA. Hemolysis, toxicity and randomly amplified polymorphic DNA analysis of Stachybotrys chartarum strains. Appl Environ Microbiol 1999; 65:3175-81. [ Links ]
53. Wannenmacher RW, Wiener SL. Trichothecene mycotoxins. En: Zajtchuck R, Bellami RF, editors. Medical aspects of chemical and biological warfare. Washington: Office of the surgeon general department of army. 1997. p 655-76. [ Links ]
54. Westendorf J. Natural Compunds. En: Marquardt H, Schafer S, Mclellan R, Welsh F editors. Toxicology. San Diego: Academic Press.1999. p.959-1007. [ Links ]
55. World Health Organization. Selected mycotoxins: ochratoxins, trichothecenes, ergot. Environmental Health Criteria 105. Geneve. WHO 1990. [ Links ]
56. Yagen B, Halevy S. Protective effect of vitamins against trichothecene toxicity towards Saccaromyces cerevisiae. Experientia 1997; 43:886-8. [ Links ]
57. Yike I, Rand TG, Dearborn DG. Acute inflammatory responses to Stachybotrys chartarum in the lungs of infant rats: time course and possible mechanisms. Toxicol Sci 2005; 84:408-17. [ Links ]
58. Yike I, Allan T, Sorenson WG, Dearborn D. Highly sensitive protein traslation assay for trichothecene toxicity in airborne particulates: comparison with citotoxicity assays. Appl Environ Microbiol 1999; 65:88-94. [ Links ]
59. Zhang HJ, Tamez PA, Aydogmus Z, Tan GT, Saikawa Y, et al. Antimalarial agents from plants. III. Trichothecenes from Ficus fistulosa and Rhaphidophora decursiva. Planta Med 2002; 68:1088-1091. [ Links ]