Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.1 Medellín Jan./Mar. 2006
Residuos de enrofloxacina y ciprofloxacina en músculo de pollos parrilleros
Hugo García1, MV, Dr; Alejandra Magnoli2, MV; Alicia Weyers2, Lic, MSc; Laura Ugnia2, MV; Carlos Lüders1, MV, MSc; Guillermo Prieto1, MV; Carlos Errecalde1, MV; Nora Gorla3, Lic, Dra.
1Departamento Clínica Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto.
2Departamento de salud Pública, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto.
3CONICET
(Recibido: 25 julio, 2005; aceptado: 16 diciembre 2005)
Resumen
Las fluoroquinolonas son antimicrobianos de uso intensivo en medicina veterinaria. En Argentina la enrofloxacina es empleada en planteles avícolas y porcinos. La Ciprofloxacina, es un metabolito de la anterior que es empleada en medicina humana y es considerada una alternativa en medicina veterinaria. Niveles de residuos de enrofloxacina y ciprofloxacina se determinaron en forma simultánea en músculo de pollos naturalmente infectados con Mycoplasma spp. y tratados con estos antimicrobianos (5 mg/kg/12h oral) durante 5 días. El objetivo de este trabajo fue establecer el momento adecuado de sacrificio de los animales, para su comercialización en buenas condiciones clínicas y niveles aceptables de residuos. Se sacrificaron animales a cinco tiempos pos- tratamiento; 200 mg de músculo pectoral homogeneizados en buffer fosfato se desproteinizaron, evaporaron y eluyeron por cromatografía líquida de alta presión con detección por fluorescencia. La concentración de residuos de enrofloxacina fue máxima a las 24 h de finalizado el tratamiento (0.073 + 0.006 mg/g), inferior al límite máximo de residuos establecido por entes reguladores internacionales (0.3 mg/g). Los niveles máximos (0.027 + 0.015 mg/g) se detectaron para ciprofloxacina a las 72 h. Es necesario desarrollar y examinar métodos simples y precisos para cuantificar residuos en diferentes productos y tejidos comestibles, promover la aplicación de buenas prácticas agrícolas y elaborar regulaciones pertinentes.
Palabras Clave: micoplasmosis, residuos, fluoroquinolonas, HPLC (cromatografía liquida de alta presión)
Introducción
El presente trabajo tuvo su inicio a partir de la consulta de un productor avícola de la zona de influencia de la Universidad Nacional de Río Cuarto. En uno de los galpones los pollos parrilleros presentaban una patología respiratoria, con diagnóstico clínico de micoplasmosis. El productor requería conocer tratamiento adecuado y el tiempo de espera para la faena y comercialización de los animales en buenas condiciones de salud y bajos niveles de residuos. Muchos fármacos poseen la capacidad de generar residuos, entendiendo que estos son todas las sustancias químicas, ya sean los componentes originales y/o sus metabolitos, que permanecen en las carnes, leches u otros alimentos derivados del animal al que se administró el producto veterinario en cuestión (11, 13). Por otro lado, la casi totalidad de los trabajos de investigación en residuos han sido efectuados en animales sanos.
La micoplasmosis aviar es una enfermedad ampliamente difundida por todo el mundo, pudiéndose presentar como enfermedad respiratoria crónica o como sinovitis infecciosa, siendo Mycoplasma gallisepticum y Mycoplasma synoviae respectivamente los responsables de las mismas. Si bien la mortalidad en estas dos formas de presentación es baja, la morbilidad es muy alta, lo cual se traduce en importantes pérdidas económicas producto del bajo incremento de peso en los planteles de pollos parrilleros (2). Las condiciones atmosféricas y ambientales adversas, junto con infecciones asociadas de origen bacteriano o vírico, desempeñan un importante papel en la propagación de micoplasmosis respiratorias clínicas, en granjas avícolas (17).
Ciprofloxacina (CFX) y enrofloxacina (EFX) son fluoroquinolonas de segunda generación con un amplio espectro de actividad antimicrobiana. Ambas poseen buena biodisponibilidad luego de la administración oral y excelente distribución en los tejidos. En nuestro país EFX es empleada en los planteles avícolas y porcinos, con propósitos preventivos y terapéuticos. CFX fue introducida en medicina humana siendo efectiva frente a un gran número de infecciones, debido a su amplio espectro e intensa actividad frente a Gram negativos, y a la propiedad de no poseer resistencia cruzada con beta lactámicos y aminoglucósidos (15). Se ha indicado su empleo en perros y gatos, pero no en animales de producción, debido al riesgo que implica para los consumidores, la presencia de residuos de esta fluoroquinolona en los alimentos.
Los Límites Máximos de Residuos (LMR) para diferentes medicamentos veterinarios son establecidos en diseños experimentales que utilizan animales sanos o a partir de los resultados de estudios de farmacocinética plasmática obtenidos, en la amplia mayoría de los tratamientos, en dosis única.
El objetivo del presente trabajo fue establecer durante 5 días pos-tratamiento los niveles de residuos de EFX y CFX en músculo de pollos tratados con estos antimicrobianos, para determinar el tiempo de espera para faena y comercialización de los animales, sin riesgos para la salud pública.
Materiales y métodos
AntimicrobianosEnrofloxacina, base, polvo liofilizado 100% de pureza y Ciprofloxacina clorhidrato, equivalente a 87% de CFX, fueron usados como estándares para el análisis por cromatografía líquida de alta presión (HPLC). Baytril oral, solución al 10% y Ciprofloxacina clorhidrato fueron empleadas para la administración de EFX o CFX a los animales. Las soluciones estándares de los antimicrobianos (500 mg/ml de agua deionizada) para estudios de HPLC se prepararon mensualmente. Las soluciones de antimicrobianos para la administración a los animales se prepararon 24 h antes de los ensayos en animales.
Animales
El trabajo se llevó a cabo en la Unidad Avícola Experimental de la Facultad de Agronomía y Veterinaria de la Universidad Nacional de Río Cuarto, con pollos parrilleros provenientes de un establecimiento situado en la zona rural de Río Cuarto, Córdoba. De un galpón de 5000 pollos parrilleros de la línea COBB con sintomatología respiratoria se muestrearon 30 animales. Los pollos, de 44 días de edad con 1.73 + 0.15 kg de peso estaban vacunados contra Marek y Gumboro y carecían de tratamiento antibacteriano. Los animales recibieron agua y alimento ad libitum y fueron mantenidos en habitación cerrada, con pared y piso de cemento, cubierto con cáscara de maní. El alimento balanceado fue a base de maíz y sorgo, sin aditivos, ni antimicrobianos. Todos los animales estuvieron sometidos al mismo manejo y los ensayos fueron conducidos sin someterlos a sufrimiento alguno.
En Argentina existen pocos estudios sobre Micoplasmosis Aviar, los cuales fueron de mucho valor como antecedentes de esta enfermedad en las granjas de nuestro medio rural (2). La evaluación clínica del cuadro respiratorio compatible con micoplasmosis se efectuó diariamente, en la mañana y en la tarde, y se evaluó la presencia de ruido pulmonar, la reacción a estímulos externos y el consumo de agua y alimento. Los animales fueron distribuidos al azar en dos grupos de 15 individuos cada uno. Un grupo fue tratado con una dosis diaria de 5 mg/kg/12h de EFX en bolus oral durante 5 días, y el otro grupo con un esquema terapéutico idéntico de CFX.
Tres animales de cada grupo, elegidos al azar, fueron sacrificados a las 24, 48, 72, 96 y 120 h después de finalizado el tratamiento. Luego del sacrificio por decapitación y desangrado, se extrajeron aproximadamente 10 g de músculo pectoral y se congelaron a –20 °C hasta el momento del procesado de la muestra. Con el tratamiento con CFX, el ruido pulmonar comenzó a desaparecer al segundo día de iniciado este, y al tercer día de iniciado con EFX. No se observó ausencia de respuesta a estímulos, y tampoco inapetencia.
Procesado de las muestras
Se pesaron 200 mg de músculo pectoral sin aponeurosis. Se homogeneizó cada muestra con 2 ml de buffer fosfato. Los homogeneizados de músculo se desproteinizaron con diclorometano (8 ml), se agitaron manualmente y con vortex 1 min y se centrifugaron a 4000 rpm a 4 oC durante 20 min. Las fases acuosa y orgánica obtenidas se separaron por filtración con papel separador de fases, colectando esta última. El precipitado se re-extrajo con 6 ml de diclorometano y las fases orgánicas obtenidas se evaporaron a sequedad a 50 oC bajo corriente de nitrógeno para luego resuspenderlas en 200 ml de fase móvil. Las fluoroquinolonas presentes se cuantificaron por cromatografía líquida de alta presión (HPLC), con detección por fluorescencia a 295 nm de excitación y 500 nm de emisión (8, 9). El ensayo fue lineal desde 0.00375 a 0.1 mg/ml. Los antimicrobianos pudieron ser cuantificados con buena resolución de ambos picos y ausencia de interferencias por la matriz biológica empleada.Los límites de cuantificación fueron 0.0119 y 0.0557 mg/g para EFX y CFX respectivamente. Los índices de recuperabilidad de los metabolitos en músculo se obtuvieron restando la concentración de los antimicrobianos de las muestras inicialmente adicionadas con EFX y CFX (0.01 y 0.1 mg/ml) respecto de muestras de músculo con incorporación de los antimicrobianos en igual concentración pero luego del procesado de la muestra. Los promedios fueron 77.47 % para EFX y 87.7 % para CFX.
Resultados
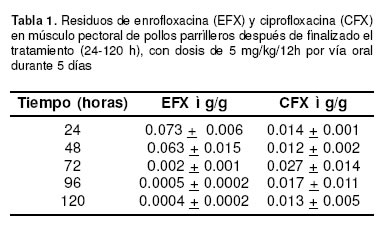
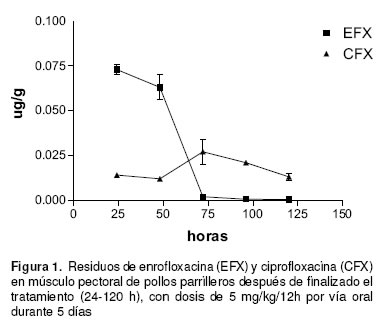
Los residuos de antimicrobianos en músculo de pollo pudieron ser cuantificados por HPLC con detector de fluorescencia. EFX eluye a los 2.70 + 0.50 min y CFX a los 4.02 + 0.15 min. Las concentraciones de residuos de ambas fluoroquinolonas en músculo se muestran en la tabla 1. CFX alcanzó su nivel máximo a las 72 h de finalizado el tratamiento con 0.027 + 0.014 mg/g. Desde las 24 a las 120 h los niveles de CFX oscilaron entre valores mínimos de 0.012 + 0.002 y máximos de 0.027 + 0.014 mg/g. En los pollos medicados con EFX, la máxima concentración de antibacteriano en músculo se alcanzó a las 24 h de suspendido el tratamiento (0.073 + 0.006 mg/g), descendiendo gradualmente hasta 0.0004 + 0.0002 mg/g a las 120 h.
Como se observa en la figura 1, los niveles de CFX se mantuvieron casi constantes en el tiempo del ensayo, promediando los 0.0166 + 0.0068 mg/g. Por el contrario, la concentración de EFX en músculo descendió en forma rápida y constante después de finalizado el tratamiento, alcanzando a las 120 h la concentración mínima.
Discusión
Si bien la efectividad terapéutica no fue el objetivo de este trabajo, cabe recordar que los niveles tisulares de EFX y CFX se determinaron en un lote de pollos con micoplasmosis. Los trabajos de residuos en tejidos de pollos en proceso infeccioso son escasos en la bibliografía. Soliman (18), evaluó la distribución tisular de EFX en pollos sanos e infectados con Escherichia coli, tratados en un esquema de dosis múltiple,observando diferencias de concentraciones antimicrobianas entre ambos grupos de animales, siendo menores en pollos enfermos. Los límites máximos de residuos (LMR) son en general establecidos en animales sanos a partir de los ensayos farmacológicos y toxicológicos pertinentes y de los métodos analíticos desarrollados. La práctica veterinaria nos enfrenta a situaciones donde es necesario lograr efectividad clínica antimicrobiana en animales enfermos y lograr carnes aptas para el consumo.
El método empleado en este trabajo para investigar la presencia de dos fluoroquinolonas simultáneamente en músculo de pollo es simple y económico (9); es simple porque se demora tres horas desde la recepción de la muestra hasta la obtención de los resultados, y económico porque la extracción líquido-líquido es accesible para países como el nuestro, sin la necesidad de la importación de insumos de alto costo como son los cartuchos de extracción en fase sólida.
Las concentraciones de estos antimicrobianos en músculo en el tiempo muestran un comportamiento cinético tisular diferente con niveles constantes para CFX y declinación rápida para EFX, como se observa en la Tabla 1 y la figura 1. En trabajos previos de farmacocinética plasmática en pollos (7) y en cabras (6) se observó una rápida eliminación de CFX. Esto también fue observado por otros autores en varias especies como caninos, equinos y ovinos (1, 4, 14). Esos trabajos midieron la disminución de CFX en plasma en el tiempo, y en todos se resaltó la rápida eliminación de este antimicrobiano. Los presentes resultados en músculo abren un interrogante, ya que la declinación plasmática de CFX no parece ser un reflejo de la eliminación tisular de este fármaco del animal, sino a su amplia distribución en los tejidos. Otros autores, en un estudio de farmacocinética plasmática y concentración tisular de danofloxacina y EFX en pollos parrilleros, informan que ambas drogas en las concentraciones tisulares exceden ampliamente las concentraciones plasmáticas (12).
A partir de los estudios farmacocinéticos, en los que se infiere la posible distribución tisular de los fármacos, CFX es presentada como una de las fluoroquinolonas con mejores cualidades. Sin embargo, los presentes resultados hacen suponer la existencia de una disociación entre la cinética plasmática y tisular, al menos en esta especie y con este esquema terapéutico. Se resalta entonces, la importancia de efectuar estudios de farmacocinética tisular de fármacos en tejidos de importancia terapéutica o económica. En un trabajo anterior, se analizó la presencia de residuos de EFX y CFX en huevos de gallinas ponedoras, cuantificándose mayor concentración en clara que en yema, y se determinó que se debería contemplar un tiempo de espera de 6 días para EFX en plantas productoras para evitar niveles de residuos violatorios de este antimicrobiano en estos productos (10).
La Food and Drug Administration (FDA) (5) estableció una tolerancia de 0.3 mg/g para residuos de EFX en músculo de pollos y pavos. Paralelamente la Comisión del Codex Alimentarius (3), un órgano creado por la FAO y la OMS para el desarrollo de estándares de residuos de fármacos en alimentos seguros, no determina los LMR para fluoroquinolonas, y sólo danofloxacina y sarafloxacina están bajo evaluación con tolerancias tentativas de 0.2 mg/g y 0.01 mg/g respectivamente. Los LMR permitidos por la Unión Europea para EFX y su metabolito CFX son 100 y 300 mg/kg en músculo de pollo. Los resultados obtenidos en los animales tratados con EFX muestran en los diferentes tiempos niveles de residuos inferiores a los establecidos por los organismos internacionales. Todo lo expuesto nos permite establecer que en pollos parrilleros con infección respiratoria por micoplasma, una vez finalizado el tratamiento con EFX 5 mg/kg/12h durante 5 días, los animales están en condiciones aceptables de consumo con niveles de residuos por debajo de los estándares internacionales. Resultados similares se obtuvieron con CFX, una alternativa terapéutica de uso actual en medicina humana, pero cuyo posible uso futuro en medicina veterinaria no debería excluirse en producción animal, como algunos autores expresan en sus trabajos (7, 15, 16). A nuestro criterio es necesario analizar la posible presencia de residuos en distintos productos y tejidos animales comestibles, e incluir estudios de distribución tisular, en la determinación de los valores de tolerancia.
Summary
Residues of enrofloxacin and ciprofloxacin in muscle of broiler chickens
Fluoroquinolones are antimicrobials of intensive usage in veterinary medicine. In our country enrofloxacin is employed in poultry and pig production. Ciprofloxacin, the mayor metabolite of enrofloxacin, is a useful resource in human medicine and one alternative for farm animals. Both antimicrobials were simultaneously detected in muscle of chickens naturally infected with Mycoplasma synoviae and administrated with enrofloxacin or ciprofloxacin (5mg/kg/12h oral) for 5 days. The purpose of this work was to determine the adequate slaughter moment of the animals, with good clinical conditions and acceptable residue levels. The animals were sacrificed at 5 times after treatment. The samples (200 mg) were homogenized in phosphate buffer, and extracted twice with dichloromethane. The fluoroquinolones were detected by high performance liquid chromatography with fluorescence detection at 295 nm excitation and 500 nm emission.
The concentration of enrofloxacin residues was maximal at 24 h after treatment (0.073 + 0.006 ìg/ g) and was lower than the maximal limit levels established by international regulations (0.3 ìg/g). In ciprofloxacin administrated animals the superior concentration of the antimicrobial in muscle was 72 h after treatment with 0.027 + 0.015 ìg/g. The consumers and the authorities must be concern about the control of veterinary residues in different products and edible tissues of farm animals.
Referencias
1. Abadía AR, Aramayona JJ, Muñoz MJ, Pla Delfina JM, Bregante MA. Ciprofloxacin pharmacokinetics in dogs following oral administration. J. Vet. Med. 1995; 42:501-511. [ Links ]
2. Cerdá O, Xavier JA, Petruccelli MA, Etcheverrigaray ME. Aislamiento de mycoplasma synoviae de pollos parrilleros y gallinas reproductoras. Primera comunicación en la República Argentina. Analecta Vet. 1998; 18(1/2):41-46. [ Links ]
3. Codex Alimentarius: Veterinary Drug Residues in Food-MRL. [ref. de 17 de mayo de 2005 ]. Disponible en Web: http://faostat.fao.org/faostat/collections [ Links ]
4. Dowling PM, Wilson RC, Tyler JW, Duran SH. Pharmacokinetics of ciprofloxacin in ponies. J. Vet. Pharmacol. Ther. 1995; 18:7-12. [ Links ]
5. FDA. Food and Drug Administration, Center for Veterinary Medicine, Updated Information on FDA ‘s Proposed withdrawal of Approval of Poultry Fluoroquinolones. [ref. de 17 de mayo de 2005 ]. Disponible en Web: http://www.fda.gov/CVM/antimicrobial/antimicrobial.HTML [ Links ]
6. García Ovando H, Gorla N, Poloni G, Trotti N, Prieto G, Errecalde C. Intravenous pharmacokinetics of ciprofloxacin in goats. Int. J. Antimicrob. Agents. 2000a; 15:77-79. [ Links ]
7. García Ovando H, Gorla N, Lûders C, Poloni G, Errecalde C, Prieto G, Puelles, I. Comparative pharmacokinetics of enrofloxacin and ciprofloxacin in chickens. J. Vet. Pharmacol. Ther. 1999; 22:209-212. [ Links ]
8. García Ovando H, Gorla N, Weyers A, Ugnia L, Martinez M, Giacomelli N, Liboa R, Chiostri E, Davicino R. Enrofloxacin liquid-liquid extraction from chicken muscle and HPLC detection. J. Liquid Chromatogr. Rel. Technol. 2000b; 23:2391-2397. [ Links ]
9.- García Ovando H, Magnoli A, Gorla N, Weyers A, Ugnia L. Simultaneous quantification of ciprofloxacin, enrofloxacin and balofloxacin in broiler chicken muscle Arch. Med. Vet. 2004; 36 (1):93-98. [ Links ]
10. Gorla N, Chiostri E, Ugnia L, Weyers A, Giacomelli N, Davicino R, García Ovando H. HPLC residues of enrofloxacin and ciprofloxacin in eggs of laying hens. Int. J. Antimicrob. Agents. 1997; 8:253-256. [ Links ]
11. Kaneene JB, Miller R. Problems associated with drug residues in beef from feeds and therapy. Rev. Sci. Tech. Off. Int. Epiz. 1997; 16:694-708. [ Links ]
12. Knoll U, Glunder G, Kietzmann M. Comparative study of the plasma pharmcokinetics and tissue concentrations of danofloxacin and enrofloxacin in broiler chickens. J. Vet. Pharmacol. Ther. 1999; 22:239-246. [ Links ]
13. Laguna DS. Residuos de fármacos de los alimentos de origen animal. Aspectos regulatorios, analíticos y toxicológicos, Universidad Nacional de Educación a Distancia, Córdoba, España, 1995. [ Links ]
14. Mengozzi G, Intorre L, Bertini S, Soldani G. Pharmacokinetics of enrofloxacin and its metabolite ciprofloxacin after intravenous and intramuscular administration in sheep. Am. J. Vet. Res. 1996; 57:1040-1043. [ Links ]
15. Nouws JFM, Mevius DJ, Vree TB, Baars AM, Laurensen J. Pharmacokinetics renal clearance and metabolism of ciprofloxacin following intravenous and oral administration to calves and pigs. Vet. Quart. 1988; 10(3):156-163. [ Links ]
16. Papich MG. Antibacterial drug therapy. Focus on new drugs. Vet. Clin. N. A. Small Animal Practice. 1998; 28(2):215-231. [ Links ]
17. Sato S. La micoplasmosis aviar en Asia. Rev. Sci. Tech. Off. Int. Epiz. 1996; 15(4):1555-1568. [ Links ]
18. Soliman GA. Tissue distribution and disposition kinetics of enrofloxacin in healthy and E.coli infected broilers. Dtsch Tierarztl Wochenschr. 2000; 107:23-27. [ Links ]