Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.2 Medellín Apr./June 2006
ARTÍCULOS ORIGINALES
Estado actual del conocimiento sobre el yamú, Brycon amazonicus
José A Arias1, Biólogo, MS, PhD
1Instituto de Acuicultura (IALL) de la Universidad de los Llanos, A.A. 24-30, Villavicencio, Colombia.
(Recibido: 21 abril, 2005; aceptado: 27 marzo, 2006)
Resumen
Se presenta y se discute la información disponible sobre el yamú Brycon amazonicus, en aspectos de su historia natural, escala de maduración gonadal, establecimiento y manejo de reproductores, reproducción inducida, criopreservación de gametos, larvicultura, alevinaje, nutrición, cultivo y otros tópicos. El objetivo del autor es presentar esta revisión como una ayuda para fortalecer la creación de un paquete tecnológico que permita la explotación sostenible de esta especie nativa con ventajas para la piscicultura de Colombia.
Palabras clave: Brycon amazonicus, cultivo, historia natural, reproducción confinada.
Introducción
Uno de los géneros de peces dulceacuícolas neotropicales de talla mediana, con mayor número de especies es el Brycon (cerca de 40 se consideran válidas y 20 más han sido propuestas) (52, 56). Estas especies están ampliamente distribuidas desde el sur de Méjico hasta la parte media de Argentina y constituyen, junto con los géneros Chilobrycon y Henochilus, la subfamilia Bryconinae (75). Alrededor de 15 especies han sido reportadas para Colombia (56), tres de ellas con estudios en biología y piscicultura (16).
El yamú, Brycon amazonicus (Spix & Agassiz, 1829) (56), es la especie más común entre los brycónidos de los Llanos Orientales colombianos y la más explorada para piscicultura (44), dado su hábito alimenticio omnívoro (29, 35, 71), su crecimiento rápido y la gran eficiencia alimenticia con raciones con bajos niveles de proteína de origen vegetal (18, 58), óptima calidad de su carne (36) y sus especiales características para la pesca deportiva (29).
Historia natural
En Colombia las pesquerías del yamú se concentran en el río Meta, en la época de inicio de las lluvias (abril y mayo), donde se han registrado hasta 10 toneladas/mes con talla total media de captura de 52 cm (29). La distribución altitudinal de la especie se delimita entre los 50-500 m.s.n.m. (16) dado su requerimiento de aguas cálidas con rangos de temperatura de 26-30 °C; estas aguas deben contener O2 disuelto entre 4-7 mg/L, un pH entre 6-7 y una dureza de 15-45 mg/L (29, 30, 35). La especie es nativa de la cuenca del río Orinoco (48) y su prevalencia es mayor en afluentes de los ríos Meta, Ariari y Guaviare, en Colombia (29), y los ríos Arauca y Apure, en Venezuela (60, 61).
El yamú presenta dorso negro, en la parte lateral es azul oscuro metálico y ventralmente presenta color plateado; las aletas pectorales, pélvicas, anal y caudal son blanquecinas con bordes oscuros (47, 52).
Los alevinos y juveniles menores de un año viven y crecen en cardúmenes, con algunas especies acompañantes, en los extensos bosques y planicies de desborde de la estación de lluvias (“rebalse” o áreas de inundación de las sabanas llaneras) (28, 53). Los adultos tienen también comportamiento grupal, pero monoespecífico, y habitan los cuerpos de agua de caños y ríos menores de la cuenca (2, 29, 59). Su comportamiento migratorio se restringe a desplazamientos relativamente cortos de tipo horizontal, con bajanza reproductiva de los caños a los ríos mayores y subienda trófica a los mismos, al final del periodo reproductivo (29).
Es una especie de régimen alimenticio omnívoro y oportunista (29). Pero al igual que otros congéneres prefiere consumir productos vegetales en especial frutos y semillas. La cantidad y composición de los contenidos estomacales varía según la estación del año. La mayor oferta alimenticia ocurre durante la época de lluvias en las que se encuentran niveles de replexión del 90%, con 80–90% de semillas y frutos y 10–20% de insectos (35, 59, 71). Lo anterior les permite depositar, durante esta estación, grandes cantidades de lípidos, que son utilizados en la época de sequía para mantener su metabolismo, y en las hembras para movilizar las reservas de vítelo, necesarias para la maduración de los ovocitos (16, 29).
Tanto en el ambiente natural como en confinamiento, los ovarios y testículos maduran una sola vez al año de manera sincrónica por grupos, al inicio de las lluvias (marzo - abril) (16, 19, 21), Si bien en condiciones confinadas es posible encontrar hembras reproductivamente maduras al segundo año de vida, en el medio natural éstas maduran al tercer año (29).
Las poblaciones naturales contienen hembras y machos en proporciones de 1:1.5, sin caracteres sexuales secundarios y con tallas de primera maduración sexual en hembras de 28 cm de longitud estándar (29, 53, 59).
Piscicultura
La producción del yamú, en cautiverio, como la de cualquier otra especie de pez implica, por una parte, la reproducción confinada y por otra el cultivo como tal. En relación con la reproducción en cautiverio la especie ha sido estudiada con énfasis en la utilización de hormonas para la inducción a la reproducción y el control del canibalismo en las primeras etapas del desarrollo, con resultados satisfactorios que se presentan más adelante.
Escala de maduración gonadal
La información sobre el desarrollo de las gónadas es posiblemente lo más importante para la reproducción de una especie en cautiverio. En yamú los ovarios sonórganos saculares del tipo cistovario, con un ciclo anual de cinco fases sucesivas de desarrollo de los ovocitos y sus envolturas, agrupadas en dos grandes etapas: en la primera (de crecimiento primario o pre-vitelogénico), el ovocito presenta proliferación de nucléolos y visualización del corpúsculo de Balbiani, y aparecen las tres envolturas de recubrimiento a saber: la más interna es la zona radiata acelular, externa a ésta está la capa granulosa de células foliculares, y la teca que está constituida por elementos del estroma conectivo del ovario y separada de las anteriores envolturas por una membrana basal. Los ovocitos en esta etapa se presentan a lo largo de todo el ciclo y constituyen el lote de reserva (ovocito cromatina nucleolo y ovocito perinucleolar). En la segunda etapa (de crecimiento secundario o vitelogénico), hay aumento del tamaño celular por depósito de vítelo con engrosamiento de las envolturas foliculares. Los ovocitos reclutados para esta etapa (del lote de reserva), constituyen el lote de maduración y son los que ovulan en el siguiente ciclo reproductivo (ovocito alvéolo cortical, ovocito vitelogénico y ovocito maduro). Se reconoce una fase de atresia ovocitaria en la cual los ovocitos se presentan en vía de reabsorción. La escala de maduración se define en cuatro estadios: inmaduro o reposo, en maduración, maduro, y desovado o regresión (5, 19, 20).
Los testículos son órganos de estructura y funcionamiento tubular irrestricto. La espermatogénesis es cística y se presenta en seis fases: una fase de espermatogonia primaria libre adosada a lo largo de la pared del túbulo durante todo el ciclo, y cinco fases contenidas en cistos, espermatogonia secundaria, espermatocito primario, espermatocito secundario, espermátide y espermatozoide. Cada túbulo seminífero contiene múltiples cistos y cada cisto contiene células germinativas en una misma fase de desarrollo. La escala de maduración testicular se define en cuatro estadios: inmaduro o reposo, maduración, maduro y regresión (6, 16, 17).
Como ocurre en otras especies del género, el índice gonadosómatico (Igs) es mayor en las hembras que en los machos, tanto en el medio natural (16 y 2.5) como en confinamiento (12 y 2) (16, 17), y los factores de condición indican con gran aproximación los diferentes estadios del desarrollo de las gónadas (9, 11). La fecundidad absoluta es amplia y variable, a menudo se obtienen cerca de 120 mil huevos uniformes kg/hembra (53). Los individuos de esta especie no poseen ningún tipo de cortejo reproductivo y la reproducción ocurre en grupos. Los huevos son demersales, semiflotantes y no reciben cuidado parental (29).
Consecución y manejo de reproductores
Existen dos formas de obtención de padrotes para la reproducción en cautiverio: una es la captura de los adultos en los ambientes naturales, antes y durante laépoca de desove. La condición muy silvestre de la especie que se traduce en gran recelo y nerviosismo, en general, y en particular el lapso en que se les captura para fines reproductivos, han hecho que esta forma de consecución sea cada vez menos utilizada, pues los animales son muy susceptibles al estrés que les genera la captura y demás manipulaciones subsecuentes, al punto que la cascada de sucesos fisiológicos determina que en el 80% de los casos, el ejemplar muera (16, 29).
La otra forma de obtener reproductores es mediante la conformación de planteles a partir de la cría de alevinos obtenidos por reproducción confinada. Los juveniles pueden ser cultivados el primer año de vida a una densidad de 0.5 individuo/m2 en estanques en tierra y, a partir del segundo año, a densidad de 200 g de peso vivo (p.v.)/m2 en estanques en tierra (16, 17). Los autores recomiendan alimentar a diario con un concentrado para peces tropicales con el 25 - 32 % de proteína bruta, en cantidades equivalentes al 3% de la biomasa/día, consiguiéndose así un aumento de peso de 1 - 2 g/individuo/día (4, 17).
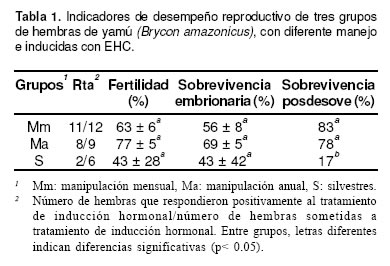
Se han experimentado técnicas de “domesticación” consistentes en la pesca y manipulación mensual de los peces. Tales prácticas han sido evaluadas mediante experimentos de inducción reproductiva de peces manipulados y peces capturados en el medio natural, encontrándose que los reproductores manipulados son menos susceptibles al estrés y más dóciles, al tiempo que presentan mejores respuestas reproductivas y mayor sobrevivencia de los padrotes posdesove, sin que la fertilidad y la sobrevivencia embrionaria entre grupos sean significativamente diferentes (véase Tabla 1) (4, 17, 24).
Como parte del proceso de preparación de los reproductores, se ha experimentado una restricción alimenticia consistente en la disminución del 50% de la ración durante los cuatro meses previos a las prácticas de reproducción, evaluando el efecto de tal restricción por la eficiencia reproductiva al inducirlos con extracto de hipófisis de carpa (EHC) (3, 15, 17). Los autores encontraron que las hembras restringidas tuvieron una mejor respuesta al inductor y óvulos de mayor tamaño, lo que se reflejó en una menor fecundidad reproductiva (peso de desove por número de óvulos en 1g de desove), lo anterior, como consecuencia de una menor acumulación de lípidos, lo cual se expresó en un menor índice de grasa visceral (Igv) (3) (véase Tabla 2).
Reproducción inducida
Los criterios que se aplican para la preselección de reproductores para inducción reproductiva, son los tradicionales: abdomen prominente y papila genital rojiza y protruida en las hembras y, emisión de semen a leve presión abdominal en los machos. De las hembras preseleccionadas se escogen las más maduras, lo cual se documenta mediante el examen de una muestra de ovocitos obtenidos por medio de biopsia ovárica, midiendo el diámetro (8) y se establece el grado de maduración final a través de la migración nuclear (74). Se recomienda tener como referencia para seleccionar hembras óptimas, aquellas que posean ovocitos con diámetro promedio igual o mayor a 1.100µ y cuyos núcleos se encuentren migrando en un 50% o más (16).
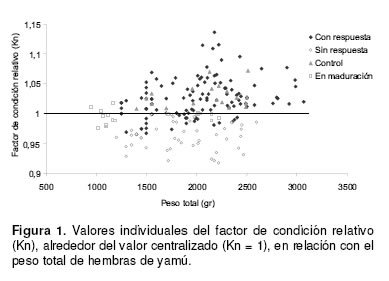
A partir de la relación alométrica (Pt = a * Lt b, donde: Pt = Peso total, a = Factor de condición o intercepto, Lt = Longitud total, b = Coeficiente de regresión), se probó durante cuatro años el empleo del factor de condición relativo Kn = Pt / Pe, donde: Kn = Factor de condición relativo, Pt = Peso total y Pe = Peso esperado calculado a partir de Pe = a Lt b, según Le Cren (55), para seleccionar hembras para inducción con hormonas (7). Los experimentos recomendaron el uso de este índice por considerarlo un criterio seleccionador tan eficiente como los descritos en el párrafo anterior (16), sin ser invasivo ni causar los traumatismos propios de otros métodos, como son el aumento del estrés y el taponamiento del oviducto (véase Figura 1) (7, 8, 9).
En confinamiento, la especie conserva su época y periodo de reproducción como en el ambiente natural, dependiendo del ciclo hidrológico. La reproducción se inicia cuando ha comenzado la estación de lluvias en la región, por lo general en el mes de abril, y tiene una duración corta de 15 - 20 días (16, 29, 59).
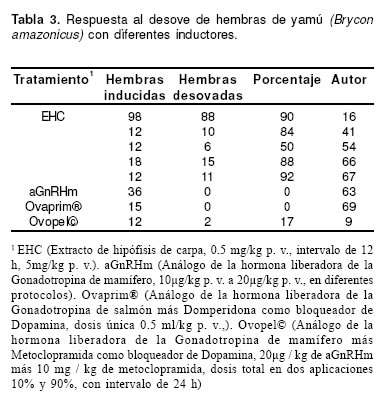
El inductor a la reproducción de primera elección es el extracto de hipófisis de carpa (EHC), en protocolo estándar: 0.5 mg/kg p. v., intervalo de 12 horas, 5 mg/ kg p. v. (4, 54, 67). Otros inductores sintéticos que se han probado en la especie con protocolo estándar, no han producido las respuestas esperadas (10, 63, 69). La tabla 3 reúne los principales trabajos relacionados con este tema.
En las hembras, la respuesta al inductor o tiempo de latencia (tiempo entre la última aplicación hormonal y la ovulación) es de 6 - 7 horas a una temperatura de 26 - 27 °C (16, 41, 64). El desove se realiza por estrujamiento durante la hora siguiente a la ovulación (la viabilidad de los óvulos dentro del ovario decrece vertiginosamente a partir de los 60 minutos) (41), obteniéndose en promedio 135 g de óvulos/hembra y fecundidad reproductiva de 270.000 óvulos/ reproductora (16, 66).
En los machos el semen también se obtiene por estrujamiento. En respuesta a los inductores estos aumentan el volumen seminal hasta 8.2 - 12.7 mL/ macho, cada mililitro con una concentración de 4.864– 8.679 x 106 espermatozoides (41), y valores del espermatocrito de 7.1 - 13.6 % (12, 67). La fecundación se practica en seco durante los 30 minutos siguientes a la obtención de los gametos (la viabilidad de los óvulos estrujados es de 1 h ± 0.5 y la viabilidad espermática posestrujamiento de 2 h ± 0.5), en ambos casos a 32 °C (43), requiriéndose 50.000 espermatozoides móviles por óvulo (42). La activación espermática (fertilización) se realiza con agua natural dispuesta para la incubación o solución de bicarbonato de sodio al 1% (46).
La incubación se efectúa en incubadoras tipo cónico de 2 a 200 litros (flujo de 0.2 a 2 L/s) (65). La fertilidad, medida al momento del cierre del blastoporo, alcanza 70 - 80% a las seis horas posfertilización (h.p.f.) (16, 43), la sobrevivencia embrionaria es del 65 % medida a las 10 h.p.f., en ambos casos en un rango de temperatura de 25.5 - 27.2 °C, pH de 6.2 - 6.7 y O2 disuelto de 5 - 6 mg/L (64). La eclosión se produce a las 12.5 h ± 0.6 de incubación a 27.5 °C ± 0.2 (16). El desarrollo embrionario es rápido (40), presentando seis estadios (ovocélula a las cero h.p.f.; primer clivaje a las 0.6 h.p.f.; discoblástula a las 2 h.p.f.; gástrula a las 5 h.p.f.; organogénesis a las 7 h.p.f.; eclosión a las 12.5 h.p.f.) (37, 38, 39). La sobrevivencia de los parentales posdesove llega al 75 % cuando son atendidos con baños largos de cloruro de sodio al 2 ‰ durante seis horas antes de ser devueltos a los estanques (16).
Criopreservación de gametos
Estudios sobre aspectos de la criopreservación de semen de la especie han arrojado, entre otros, los siguientes resultados: el mejor diluyente encontrado hasta el momento consiste en una solución de glucosa 5.5% peso/volumen (p/v) y yema de huevo 12% volumen/volumen (v/v), y como crioprotector DMSO (10% v/v) (41, 42, 45). Experimentos con diferentes volúmenes de congelamiento (0.5, 2.5 y 4.0 mL), mostraron que pajillas de mayor volumen son tan eficientes para conservar semen como las micropajillas (42). La temperatura de descongelación más apropiada es de 35 ºC durante 5 mtos (43). Se requieren 75000 espermatozoides móviles de semen conservado por óvulo para obtener fertilización del 65% (41).
Larvicultura
La mayor parte de los productores de alevinos se limitan a la siembra de las larvas en estanques en tierra entre las 24 - 36 horas poseclosión (h.p.e.), sin un manejo previo bajo condiciones vigiladas. La larvicultura, como cultivo de larvas en condiciones controladas, es descrita para esta especie por varios autores (13, 31, 73), pudiéndose destacar lo siguiente: se puede efectuar en incubadoras o tanques cilíndricos hasta por 60 h.p.e. (poco antes de la reabsorción completa del saco vitelino) (33). El canibalismo, muy acentuado durante el cultivo larval se inicia a las 36 h.p.e., siendo posible aumentar la sobrevievencia en un 20 - 30% cuando se mantiene una densidad de 50 larvas/L en agua con temperatura de 27-28°C, pH de 6.8-7.2, y se alimenta por primera vez a las 32 h.p.e (33).
Las fuentes experimentadas como primera alimentación durante 24 horas son: náuplios de Artemia salina, plancton silvestre seleccionado por tamaño y poslarvas de otros peces como Piaractus brachypomus (cachama), ofrecidos los dos primeros, al menos en seis ocasiones a intervalos de 4 -5 horas; y el tercero una sola vez a las 32 h.p.e. Los resultados muestran 70%±6, 61%±4 y 19%±6 de sobrevivencia a las 60 h.p.e. cuando son alimentadas con poslarvas de cachama, náuplios de A. salina y plancton silvestre respectivamente (31, 32).
El uso de la hormona del crecimiento Triyodotironina (T3) aplicada a las hembras al momento de la aplicación de la primera dosis hormonal inductora, con el propósito de atenuar el canibalismo, ha mostrado que esta hormona no aumenta la sobrevivencia larvaria, pero las larvas a las 60 h.p.e. son de talla más homogénea, lo que podría disminuir el canibalismo en la etapa de alevinaje (50).
Alevinaje
Las larvas cultivadas en condiciones controladas a las que se les ha proporcionado primera alimentación, pueden ser criadas en estanques en tierra previamente preparados como lo propone Arias (18). Los resultados obtenidos cuando son sembradas a densidad de 50 larvas-poslarvas/m² de espejo de agua, a la edad de 60 h.p.e. y alimentadas con concentrado pulverizado para peces del 45% de proteína bruta, ofrecido a voluntad tres a cinco veces/día, siete días a la semana, a partir del cuarto día de la siembra, han arrojado resultados de sobrevivencia del 33% a los 12 - 15 días de alevinaje (33). Los alevinos obtenidos son generalmente heterogéneos, con longitud total de 29 mm ± 10 (31, 32, 34).
Nutrición
Los trabajos en aspectos nutricionales para yamú apenas empiezan, pero ya muestran resultados sorprendentes en cuanto a los requerimientos de la especie y las relaciones entre nutrientes. En experimentos con dietas semipurificadas de 17, 21 y 25% de proteína y 2.6, 2.9 y 3.2 Kcal de energía digestible/g, la relación que produjo el mejor crecimiento fue la de 21% de proteína con 3.2 kcal/g (58, 70).
Cultivo
En Colombia, el cultivo en estanques de tierra de 500-2000 m², se concentra en los departamentos de los Llanos Orientales (Meta, Casanare, Arauca y Guaviare) y en algunos de la Amazonía (Caquetá y Putumayo) (44). En otros departamentos del país (Valle del Cauca, Antioquia y Eje Cafetero), la especie incursiona con gran éxito en cultivos para pesca deportiva. Es un cultivo nuevo, con sólo seis años de desarrollo, pero que ya se perfila como una alternativa rentable (44), con producción estimada de 1500 toneladas métricas para el año 2003 (Torres, com. pers.). Las condiciones de cultivo son similares a las utilizadas para otras especies nativas como la cachama (44, 72). Las diferentes actividades propuestas para el monocultivo de la especie son (18): densidad de siembra de 1 - 1.5 individuos/m2 con reposición de agua por infiltración y evaporación (22, 23, 26), alimentación con raciones comerciales para peces o mezclas de granos que contengan 22 - 30% de proteína bruta (25), y suplementación alternativa con hojas y frutos (22). Las raciones pueden ser administradas diariamente en cantidades correspondientes al 3% de la biomasa, dos veces al día, seis días a la semana (27). En las condiciones anteriores se han logrado conversiones alimenticias entre 1.5 - 2, en tiempo de cultivo de 4 - 6 meses, cosechando animales entre 400 - 600 g (51, 57, 68). En policultivo su rendimiento mejora hasta un 20% al igual que la producción de las especies acompañantes (21, 22).
Otros estudios
En el análisis de la distribución proteica sérica de la especie mediante electroforesis en acetato de celulosa, fueron hallados 5.02 g.dL-1 de proteína total con dos patrones electroforéticos, el primero de 5 a 6 bandas y el segundo de 10 bandas, sugiriendo una mayor proporción de gama globulinas que en otros carácidos (1). La descripción de la morfología macro y microscópica del esófago, estómago y ciegos pilóricos de la especie, fijó la atención en estos últimos como estructuras de gran importancia fisiológica en el manejo digestivo y metabólico de los alimentos (49).
Al estudiar los valores normales hematológicos y la química sanguínea en tres edades, comparándolas entre sí y con otras especies del género, se concluyó que las constantes sanguíneas se encuentran dentro de los rangos hallados para otras especies de peces suramericanos (14). Mediante el cultivo de linfocitos se encontró una dotación cromosómica de 2n=50 (24 metacéntricos y 26 submetacéntricos / subtelocéntricos), con un gran metacéntrico que es considerado un marcador para el género Brycon (62).
Conclusiones
A pesar de los avances en el último lustro sobre los diferentes aspectos de la reproducción y cultivo del yamú, son varios los temas que requieren atención para el fortalecimiento de su piscicultura, los más urgentes se relacionan con: 1) el rompimiento reproductivo anual y estacional, 2) en la larvicultura y alevinaje, el uso de nuevas técnicas que permitan aumentar las expectativas de sobrevivencia sobre la base de la disminución del canibalismo, 3) en la nutrición y alimentación, estudios sobre los requerimientos nutricionales y digestibilidad de dietas en las diferentes edades, para aumentar su rendimiento y evitar la sobrecarga de desechos nitrogenados, 4) en los sistemas de cultivo, practicas amigables con el medio ambiente, 5) en los procesos de beneficio de los productos, se requieren trabajos sobre técnicas y procedimientos para la cosecha, manejo poscosecha y mercadeo, y 6) otros temas que requieren investigaciones son la genética, la selección artificial, la morfo-fisiología y la inmunología.
Agradecimientos
El autor agradece a todos los profesores colegas, estudiantes y operarios del Instituto de Acuicultura IALL de la Universidad de los Llanos y a los demás investigadores de otras instituciones, por los estudios realizados sobre el yamú durante los últimos años.
Summary
Actual situation of the knowledge about Yamú (Brycon amazonicus) This article presents and discusses the available information on yamú Brycon amazonicus, with special reference to its natural history, gonadal maturation scale, establishment and management of reproducers, induced reproduction, gametes obtention and preservation, larva culture, alevin management, and nutrition. It is our intention to present this information to aid in the building of a technological package that would eventually allow a sustainable fish culture of this and other native species in Colombia.
Key words: Brycon amazonicus, confined reproduction, fish culture, natural history.
Referencias
1. Almansa JE, Montoya FJ, Arias CJA, Eslava MPR. Proteínas séricas del yamú (Brycon siebenthalae) de los Llanos de Colombia. Aqüicultura Brasil 2000; Florianópolis, Brasil; 2000. P. 123. [ Links ]
2. Álvarez de León M. Contribución al conocimiento de los peces de los Llanos, anatomía e histología básica del yamú Brycon siebenthalae. Trabajo de pregrado, Universidad de los Llanos, Villavicencio, 1991. 95p. [ Links ]
3. Arias CJA, Zaniboni FE, Pardo CSC, Vásquez TW, Atencio GVJ. Effect of food restriction in spawning of yamu females Brycon siebenthalae. Rev Acta Scientiarum Ani Sci Maringá 2005; 272:235-239. [ Links ]
4. Arias CJA, Zaniboni FE, Pardo CSC, Vásquez TW, Atencio GVJ. Breeding and domesticating Brycon siebenthalae females for reproduction. Rev Acta Scientiarum Ani Sci Maringá 2004; 262:159-163. [ Links ]
5. Arias CJA, Zaniboni F, Vásquez TW. Ovogénesis del yamú Brycon siebenthalae (Teleostei: Characidae) en cautiverio. Rev Actual Biol 2004; 81:75-87. [ Links ]
6. Arias CJA, Zaniboni-Filho E, Cruz-Casallas PE. Ciclo testicular yamú, Brycon siebenthalae (Teleostei: Characidae) en cautiverio. Rev Actual Biol 2004; 81:88-98. [ Links ]
7. Arias CJA, Zaniboni FE, Vásquez TW. Atencio GVJ. Selección de hembras de yamú Brycon siebenthalae para reproducción inducida mediante el factor de condición relativo (Kn). Rev Orinoquia 2004; 8:49-55. [ Links ]
8. Arias CJA, Zaniboni FE, Pardo CSC, Vásquez TW, Muñoz RAP. Diâmetro dos ovócitos como critério de seleção de fêmeas de Brycon siebenthalae para reprodução induzida. I Congresso da Sociedad Brasileira de Aqüicultura e Biología Aquática; Recife, Brasil; 2004. P. 213. [ Links ]
9. Arias CJA, Zaniboni FE, Pardo CSC, Vásquez TW, Atencio GVJ. El factor de condición relativo (Kn), como indicador de madurez gonadal en hembras de Brycon siebenthalae. I Congresso da Sociedad Brasileira de Aqüicultura e Biología Aquática; Recife, Brasil; 2004. P. 221. [ Links ]
10. Arias CJA, Aya BE, Velasco SJ. Inducción reproductiva de yamú con Ovopel©. II Congreso Col Acuicultura; Villavicencio; 2004. P. 131. [ Links ]
11. Arias CJA, Zaniboni FE. Los factores de condición como indicadores del desarrollo y madurez ovocitaria en yamú Brycon siebenthalae. II Congreso Col Acuicultura; Villavicencio; 2004. P. 133-134. [ Links ]
12. Arias H, Luque JA, Landines MA. Efecto del extracto de hipófisis de carpa (EPC) sobre las características seminales y el porcentaje de fertilización de machos de yamú (Brycon siebenthalae). II Congreso Col Acuicultura; Villavicencio; 2004. P. 121-122. [ Links ]
13. Arias CJA, Balaguera D, Rodríguez SCM. Desarrollo larvario del yamú Brycon siebenthalae. Rev Orinoquia 2003. 7:28-33. [ Links ]
14. Arias CJA, Benavides SM, Hernández AG. Valoración hematológica y química sanguínea del yamú Brycon siebenthalae, en tres etapas de cultivo. Rev Orinoquia 2003; 7:34-41. [ Links ]
15. Arias CJA, Zaniboni FE, Pardo CSC, Vásquez TW. Atencio GVJ. Effect of food restriction in spawning of yamu females Brycon siebenthalae. Aquaculture 2003; Bahia, Salvador, Brazil; 2003. P. 52. [ Links ]
16. Arias CJA. Biología reproductiva del yamú Brycon siebenthalae (Teleostei, Characidae) en cautiverio. Tesis de doctorado, Universidad del Valle, Cali, 2002. 112p. [ Links ]
17. Arias CJA, Zaniboni FE, Pardo CSC, Atencio GVJ, Vásquez TW. Desarrollo gonadal y efectos de la domesticación y la restricción alimenticia de yamú (Brycon siebenthalae) en cautiverio. VIII Jornada de Acuicultura, Villavicencio: Universidad de los Llanos-IALL; 2002: P. 55-63. [ Links ]
18. Arias CJA. El cultivo del yamú. 2da Ed Juan XXIII. UniLlanos-IALL-IIOC. Villavicencio, 2001. [ Links ]
19. Arias CJA, Aya BE, Vásquez TW. Reproductive biology of the yamú Brycon siebenthalae (characiforme:characidae) of the Meta River, Colombia. Aquaculture 2001, Orlando, Florida, USA; 2001. P. 28. [ Links ]
20. Arias CJA, Aya BE. Biología reproductiva del yamú Brycon siebenthalae, en ambientes naturales. I Congreso Col Zool; Bogotá: Univ Nal; 2000. P. 86. [ Links ]
21. Arias CJA, Murillo PR. Evaluación de dos densidades de siembra en policultivo del yamú Brycon siebenthalae con cherna Colossoma macropomun y coporo Prochilodus mariae. VI Jornada de Acuicultura, Segunda Reunión Regional del Género Brycon; Granada: Universidad de los Llanos-IALL; 2000. P. 17-20. [ Links ]
22. Arias CJA, Murillo PR, Parada SL, Rodríguez SCM, García JA. El cultivo del yamú en la región del Ariari del departamento del Meta. VI Jornada de Acuicultura, Segunda Reunión Regional del Género Brycon; Granada: Universidad de los Llanos-IALL; 2000. P. 1-6. [ Links ]
23. Arias CJA, Parada GSL, García TJ. Desempeño del yamú Brycon siebenthalae, en monocultivo con tres densidades de siembra. VI Jornada de Acuicultura, Segunda Reunión Regional del Género Brycon; Granada: Universidad de los Llanos-IALL; 2000. P. 11-13. [ Links ]
24. Arias CJA, Pardo CSC, Atencio GVJ, Vásquez TW. Domesticación y cría de reproductores de yamú Brycon siebenthalae en los llanos de Colombia. Aqüicultura Brasil 2000; XI Simbraq, Florianópolis, Brasil; 2000. P. 35. [ Links ]
25. Arias CJA, Rodríguez SCM. Experimentos con tres niveles de proteína en la ración para engorde del yamú Brycon siebenthalae. VI Jornada de Acuicultura, Segunda Reunión Regional del Género Brycon; Granada: Universidad de los Llanos-IALL; 2000. P. 14-16. [ Links ]
26. Arias CJA, Pardo CSC. Ensayos preliminares de tres densidades de siembra en monocultivo de yamú. Memoria Primera Reunión Regional del Género Brycon; Villavicencio: Universidad de los Llanos-IALL INPA Agropesca Acuoriente; 1998. P. 7. [ Links ]
27. Arias CJA, Cardona E, Acevedo O, Muñoz A, Cruz CPE, et al. Ensayos de monocultivo por etapas en yamú. Primera Reunión Regional del Género Brycon; Villavicencio: Universidad de los Llanos-IALL INPA Agropesca Acuoriente; 1998. P. 8. [ Links ]
28. Arias CJA. Contribución al conocimiento de los peces de los llanos, anatomía, histología y fisiología del yamú Brycon siebenthalae Eingenmann, 1912. 3er Simposio Col Ictiol; Barranquilla; 1996. P. 51. [ Links ]
29. Arias CJA. Contribución al conocimiento biológico de los peces de los Llanos, yamú (Brycon siebenthalae) y sapuara (Semaprochilodus laticeps cf.), con fines de cultivo. Informe final de investigación. UniLlanos-Colciencias; Villavicencio; 1995. 63P. [ Links ]
30. Arias CJA. Abióticos del Medio Río Meta. Rev MVZ UniLlanos; 1994. 1:32-35. [ Links ]
31. Atencio GVJ, Zaniboni FE, Pardo CSC, Arias CJA. Influência da primeira alimentação na larvicultura e alevinagem do yamú Brycon siebenthalae (Characidae). Rev Acta Scientiarum Ani Sci Maringá 2003; 25:61- 72. [ Links ]
32. Atencio GVJ, Zaniboni FE, Pardo CSC, Arias CJA, Vásquez TW. Influencia de la primera alimentación en el alevinaje del yamú Brycon siebenthalae. VIII Jornada de Acuicultura; Villavicencio: Universidad de los Llanos- IALL; 2002. P. 65-76. [ Links ]
33. Atencio GVJ. Influéncia da primera alimentação na alevinagen do yamú Brycon siebenthalae (Eigenmann, 1912). Tese de maestrado, Universidad Federal de Santa Catarina, Florianópolis, Brasil, 2000.130p. [ Links ]
34. Atencio GVJ, Pardo CSC, Arias CJA, Zaniboni FE, Vásquez TW. Larvicultura y alevinaje del yamú Brycon siebenthalae en los Llanos colombianos. I Congreso Suramericano Acuicul; Recife, Brasil, 1998. P. 68. [ Links ]
35. Bernal RJH, Cala P. Composición de la dieta alimenticia del yamú Brycon siebenthalae (Pisces:Characidae), en la parte media del río Guayabero, sistema del alto río Guaviare, Colombia. Dahlia Rev Asoc Colom Ictiol 1997; 2:55-63. [ Links ]
36. Cifuentes RA. Composición nutricional de la carcaza de yamú en cinco etapas de cultivo. Trabajo de preparado, Universidad La Salle, Bogotá, 1999. 64p. [ Links ]
37. Clavijo AJA, Arias CJA. Avances en el estudio de la embriología del yamú, Brycon siebenthalae (Pisces: Characidae). Dahlia Rev Asoc Col Ictiol 2004; 7:37-48. [ Links ]
38. Clavijo AJA, Arias CJA. Development embryonic of yamú Brycon siebenthalae (Pisces, Characidae). Aquaculture 2003, Bahia, Salvador, Brasil; 2003. P. 52. [ Links ]
39. Clavijo AJA, Arias CJA. Apuntes acerca de la embriología de peces reofílicos: el modelo en el yamú Brycon siebenthalae. IX Jornada de Acuicultura; Villavicencio: Universidad de los Llanos-IALL Villavicencio; 2003: P. 39-48. [ Links ]
40. Clavijo AJA. Desarrollo embrionario del yamú, Brycon siebenthalae Eigenmann, 1912 (Pisces: Characidae). Trabajo de pregrado, Fundación Universidad Agraria de Colombia, Bogotá, 2002. 58p. [ Links ]
41. Cruz CPE, Pardo CSC, Arias CJA, Lombo CPE, Lombo RDA, et al. Cryopreservation of yamu Brycon siebenthalae Milt. J World Aquac Soc 2004; 35:529-535. [ Links ]
42. Cruz CPE, Velasco SYM. Crioconservación de semen de yamú (Brycon siebenthalae): calidad seminal, dosis inseminante y sistemas de empaque. II Congreso Col Acuicultura; Villavicencio; 2004. P. 27-34. [ Links ]
43. Cruz CPE. Características espermáticas y crioconservación de semen de yamú (Brycon siebenthalae) situación actual y perspectivas. VIII Jornada de Acuicultura: Villavicencio; Universidad de los Llanos-IALL 2002. P. 39-48. [ Links ]
44. Cruz CPE, Arias CJA, Vásquez TW, Eslava MPR. Cultivo de la cachama y el yamú en los Llanos Orientales de Colombia. Rev Col Cien y Tec colciencias 2000. 18:25-29. [ Links ]
45. Cruz CPE, Pardo CSC, Arias CJA. Resultados preliminares sobre características seminales del yamú Brycon siebenthalae. II Congreso Suramericano de Acui, Puerto La Cruz, Venezuela; 1999. P. 35. [ Links ]
46. Cruz CPE, Pardo CSC, Arias CJA, Pardo MJA, Lombo RDA. Fertilidad de semen de yamú Brycon siebenthalae criopreservado con DMSO y activado con bicarbonato de sodio. II Congreso Suramericano de Acui, Puerto La Cruz, Venezuela; 1999. P. 36. [ Links ]
47. Eigenmann CH. The Freshwater fishes of British Guiana. Mem Carnegie Mus Pittsburg 1912; V:370-372. 48. Eigenmann CH. Fishes of Northwestern South America. Mem Carnegie Mus Pittsburg 1922; IXV:129-139. [ Links ]
49. Eslava RPR, Suárez MH, Pardo CSC, Arias CJA, Cruz CPE. Morfología macro y microscópica del esófago, estómago y ciegos pilóricos del yamú Brycon siebenthalae. Rev Orinoquía 2001; 5:111-128. [ Links ]
50. García TJ, Arias CJA, Cruz CPE. Efectos de la administración preovulatoria de Triiodotironina (T3) sobre el desempeño reproductivo y desarrollo larvario en yamú Brycon siebenthalae. Rev Orinoquia 2004; 8:57-63. [ Links ]
51. González OM, Murillo PR, Arias CJA, Vásquez TW, Medina RVM. Ensayos de alimentación del yamú Brycon siebenthalae con tres diferentes proporciones de soya integral en la ración. VII Jornada de Acuicultura, Villavicencio, Universidad de los Llanos-IALL; 2001. P. 27-32. [ Links ]
52. Howes G. Review of the genus Brycon (Teleostei:Characoidei). Bull Br Mus Nat Hist (Zool.) 1982; 43:1-47. [ Links ]
53. Hurtado RH, Useche LCA. Estudio sobre la biología del yamú Brycon siebenthalae Eigenmann, 1912 y de la palometa, Mylossoma duriventris Cuvier, 1818, (Pisces: Characidae), en la parte baja del río Cafre, sistema del río Guaviare. Trabajo de pregrado, Universidad Nacional, Bogotá, 1986. 136p. [ Links ]
54. Landines PMA. Inducción de la reproducción del yamú Brycon siebenthalae a partir de extracto de hipófisis de carpa (EPC). Bol Cient INPA 1995; 3:5-17. [ Links ]
55. Le Cren R. The length-weight and seasonal cycle in gonad weight and condition in the perch (Perca fluviatilis). J Anim Ecol 1951; 20:201-209. [ Links ]
56. Lima FCT. Subfamily Bryconinae (Characins, tetras). In: Check list of the freshwater fishes of South and Central America. Organized by Reis RE, Kullander SO, Ferraris CJ. Edipucrs, Porto Alegre 2003; 174-181. [ Links ]
57. Lizarazo CDA. Factor de condición y curva de crecimiento del yamú Brycon siebenthalae, en condiciones de cultivo. Trabajo de pregrado, Universidad La Salle, Bogotá.1999. 45p. [ Links ]
58. López OYM, Vásquez TW, Arias CJA, Wills FA. Evaluación de diferentes proporciones de energía/proteína en dietas para juveniles de yamú, Brycon siebenthalae (Eigenmann, 1912). Rev Orinoquia 2004; 8:64-76. [ Links ]
59. Lugo RLM. Determinación de hábitos alimenticios, madurez sexual y desove en tres especies ícticas de la cuenta del río Tomo, Vichada y consideraciones para el mantenimiento de padrotes. Informe final de investigación, Universidad de los Llanos colciencias coinco; Villavicencio; 1989. 137p [ Links ] 60. Machado AA. Los peces de los llanos de Venezuela. Un ensayo sobre su historia natural. Universidad Central de Venezuela; Litopar, CA, Caracas; 1993. [ Links ]
61. Mago L F. Estudios preliminares sobre la ecología de los peces de los llanos de Venezuela. Acta Biol Venez 1970; 7:71-102. [ Links ]
62. Parada GSL, Arias CJA, Cruz CPE. Caracterización cariotípica del yamú (Brycon siebenthalae). Rev Orinoquia 2003; 7:42-46. [ Links ]
63. Pardo CSC, Suárez MH, Muñoz LD, Arias CJA, Gil H. Inducción de la ovulación y el desove de yamú con implantes de m-GnRH-a. Bol Inst Pesca Sao Paulo 2002; 28:19-24. [ Links ]
64. Pardo CSC. Reprodução induzida de Yamú Brycon siebenthalae (Pisces: Characiformes). Tese de Maestrado, Univ de Santa Cataraina, Florianópolis, Brasil, 2001. 67p. [ Links ]
65. Pardo CSC, Suárez MH, Arias CJA, Atencio GVJ, Zaniboni FE, Vásquez TW. Avaliação de incubadoras experimentais para pesquisa em reprodução induzida. Aqüicultura Brasil 2000. XI Simbraq, Florianópolis, Brasil, 2000. P. 134-140. [ Links ]
66. Pardo CSC, Arias CJA, Atencio GVJ, Zaniboni FE. Experiencias de reproducción inducida en el yamú, Brycon siebenthalae en los Llanos colombianos. II Curso Internacional de Acuicultura, Universidad Nacional, Bogotá, 1999. P. 122-128. [ Links ]
67. Pardo CSC, Arias CJA, Atencio GVJ, Zaniboni FE. Ensayos de reproducción inducida del yamú, Brycon siebenthalae en los Llanos colombianos. I Congreso Suramericano de Acuicultura, Recife, Brasil; 1998. P. 78. [ Links ]
68. Peñaloza GNT, Arias CJA, Rodríguez SCM, Vásquez TW. Alimentación del yamú Brycon siebenthalae, con tres diferentes presentaciones de la ración en la etapa de terminación de engorde. VII Jornada de Acuicultura, Villavicencio, Universidad de los Llanos-IALL; 2001. P. 33-38. [ Links ]
69. Rodríguez SCM, Arias CJA, Parada GSL. Utilización del OVAPRIM® en la reproducción inducida del yamú Brycon siebenthalae. aqüicultura Brasil 2000. XI Simbraq, Florianópolis, Brasil; 2000. P. 67. [ Links ]
70. Salinas VJC, Vásquez TW, Wills FA, Arias CJA. Estudio preliminar para la determinación de proteína cruda en juveniles de yamú Brycon siebenthalae (Eigenmann, 1912). VII Jornada de Acuicultura, Villavicencio; Universidad de los Llanos; 2001. P. 39-46. [ Links ]
71. Useche CP, Hurtado RH, Cala P. Sobre la ecología de Brycon siebenthalae y Milossoma duriventris (Pices: Characidae) en el río Cafre, Orinoquia. Rev Caldasia 1993; 17:341-352. [ Links ]
72. Vásquez TW. Hablemos del cultivo de la Cachama. Univ de los Llanos DRI; Villavicencio; 1991. [ Links ]
73. Venegas S, Lombo A. Larvicultura y alevinaje del yamú Brycon siebenthalae (eigenmann, 1912). Trabajo de pregrado, Universidad La Salle, Bogotá, 1996. 67p. [ Links ]
74. Woynarovich E, Horvath L. A propagação artificial de peixes de águas tropicais- Manual de extensao. FAO/CODEV/CNPq; Brasilia; 1983. [ Links ]
75. Zanata AM. Estudo das relações filogéneticas do gênero Brycon Mueller & Troschel, 1844 (Characidae; Characiformes). Tese do doutorado, Instituto de Biociência, Universidad de San Pablo, Brasil, 2000. 358p. [ Links ]