Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.2 Medellín Apr./June 2006
Determinación del espermatocrito y efecto del volumen de la dosis seminante sobre la fertilidad en yamú (Brycon amazonicus)
Pablo E Cruz-Casallas1, MVZ, MSc, PhD; Yohana M Velasco-Santamaría1, MV; Víctor M Medina-Robles1, MVZ, cMSc
1Grupo de Reproducción y Toxicología de Organismos Acuáticos – GRITOX, Instituto de Acuicultura, Facultad de Ciencias Agropecuarias y Recursos Naturales, Universidad de los Llanos, A.A. 110, Villavicencio, Meta - Colombia.
(Recibido: 18 abril, 2005; aceptado: 24 abril, 2006)
Resumen
El yamú (Brycon amazonicus – Spix & Agassiz 1829) es un pez omnívoro de rápido crecimiento y carne de alta calidad y aceptación comercial. Para estandarizar el espermatocrito (SPCTO), 23 muestras de semen fueron centrifugadas a 14000 g durante 1, 3, 5, 7 ó 10 min. El tiempo de centrifugación tuvo un efecto significativo sobre el valor del espermatocrito (SPCTO) (p<0.05). Para conocer la concentración espermática (CE) durante la época reproductiva y su relación con el SPCTO, la espermiación de 40 machos fue inducida con extracto de hipófisis de carpa (4.0 mg.kg -1). La CE fue evaluada mediante cámara de Neubauer (dilución 1:1200) y el SPCTO por centrifugación a 14000 g durante 5 min. La relación entre SPCTO y CE fue positiva y altamente significativa (y= 1.69 + 0.59x; r2= 0.74; p<0.0001), pero no se observaron diferencias estadísticas (p>0.05) entre los meses evaluados (marzo, abril y mayo). Finalmente, para determinar el efecto del volumen de la dosis seminante sobre la fertilidad, 2 g de oocitos fueron seminados con 3, 15, 45, 90 o 180 mL de semen (n= 12), cuya CE fue previamente ajustada para contener 50000 espermatozoides (sptz)/oocito, utilizando como diluyente plasma seminal homólogo. Los porcentajes de fertilidad fueron 83, 86, 86, 85 y 87%, respectivamente (p>0.05).
Palabras clave: concentración espermática, dosis seminante, espermatocrito, yamú.
Introducción
Brycon es un género de carácidos neotropicales, ampliamente distribuido en las aguas continentales desde México hasta Argentina (9). Brycon amazonicus (yamú) es una especie nativa de la cuenca del río Orinoco de Colombia y Venezuela, de hábitos alimenticios omnívoros, rápido crecimiento y carne de alta calidad, la cual es actualmente considerada de importancia económica para la piscicultura suramericana (14).
En todas las especies animales, evaluar la calidad espermática es requisito indispensable para asegurar el éxito de la inseminación artificial y para monitorear los procedimientos de manipulación del material seminal, tales como su almacenamiento en fresco y la crioconservación (5). Junto con la movilidad y el tiempo de activación, la concentración espermática (CE) es una de las variables más utilizadas para determinar la calidad seminal en peces (2, 10), la cual consiste en la expresión del número de espermatozoides (sptz) por mL o mL.
Varios procedimientos han sido utilizados para calcular la CE (1, 13), siendo el más común la utilización del hemocitómetro o cualquier otra cámara contadora de partículas. Sin embargo, este proceso es laborioso y consume mucho tiempo, lo cual reduce su practicidad cuando el resultado de varios reproductores debe ser conocido en un corto periodo de tiempo.
El SPCTO es un procedimiento alternativo para medir la CE, el cual ha sido utilizado en peces (11, 13, 17). Varios autores han reportado en algunas especies una relación positiva y estadísticamente significativa entre el SPCTO y la CE (4, 12); sin embargo, dicha relación no siempre es alta, debido especialmente a una deficiente estandarización de las condiciones de centrifugación para la lectura del SPCTO o de la preparación y montaje de la cámara de Neubauer (6, 13). En yamú, trabajos previos realizados en nuestro laboratorio (6) mostraron una baja correlación (r2= 0.30) entre el SPCTO y la CE, por lo tanto es aún necesario estandarizar las condiciones de centrifugación para obtener un empaquetamiento espermático eficiente y que permita establecer una mayor relación entre la CE y el SPCTO.
Aunque varios trabajos han sido realizados con el propósito de conocer la proporción o número de sptz/ oocito necesaria para una seminación exitosa, la información disponible sobre los efectos del volumen de la dosis seminante sobre la fertilidad aún no han sido suficientemente estudiados. Los objetivos del presente trabajo fueron estandarizar la determinación del SPCTO, conocer la CE durante la estación reproductiva y evaluar el efecto del volumen de la dosis seminante sobre la fertilidad.
Materiales y métodos
Fueron utilizados individuos adultos de yamú de tres años de edad, sexualmente maduros, criados y mantenidos en la estación piscícola del Instituto de Acuicultura (IALL) de la Universidad de los Llanos (UNILLANOS), con un peso corporal de 2.0 y 1.7 kg y una longitud total de 52.0 y 49.4 cm, hembras y machos respectivamente. En las hembras la maduración final y la ovulación fueron inducidas mediante la administración intramuscular (IM) de 5.75 mg kg-1 de peso corporal de extracto de hipófisis de carpa (EHC, Stoller Fisheries, USA) distribuida en tres aplicaciones a las 0 (0.25 mg.kg-1), 24 (0.5 mg.kg-1) y 36 (5.0 mg.kg-1) horas. La espermiación fue estimulada administrando 4.0 mg.kg-1 de EHC, en una sola inyección IM, aplicada simultáneamente con la segunda inyección de las hembras.
La extracción de los gametos fue realizada mediante masaje cráneo-caudal del abdomen, 6 a 7 horas y 18 a 24 horas después de la última inyección de la hormona, en hembras y machos, respectivamente. Para determinar el volumen total de semen, el material seminal fue recolectado directamente en tubos de vidrio aforados. Para conocer el peso del desove, los oocitos se colectaron en recipientes plásticos limpios y secos, los cuales fueron inmediatamente pesados en una balanza digital (Scout Pro, Ohaus Corporation, Pine Brook NJ. USA). Previo a la obtención de los gametos, los animales fueron tranquilizados por inmersión en una solución de 300 ppm de 2- fenoxietanol (Sigma Co, St Louis, Missouri), durante 3 a 5 minutos. Inmediatamente después de perdido el eje de nado, fueron retirados de la solución anestésica, secados cuidadosamente en la región abdominal y aplicada una leve presión para provocar la expulsión de orina, heces o bilis, para reducir el riesgo de contaminación de los gametos.
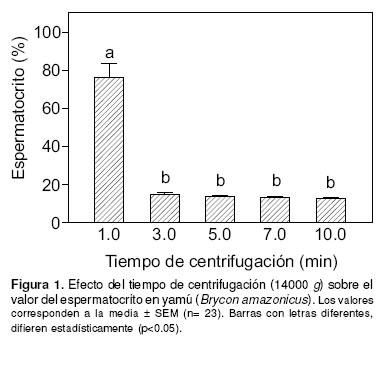
El trabajo comprendió tres experimentos: en el primero se determinó el tiempo de centrifugación necesario para obtener lecturas estables del espermatocrito, efectuando la medición de la proporción del volumen celular empacado con relación al volumen total de la muestra de semen, después de 1, 3, 5, 7 ó 10 min de centrifugación, conservando una fuerza centrífuga constante de 14000 g (12000 r.p.m., Microcentrífuga Ebba 12, Hettich, Tuttlingen, Alemania). Para este propósito, se utilizaron 23 muestras de semen y tubos microcapilares de 75.0 mm de longitud y 1.1 mm de diámetro interno (Brand, Alemania), los cuales fueron llenados (ca. 90%) con semen y uno de los extremos sellado con plastilina e inmediatamente sometido a centrifugación, de acuerdo con el protocolo descrito anteriormente.
En el segundo experimento se estudió la relación entre el espermatocrito y la concentración espermática, así como el valor de estas variables durante la estación reproductiva. El espermatocrito se obtuvo con base en los resultados del primer experimento, centrifugando la muestra de semen a 14000 g durante 5 min. El tiempo de cinco minutos de centrifugación fue elegido teniendo como criterio la presencia de menos de 5 espermatozides por campo microscópico (40X) en una muestra tomada de la columna de plasma seminal. La concentración espermática fue calculada mediante la cámara de Neubauer (Bright Line, Optik Labor, Alemania), contando los sptz presentes en 0.02 mm3, previa dilución (1:1200) de la muestra con solución salina fisiológica (0.9% NaCl). Previo al conteo de las células, la cámara de Neubauer fue mantenida durante 10 min en una atmósfera húmeda. El recuento de las células espermáticas fue realizado con la ayuda de un microscopio óptico (40X). Para cada muestra, la dilución fue preparada por duplicado y para cada una efectuados dos recuentos, el promedio de las cuatro lecturas se utilizó para los cálculos subsecuentes. La concentración espermática fue expresada en millones de sptz por mililitro. Para determinar la eventual variación estacional, los datos obtenidos fueron clasificados de acuerdo con el mes de muestreo, el cual comprendió el periodo desde marzo hasta mayo de 2003.
El tercer experimento evaluó el efecto del volumen de la dosis seminante sobre la fertilidad de oocitos de yamú. Para este propósito, 2 g de oocitos (ca. 2800) fueron seminados con cinco volúmenes diferentes de semen fresco diluido (n= 12), así: 3, 15, 45, 90 y 180 mL, cuya concentración espermática fue ajustada para mantener una relación de número de sptz/oocito (50000:1) constante en todos los casos. Para ajustar la concentración espermática fue utilizado plasma seminal de la misma especie, libre de sptz, el cual se obtuvo por centrifugación de muestras de semen a 2430 g (5000 r.p.m.) durante 10 min. La activación espermática fue inducida adicionando a la mezcla de semen y oocitos 5 mL de agua corriente.
Después de hidratados, los oocitos seminados se incubaron en recipientes plásticos de 2.0 L con flujo ascendente. La fertilidad fue evaluada seis horas postseminación y expresada en porcentaje, calculado a partir del número de oocitos fertilizados (fase de cierre del blastoporo) sobre un total de 100.
Los porcentajes de fertilidad y de espermatocrito fueron transformados en arcoseno. Los resultados de esta última variable y la concentración espermática fueron sometidos a análisis de regresión lineal. Diferencias entre el espermatocrito y la concentración espermática durante la estación reproductiva y en los tiempos de centrifugación fueron determinadas por análisis de varianza de una vía (ANOVA). Los resultados son mostrados como media ± error estándar de la media (SEM). p<0.05 fue considerado significativo. Para todos los análisis estadísticos fue utilizado el software GraphPad Instat v 2.01 (1990 - 1993) para Windows.
Resultados
La duración de la centrifugación tuvo efecto sobre el valor del espermatocrito, aunque mostrando diferencias significativas sólo cuando las lecturas fueron comparadas entre el primer tiempo de centrifugación (1 min) y los cuatro tiempos restantes (p<0.05). Entre estos últimos (3, 5, 7 y 10 min) no fue observada diferencia significativa (15.1 ± 0.8%, 13.8± 0.7%, 13.4 ± 0.6%, 13.0 ± 0.6%, respectivamente) (véase Figura 1); sin embargo, la centrifugación durante tres minutos aún permitió detectar un número de espermatozoides por campo mayor que cinco, mientras que con 5, 7 y 10 min el plasma se encontró libre de células espermáticas. Con base en estos resultados, un tiempo de centrifugación de cinco minutos a 14000 g fue considerado suficiente para obtener lecturas reales del espermatocrito en esta especie.
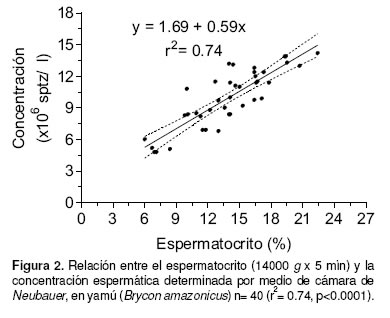
Durante la estación reproductiva evaluada, la concentración espermática fluctuó entre 4.8 x 106 y 14.2 x 106 sptz/µL y el espermatocrito entre 6.0 y 22.4 %. La relación entre estas dos variables fue positiva y altamente significativa (p<0.0001, r2= 0.74) (véase Figura 2). La tabla 1 muestra las principales características seminales, durante la estación reproductiva de 2003.
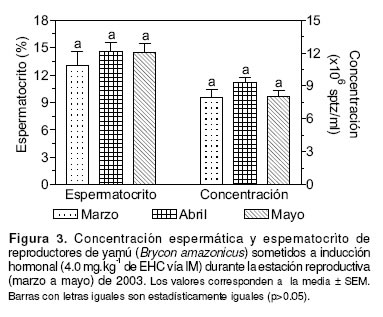
La concentración espermática y el espermatocrito, registrados durante la estación reproductiva (marzo, abril y mayo), son ilustrados en la figura 3. No se observaron diferencias significativas para ninguna de las variables (p>0.05), cuando se compararon los tres meses evaluados.
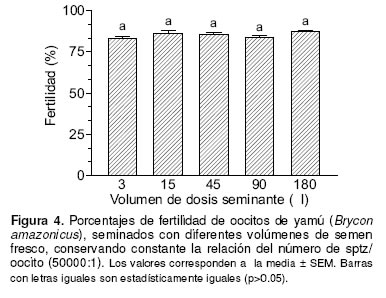
La figura 4, ilustra los porcentajes de fertilidad de 2 g de oocitos seminados con cinco volúmenes diferentes de dosis seminante (3, 15, 45, 90 y 180 mL). Para cada uno de los tratamientos los porcentajes de fertilidad fueron 83, 86, 86, 85 y 87%, respectivamente, sin mostrar diferencias significativas entre ellos (p>0.05).
Discusión
El tiempo de centrifugación influyó sobre la lectura del volumen celular empacado, ya que los menores tiempos de centrifugación (1 y 3 min) generaron un valor no real del espermatocrito, debido a que aún permitieron la presencia de espermatozoides en la columna de plasma seminal. Tvedt et al (18) en Hippoglossus hippoglossus requirieron de un tiempo considerablemente mayor (40 min) al determinado en el presente estudio, lo cual fue atribuido principalmente a la mayor densidad espermática en esta especie y a la menor fuerza centrífuga utilizada (5500 g).
Se observó una correlación significativa entre el espermatocrito y la concentración espermática (r2= 0.74, p<0.0001), lo cual permitiría utilizar la ecuación de regresión obtenida como una alternativa simple y rápida para estimar la concentración espermática en yamú. Aunque una correlación similar había sido reportada previamente para salmónidos (3) y Piaractus mesopotamicus (7), trabajos previos realizados en yamú (6), revelaron una correlación inferior, lo cual fue atribuido a una deficiente estandarización de las condiciones de centrifugación y al reducido número de muestras evaluadas.
Considerando todas las muestras recolectadas, la concentración espermática promedio para esta especie fue de 9.5 x 106 ± 0.4 sptz.µL-1, valor muy próximo al reportado por Silveira (15) para Brycon cephalus. Estudios anteriores realizados en yamú (6), habían reportado una concentración superior (13.9 ± 4.0 x 106 sptz.µL-1); sin embargo, ésta correspondió a animales sin previo tratamiento hormonal, siendo ampliamente conocido que la administración de Extracto de Hipófisis de Carpa (EHC) en los peces aumenta el volumen de semen, pero disminuye la concentración espermática (19).
A pesar que varios autores han reportado clara variación estacional en las características seminales de diferentes especies de peces (8, 13), los valores observados, tanto para el espermatocrito como para la concentración espermática, no variaron significativamente. Este hallazgo puede explicarse debido a que el período de muestreo coincidió con laépoca natural de mayor actividad reproductiva de la especie (febrero - junio). Por lo tanto, es recomendable realizar un número mayor de observaciones durante los meses de febrero y junio, para considerar posibles variaciones durante el inicio y el final de su estación reproductiva. Adicionalmente, aunque no fueron observados cambios estacionales en estas dos variables dentro de la misma época reproductiva, recientemente han sido observadas diferencias significativas entreépocas de diferentes años (datos sin publicar).
En términos generales, la variación en los resultados de las pruebas de fertilidad puede atribuirse a diferencias en la calidad de los gametos o en las condiciones de la seminación y/o incubación (16); por lo tanto, la estandarización del protocolo de seminación es requisito para relacionar las características seminales con la capacidad fecundante del semen. El conocimiento del efecto del volumen de la dosis seminante reviste importancia, particularmente cuando se utiliza semen conservado, ya que el costo de almacenamiento del material seminal es directamente proporcional al volumen de las dosis conservadas. Podría esperarse que dosis de pequeños volúmenes redujeran los porcentajes de fertilidad debido a la menor posibilidad de interacción entre los gametos (16); sin embargo, en el presente estudio, dosis de 3 mL mostraron porcentajes de fertilidad similares a dosis de volumen 60 veces mayor.
En conclusión, el espermatocrito constituye una alternativa para determinar la concentración espermática del yamú y puede ser determinado empleando una fuerza centrífuga de 14000 g durante 5 min. Aunque esta variable mostró estar altamente correlacionada con la concentración espermática, un número mayor de muestras puede ser necesario para aumentar esta correlación y establecer posibles variaciones durante la época reproductiva. Finalmente, no se observaron efectos del volumen de la dosis seminante sobre el porcentaje de fertilidad, lo cual permitiría la formulación de dosis seminantes de pequeño volumen, más fáciles de almacenar en los contenedores de nitrógeno líquido comerciales.
Agradecimientos
Este trabajo contó con el apoyo financiero de COLCIENCIAS y el Instituto de Investigaciones de la Orinoquía Colombiana (IIOC) - Universidad de los Llanos. Proyecto código: 12209-12396.
Summary
Determination of spermatocrit and effect of volume of insemination dose on fertility in yamú (Brycon amazonicus)
Yamú (Brycon amazonicus - Spix & Agassiz 1829) is an omnivorous, fast- growing fish with excellent meat quality, given it commercial importance. To standardize the spermatocrit (SPCT), 23 samples of semen were centrifuged at 14000 g during 1, 3, 5, 7 or 10 min. The centrifugation time had a significant effect on SPCT value (p<0.05). With the aim to know the sperm concentration (SC) throughout the reproductive season and its relationship with the SPCT, 40 males were treated with carp pituitary extract (4.0 mg.kg-1). The SC was evaluated by Neubauer chamber (dilution 1:1200) and SPCT by centrifugation at 14000 g during 5 min. The relationship between SPCT and SC was positive and highly significant (y= 1.69 + 0.59x; r2= 0.74; p <0.0001), but statistical differences were not observed (p>0.05) among the months evaluated (march, april and may). Finally, to determine the effect of volume of seminant dose on fertility, 2 g of eggs were seminated with 3, 15,45, 90 or 180 µL of semen (n= 12). The SC was previously adjusted to contain 50000 sptz/egg, using as extender seminal plasma homologous. The fertilization rate were 83, 86, 86, 85 and 87%, respectively (p>0.05).
Key words: seminant dose, spermatocrit, sperm concentration, yamú.
Referencias
1. Bart AN, Dunham RA. Effects of sperm concentration and egg number on fertilization efficiency with channel catfish (Ictalurus punctatus) eggs and blue catfish (I. furcatus) spermatozoa. Theriogenology 1996; 45:673-82. [ Links ]
2. Billard R, Cosson J, Crim LW, Suquet M. Sperm Physiology and Quality. In: Bromage NR, Roberts RJ, editors. Broodstock management and eggs and larval quality. Cambridge: Blackwell Science; 1995, p. 25- 52. [ Links ]
3. Bouck GR, Jacobson J. Estimation of salmonid sperm concentration by microhematocrit technique. Trans Am Fish Soc 1976; 105:534-35. [ Links ]
4. Ciereszko A, Dabrowski K. Estimation of sperm concentration of rainbow trout, whitefish and yellow perch using a spectrophotometric technique. Aquaculture 1993; 109:367-73. [ Links ]
5. Cruz-Casallas PE, Pardo-Carrasco SC, Arias-Castellanos JA, Lombo-Castellanos PE, Lombo-Rodríguez DA, et al. Cryopreservation of Yamú Brycon siebenthalae Milt. J World Aquacult Soc 2004; 35:529-35. [ Links ]
6. Cruz-Casallas PE, Lombo-Rodríguez DA, Velasco-Santamaría YM. Milt quality and spermatozoa morphology of captive Brycon siebenthalae (Eigenmann) broodstock. Aquacult Res 2005; 36:682-86. [ Links ]
7. Fogli da Silveira W, Kavamoto ET, Cestarolli MA, Godinho HM, Ramos SM, et al. Avaliaçao espermatica, preservaçao criogénica e fertilidade do sémen do pacu, Piaractus mesopotamicus (Holmberg, 1887). Proveniente de reproduçao induzida. Bull Inst Pesca 1990; 17:1-13. [ Links ]
8. Holland MC, Mylonas CC, Zohar Y. Sperm characteristic of precocious 1-year-old male Striped bass Morone saxatalis. J World Aquacult Soc 1996; 27:208-12. [ Links ]
9. Howes G. Review of the genus Brycon (Teleostei: Characoidei). Bulletin of British Museum of Natural History 1982; 43:1-47. [ Links ]
10. Lahnsteiner F, Patzner RA. Sperm motility of the marine teleosts Boops boops, Diplodus sargus, Mullus barbatus and Trachurus mediterraneus. J Fish Biol 1998; 52:726-42. [ Links ]
11. Munkittrick KR, Moccia RD. Seasonal changes in the quality of rainbow trout (Salmo gairdneri) semen: effect of a delay in stripping on spermatocrit, motility, volume and seminal plasma constituents. Aquaculture 1987; 64:147-56. [ Links ]
12. Piironen J. Variation of the properties of milt from the Finnish landlocked salmon (Salmo salar M Sebago Girard) during spawning season. Aquaculture 1985; 48:337-50. [ Links ]
13. Rakitin A, Ferguson MM, Trippel EA. Spermatocrit and spermatozoa density in Atlantic cod (Gadus morhua): correlation and variation during the spawning season. Aquaculture 1999; 170:349-58. [ Links ]
14. Saint-Paul U. Potential for aquaculture of South American freshwater fishes: a review. Aquaculture 1986; 54:205-40. [ Links ]
15. Silveira NA. Caracterização espermática, preservação criogênica do semên e fertilidadde do matrinxã, Brycon cephalus (Günther, 1860) (Teleostei; Characidae). Dissertação (Mestrado). Universidade Estadual Paulista Botucatu, Brasil, 2000. 45 p. [ Links ]
16. Suquet M, Billard R, Cosson J, Normant Y, Fauvel C. Artificial insemination in turbot (Scophthalmus maximus): determination of the optimal sperm to egg ratio and time of gamete contact. Aquaculture 1995; 133:83-90. [ Links ]
17. Suquet M, Omnes MH, Normant Y, Fauvel C. Assessment of sperm concentration and motility in turbot (Scophthalmus maximus). Aquaculture 1992; 101:177-85. [ Links ]
18. Tvedt HB, Benfey TJ, Martin-Robichaud DJ, Power J. The relationship between sperm density, spermatocrit, sperm motility and fertilization success in Atlantic halibut Hippoglossus hippoglossus. Aquaculture 2001; 194:191-200. [ Links ]
19. Velasco-Santamaría YM, Arias-Castellanos JA, Cruz-Casallas PE. Efecto de la inducción hormonal con extracto de hipófisis de carpa (EHC) sobre algunas características seminales de Rhamdia sebae c.f. Memorias II Congreso Colombiano de Acuicultura, X Jornada de Acuicultura. Instituto de Acuicultura de la Universidad de los Llanos. Villavicencio, Meta - Colombia. 2004; p. 116-17. [ Links ]