Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.2 Medellín Apr./June 2006
Protocolo para la crioconservación de semen de yamú (Brycon amazonicus Spix & Agassiz 1829)
Pablo E Cruz-Casallas MVZ1, MS, PhD; Víctor M Medina-Robles1, MVZ, cMS; Yohana M Velasco-Santamaría1, MV.
1Grupo de Reproducción y Toxicología de Organismos Acuáticos - GRITOX, Instituto de Acuicultura, Facultad de Ciencias Agropecuarias y Recursos Naturales, Universidad de los Llanos, A.A 110, Villavicencio, Meta - Colombia.
(Recibido: 18 abril, 2005; aceptado: 8 noviembre, 2005)
Resumen
La crioconservación es una herramienta importante para el almacenamiento de gametos por tiempo indefinido, especialmente de especies con hábitats y poblaciones amenazadas. En peces, es además una alternativa para optimizar los procesos reproductivos en cautiverio de especies con maduración gonadal asincrónica y ciclos reproductivos estacionales como el yamú (Brycon amazonicus - Spix & Agassiz 1829), un carácido distribuido en las cuencas de los ríos Amazonas, Orinoco y Essequibo. Este reporte presenta el protocolo para la crioconservación de semen en esta especie, obtenido después de evaluar diferentes sustancias crioprotectoras, curvas de congelación y volúmenes de empaque. Su eficiencia ha sido demostrada en varios experimentos a nivel de laboratorio y de granjas comerciales, lográndose tasas de fertilidad cercanas a aquellas con semen fresco, constituyéndose en una importante herramienta metodológica para la crioconservación seminal de la especie.
Palabras clave: criopreservación, fertilidad, peces tropicales, semen, yamú.
Introducción
El yamú (Brycon amazonicus - Spix & Agassiz 1829) es un carácido distribuido en las cuencas de los ríos Amazonas, Orinoco y Essequibo (13), que por sus hábitos alimenticios omnívoros, crecimiento rápido y alta calidad y aceptación comercial de su carne, se ha convertido en una especie de excelentes condiciones para cultivo (1). Posee un ciclo reproductivo estacional, que se extiende desde Febrero a Mayo, coincidiendo con la época de lluvias (2), lo cual limita a este periodo la producción de alevinos y la investigación en varios aspectos de su biología y fisiología reproductiva.
Producto de las investigaciones realizadas en esta especie por el Instituto de Acuicultura de la Universidad de los Llanos, particularmente sobre su biología y desempeño reproductivo, se ha desarrollado un paquete tecnológico que permite actualmente su reproducción artificial en cautiverio y su cultivo a escala comercial. Sin embargo, debido a su estacionalidad reproductiva, al asincronismo en la maduración gonadal presentada entre machos y hembras y a la baja calidad seminal al inicio y final de la estación reproductiva (2), es necesario implementar estrategias que permitan disponer permanentemente de gametos potencialmente fértiles para el proceso de fertilización artificial. Por lo tanto, la crioconservación seminal se convierte en una herramienta biotecnológica útil para afrontar esta situación en la especie, ya que este método de conservación de gametos, que utiliza temperaturas criogénicas (-196°C), prolonga indefinidamente la vitalidad de los espermatozoides y las funciones metabólicas necesarias para los procesos de activación espermática y fertilización (10).
El almacenamiento de gametos por periodos prolongados de tiempo es útil como método para la conservación de especies de peces, especialmente de aquellas en peligro de extinción, ya que permite el establecimiento de bancos genéticos (3, 16, 17). Varios procedimientos para la crioconservación de espermatozoides han sido desarrollados durante los últimos 20 años (5, 7, 9); sin embargo, los resultados aún muestran gran variación entre especies en los porcentajes de fertilidad, creando la necesidad de ajustar dichos protocolos para cada una de ellas.
En yamú, la evaluación de diluyentes basados principalmente en yema de huevo y crioprotectores como dimetilsulfóxido, metanol, propilenglicol y etilenglicol, junto con el estudio de diferentes velocidades de congelación (4, 7), ha permitido ajustar un protocolo para la crioconservación de semen de la especie, que ha mostrado ser eficiente de acuerdo con las tasas de fertilidad observadas en los ensayos a nivel de laboratorio y de granjas comerciales.
El objetivo de este reporte es divulgar un manual de procedimientos estandarizado para la congelación de semen de yamú, facilitando el uso de esta biotecnología, tanto por investigadores como por productores de alevinos de la especie.
Procedimientos
Selección de machos para obtención de semen.
Para la obtención del semen pueden preseleccionarse individuos a partir de dos años de edad. Para este propósito, durante la época reproductiva de la especie (febrero-mayo), los animales deben ser revisados periódicamente con el fin de identificar aquellos que presenten semen en la papila urogenital después de un suave masaje abdominal en sentido cráneo-caudal. La presencia de semen indica que el macho ha alcanzado la madurez gonadal y por lo tanto, puede ser sometido al tratamiento hormonal para inducir la espermiación (2).
Los animales preseleccionados son llevados a estanques pequeños o piletas de manejo, donde son identificados por medio de dispositivos de colores (chaquiras o hilos) instalados en la aleta caudal. Posteriormente se determina su peso corporal, la longitud total y se realiza la estimación indirecta de la concentración espermática por medio del espermatocrito, procedimiento descrito más adelante en el aparte sobre evaluación macroscópica del semen. Se deben seleccionar animales con espermatocrito mayor de 12%, que luego son sometidos al tratamiento hormonal para la maduración final de las gónadas y la espermiación, utilizando una única inyección intramuscular de extracto de hipófisis de carpa (EHC), equivalente a 4 mg/kg de peso corporal (véase Figura 1). La hormona se diluye en solución salina fisiológica, hasta un volumen suficiente para administrar entre 0.5 y 1.0 mL por animal.
Obtención del semen
El semen se obtiene 18 a 20 horas después de la inyección del EHC. Los reproductores son previamente tranquilizados por inmersión durante 3 a 5 minutos en una solución de 2-fenoxietanol (300 ppm, Sigma Chemical Co., St. Louis, MO, USA). Cuando los animales pierden el eje de nado, son retirados inmediatamente de la solución anestésica y las aletas y el abdomen secados cuidadosamente para evitar el contacto del semen con agua durante su obtención, ya que ésta activa la movilidad de los espermatozoides. De igual manera, debe realizarse una suave presión sobre la papila urogenital, con el objetivo de eliminar restos de agua, orina o heces. El semen es obtenido mediante masaje abdominal en sentido cráneo-caudal, colectándolo directamente en un tubo de vidrio o de plástico de 15 mL, aforado, estéril y seco (véase Figura 1). El masaje es suspendido cuando hay evidencia de contaminantes en el semen tales como sangre, bilis, orina, heces o agua. En todos los casos, muestras contaminadas no deben procesarse, ya que estas sustancias disminuyen la calidad seminal (8).
Evaluación del semen precongelación
Inmediatamente después de colectada la muestra se realiza la evaluación seminal, con el fin de conocer la calidad del semen precongelación, la cual sirve como referencia para evaluar el resultado del proceso. Este procedimiento consta de una evaluación macroscópica y microscópica y debe hacerse dentro de los 30 minutos siguientes a la obtención de la muestra.
Evaluación macroscópica
Volumen seminal. Se determina directamente en el tubo aforado de recolección y se expresa en mL. Con base en el volumen de semen recolectado se calcula la cantidad de diluyente a ser adicionado.
Color. Se registra para evidenciar la posible presencia de sustancias contaminantes, siendo blanco puro o marfil el color de una muestra ideal (6).
Evaluadas las variables anteriores, la muestra debe ser mantenida a temperatura ambiente (28 ± 1°C) por no más de 30 minutos tiempo durante el cual debe realizarse la evaluación microscópica.
Evaluación microscópica
Concentración espermática. Determina el número de células espermáticas por unidad de volumen y se expresa en millones de espermatozoides por mL. Para este propósito se utiliza el método del hemocitómetro, el cual consiste en diluir una muestra de semen en una proporción 1:1200 con solución salina fisiológica (NaCl 0.9%). Una vez diluido el semen, se realiza el conteo individual de los espermatozoides en una cámara contadora de partículas (Neubauer o Makler). El conteo debe realizarse por duplicado, no permitiéndose una diferencia mayor del 10% entre las dos lecturas; cuando esto ocurre debe repetirse el procedimiento.
Movilidad masal y tiempo de activación. Para determinar la movilidad masal se utiliza una lámina excavada (1.0 a 1.2 mm de profundidad, Premiere, China) o portaobjetos, sobre la cual se coloca una gota de semen (20 mL). La movilidad espermática es activada con 180 mL de bicarbonato de sodio (NaHCO3) al 1%. Las muestras se observan en un microscopio óptico (10X) y se expresa en porcentaje. Las muestras aptas para congelación deben presentar movilidad masal superior a 80%. El tiempo de activación espermática se mide con un cronómetro, registrando el tiempo (seg) transcurrido desde la adición de la solución de NaHCO3 hasta el cese completo de los movimientos espermáticos.
Espermatocrito. Evalúa la proporción de células espermáticas con relación al plasma seminal. Para este fin, un microcapilar de 75 mm de longitud y 1.1 mm de diámetro interno, se llena aproximadamente en un 90% con semen y se sella uno de sus extremos con plastilina. Posteriormente se centrifuga a 14000 g durante 5 minutos e inmediatamente después se mide la altura del paquete celular (columna blanca) y se calcula su proporción (en porcentaje) con relación a la altura total de la columna de semen.
Congelación del semen
El semen puede ser procesado individualmente o mezclando muestras provenientes de varios machos de calidad espermática similar. En esteúltimo caso se recomienda determinar nuevamente el número de espermatozoides por mL, con el fin de conocer la concentración final del material seminal a congelar.
Preparación del diluyente. El diluyente es una solución en agua destilada estéril de 5.5% (p:v) de glucosa, 12% (v:v) de yema de huevo de gallina y 10% (v:v) de dimetilsulfóxido (DMSO, Sigma Chemical Co., St. Louis, MO, USA). Este diluyente se incorpora eficazmente con el semen y no induce la movilidad espermática (7).
Para la preparación del diluyente, primero se debe mezclar la glucosa con aproximadamente el 60% del agua destilada, previamente calentada a 37°C y luego se adiciona el volumen total de DMSO. Para la obtención de la yema, el huevo de gallina debe ser previamente lavado y desinfectado con alcohol; luego se rompe y su contenido se coloca sobre un papel adsorbente para separar la yema de la clara y la membrana vitelina, ya que éstas son tóxicas para los espermatozoides. La yema debe incorporarse inmediatamente antes de la utilización del diluyente y cuando la reacción exotérmica del DMSO con el agua haya terminado. Finalmente, se adiciona la cantidad suficiente de agua destilada para completar el volumen de diluyente deseado. Es recomendable no almacenar diluyente, ya que se favorece la proliferación bacteriana.
Empacado y congelación
Semen y diluyente se mezclan a temperatura ambiente (28 ± 1°C) en proporción 1:4 (una parte de semen más tres partes de diluyente), la cual ha sido la más apropiada de acuerdo con la concentración espermática promedio de la especie (6, 7). Inmediatamente después se empaca en pajillas de 4.0 mL (Minitub, Abfül - und Labortechnik GmbH & Co., KG), las cuales deben sellarse en sus extremos con polivinilo y algodón o con esferas de acero inoxidable.
Para la congelación, las pajillas deben colocarse en posición vertical en un soporte construido con polímero de PVC y aluminio (véase Figura 2), diseñado según la longitud de las pajillas y la altura del termo de congelación. Una vez dispuestas las pajillas en el soporte, se introducen en un termo seco de vapores de nitrógeno líquido (Taylor-Wharton, CP 100, Theodore, AL, USA) durante 30 minutos, el cual permite una tasa de enfriamiento rápido (27.3°C/min desde 28 a -20°C, 29.9°C/min desde -20 a -100°C, 5.5°C/min desde -100 a -196°C). Alcanzada la temperatura de crioconservación de -196 °C (30 minutos después de la introducción de las pajillas en vapores de nitrógeno), las pajillas deben ser trasladadas rápidamente a un termo de almacenamiento (Taylor- Wharton HC 35, Theodore, AL, USA), sumergiéndolas directamente en el nitrógeno líquido, allí teóricamente pueden permanecer por tiempo indefinido.
Descongelación del semen
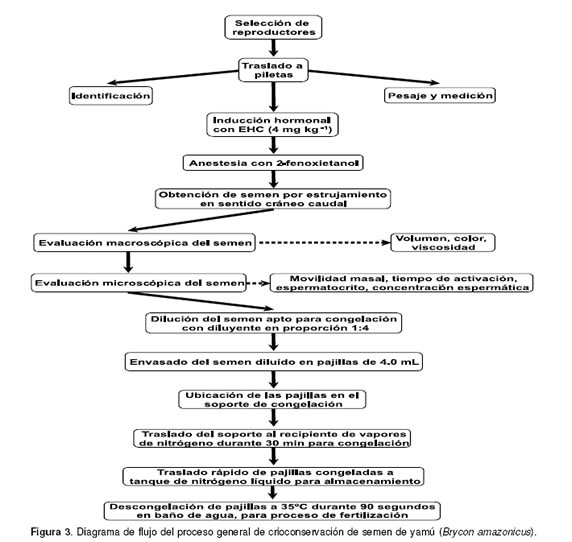
Las pajillas congeladas y conservadas en nitrógeno líquido, deben ser descongeladas por inmersión directa en baño de agua a 35°C durante 90 seg. Para este propósito, un baño maría o un recipiente artesanal, debe prepararse previamente con agua a dicha temperatura, con el objetivo de que el intervalo entre el retiro de la pajilla del nitrógeno líquido y la inmersión en el baño de descongelación, sea lo más corto posible (< 5 seg). Este sistema ofrece una tasa de descongelación rápida (388°C/min desde -196 a 0°C y de 19.1°C/min desde 0 a 35°C), la cual es adecuada cuando se ha utilizado un método de congelación rápido, evitando de esta forma procesos de recristalización celular, que pueden generar daño en la membrana plasmática y muerte espermática (11, 14). Una vez el semen es descongelado, la pajilla es abierta en uno de sus extremos y el semen vertido en un tubo de vidrio estéril. Previo a la seminación de los oocitos, debe verificarse que el semen al descongelarse no se haya activado, verificando la ausencia de movilidad espermática observando una gota de semen bajo el microscopio óptico (10X). La figura 3 muestra de manera resumida los pasos generales llevados a cabo para la congelación y descongelación seminal en yamú.
Consideración final
Los diferentes ensayos sobre crioconservación seminal en peces (15), muestran que los protocolos de congelación son en su mayoría complejos y utilizan reactivos o materias primas costosas o de difícil adquisición y preparación y, aún cuando muchos de estos protocolos pueden estar ofreciendo altos niveles de eficiencia en una especie íctica determinada, su aplicación en granjas comerciales es limitada. El protocolo de congelación para semen de yamú anteriormente expuesto sintetiza de una manera sencilla los procedimientos para la congelación seminal en esta especie, permitiendo que cualquier profesional del área acuícola, pueda extrapolarlos y obtener resultados satisfactorios, facilitando la optimización de los procesos rutinarios de fertilización artificial del yamú y por consiguiente disminuyendo la extracción de reproductores silvestres.
Agradecimientos
Los autores agradecen a COLCIENCIAS proyecto código 1122-09-12396, contrato RC. No. 397 - 2002 Universidad de los Llanos - COLCIENCIAS por el apoyo financiero y al Instituto de Acuicultura de los Llanos IALL y a las diferentes granjas acuícolas del departamento del Meta por su apoyo logístico.
Summary
Protocol for cryopreservation of yamú (Brycon amazonicus) semen Cryopreservation is an important tool for gametes storage during indefinite time, especially in species whose habitat and population are endangered. This is an alternative to optimize the breeding process in captive fish, especially in species with a gonadal maturation asynchronous and seasonal reproductive cycle like yamú (Brycon amazonicus - Spix & Agassiz 1829), a characidae fish distributed in Amazon, Orinoco and Essequibo river basins. This report presents the protocol for semen cryopreservation in this species, it was obtained after the evaluation of different cryoprotectants, freezing curves and packaging volume. The efficient of this protocol has been demonstrated in several laboratory and fish farm experiments, with similar fertility rates to obtained with fresh sperm, being an important methodological tool for seminal cryopreservation in yamú.
Key words: cryopreservation, fertility, semen, tropical fish, yamú.
Referencias
1. Arias CJ. Contribución al conocimiento biológico de los peces de los llanos, Yamú (Brycon siebenthalae) y Sapuara (Semaprochilodus laticeps), con fines de cultivo. Informe Final. Universidad de los Llanos – Colciencias 1995; p. 30. [ Links ]
2. Arias CJ, Zaniboni-Filho E, Pardo-Carrasco SC, Atencio- García V, Vásquez-Torres W. Desarrollo gonadal y efectos de la domesticación y la restricción alimenticia de yamú Brycon siebenthalae en cautiverio. En: Memorias VIII Jornada de Acuicultura. Villavicencio, Meta, 2002; p. 55-63. [ Links ]
3. Babiak I, Glogowski S, Kuzminski H, Goryczko K. Semen from rainbow trout produced using cryopreserved spermatozoa is more suitable for cryopreservation. J Fish Biol 2002; 60: 561-70. [ Links ]
4. Bolaños PM, Romero O. Evaluación del uso de propilenglicol, etilenglicol, metanol y dimetilsulfoxido para la crioconservación de semen de Yamú (Brycon siebenthalae). Trabajo de Pregrado, Facultad de Ciencias Agropecuarias y Recursos Naturales, Universidad de los Llanos, Villavicencio, 2003. 71 p. [ Links ]
5. Carolsfeld J, Godinho HP, Zaniboni E, Harvey BJ. Cryopreservation of sperm in Brazilian migratory fish conservation. J Fish Biol 2003; 63:472-89. [ Links ]
6. Cruz-Casallas PE, Lombo-Rodríguez DA, Velasco-Santamaría YM. Milt quality and spermatozoa morphology of captive Brycon siebenthalae (Eigenmann) broodstock. Aquacult Res 2005; 36: 682-86. [ Links ]
7. Cruz-Casallas PE, Pardo-Carrasco SC, Arias-Castellanos JA, Lombo-Castellanos PE, Lombo-Rodríguez DA, et al. Cryopreservation of Yamú Brycon siebenthalae Milt. J World Aquacult Soc 2004; 35 (4): 529-35. [ Links ]
8. Dreanno C, Suquet M, Desbruyéres E, Cosson J, Le Delliou H, et al. Effect of urine on semen quality in turbot (Psetta maxima). Aquaculture 1998; 169: 247-62. [ Links ]
9. Fogli da Silveira W, Kavamoto ET, Narahara MY. Avaliação espermática, preservação criogenica do semen do pacu Piaractus mesopotamicus, proveniente de reprodução induzida. Bull Inst Pesca 1990; 17:1-13. [ Links ]
10. González-Sarmiento E, Díaz-Sarmiento J. Principios básicos de la criopreservación de esperma de peces. En: INPA, editor. Fundamentos de Acuicultura Continental. 2ª ed. 2001. p. 233-63. [ Links ]
11. Holt WV. Basic aspects of frozen storage of semen. Anim Reprod Sci 2000; 62:3-22. [ Links ]
12. Lahnsteiner F, Berger B, Horvarth A, Urbanyi B, Weismann T. Cryopreservation of spermatozoa in cyprinid fishes. Theriogenology 2000; 54: 1477-98. [ Links ]
13. Lima F. Subfamily Briconinae (Characins, tetras). In: Reis RE, Kullander SO, Ferraris CJ, editors. Check list of the freshwater fishes of South and Central American. Porto Alegre: Edipucrs; 2003. 742 p. [ Links ]
14. Mazur P. Fundamental aspects of the freezing of cells, whit emphasis on mammalian ova and embryos. En: 9th International congress on animal reproduction and artificial insemination. Madrid, España, 1980; p. 99-114. [ Links ]
15. Medina-Robles VM, Velasco-Santamaria YM, Cruz-Casallas PE. Aspectos generales de la crioconservación espermática en peces teleósteos. Rev Col Cien Pec 2005; 18 (1): 34-48. [ Links ]
16. Taddei AR, Barbato F, Abelli L, Canese S, Moretti F, et al. Is cryopreservation a homogeneous process? Ultrastructure and motility of untreated, prefreezing, and postthawed spermatozoa of Diplodus puntazzo (Cetti). Cryobiology 2001: 244-55. [ Links ]
17. Yao Z, Crim LW, Richardson GF, Emerson CJ. Motility, fertility and ultrastructural changes of ocean pout (Macrozoarces americanus L.) sperm after cryopreservation. Aquaculture 2000; 181: 361-75. [ Links ]