Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.2 Medellín Apr./June 2006
Evaluación de diferentes crioprotectores para la crioconservación de espermatozoides de yamú (Brycon amazonicus)
Pablo E Cruz Casallas1, MVZ, MS, PhD; Víctor M Medina Robles1, MVZ, cMSc; Yohana M Velasco Santamaría1, MV.
1Grupo de Reproducción y Toxicología de Organismos Acuáticos - GRITOX, Instituto de Acuicultura, Facultad de Ciencias Agropecuarias y Recursos Naturales, Universidad de los Llanos, A.A 110, Villavicencio, Meta - Colombia.
(Recibido: 18 abril, 2005; aceptado:31 enero, 2006)
Resumen
El uso de dimetilsulfoxido (DMSO), etilenglicol (ETG), propilenglicol (PPG) y metanol (MET) para la crioconservación de semen de yamú (Brycon amazonicus - Spix & Agassiz 1829) fue evaluado con el objetivo de determinar la calidad post-descongelación y la fertilidad in vitro del semen. Para este propósito, machos y hembras, sexualmente maduros fueron inducidos a la maduración final de las gónadas por medio de extracto de hipófisis de carpa. El semen obtenido fue evaluado y diluido (1:4) en una solución a base de yema de huevo (12%) y glucosa (5.5%). Se utilizó cada crioprotector a concentraciones de: 3.75, 5, 7.5, 10, 11.25 y 15% para un total de 24 tratamientos. El semen diluido fue empacado en pajillas de 0.5 mL para ser congelado en vapores de nitrógeno líquido (NL) a -194 °C durante 30 min y luego transferidas y almacenadas hasta por 10 días en un termo de NL para su evaluación. Para las pruebas de fertilidad, las pajillas (n= 6) de cada uno de los tratamientos fueron descongeladas a 35 °C por 60 seg y posteriormente evaluadas. Se encontró que los tratamientos DMSO-5%, ETG-3.75%, PPG-3.75% y MET-3.75% presentaron los mayores porcentajes de movilidad (PM) y tiempos de activación (TA), siendo DMSO-5% el más alto (PM 76 ± 2.4; TA 88.2 ± 6.1). De otro lado, los tratamientos PPG-3.75% y MET-3.75% mostraron los mayores porcentajes de fertilidad (50 ± 1.4 y 47.8 ± 1.4, respectivamente), pero fueron inferiores (p<0.05) cuando se compararon con el semen fresco (64.7 ± 1.7). En general se observó que a medida que aumentó la concentración del crioprotector, la calidad seminal postdescongelación disminuyó, sin observarse relación directa entre la movilidad espermática y la fertilidad.Palabras clave: calidad seminal, crioprotector, espermatozoide, fertilización.
Introducción
La acuicultura se presenta como una alternativa de producción en el sector pecuario, con excelentes perspectivas para nuestro país. Sin embargo, se hace necesario desarrollar o adaptar tecnologías que permitan optimizar los sistemas de producción actuales, principalmente de aquellos basados en especies ícticas nativas de alto potencial productivo. El yamú (Brycon amazonicus - Spix & Agassiz 1829) es un carácido nativo de la cuenca del río Orinoco de Colombia y Venezuela, omnívoro de crecimiento rápido y carne de alta calidad y aceptación comercial (1). Debido a la estacionalidad reproductiva, al asincronismo en la maduración gonadal presentada por machos y hembras y a la disminución en la calidad seminal observada dentro de la misma época reproductiva, se hace necesario implementar estrategias como la crioconservación que permitan conservar los gametos obtenidos durante la época de reproducción, para asegurar la oferta permanente de alevinos.
La crioconservación es la rama de la criobiología por medio de la cual se espera prolongar indefinidamente el potencial total de vitalidad y las funciones metabólicas normales de las células. Por medio de este proceso se busca la estabilización de las células a temperaturas criogénicas (-196° C), en las que se detiene la actividad metabólica, permitiendo su preservación por periodos de tiempo indefinidos (10). La crioconservación del semen en peces constituye una alternativa biotecnológica útil para el almacenamiento de gametos, facilitando la conservación de especies en peligro de extinción (2, 20, 24).
Durante el proceso de congelación, las sustancias crioprotectoras son esenciales para disminuir el daño espermático ocasionado por el descenso de temperatura, ya que estos remplazan el agua intracelular durante la congelación (16), permitiendo que el fluido intracelular pueda ser superenfriado a temperaturas entre -5 y -15 °C sin que ocurra la formación de cristales de hielo, debido a que estas sustancias disminuyen el punto de congelación por medio de la reducción en la interacción entre las moléculas de agua (23). Por su parte, la velocidad del enfriamiento puede determinar un mayor o menor efecto de la congelación sobre la viabilidad espermática. En este sentido, la congelación intracelular es letal para la célula dependiendo particularmente del tamaño y de la cantidad de cristales de hielo formados en el citoplasma, ya que altas velocidades de enfriamiento producen cristales intracelulares pequeños que pueden llegar a ser inocuos, pero éstos pueden unirse y crecer durante la descongelación por medio de un proceso denominado recristalización (12, 15).
El grado de toxicidad del crioprotector y su velocidad de difusión a través de la membrana plasmática, dependen de la temperatura a la cual son incorporados a la solución de semen y del tiempo de exposición celular. Esta difusión puede verse afectada por el descenso de la temperatura, ya que durante este proceso la membrana celular aumenta la proporción de colesterol con el propósito de lograr mayor estabilidad mecánica; sin embargo, este aumento del colesterol también disminuye la permeabilidad de la membrana a pequeñas moléculas, pudiendo afectar la penetración del crioprotector en la célula de una manera efectiva (19).
En las últimas décadas, varios procedimientos para la crioconservación de espermatozoides de diferentes especies de peces han evaluado el uso de una amplia variedad de sustancias crioprotectoras, utilizadas en diferentes concentraciones y protocolos de congelación, con resultados variables (3, 13, 17), lo cual hace necesario la realización de más estudios para estandarizar un protocolo definitivo. A pesar que en yamú han sido realizados algunos estudios encaminados al conocimiento de la calidad seminal y del efecto de algunas sustancias crioprotectoras sobre la viabilidad espermática (5, 6), aún es necesario estandarizar un protocolo de crioconservación más eficiente.
El objetivo del presente estudio fue evaluar la utilización de 4 sustancias crioprotectoras (dimetilsulfoxido - DMSO, etilenglicol - ETG, propilenglicol - PPG y metanol - MET) para la crioconservación de semen de yamú, con base en su calidad postdescongelación y en pruebas de fertilidad in vitro.
Materiales y métodos
Localización y material biológico
El estudio fue realizado en la estación piscícola del Instituto de Acuicultura (IALL) de la Universidad de los Llanos (UNILLANOS) en Villavicencio (Meta), durante la época reproductiva del año 2002 (marzo a mayo). Se utilizaron diez machos (peso corporal 1482.5 ± 211.8 g y longitud total 47.8 ± 3.7 cm) de tres años de edad y sexualmente maduros (presencia de semen en la papila urogenital por presión abdominal), obtenidos por reproducción artificial a partir de ejemplares criados y mantenidos en cautiverio. Los peces fueron mantenidos en estanques en tierra de 350 m2 a una densidad de 1 animal por 2 m2, con recambio diario de agua del 5% y alimentados una vez por día, seis veces por semana, a razón del 3% del peso vivo con alimento peletizado del 25% de proteína bruta.
Obtención del semen
Los animales fueron trasladados 24 h antes de la extracción del semen a piletas circulares de cemento de 7 m3, ubicando tres animales por pileta, con recambio de agua diario del 5% y sin alimentación. La espermiación fue inducida por inyección de Extracto de Hipófisis de Carpa (EHC, Stoller Fisheries, USA) vía intramuscular en una dosis total de 4 mg kg-1 de peso vivo, administrada 18 h antes de la extracción del semen. Previo a la obtención seminal, los animales fueron tranquilizados por inmersión en una solución de 300 ppm de 2- fenoxietanol (Sigma Co, St Louis, Missouri), durante 3 a 5 minutos. Inmediatamente después de perdido el eje de nado, fueron extraídos y secados en la región abdominal y aplicada una leve presión para provocar la expulsión de orina, heces o bilis, para reducir el riesgo de contaminación del material seminal. Posteriormente fue realizado un masaje abdominal en sentido cráneo caudal, con el fin de producir la salida de semen, el cual fue colectado individualmente en tubos de vidrio aforados estériles. Las muestras contaminadas fueron descartadas.
Evaluación seminal precongelación
Inmediatamente después de colectada la muestra fue registrado el volumen y el color; posteriormente la muestra fue mantenida a temperatura ambiente (24.5 °C) para la determinación de la movilidad, tiempo de activación y concentración espermática. La movilidad fue estimada subjetivamente bajo microscopio óptico (100X) después de la activación de una gota de semen (20 mL) con agua destilada (180 mL) y expresada en porcentaje. El tiempo de activación fue medido inmediatamente después de la activación espermática hasta la suspensión del 95% de movimientos y expresado en segundos. La concentración espermática fue determinada por conteo en cámara de Neubauer con previa dilución del semen 1:1200 con solución salina fisiológica (0.9% NaCl) y expresada en millones de espermatozoides por mililitro.Todas las evaluaciones fueron realizadas dentro de los 30 min siguientes a la colección del semen.
Diseño experimental
Se empleó un diseño completamente al azar con 24 tratamientos, constituidos por los efectos de los 4 crioprotectores (DMSO, PPG, ETG y MET) y sus 6 concentraciones (3.75, 5, 7.5, 10, 11.25 y 15%), sobre la calidad espermática y la capacidad de fertilización in vitro posdescongelación. Como control fue usado semen fresco, utilizando un macho por réplica.
Dilución y congelación seminal
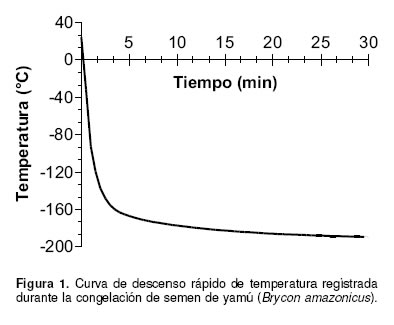
Únicamente muestras de semen con movilidad superior al 80% fueron procesadas para congelación. Éstas fueron diluidas en proporción 1:3 con una solución a base de 12% (v:v) de yema de huevo y 5.5% (p:v) de glucosa, cada una conteniendo los crioprotectores a las diferentes concentraciones establecidas. Posteriormente el semen fue empacado en pajillas francesas de 0.5 mL (Instrument de Médecine Vétérinaire, Minneapolis, USA) previamente identificadas y selladas con polivinilo y ubicadas en posición vertical dentro de una canastilla de acero inoxidable, la cual fue introducida en un tanque seco de vapores de nitrógeno (Taylor- Wharton, CP 100, Theodore, AL, USA). El descenso de la temperatura fue monitoreado cada 30 segundos durante 30 min (tiempo al cual alcanzó una temperatura de -194 °C), por medio de una termocoupla digital (WBrand, USA, precisión 0.001 °C) localizada en medio de las pajillas dentro del tanque de congelación. Inmediatamente después, las pajillas fueron trasladadas a un termo de almacenamiento sumergiéndolas en nitrógeno líquido hasta su evaluación. La curva de descenso de temperatura fue realizada por triplicado.
Evaluación postcongelación y pruebas de fertilidad
Diez días después de la congelación del semen, seis pajillas fueron escogidas al azar por cada tratamiento y descongeladas a 35 °C por 60 seg, para evaluar la movilidad y el tiempo de activación, de igual forma como se hizo con semen fresco. La activación espermática fue inducida con bicarbonato de sodio (NaHCO3) al 1%, ya que esta solución prolongó la duración de la movilidad de espermatozoides descongelados (7). Para cada crioprotector, el tratamiento que mostró los mayores porcentajes de movilidad posdescongelación fue elegido para efectuar la prueba de fertilidad, quedando en consecuencia un total de cuatro tratamientos con seis repeticiones. Para este propósito, los oocitos fueron obtenidos por inducción hormonal con 5.75 mg kg-1 peso corporal de EHC, divididas en tres inyecciones (0, 24 y 36 h) y obtenidos 6 h después de la última aplicación. La prueba de fertilidad consistió en inseminar 3 g de oocitos (ca. 3600), obtenidos de una misma hembra, con 0.17 mL de semen fresco (control) o 0.5 mL de semen descongelado de cada uno de los tratamientos seleccionados (n= 6). La cantidad de semen descongelado, fue definida con base en la dilución a que fue sometido el semen antes de la congelación (1:3). Posteriormente los oocitos inseminados fueron incubados en recipientes plásticos tipo funil de 2.0 L. La fertilidad fue evaluada 6 h postseminación y expresada en porcentaje, calculado a partir del número de oocitos fertilizados (fase de cierre del blastoporo) sobre un total de 100.
Análisis estadístico
La información correspondiente a las características seminales pre y postdescongelación fue sometida a estadística descriptiva. El efecto de los crioprotectores y su concentración sobre la movilidad espermática fue analizado a través de análisis de varianza de una vía (ANOVA) o por medio de la prueba de Kruskal-Wallis, seguido de la prueba de Tukey o Dunn. Diferencias estadísticas entre los resultados de fertilidad en los tratamientos seleccionados fueron obtenidas por ANOVA. Valores de p<0.05 fueron considerados significativos. Todos los análisis estadísticos fueron realizados utilizando el software Instat versión 2.01(1990 - 1993).
Resultados
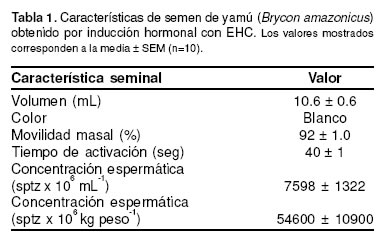
Las características seminales correspondientes a los 10 machos evaluados son mostradas en la tabla 1. Para propósitos de crioconservación espermática las muestras obtenidas presentaron características aceptables y homogéneas, mostrando movilidades espermáticas superiores al 90%.
La curva de congelación registrada bajo las condiciones de congelación utilizadas en este estudio para todos los tratamientos fue de descenso rápido: 150 °C min-1 desde 24.3 °C hasta -51 °C; 60 °C min-1 desde -51 °C a -142 °C; 7.7 °C min-1 desde -142 °C hasta -169 °C y de 0.8 °C min1, desde -169 °C hasta -194 °C (véase Figura 1). En general, para los 24 tratamientos estudiados, las concentraciones de 3.75 y 5% mostraron los valores más altos de movilidad y tiempo de activación postdescongelación, sin presentar diferencias significativas entre ellas (p>0.05), a excepción del DMSO. Los más bajos Característica seminal Valor Volumen (mL) 10.6 ± 0.6 Color Blanco Movilidad masal (%) 92 ± 1.0 Tiempo de activación (seg) 40 ± 1 Concentración espermática (sptz x 106 mL-1) 7598 ± 1322 Concentración espermática (sptz x 106 kg peso-1) 54600 ± 10900 valores fueron observados con cada uno de los crioprotectores a la concentración de 15% (véase Tabla 2). De los 24 tratamientos evaluados, sólo el que presentó la mejor movilidad espermática postdescongelación dentro de cada crioprotector, fue utilizado para las pruebas de fertilidad, con el objetivo de poder establecer logísticamente un número representativo de réplicas con el desove de una misma hembra. Los tratamientos seleccionados fueron DMSO-5%, ETG-3.75%, PPG-3.75% y MET- 3.75% (véase Tabla 2).
El semen crioconservado con DMSO-5% presentó los mayores porcentajes de movilidad postdescongelación y tiempo de activación, con respecto a los otros tres tratamientos seleccionados (véase Tabla 2), sin embargo, sólo el porcentaje de movilidad mostró diferencias significativas (p<0.05) cuando se comparó con los dos últimos (véase Tabla 2). El tratamiento con MET-3.75% presentó la más baja movilidad y tiempo de activación dentro de los cuatro tratamientos seleccionados para las pruebas de fertilidad.
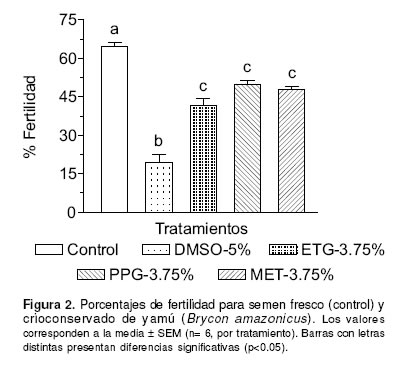
Con relación a las pruebas de fertilidad, el semen crioconservado con PPG-3.75% mostró mayor porcentaje de fertilidad (50 ± 1.4) cuando se comparó con DMSO-5%, ETG-3.75% y MET- 3.75% (19.5 ± 2.9, 41.8 ± 2.4, 47.8 ± 1.4, respectivamente), sólo el tratamiento con DMSO- 5% fue significativamente inferior entre tratamientos (p<0.05). En general, todos los tratamientos presentaron un porcentaje de fertilidad significativamente menor con respecto al semen fresco (64.7 ± 1.7) (véase Figura 2).
Discusión
Uno de los factores para el éxito del proceso de crioconservación espermática es seleccionar reproductores con capacidad de producir volúmenes adecuados de semen de alta calidad. Por lo tanto, la evaluación previa de la calidad seminal es un requisito esencial para la eficiencia del proceso. En este estudio, todas las muestras seminales recolectadas fueron aptas para su crioconservación, mostrando un porcentaje de movilidad masal para semen fresco similar al reportado por Cruz-Casallas et al (6) en la misma especie (98 ± 2%); sin embargo, el volumen seminal registrado en este estudio fue superior y la concentración espermática inferior a los valores determinados por Cruz-Casallas et al. (6) en semen fresco de yamú (1.8 a 4.0 mL y 12.8 ± 1.1 x 109 sptz/mL, respectivamente). En especies como cachama blanca (Piaractus brachypomus) y barbilla (Rhamdia sebae c.f), han sido encontradas concentraciones espermáticas y movilidades mayores a las encontradas en yamú (18, 22); requiriéndose un mayor grado de dilución en las muestras seminales para congelación.
En los 24 tratamientos evaluados se pudo evidenciar que el aumento en la concentración de los crioprotectores ocasionó disminución en los porcentajes de movilidad masal y en el tiempo de activación postdescongelación, siendo este descenso más evidente cuando se comparó con los observados en el semen fresco. La toxicidad de los crioprotectores y su efecto sobre la disminución de la movilidad y del tiempo de activación espermático ha sido relacionado con el estado bioenergético del espermatozoide después del proceso de congelación. Crioprotectores como DMSO o glicerol pueden interferir con el balance entre síntesis y utilización de ATP, ocasionando una inapropiada activación de fosfolipasas y proteasas y un daño celular irreversible (11, 12). El aumento en la concentración del crioprotector podría agudizar este evento disminuyendo así la movilidad y el tiempo de activación espermático.
La efectividad en la protección de cada una de las sustancias crioprotectoras esta ligada a su capacidad de entrada y salida de la célula espermática en favor de su gradiante de concentración y la tasa de congelación y descongelación utilizada durante el proceso (23). La velocidad de difusión del crioprotector a través de la membrana plasmática, puede verse afectada también por el aumento de la proporción de colesterol en la membrana durante el descenso de temperatura, ya que al aumentar, para proporcionarle una mayor estabilidad mecánica, su permeabilidad a pequeñas moléculas disminuye, afectando así la penetración del crioprotector a la célula (19). En este estudio, todos los tratamientos fueron sometidos a iguales condiciones de congelación y descongelación, colocando quizás en desventaja a aquellos espermatozoides en soluciones con mayor concentración de crioprotector, ocasionando tal vez intoxicación celular, debido a una ineficiente salida del crioprotector del interior de la célula durante la descongelación o a procesos de desbalance bioenergético como fue explicado anteriormente.
Los porcentajes de movilidad masal postdescongelación de los cuatro tratamientos seleccionados fueron superiores a los reportados para Sparus aurata (8) donde también fueron evaluados DMSO, ETG y PPG como crioprotectores con 65, 50 y 50%, respectivamente. Trabajos realizados en cachama blanca (18) muestran porcentajes de movilidad inferiores para DMSO y ETG (55 y 37%) y superiores para PPG y MET (64 y 47%) a concentración del 5%, siendo los tiempos de activación muy superiores (>100 seg) a los encontrados para yamú en este trabajo. La congelación seminal de Cyprinus carpio utilizando 10% de DMSO permitió porcentajes de movilidad de 69 ± 14 (14), siendo superior a los encontrados en yamú con 10 ó 3.75 % de DMSO (33 ± 4 y 60 ± 6, respectivamente). Estos resultados contrastantes entre especies, pueden inferir que aun cuando las condiciones de congelación - descongelación sean similares en los diferentes estudios, el efecto del crioprotector sobre la célula espermática presenta variación inter e intra especies, no permitiendo generalizar los protocolos.
Navarro et al (18) reportan la congelación seminal de cachama blanca utilizando como crioprotectores DMSO-5%, ETG-5%, PPG-5% y MET-10%, los porcentajes de fertilidad determinados fueron inferiores a los encontrados en este estudio, a excepción de DMSO-5% en donde fue superior para esta especie (25 ± 4%). Al comparar los resultados obtenidos en los tratamientos seleccionados para movilidad masal y porcentaje de fertilidad, se observa, que aquellos que fueron superiores en movilidad (DMSO-5% y ETG- 3.75%) no presentaron los mayores porcentajes de fertilidad. A diferencia, PPG-3.75% y MET-3.75% alcanzaron fertilidades más relacionadas con su movilidad postdescongelación (62 ± 3 y 44 ± 3%, respectivamente). Aunque los tratamientos utilizados en las pruebas de fertilidad fueron seleccionados con base en su calidad seminal postdescongelación (movilidad y tiempo de activación espermática), al parecer en este estudio estas variables no mostraron relación directa con la fertilidad espermática. Algunos autores han observado relación similar en especies como Piaractus brachypomus (18), Exos masquinungy (4) y Piaractus mesopotamicus (9) entre otros.
Al parecer, el PPG y MET suelen ser menos tóxicos en unas especies que en otras y su efecto puede ser atribuido a su capacidad de salir y entrar más rápidamente de la célula que otros crioprotectores (21). No obstante, el hecho que espermatozoides con baja movilidad postdescongelación como en el caso de PPG y MET (en nuestro estudio) puedan presentar porcentajes de fertilidad altos aún no está muy claro. Ciereszko et al (4) en Muskellunge observó que sólo espermatozoides crioconservados con metanol presentaban tiempos de activación mayores a 35 seg y que tratamientos con movilidad baja alcanzaban altos porcentajes de fertilidad, proponiendo que quizás la existencia de factores de activación suministrados por el oocito al momento de la fertilización podrían mejorar la activación de la movilidad espermática.
En conclusión se determinó que el semen de yamú crioconservado con DMSO-5% presentó el mejor porcentaje de movilidad y tiempo de activación, siendo PPG-3.75% y MET-3.75% los que alcanzaron las mayores tasas de fertilidad. Se observó de igual manera, que al aumentar la concentración del crioprotector en el diluyente la calidad seminal postdescongelación disminuye significativamente, no existiendo relación directa entre la movilidad espermática observada y la fertilidad. Finalmente, se recomienda evaluar nuevamente estos crioprotectores bajo diferentes condiciones de congelación y descongelación con el objetivo de determinar su eficiencia real durante el proceso de crioconservación y ajustar un protocolo definitivo para la especie.
Agradecimientos
Los autores manifiestan su gratitud a Paola Milena Bolaños López y Orlando Romero Ortiz, por su colaboración en la realización de los experimentos preliminares. Igualmente, al Instituto de Acuicultura de la Universidad de los Llanos (IALL) por el apoyo logístico.
Summary
Evaluation of different cryoprotectors for cryopreservation of yamú (Brycon amazonicus) spermatozoa
The effect of dimethyl sulphoxide (DMSO), ethylene glycol (ETG), propylene glycol (PPG) and methanol (MET) in yamú (Brycon amazonicus – Spix & Agassiz, 1829) semen cryopreservation was evaluated with the aim of determining the post-thawing quality and in vitro fertility. For this purpose, sexually mature yamú females and males were induced to promote ovulation and spermation with carp pituitary extract. The semen obtained was evaluated and diluted 1:4 in a solution with 12% egg yolk and 5.5% glucose. Different concentrations (3.75, 5, 7.5, 10, 11.25 and 15%) for each one of the 4 cryoprotectants were used for a total of 24 treatments. The diluted semen was frozen into 0.5 mL straws by liquid nitrogen vapours (LN) during 30 minutes and then transferred to a container with LN until be assayed. The straws (n= 6) corresponding to each treatment were thawed at 35 °C for 60 seconds and evaluated to select the best concentration for each cryoprotector for the fertility test. 5% DMSO, 3.75% ET, 3.75% PPG and 3.75% MET treatments presented the highest motility percentages (MP) and activation time (AT) being 5% DMSO the best (MP 76 ± 2.4; AT 88.2 ± 6.1). On the other hand, 3.75% PPG and 3.75% MET treatments showed the highest fertility percentages (50 ± 1.4 and 47.8 ± 1.4, respectively); however, these percentages were significantly lower (p<0.05) than these obtained with fresh semen (64.7 ± 1.7). In general, it was observed that the increase in the cryoprotector concentration decreased semen quality post-thawing, and there was not direct relationship between sperm motility and fertility.Key words: cryoprotectant, fertilization, seminal quality, spermatozoa
Referencias
1. Arias CJA. Contribución al conocimiento biológico de los peces de los llanos, Yamú (Brycon siebenthalae) y Sapuara (Semaprochilodus laticeps), con fines de cultivo. Informe Final. Universidad de los Llanos – Colciencias 1995; p. 30. [ Links ]
2. Babiak I, Glogowski S, Kusminski H, Goryezko K. Semen from rainbow trout produced using cryopreserved spermatozoa is more suitable for cryopreservation. J Fish Biol 2002; 60: 561-70. [ Links ]
3. Carolsfeld J, Godinho HP, Zaniboni E; Harvey BJ. Cryopreservation of sperm in Brazilian migratory fish conservation. J Fish Biol 2003; 63:472-89. [ Links ]
4. Ciereszko A, Dabrowski K, Lin F, Christ SA, Toth GP. Effects of extenders and time of storage before freezing on motility and fertilization of cryopreserved Muskellunge spermatozoa. Trans Am Fish Soc 1999; 128: 542-48. [ Links ]
5. Cruz-Casallas PE, Lombo-Rodríguez DA, Velasco-Santamaría YM. Milt quality and spermatozoa morphology of captive Brycon siebenthalae (Eigenmann) broodstock. Aquacult Res 2005; 36: 682-86. [ Links ]
6. Cruz-Casallas PE, Pardo-Carrasco SC, Arias-Castellanos JA, Lombo-Castellanos PE, Lombo-Rodríguez DA, et al. Cryopreservation of Yamú Brycon siebenthalae Milt. J World Aquacult Soc 2004; 35: 529-35. [ Links ]
7. Cruz-Casallas PE, Pardo-Carrasco SC; Arias-Castellanos JA, Pardo-Mariño JE, Lombo-Rodríguez DA. Fertilidad de semen de Yamú Brycon siebenthalae criopreservado con DMSO y activado con bicarbonato de sodio. II Congreso Latinoamericano de Acuicultura - Acuicultura Venezuela´99, Puerto La Cruz 1999; p. 20-1. [ Links ]
8. Fabbrocini A, Lubrano-Lavadero S, Rispoli S, Sansone G. Cryopreservation of Seabream (Sparus aurata) spermatozoa. Cryobiology 2000; 40 (1): 46-53. [ Links ]
9. Fogli da Silveira W, Kavamoto ET, Narahara MY. Avaliação espermática, preservação criogenica do semen do pacu Piaractus mesopotamicus, proveniente de reprodução induzida. Bull Inst Pesca 1990; 17: 1-13. [ Links ]
10. González-Sarmiento E, Díaz-Sarmiento J. Principios básicos de la criopreservación de esperma de peces. En: Fundamentos de Acuicultura Continental. INPA. 2da Ed; 2001. p 233-63. [ Links ]
11. Hammerstedt RH, Graham JK. Cryopreservation of poultry sperm: the enigma of glycerol. Cryobiology 1992; 29:26-38. [ Links ]
12. Holt WV. Basic aspects of frozen storage of semen. Anim Reprod Sci 2000; 62:3-22. [ Links ]
13. Lahnsteiner F, Berger B, Horvarth A, Urbanyi B, Weismann T. Cryopreservation of spermatozoa in cyprinid fishes. Theriogenology 2000; 54:1477-98. [ Links ]
14. Linhart O, Rodino M, Cosson J. Cryopreservation of sperm in common carp Cyprinus carpio: sperm motility and hatching success of embryos. Cryobiology 2000; 41:241-50. [ Links ]
15. Mazur P. Fundamental aspects of the freezing of cells, whit emphasis on mammalian ova and embryos. En: 9th International congress on animal reproduction and artificial insemination. Madrid, España, 1980. p. 99-114. [ Links ]
16. Mizukami A, Carrell DT, Peterson CM. Cryopreservation of embryos. En: Encyclopedia of reproduction. vol 1. Utah : Academic Press; 1999. p. 765-72. [ Links ]
17. Munkittrick KR, Moccia RD. Advances in the cryopreservation of salmonid semen and suitability for a production – scale artificial fertilization program. Theriogenology 1984; 21:645-59. [ Links ]
18. Navarro OJ, Velasco-Santamaría YM, Cruz-Casallas PE. Evaluación de cinco protectores para la crioconservación de semen de cachama blanca (Piaractus brachypomus). Rev Col Cienc Pec 2004; 17(sup):53-59. [ Links ]
19. Spinel C. Biología molecular de la célula eucariótica animal. 1 ed. Medellín (Colombia) : Fondo editorial Biogénesis; 2002. p. 31-68. [ Links ]
20. Taddei AR, Barbato F, Abelli L, Canese S, Moretti F, et al. Is cryopreservation a homogeneous process? Ultrastructure and motility of untreated, prefreezing, and postthawed spermatozoa of Diplodus puntazzo (Cetti). Cryobiology 2001; 244-55. [ Links ]
21. Tiersch TR, Figiel CR, Wayman WR, Williamson JH, Carmichael GJ, et al. Cryopreservation of sperm of the endangered Razorback sucker. Trans Am Fish Soc 1998; 127:95-104. [ Links ]
22. Velasco-Santamaría YM, Arias-Castellanos JA, Cruz-Casallas PE. Efecto de la inducción hormonal con extracto de hipófisis de carpa (EHC) sobre algunas características seminales de Rhamdia sebae c.f. Memorias II Congreso Colombiano de Acuicultura 2004; p.116-17. [ Links ]
23. Vincent C, Pruliere G, Pajot-Augy E, Campion E, Douzou P. Biophysical chemical aspects of cellular cryobehavior. Biophys Chem 1998; 29:161-69. [ Links ]
24. Yao Z, Crim LW, Richardson GF, Emerson CJ. Motility, fertility and ultrastructural changes of ocean pout (Macrozoarces americanus L.) sperm after cryopreservation. Aquaculture 2000; 181:361-75. [ Links ]