Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.2 Medellín Apr./June 2006
Efectos del sistema de conservación sobre la fertilidad de oocitos de yamú (Brycon amazonicus) durante cortos períodosde almacenamiento
Yohana M Velasco-Santamaría1, MV; Wilson Corredor-Santamaría2, MV; Pablo E Cruz-Casallas1 MVZ, MS, PhD
1Grupo de Reproducción y Toxicología de Organismos Acuáticos - GRITOX, Instituto de Acuicultura, Facultad de Ciencias Agropecuarias y Recursos Naturales, Universidad de los Llanos, A.A. 110, Villavicencio, Meta - Colombia.
2Ejercicio profesional particular.
ymvelasco@yahoo.com; pecruz@telecom.com.co
(Recibido: 18 abril, 2005; aceptado: 27 marzo, 2006)
Resumen
El objetivo fue evaluar los efectos del sistema de conservación sobre la fertilidad de oocitos de yamú (Brycon amazonicus) durante cortos períodos de almacenamiento. Se utilizaron hembras y machos adultos tratados con extracto de hipófisis de carpa para estimular la ovulación y aumentar el volumen seminal. Oocitos obtenidos de la misma hembra fueron sometidos a tres sistemas de conservación: in situ (IS, mantenidos dentro de la cavidad ovárica), ex situ a temperatura ambiente (T°A) y ex situ a temperatura de refrigeración (T°R). El diámetro ovocitario (DO) y la viabilidad fueron evaluados a los 0 (control), 15, 30, 60 y 120 min de almacenamiento. El DO fue medido con reglilla acoplada al ocular del estéreomicroscopio y la viabilidad mediante prueba de fertilidad, seminando 3g de oocitos con 250 mL de semen fresco. También fueron medidos la longitud total y el volumen del saco vitelino de las larvas. Bajo los tres sistemas de conservación, DO aumentó con el tiempo, siendo mayor (p<0.001) que el control a partir de los 15 min de almacenamiento. Los mayores DO fueron observados en oocitos conservados a T°R (p<0.05). Hasta 60 min de almacenamiento, en los sistemas de conservación IS y a T°A, la fertilidad no varió (p>0.05) con respecto al control. A los 120 min de almacenamiento, todos los sistemas de conservación mostraron fertilidad menor que el control; sin embargo, en el sistema T°R disminuyó más rápidamente, siendo menor (p<0.05) que el control a los 30 min. Aunque las larvas no presentaron evidentes alteraciones morfológicas, las del control fueron más largas (p<0.01) que aquellas de oocitos conservados. En conclusión, oocitos ovulados de yamú pueden mantenerse viables hasta por 60 min, conservándolos en la cavidad ovárica o a temperatura ambiente. En contraste, la refrigeración deterioró rápidamente la fertilidad de oocitos ovulados.
Palabras clave: conservación, fertilidad, oocitos, temperatura, yamú.
Introducción
El yamú (Brycon amazonicus - Spix & Agassiz 1829) es un carácido reofílico endémico de la cuenca del Orinoco de Colombia y Venezuela, su reproducción se ve influida por factores ambientales, como el aumento de la precipitación, que estimula la maduración gonadal (3). En peces mantenidos en cautiverio, la evaluación del estado de maduración de los oocitos es un factor importante para el éxito de la reproducción artificial, ya que estados de submaduración o de sobremaduración, disminuyen la viabilidad ovocitaria (tiempo en que se mantiene la fertilidad post-ovulación) por alteraciones morfológicas y bioquímicas y, en consecuencia, reducen las tasas de fertilidad y eclosión (25).
La intensificación de los procesos productivos y reproductivos, ha generado la necesidad de implementar técnicas para conservar la viabilidad de los gametos y facilitar la reproducción artificial; sin embargo, estos procedimientos deben adaptarse teniendo en cuenta las características particulares de cada especie. Se han propuesto dos tipos de conservación: a corto plazo (desde horas hasta menos de cuatro semanas) y a largo plazo (por tiempo indefinido). El primero es utilizado principalmente en aquellas especies donde existe asincronía en la maduración gonadal o para resolver problemas de endocruzamientos que reducen la variabilidad genética (25). En el segundo se recurre a la crioconservación, una rama de la criobiología que consiste en someter los gametos por periodo indefinido a temperaturas criogénicas (-196 °C), deteniendo el metabolismo celular pero conservando la integridad y capacidad fecundante de los gametos. La principal utilidad de este último método es la creación de bancos de germoplasma, con el fin de reducir el espacio para el mantenimiento de reproductores o para la conservación genética de especies vulnerables o en vía de extinción (19, 26). Sin embargo, la crioconservación de oocitos y embriones de peces, no ha tenido hasta el momento los resultados deseados, debido a la alta sensibilidad de dichas células al enfriamiento (4, 15, 22).
La conservación a corto plazo es necesaria en situaciones donde los gametos masculinos y femeninos son colectados en momentos diferentes, cuando existen amplias distancias entre los sitios de su recolección o para minimizar el uso de gametos infectados reduciendo la diseminación de enfermedades; sin embargo, este tipo de conservación es posible sólo en especies como los salmónidos, en los cuales es posible detener la activación del oocito después del desove (26).
Cuando los oocitos ovulados se mantienen por un período prolongado de tiempo dentro de la cavidad ovárica o peritoneal (dependiendo de la especie), se genera un deterioro de la calidad de los mismos, denominado sobremaduración. Durante este proceso se presentan modificaciones morfológicas, tales como: agregación de gotas lipídicas y alvéolos corticales en el polo animal del oocito, exocitosis parcial de alvéolos corticales y oocitos irregulares, aumento de la permeabilidad del vitelo y consecuentemente aumento del diámetro ovocitario, lo cual ocasiona disminución de la fertilidad y alteraciones en el desarrollo larvario (11). De igual modo, se reporta en Salmo gairdneri, que las principales alteraciones bioquímicas son aumento en el contenido de agua y disminución en los niveles de proteína precipitada (6). En oocitos sobremadurados de carpa (Cyprinus carpio L.) se reporta aumento en la respiración anaeróbica con producción de ácido láctico, que se acumula en el fluído ovárico, reduciendo progresivamente el pH y generando pérdida de la integridad de la membrana del oocito (21). Crack y Harvey (6) reportaron que la sobremaduración es el reflejo de la descomposición del vitelo con ruptura de proteínas vitelínicas, pérdida de moléculas orgánicas y defosforilación de proteínas y lípidos. Los principales factores que influyen en los procesos de conservación de oocitos son la temperatura, el intercambio gaseoso y la desecación. Por tal razón, el control de la temperatura y la oxigenación durante el almacenamiento se ha recomendado para reducir el metabolismo celular durante la conservación de oocitos y favorecer los procesos aeróbicos, requisitos importantes para prolongar la viabilidad de los gametos (19, 26). Esta disminución en el metabolismo del oocito, permite que se mantengan las reservas de energía en forma de ATP provenientes de reacciones oxidativas y glicolíticas (21).
Se ha reportado ausencia de efectos deletéreos en oocitos de especies de clima templado, almacenados por cortos periodos de tiempo a baja temperatura. Oocitos de salmónidos fueron almacenados exitosamente, tanto suspendidos en fluido ovárico in situ, como secos y a temperatura de 0 a 4 °C, mostrando fertilidades superiores a 70% (26). En cuanto a la conservación de oocitos de especies de clima tropical, conservados in situ o ex situ, los estudios son aún escasos, disponiéndose sólo de alguna información en sábalo (Prochilodus platensis) (12), tilapia (Sarotherodon mossambicus) (14), bagre (Silurus glanis) (20), curimatã (Prochilodus marggravii) (5, 24, 25) y carpa (Cyprinus carpio) (21). En todas estas especies, la viabilidad postovulación reportada es de apenas unas pocas horas.
Con base en lo anterior, el objetivo del presente trabajo fue evaluar los efectos del sistema de conservación sobre la fertilidad de oocitos de yamú (Brycon amazonicus) durante cortos períodos de almacenamiento, para determinar las condiciones más adecuadas para almacenarlos hasta su fertilización.
Materiales y métodos
Material biológico
Durante la época reproductiva de 2003 (febrero a mayo), se utilizaron ejemplares adultos de yamú (Brycon amazonicus), criados y mantenidos en estanques en tierra a una densidad de 170 g/m2, provenientes de la Estación Piscícola del Instituto de Acuicultura (IALL) de la Universidad de los Llanos, con peso corporal de 2.5 ± 0.4 kg y 1.6 ± 0.1 kg y longitud total de 51.8 ± 1.9 cm. y 47.8 ± 1.2 cm., para hembras y machos, respectivamente. Para la selección de las hembras se tuvieron en cuenta las características externas de madurez sexual (abdomen distendido y papila urogenital dilatada y enrojecida) y el diámetro de los oocitos obtenidos por biopsia ovárica, seleccionándose aquellas con diámetros ovocitarios superiores a 1100 µm; este criterio ha sido utilizado rutinariamente en la selección de hembras de esta especie para inducir la maduración final de sus gónadas (2). Con relación a los machos, se seleccionaron ejemplares que presentaron semen viscoso después de una leve presión abdominal. Durante la fase experimental, los reproductores fueron mantenidos en piletas circulares y sin suministro de alimento.
Obtención de gametos
En las hembras, la maduración final y la ovulación fueron inducidas mediante la administración intramuscular de 5.75 mg.kg-1 de peso corporal de extracto de hipófisis de carpa (EHC, Stoller Fisheries, USA) distribuida en tres aplicaciones, administradas a las 0 (0.25 mg.kg-1), 24 (0.5 mg.kg-1) y 36 h (5.0 mg.kg-1) del tratamiento hormonal. En los machos, el aumento del volumen seminal fue inducido administrando 4.0 mg.kg-1 de EHC, en una sola inyección, aplicada simultáneamente con la segunda inyección de la hembra. La extracción de los gametos fue realizada mediante masaje cráneo-caudal del abdomen, 6 a 7 h y 18 a 20 h después de la última dosis de EHC, para hembras y machos, respectivamente (7). Previo a la obtención de los gametos, los reproductores fueron tranquilizados por inmersión en una solución anestésica de 300 ppm de 2-fenoxietanol (Sigma Co., St Louis, Missouri) hasta observar pérdida del eje de nado. Posteriormente, se realizó un secado cuidadoso de la zona urogenital, con el fin de evitar el contacto de los oocitos y del semen con agua. Los oocitos se recibieron en recipientes plásticos, pesados en una balanza digital (Scout Pro, Ohaus Corporation, Pine Brook NJ, USA) y contada la cantidad presente en un gramo. El semen fue colectado en tubos de vidrio aforados de 15 mL. Para cada muestra seminal se determinó la movilidad y la concentración espermática. Las muestras contaminadas con sangre, orina, heces o bilis no se utilizaron.
Tratamientos
Se evaluaron tres sistemas de conservación de oocitos, así: in situ (mantenidos dentro de la cavidad ovárica), ex situ a temperatura ambiente (28 ± 1 °C) y ex situ a temperatura de refrigeración (4 ± 1 °C) durante 120 min. Para evitar la eventual variación individual en la viabilidad de los gametos, se utilizaron oocitos provenientes de una misma hembra en los tres sistemas de conservación. La ovulación ocurrió transcurridas 180 horas-grado después de aplicada laúltima inyección de EHC, con una temperatura aproximada de 26 ºC (6 a 7 h), momento en el cual fue extraído aproximadamente el 60% de los oocitos (ca. 120 g), porcentaje basado en la distensión inicial de la cavidad abdominal, éstos fueron divididos en dos baches iguales y colocados en recipientes plásticos. El bache uno fue conservado a temperatura ambiente (28 ± 1 °C) y el bache dos bajo condiciones de refrigeración en una nevera convencional (4 ± 1 °C). En ambos casos, los recipientes fueron cubiertos con un paño húmedo con el fin de mantenerlos en una atmósfera húmeda y reducir la deshidratación. Para evaluar el sistema de conservación in situ, se utilizaron los oocitos ovulados remanentes en la cavidad ovárica, extrayendo en cada muestreo aproximadamente 10 g de oocitos por medio de masaje abdominal.
Diámetro ovocitario
Con el fin de evaluar los efectos del sistema de conservación sobre el diámetro ovocitario, se midió el diámetro de los oocitos de una muestra aleatoria (n= 149) de cada tratamiento, utilizando una reglilla instalada en el ocular del estéreomicroscopio (Carl Zeiss, Stemi 2000-C, Thornwood, NY, USA). Las muestras fueron recolectadas al momento de la primera extracción (0 min) y a los 15, 30, 60 y 120 min de almacenamiento y las mediciones fueron realizadas dentro de las 12 horas siguientes. Durante este periodo los oocitos fueron mantenidos a temperatura ambiente (28 ± 1 °C), suspendidos en solución salina fisiológica (NaCl 0.9%) con el fin de disminuir su deshidratación o hidratación excesivas (2).
Pruebas de fertilidad
La fertilidad fue evaluada a los 0, 15, 30, 60 y 120 min de almacenamiento, realizando para cada momento ocho repeticiones (n= 8). Para evaluar los efectos del sistema de conservación sobre la fertilidad, muestras de 3 g de oocitos (ca. 4200) de cada tratamiento fueron seminadas con 250 mL de semen proveniente de un mismo macho, cuya calidad seminal fue verificada antes de cada prueba (movilidad masal > 90% y concentración superior a 6 millones de espermatozoides por mL). Los oocitos seminados e hidratados fueron dispuestos en incubadoras de flujo ascendente de 2 L de capacidad. En todos los casos, la fertilidad fue evaluada a las 6 h postseminación a partir de muestras de ca. 100 oocitos, tomadas al azar con una varilla de vidrio y determinada como el porcentaje de oocitos fertilizados sobre el total de oocitos observados. La lectura fue realizada por triplicado y el promedio de las tres mediciones utilizado en los análisis posteriores. Finalmente, para cada uno de los sistemas de conservación estudiados, el porcentaje de eclosión fue evaluado a las 12 h postseminación y definido como el número de larvas vivas y móviles en una muestra de aproximadamente 100 embriones.
Desarrollo larvario
Para evaluar si el sistema de conservación podría influir sobre el desarrollo larvario, se tomaron aleatoriamente de cada tratamiento 40 - 87 larvas de 10 horas posteclosión (HPE) y se conservaron durante aproximadamente 24 h en solución salina fisiológica (NaCl 0.9%) formolada (3%), para medir la longitud total, la longitud y la altura del saco vitelino. A partir de las medidas del saco vitelino se calculó su volumen, aplicando la fórmula descrita por Junqueira (16): V= [(ð/6)*L*H²], donde V es el volumen del saco vitelino expresado en mm³, L la longitud total del saco vitelino y H la altura del saco vitelino, expresadas en mm.
Análisis estadístico
Todos los datos fueron sometidos a estadística descriptiva y expresados como media ± SEM. Previo al análisis de los datos, los porcentajes de fertilidad y eclosión, fueron transformados en arco seno. Posteriormente, las variables de fertilidad, eclosión, diámetro ovocitario, longitud total y volumen del saco vitelino, fueron sometidas a análisis de varianza de dos vías (ANOVA) seguido de la prueba de Tukey-Kramer. Para todos los datos, se realizó homogeneidad de varianza por medio del test de Bartlett. En todos los casos un valor de p<0.05 reveló diferencias significativas. Todos los análisis estadísticos fueron realizados empleando el software SAS para Windows versión 8.02 (1999-2001 por SAS Institute Inc., Cary,NC, USA).
Resultados
Diámetro Ovocitario
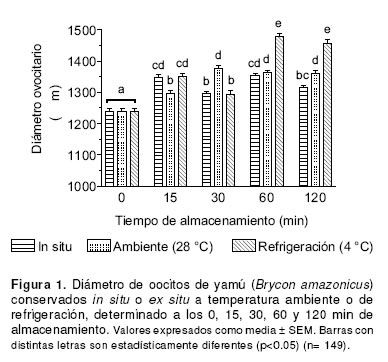
Los diámetros ovocitarios de las muestras obtenidas a los 15, 30, 60 y 120 min de almacenamiento, fueron estadísticamente mayores (p<0.001) comparados con el diámetro ovocitario inicial (1238 ± 9.7 µm). Los mayores diámetros ovocitarios fueron observados a partir de los 60 min de almacenamiento en aquellas muestras conservadas ex situ bajo condiciones de refrigeración (p<0.05) (véase Figura 1).
Fertilidad y eclosión
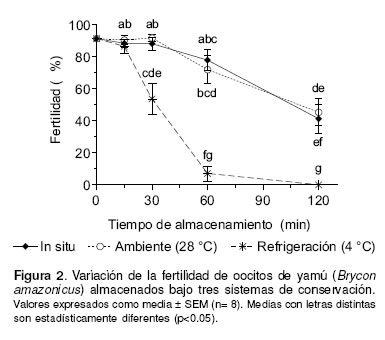
Bajo el sistema de conservación in situ, la fertilidad no varió significativamente (p>0.05) con respecto al control hasta los 60 min de almacenamiento. A partir de los 30 min de almacenamiento, la conservación ex situ a temperatura de refrigeración presentó una disminución progresiva (p<0.01) de la fertilidad comparada con los demás sistemas de conservación. A los 60 min de almacenamiento el porcentaje de fertilidad de oocitos conservados ex situ a temperatura ambiente, fue inferior (p<0.05) en un 20% con respecto al control. Sin embargo, en este momento no se observaron diferencias entre el sistema de conservación in situ y ex situ a temperatura ambiente. A partir de este momento, la conservación ex situ a temperatura de refrigeración mostró una disminución drástica de la fertilidad (p<0.001). Finalmente, a los 120 min de almacenamiento, la fertilidad de los oocitos mantenidos bajo los tres sistemas de conservación, descendió significativamente con relación al control (véase Figura 2).
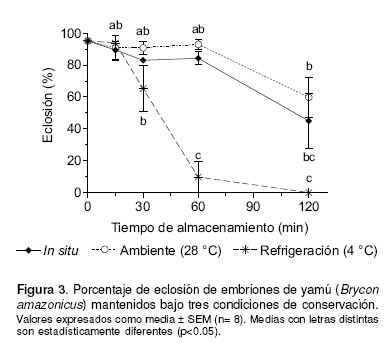
El porcentaje de eclosión no presentó diferencias significativas (p>0.05) a los 15, 30 y 60 min de almacenamiento para los sistemas de conservación in situ y ex situ a temperatura ambiente. A partir de los 30 min de almacenamiento se presentaron diferencias significativas (p<0.01) entre la conservación ex situ a temperatura de refrigeración y los otros dos sistemas evaluados (véase Figura 3). Al igual que el porcentaje de fertilidad, a los 120 min de almacenamiento, la proporción de larvas eclosionadas para los tres sistemas de conservación, fue significativamente menor comparada con los demás periodos de almacenamiento.
Desarrollo larvario
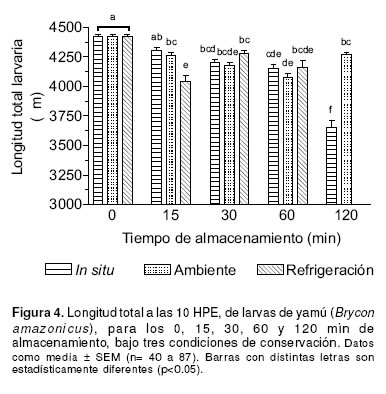
Larvas obtenidas de oocitos fertilizados en el momento de la extracción inicial (0 min), tuvieron una mayor longitud total (4419 ± 21.5 mm, p<0.05) comparadas con las obtenidas de los demás sistemas de conservación, excepto para la conservación in situ a los 15 min de almacenamiento (p>0.05). La longitud total de las larvas provenientes de la conservación in situ a los 120 min de almacenamiento, fue menor (3651± 61.3 mm) con respecto a los demás tratamientos (p<0.001). No se reporta para los 120 min de almacenamiento la longitud de larvas provenientes de la conservación ex situ a temperatura de refrigeración, puesto que no sobrevivieron hasta las 10 HPE (véase Figura 4). En general, se observó una disminución progresiva en la longitud de larvas mantenidas en los tres diferentes sistemas de almacenamiento.
.
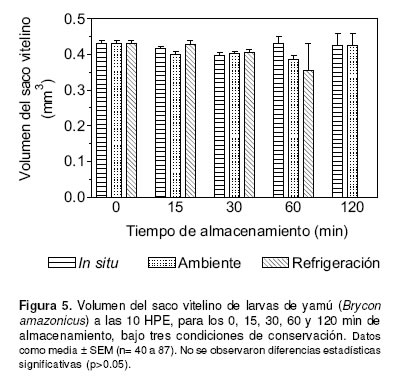
El volumen del saco vitelino de larvas obtenidas de oocitos conservados in situ y ex situ a temperatura ambiente o emperatura de refrigeración, no varió significativamente a lo largo del tiempo (p>0.05). Sin embargo, el menor volumen del saco vitelino (0.356 ± 0.074 mm3) fue observado en las larvas obtenidas de oocitos conservados ex situ a temperatura de refrigeración durante 60 minutos de almacenamiento (véase Figura 5).
Discusión
La conservación a corto término de oocitos ovulados es una alternativa útil cuando es necesario su transporte o se requiere de un tiempo mayor para los procesos de seminación, como en aquellos casos donde la disponibilidad de semen no es inmediata (18). La conservación ex situ llevada a cabo en este estudio, se realizó bajo la técnica de almacenamiento en seco, es decir, sin adicionar fluido ovárico u otra solución que mantuviera un ambiente isosmótico. Estas técnicas son recomendadas en acuicultura debido a su practicidad y poco uso de tecnología (18).
Se ha observado que en oocitos conservados ex situ, el vitelo tiende a endurecerse debido a su deshidratación progresiva por la evaporación del agua. Esta reducción en el contenido hídrico conlleva a una hiperconcentración de solutos no permeables, tales como polisacáridos y mucopolisacáridos, en el espacio perivitelino, ocasionando un aumento de la presión osmótica y un mayor ingreso de líquidos hacia este espacio (1, 17). Así mismo, las modificaciones morfológicas y bioquímicas que ocurren en oocitos sobremadurados, conducen finalmente a un incremento del influjo de agua y consecuentemente a un aumento en el diámetro ovocitario (6, 11, 21). Los anteriores reportes, podrían explicar el aumento significativo en el diámetro ovocitario presentado en este estudio bajo los tres sistemas de conservación; además, la temperatura de refrigeración pudo haber favorecido el endurecimiento del vitelo.
Los estudios encaminados a determinar el tiempo y las condiciones de conservación de oocitos de peces han sido ampliamente estudiados en especies de aguas templadas (salmones y truchas); sin embargo, aún son pocos los estudios reportados en especies tropicales (12, 14, 22). La duración de la viabilidad de los oocitos de yamú conservados in situ o ex situ a temperatura ambiente, concuerda con la observada en Sarotherodon mossambicus 1.5 h a 20 °C en fluido celómico (14), Prochilodus platensis 1 h a 26 - 27 °C (12), Cyprinus carpio entre 1 a 6 h a 20 - 23 °C (21) y Prochilodus marggravii de 1 a 2 h a 26 °C (24). Por otra parte, los resultados del presente trabajo son inferiores a lo reportado en otras especies tropicales como Carassius auratus de 3 a 6 h a 23 °C (11) y Rhamdia sapo de 5 a 9 h a 20 - 24 °C (10).
En yamú, al igual que otros carácidos como Prochilodus marggravii (24, 25) y Prochilodus platensis (12), la viabilidad de los oocitos disminuye progresivamente con el aumento del tiempo de almacenamiento tanto para la conservación in situ o ex situ. La baja viabilidad reportada por estos autores, se refiere a una menor sobrevivencia del oocito, disminución progresiva de la fertilidad, así como la ocurrencia de anormalidades larvarias (12, 25). Oocitos de zebrafish (Danio rerio) mantenidos en temperaturas inferiores a 10 ºC por 15 o 60 min, mostraron una sensibilidad al enfriamiento manifestada por disminución en la sobrevivencia conforme disminuía la temperatura y aumentaba el tiempo de almacenamiento (15).
El hecho de que oocitos de una especie acuática respondan eficientemente al almacenamiento bajo condiciones de refrigeración, reducirá los factores limitantes para la implementación de protocolos de crioconservación de oocitos y (o) embriones (15). En especies de agua templada como los salmónidos, los oocitos pueden ser conservados exitosamente en fluido ovárico a una temperatura de 0 a 4 °C. En Onchorhynchus keta, la fertilidad de oocitos mantenidos a 3 °C durante 6 días fue de 90%; de igual modo, oocitos de trucha marrón (Salmo trutta), mantenidos hasta por 10 días a temperaturas de 0.4 a -1 °C, presentaron fertilidades cercanas al 70% (13). Estos resultados revelan que bajas temperaturas de conservación a corto plazo son adecuadas para el almacenamiento de oocitos de estas especies cuyo desarrollo embrionario es prolongado (días). En contraste con los resultados previamente enunciados, bajas temperaturas de almacenamiento no se considerarían aptas para la conservación de oocitos de especies tropicales con un rápido desarrollo embrionario. Así mismo, en especies de agua dulce, la disminución de la fertilidad se ha relacionado con el cierre del canal micropilar y en especies marinas esta disminución probablemente está relacionada con la incapacidad de los oocitos para mantener su osmoregulación, debido a inducción de desarrollo partenogénico (8, 9). Oocitos de especies subtropicales y tropicales requieren mayor temperatura y un periodo más corto de almacenamiento que los oocitos de salmónidos. Por otro lado, la sensibilidad de los oocitos al almacenamiento ex situ, también puede variar dependiendo de la especie, el individuo o el patrón de desove (15, 26).
Las reservas energéticas del saco vitelino son necesarias para el desarrollo y sobrevivencia larvaria hasta el inicio de la alimentación exógena (23). Es probable que el menor volumen del saco vitelino (0.356 mm3) mostrado por las larvas obtenidas de oocitos conservados ex situ a temperatura de refrigeración, sea el reflejo de un mayor gasto de estas reservas, lo que pudo haber limitado su sobrevivencia.
En conclusión, en los tres sistemas de conservación estudiados se observó un descenso gradual de la fertilidad de oocitos de yamú, siendo más acentuado cuando fueron conservados bajo condiciones de refrigeración. El porcentaje de fertilidad y de eclosión puede mantenerse durante 1 h bajo conservación in situ o ex situ a temperatura ambiente con resultados satisfactorios. Así mismo, se concluye que el tiempo de almacenamiento y el sistema de conservación afectaron negativamente la calidad y viabilidad de los oocitos y de las larvas obtenidas.
Agradecimientos
Los autores manifiestan su gratitud a Mauricio Medina Robles, por la colaboración en la revisión del manuscrito. Igualmente, al Instituto de Acuicultura de la Universidad de los Llanos (IALL), por el apoyo logístico.
Summary
Effects of the conservation system on eggs fertility of yamú (Brycon amazonicus) during shortterm storage.
The aim of this study was to evaluate the effects of the conservation system on eggs fertility of yamú (Brycon amazonicus) during short-term storage. Mature yamú females and males were induced to stimulated ovulation and spermiation by injection of carp pituitary extract. The eggs obtained from the same female were subjected to three different conservation systems: in situ conservation (IS, in the ovarian cavity), ex situ at room temperature (T°E) and ex situ at refrigeration temperature (T°R). The egg diameter (ED) and egg viability were evaluated at different times of storage (0 - control-, 15, 30, 60 and 120 min). The ED was measured with a rule coupled to the stereomicroscope objective, and the viability was evaluated by fertility test; for this purpose, three g of eggs were inseminated with 250 mL of fresh semen. The total larvae length and the volume of the egg yolk were measured, too. In the three conservation system, the ED increased through the time, being higher than the control (p<0.05) from the 15 min of storage. The highest ED values were observed in eggs storage at TºR (p<0.05). Up to 60 min of storage, in IS and T°E conservation system, the fertilization rate with respect to control did not vary (p>0.05). In all conservation system at 120 min of storage, the fertilization rate was smaller than the control; however, in the TºR conditions the fertilization percentage decreased drastically after 30 min, being smaller (p<0.05) than the control. Although the larvae did not show morphological alterations, the larvae control were longer than the other conservation system (p<0.01). In conclusion, the ovulated eggs of yamú could maintain its viability up to 60 min postovulation in the ovarian cavity or at room temperature. In contrast, the refrigeration produced a drastic reduction of egg fertility in this species.
Key words: eggs, fertility, storage, temperature, yamú.
Referencias
1. Alderdice DF. Osmotic and ionic regulation in teleost eggs and larvae. In: Hoar WS, Randall DJ, editors. Fish Physiology. The Physiology of developing fish, eggs and larvae, vol. 11A. London: Academic Press; 1988. p. 163-251. [ Links ]
2. Arias JA. Biología reproductiva del yamú Brycon siebenthalae (PISCES: CHARACIDAE) bajo condiciones de cautiverio. Tesis de Doctorado, Facultad de Ciencias, Universidad del Valle. Cali. Colombia, 2002. 120 p. [ Links ]
3. Atencio-García VJ. Alguns aspectos da fisiologia do yamú (Brycon siebenthalae, Eigenmann 1912). Revisión teórica acerca de la especie yamú, Universidade Federal de Santa Catarina, Florianópolis. 1999. 20 p. [ Links ]
4. Chao Nai-Hsien, Chiu Liao I. Cryopreservation of finfish and shellfish gametes and embryos. Aquaculture 2001; 197:161-89. [ Links ]
5. Coser AML, Godinho HP. Capacidade de fertilização de ovócitos e sêmen de curimatã-pacú (Prochilodus marggravii) em condições experimentais. In: Associação Mineira de Aquaicultura (AMA), 1987. Resumos dos encontros 1982-87. Brasília: CODEVASF, 1988. p. 112-13. [ Links ]
6. Craik JCA, Harvey SM. Biochemical changes associated with overripening of the eggs of rainbow trout Salmo gairdneri Richardson. Aquaculture 1984; 37:347-57. [ Links ]
7. Cruz-Casallas PE, Pardo-Carrasco SC, Arias-Castellanos JA, Lombo-Castellanos PE, Lombo-Rodríguez DA, et al. Cryopreservation of Yamú Brycon siebenthalae Milt. J. World Aquacult Soc 2004; 35:529-35. [ Links ]
8. Davenport J, Lonning S, Kjørsvik E. Osmotic and structural changes during early development of eggs and larvae of the cod, Gadus morhua L. J Fish Biol 1981; 19:317-31. [ Links ]
9. Dushkina LA. Viability of herring (Clupea) eggs and fertilizing capacity of herring sperm stored under various conditions. J Ichthyol 1975; 15:423-29. [ Links ]
10.Espinach-Ros A, Amutio VG, Mestre Arceredillo JP, Orti G, Nani A. Induced breeding of the South American catfish, Rhamdia sapo (C.& V.). Aquaculture 1984; 37:141-46. [ Links ]
11.Formacion MJ, Hori R, Lam TJ. Overripening of ovulated eggs in goldfish: I. Morphological changes. Aquaculture 1993; 114:155-68. [ Links ]
12.Fortuny A, Espinach Ros A, Amutio VG. Hormonal induction of final maturation and ovulation in the sábalo, Prochilodus platensis Holmberg: Treatments, latency and incubation times and viability of ovules retained in the ovary after ovulation. Aquaculture 1988; 73:373-81. [ Links ]
13.Ginsburg AS. Fertilization in fishes and the problem of polyspermy. Keter Press, Jerusalem (Translated from Russian, available from U.S. Dept. of Commerce, NTIS, Springfield, Virginia). 1972. 253 p. [ Links ]
14.Harvey B, Kelley N. Short-term storage of Sarotherodon mossambicus ova. Aquaculture 1984; 37:391-95. [ Links ]
15.Isayeva A, Zhang T, Rawson DM. Studies on chilling sensitivity of zebrafish (Danio rerio) oocytes. Cryobiology 2004; 49: 114-22. [ Links ]
16.Junqueira CAP. Efeito da temperatura no desenvolvimento inicial de larvas de “Curimbatá” Prochilodus scrofa STEINDACHNER, 1882 (CHARACIFORMES, PROCHILODONTIDAE). Dissertação de Mestrado em Acuicultura. Universidade Federal de Santa Catarina. Brasil. 1999. 83 p. [ Links ]
17.Kjørsvik E, Lønning S. Effects of egg quality on normal fertilization and early development of the cod, Gadus morhua L. J Fish Biol 1983; 23:1-12. [ Links ]
18.Lahnsteiner F, Weismann T. Changes in eggs of brown trout, rainbow trout, and grayling during short-term storage. North Am J Aquacult 1999; 61:213-19. [ Links ]
19.Leung LKP, Jamieson BGM. Live preservation of fish gametes. In: Jamieson BGM, editors. Fish evolution and systematics: evidence from spermatozoa. Cambridge: Cambridge University Press, 1991. p. 245-69. [ Links ]
20.Linhart O, Billard R. Survival of ovulated oocytes of the European catfish (Silurus glanis) after in vivo and in vitro storage or exposure to saline solutions and urine. Aquat Living Resour 1995; 8:317-22. [ Links ]
21.Linhart O, Kudo S, Billard R, Slechta V, Mikodina EV. Morphology, composition and fertilization of carp eggs: a review. Aquaculture 1995; 129:75-93. [ Links ]
22.Liu XH, Zhang T, Rawson DM. Effect of cooling rate and partial removal of yolk on the chilling injury in zebrafish (Danio rerio) embryos. Theriogenology 2001; 55:1719-31. [ Links ]
23.Mommsen TP, Walsh PJ. Vitellogenesis and oocyte assembly. In: Hoar WS, Randall DJ, editors. Fish Physiology. The Physiology of developing fish, eggs and larvae, vol. 11A. London: Academic Press; 1988. p. 347-406. [ Links ]
24.Rizzo E, Godinho HG, Sato Y. Short-term storage of oocytes from the neotropical teleost fish Prochilodus marggravii. Theriogenology 2003; 60:1059-70. [ Links ]
25.Rizzo E. Biologia de ovos de peixes neotropicais de água doce: Estudos comparativo e experimental, com ênfase na análise da superfície e do aparelho micropilar. Tese de Doutorado em Ciências. Universidade Federal de Minas Gerais. Belo Horizonte. Brasil. 2001. 103 p. [ Links ]
26.Stoss J. Fish gamete preservation and spermatozoan physiology. In: Hoar WS, Randall DJ, Donaldson EM, editors. Fish Physiology. Vol. 9B. New York: Academic Press; 1983. p. 305-51. [ Links ]