Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.2 Medellín Apr./June 2006
Efecto de la súper refrigeración sobre la textura de la carne de matrinxã (Brycon cephalus)
Héctor Suárez Mahecha1 MVZ, M.Sc; Sandra C. Pardo Carrasco1 MVZ, PhD; Luiz Henrique Beirão2 Q.F, PhD; Alicia de Francisco2 Biol, PhD; Laura L. Okada Nagaky3 Biol, PhD.
1Centro de Investigación Piscícola, Dpto Ciencias Acuícolas, FMVZ, Universidad de Córdoba, Kra 6 N° 67-103, Montería, Col.
2Departamento de Ciencias de los Alimentos, Universidad Federal de Santa Catarina, Florianópolis, SC (Brasil)
3Departamento de Histologia, Universidade Estadual de São Paulo, Jaboticabal, SP (Brasil)
(Recibido: 11 abril, 2005; aceptado: 19 abril, 2006)
Resumen
Para determinar los mecanismos que causan el ablandamiento post-mortem de la carne del pez matrinxã, fueron observados los cambios en la micro estructura del tejido muscular inmediatamente después de la muerte y después de 12 horas de almacenamiento a –3 °C. Las observaciones realizadas con microscopio electrónico de transmisión, presentan concordancia con los resultados obtenidos en la fuerza de ruptura muscular obtenidos con texturómetro. Los valores de la fuerza de ruptura fueron menores para la carne del matrinxã después de la súper refrigeración. Al mismo tiempo, se observó que las fibras del tejido conectivo pericelular fueron desintegradas. Además, fue observada poca degradación de la línea Z. Se sugiere que el ablandamiento post-mortem de la carne del matrinxã, como efecto de la súper refrigeración, sea debido a la desintegración de las fibras de colágeno en el tejido conectivo pericelular y en menor grado a la degradación de la línea Z.
Palabras clave: Bryconinae, colágeno, tejido conectivo, post mortem.
Introducción
La firmeza es un factor muy importante para evaluar la calidad de la carne de pescado y fundamental en el momento de comercializar los productos de la piscicultura (33). Además, generalmente es aceptado que la carne de diversos peces es afectada por procesos de ablandamiento después de 24 horas de almacenamiento a bajas temperaturas (23, 24, 25).
Para conocer la causa del ablandamiento postmortem en la carne, se han realizado estudios en peces marinos y unos pocos en especies de agua dulce como la carpa Cyprinus carpio, y truchas Oncorhynchus mykiss y Salmo irideus (3).
El colágeno es el mayor constituyente en el tejido conectivo intramuscular de los peces y como ha sido demostrado, ejerce un importante significado en la textura de la carne (17, 31). Estudios histológicos han demostrado que el tejido conectivo pericelular es degradado más intensamente durante el almacenamiento a bajas temperaturas que el tejido conectivo intersticial (11, 14,18).
Actualmente es aceptado que existen distintos colágenos, química y genéticamente diferentes, entre mismos individuos (9). En peces, en el tejido conectivo pericelular es reconocida la existencia de colágeno tipo I, y en mayor proporción colágeno tipo V, este último, sugerido como responsable de la textura post-mortem (29, 30). Según estudios realizados por Ando et al (3); Sato et al (29), realizados con microscopía electrónica de transmisión, determinaron que la fibra de colágeno tipo V presenta menor diámetro, frente a la fibra de colágeno tipo I. También se demostró que el diámetro de la fibra de colágeno diminuye con el incremento del colágeno tipo V (1, 8).
La firmeza del músculo también es un importanteíndice de frescura y el ablandamiento puede ser un parámetro que indique deterioro de la calidad de la carne. En tal sentido es necesario conocer los mecanismos del ablandamiento, para desarrollar métodos que puedan ser utilizados en la piscicultura, con el fin de prevenir este proceso de pérdida de calidad en la textura de la carne. Algunas investigaciones refieren este fenómeno, especialmente en ciertas especies de peces cultivados, más que a especies capturadas en el medio natural (2, 3, 32).
De otra parte la producción de peces de cultivo ha aumentado cada vez más, y el matrinxã es una de las especies que en el Brasil es preferida para este fin (12, 13, 26). Sin embargo, se desconocen las causas del ablandamiento post-mortem durante el almacenamiento a bajas temperaturas de este pez. El objetivo de esta investigación fue establecer la posible desintegración del tejido conectivo pericelular y su relación con la pérdida de textura en matrinxã cuando es sometido a almacenamiento de súper refrigeración.
Materiales y métodos
Para los análisis se utilizaron matrinxãs cultivados en estanques en tierra, donados por el Centro de Acuicultura de la Universidad Estadual de São Paulo (CAUNESP). Se seleccionaron peces de tres tamaños, con peso y longitud estándar de 120g, 230g, 350g y 15cm, 18cm, y 22cm, respectivamente. De cada talla se utilizaron tres peces. Fueron sacrificados por medio de punción cerebral (5) e inmediatamente después, a cada ejemplar se le retiraron muestras del músculo dorsal para los diferentes análisis y lo demás fue empacado en bolsas de polietileno y almacenado a –3 °C durante 12 horas, tiempo propuesto por los autores para conocer si se presenta degradación del colágeno.
Análisis instrumental
La firmeza de la carne fue determinada a nivel del músculo dorsal, siguiendo la metodología descrita por Ando et al (4). Un émbolo cilíndrico de 3mm de diámetro fue forzado a entrar en la muestra de músculo de 10mm de espesor, paralelo a la orientación de las fibras musculares, a una velocidad de 60mm/min, registrando la máxima fuerza de penetración. Los resultados fueron expresados como fuerza a la ruptura, con un promedio de 5 a 8 mediciones por muestra. El texturómetro empleado fue el Texture Analiser TAXT2, (Stabble Micro Sistems, Haslemere, Surrey, UK). Las mediciones fueron realizadas antes y después de la súper refrigeración.
Microscopia electrónica de transmisión (TEM)
Las muestras de músculo dorsal (1mm x 1mm x 5mm) fueron fijadas en glutaraldehído al 2.5% durante 2 horas, lavadas varias veces en tampón fosfato de sodio al 0.1M y pH 7.2; fijadas posteriormente en tetra óxido de osmio al 1%, por 2 horas. Posteriormente, se lavaron en el mismo tampón y se deshidrataron con soluciones de concentraciones crecientes de etanol: 50%, 60%, 70%, 80%, 90%, 100% y 100% por 20 minutos en cada una de estas soluciones. El procedimiento siguiente fue la infiltración, iniciada con la inmersión de las muestras en una mezcal de araldite y etanol puro (1:1) durante 12 horas a temperatura ambiente.
La inclusión fue realizada en mezcla plena de resina araldite. El material incluido fue colocado en la estufa a temperatura de 60 oC por 72 horas, para efectuar la polimerización. Después fueron realizados cortes de 0.3 mm para análisis y selección de las áreas que fueron observadas en microscopia electrónica de transmisión. Los cortes fueron teñidos con azul de toluidina al 1% en ácido bórico saturado. De estas áreas se seleccionaron las mejores para tomar microfotografía con auxilio de foto microscopio. Seguido a este procedimiento, cortes ultrafinos con 70 nm de espesor fueron obtenidos en ultramicrótomo (ULTRACUT-LEICA, Vienna, Austria), con navaja de vidrio, montados en gradas de cobre y contrastados con acetato de uranilo y citrato de plomo. Observados y electromicrografiados en microscopio electrónico de transmisión (JEOL – JEM 1010, New York, USA) con aceleración de 80 kv.
Análisis estadístico
En los valores de textura (fuerza de ruptura) fue realizado un análisis de variancia con posterior prueba de Tukey. El nivel de significancia estadística adoptado fue de p< 0.005.
Resultados
Cambios en la firmeza del músculo
Los resultados de la fuerza de ruptura aparecen descritos en la tabla 1. La firmeza del músculo disminuyó significativamente después de 12 horas de súper refrigeración (p<0.001).
También fueron comparados los resultados de fuerza de ruptura dependiendo del tamaño de los peces utilizados, no encontrando diferencias significativas que pudieran asociar el grado de pérdida de firmeza con el peso de los pescados utilizados. Es posible que con pesos mayores se logre obtener una diferencia estadística significativa.
Observaciones histológicas
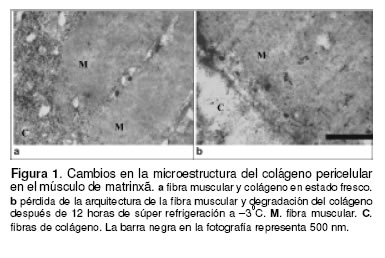
En el músculo inmediatamente después de la muerte (véase Figura 1a), las fibras de colágeno del tejido conectivo pericelular son observados claramente, manteniendo una arquitectura ordenada junto con la fibra muscular. Después de la súper refrigeración durante 12 horas a –3 0C (véase Figura 1b), las fibras del tejido conectivo pericelular fueron desintegradas y se observó una pérdida del arreglo arquitectónico en relación con la fibra muscular.
Por otro lado, no fue observada alteración o degradación en ninguna de las fibras de colágeno en el tejido conectivo del miocommata, después del tiempo de almacenamiento utilizado en este estudio. El diámetro de la fibra de colágeno en el tejido conectivo pericelular estuvo entre 20-28 nm, coincidiendo con otros estudios (3, 29).
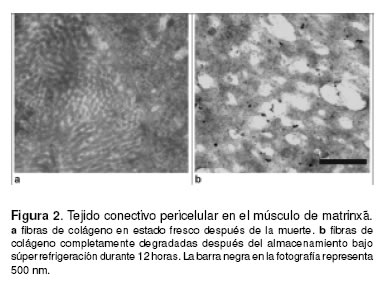
En la Figura 2a puede observarse claramente la simetría de las fibras de colágeno en el tejido conectivo pericelular, inmediatamente después de la muerte. En la Figura 2b, se observa el efecto de la súper refrigeración sobre el tejido conectivo pericelular, observándose que las fibras de colágeno aparecen completamente degradadas y no es posible determinar la simetría de la fibra.
La desintegración de las fibras de colágeno en el tejido conectivo pericelular muestra una evidente relación con la disminución de los valores obtenidos en la fuerza de ruptura en la prueba instrumental, evento conocido como ablandamiento post-mortem. De acuerdo con estos resultados, el ablandamiento post-mortem de la carne de matrinxã podría ser causado por la desintegración de las fibras de colágeno del tejido conectivo pericelular.
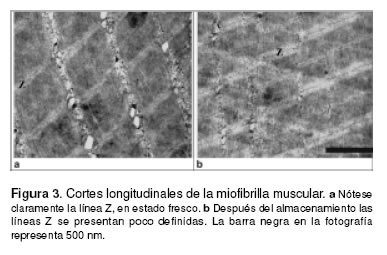
La micro estructura de la fibra muscular es mostrada en la figura 3. En el músculo en estado fresco, la línea Z está localizada en el centro de los filamentos de actina pudiendo ser identificada. Después del almacenamiento, la estructura de la línea Z es difícil de observar y se aprecia pérdida del arreglo arquitectónico.
Discusión
Cambios en la firmeza del músculo
Aunque no existe diferencia estadística significativa, se observa una tendencia en el aumento de la fuerza de ruptura a medida que aumenta el peso del matrinxã (datos no mostrados). Según Love et al (20, 21), el colágeno del miocommata de los peces viejos es más débil y tiene menos enlaces cruzados que el colágeno de los jóvenes. En el presente estudio se utilizaron peces jóvenes, porque el matrinxã alcanza pesos de 3 – 4 kg en el estado adulto (12).
Observaciones histológicas
La micro estructura del músculo del matrinxã fue observada por TEM, y mostrada en las figuras 1 a 3. Las fibras de colágeno en el tejido conectivo pericelular fueron observadas, en las cuales se ha demostrado que mantienen estrecha relación con el ablandamiento post-mortem de la carne de peces almacenados a bajas temperaturas (4, 7, 29).
Durante la manipulación y el almacenamiento bajo súper refrigeración de los peces, la unión de los bloques musculares al miocommata podría fallar, causando el conocido “gaping” o resquebrajamiento (22, 35), y según estos autores, dos tipos de “gaping” son identificados. El primero ocurre durante el congelamiento en estado de rigor mortis, y es atribuido al debilitamiento de las conexiones de colágeno debido a la formación de cristales de hielo. En este estudio, los peces fueron refrigerados en estado de pre rigor. La causa del segundo tipo de“gaping” puede suceder a lo largo del tiempo en peces almacenados.
Hallet y Bremner (10, 14) determinaron que el“gaping” causado por la degradación de las fibras de colágeno entre la fibra muscular y el miocommata, es el responsable por el ablandamiento del músculo de“hoki” Macruronus novaezelandiae. Sin embargo, en estos autores no realizaron pruebas de firmeza en el músculo. Ando et al (4) sugieren que la relación entre “gaping” y ablandamiento del músculo permanece poco clara. Si el “gaping” tiene estrecha relación con el ablandamiento del músculo, este fenómeno en el pez “hoki” sería el causante del ablandamiento relativamente tarde, cuando es comparado con otros peces (2, 25, 29), porque no fueron observados cambios microestructurales en el músculo de “hoki” después de 24 horas de almacenamiento. No obstante, en el presente estudio no se encontraron cambios en las fibras de colágeno del miocommata que puedan relacionar el ablandamiento del músculo del matrinxã a algún tipo de “gaping”.Kumano y Seki (19) mediante pruebas bioquímicas, demostraron la desintegración de los filamentos de conectina, los cuales están compuestos por a-conectina. Estos filamentos son altamente elásticos y conectan las líneas Z con el filamento de miosina. La disminución de a-conectina también se presentó rápidamente cuando el músculo de la carpa (Cyprinus carpio) y de la trucha arco iris (Oncorhynchus mykiss) alcanzaron la temperatura de almacenamiento a –2 0C. Sin embargo, en el músculo de carpa después de la súper refrigeración, los valores de la fuerza de ruptura continuaron disminuyendo, después de haber degradado completamente la a-conectina. No obstante, en el músculo de la trucha arco iris, la fuerza de la ruptura disminuyó más rápidamente que los valores de a-conectina. Estos resultados sugieren que existen otros factores adicionales relacionados con el ablandamiento post-mortem, infortunadamente este estudio no realizó observaciones histológicas. Además, otros autores coinciden en sugerir que los cambios en las fibras de conectina influencian junto con otras posibles alteraciones estructurales en el músculo, como las causas del ablandamiento post-mortem (29, 32). En el presente estudio, no se realizaron pruebas bioquímicas sobre los filamentos de conectina.
De otra parte, ha sido demostrado que el diámetro de la fibra de colágeno en el tejido conectivo pericelular fluctúa entre 20-30 nm y corresponde al colágeno tipo V, presente en mayor cantidad (1, 8, 29), en el ablandamiento post mortem de la carne de diferentes peces. En este sentido, Sato et al (27, 28, 29) proponen al colágeno tipo V como principal constituyente del tejido conectivo pericelular, siendo responsable por el ablandamiento post-mortem. Sin embargo, el motivo por el cual sucede preferentemente la degradación de este colágeno, aún no esta claro, sin embargo se han propuesto algunas hipótesis: Yamashita y Konagaya (34, 35) reportan que la catepsina L fue la responsable por el ablandamiento de la carne de salmón chum (Salmo salar), encontrando fagocitos alrededor de las fibras musculares. En nuestra investigación no se observaron fagocitos alrededor de las fibras de colágeno degradadas en el tejido conectivo pericelular, coincidiendo con Ando et al (3). Otra posible hipótesis, propone que los péptidos que contiene hidroxiprolina, posiblemente como producto de la degradación del colágeno, podrían ser cuantificados y servirían como indicadores de la degradación del colágeno. Sin embargo, Ando et al (3), no encontraron diferencias en los niveles de hidroxiprolina en pescados pelágicos y demersales, porque la molécula de colágeno puede ser degradada en una región donde la hidroxiprolina no está presente. Por otro lado, Kubota et al (21) considera a las metaloproteinasas como responsables por los procesos proteolíticos generando una degradacion de los colágenos tipo I y V.
En lo que tiene que ver con cambios ocurridos en el tejido conectivo como efecto de periodos prolongados de inanición, Bugeon et al (11) encontró aumento del pH post mortem a nivel muscular, disminución de la fibra muscular y mayor contenido de tejido conectivo en miocommata. Después de reiniciar la alimentación no fueron observadas diferencias. El periodo de ayuno influyo en el aumento del peso molecular del colágeno y de la temperatura de galatinización de la piel. Estas diferencias permanecieron constantes después del periodo de alimentación, sin embargo las pruebas reológicas no mostraron diferencia.
Finalmente, Hatae et al (15, 16), sugieren que definitivamente la degradación del colágeno como efecto de la pérdida de textura, sucede más frecuente en peces de cultivo que en aquellos extraídos del medio ambiente. Así mismo que, puedan existir otros factores involucrados en el ablandamiento post-mortem de la carne de matrinxã, por lo que sería conveniente iniciar estudios comparados de especies provenientes de cultivo y de ambiente natural nativas del Brasil.
Conclusión
El ablandamiento de la carne del matrinxã fue causado por la degradación del tejido conectivo pericelular, como efecto de la súper refrigeración a –3 0C durante 12 horas. Las observaciones histológicas coinciden con la pérdida significativa de la textura (p<0.<001), medida en texturómetro.
Summary
Chilling effect on the post-mortem texture of the Matrinxã fish muscle Brycon cephalus
To determine the mechanisms that cause the post mortem muscle softness of the matrinxã, the changes were observed immediately after death in the micro structure of the muscle and after 12 hours of storage at –3 °C. Observations by transmission electron microscope agree with the results obtained noting the breaking strength in the muscle measured with a texturometer. The values of the breaking strength on the fish muscle were smaller after chilling. At the same time, it was observed that collagen fibers in the pericellular connective tissue had disintegrated. On the other hand, no evident breakdown of Z-discs was observed. It is suggested that the post-mortem tenderization of matrinxã muscle during chilled storage was due to the disintegration of collagen fibers in the pericellular connective tissue, and, to a smaller degree, to the weakening of Z-disk.
Key words: Bryconinae, collagen, connective tissue, post mortem.
Referencias
1. Adachi E, Hayashi T. In vitro formation of hybrid fibrils of type V collagen and type I collagen. Conn. Tissue Res. 1986; 14: 257-266. [ Links ]
2. Alasalvar C, Taylor K. D, Shahidi S. Comparative Quality Assessment of Cultured and Wild Sea Bream Sparus aurata Stored in Ice. J. Agri. and. Food Chem. 50, p2039-2045, 2002. [ Links ]
3. Ando M. Softening mechanism of fish meat. Suisangaku Series. Kouseisha Kouseikaku. Tokyo. Japan. 1997; 114: 73-82. [ Links ]
4. Ando M, Nishiyabu A, Tsukamasa Y, Makinodan Y. Postmortem softening of fish muscle during chilled storage as affected by bleeding. J. of Food Sci. 1999; 64 (3): 423-428. [ Links ]
5. Ando M, Toyohara H, Sakaguchi, M. Post-mortem tenderization of rainbow trout muscle caused by the disintegration of collagen fibers in the pericellular connective tissue. Bull. Japan Society Sci. of Fish. 1992; 58: 567-570. [ Links ]
6. Ando M, Toyohara H, Shimizu Y, Sakaguchi M. Validity of la puncture test for evaluating the change in muscle firmness of fish during ice storage. Nippon Suisan Gakkaishi. 1991; 57: 2341. [ Links ]
7. Ando M, Toyonara H, Shimizu, Y, Sakaguchi M. Post-mortem tenderization of rainbow trout (Oncorhychus mykiss) muscle caused by gradual disintegration of the extracellular matrix structure. J. Sci. Food Agri. 1991b; 55: 589-597. [ Links ]
8. Ando M, Yoshimoto Y, Inabu K, Nakagawa T, Makimodan Y. Post-mortem change of three-dimensional structure of collagen fibrillar network in fish muscle pericellular connective tissues corresponding to post-mortem tenderization. Fisheries Sci. 1995; 61: 327-330. [ Links ]
9. Birk DE, Fitch MJ, Babiarz PI. Linsenmyer ET. Fibrogenesis in vitro: interaction of type I and V collagen regulates fibril diameter, J. Cellular Sci. 1990; 95: 649-657. [ Links ]
10. Bornstein H, Sage H. Structurally distinct collagen types, Ann. Rev. Bioche. 1980; 49: 957-1003. [ Links ]
11. Bugeon J, Lefèvre F, Fauconneau B. Correlated changes in skeletal muscle connective tissue and flesh texture during starvation and re-feeding in brown trout (Salmo trutta) reared in seawater. Journal of the Science of Food and Agriculture 2004; 84; 11. 1433-1441. [ Links ]
12. Bremmer AH, Hallet, CI. Muscle fiber-connective tissue junctions in the fish blue grenadier (Macruronus novaezelandiae). a scanning electron microscope study. J. of Food Sci. 1985; 50: 975-980. [ Links ]
13. Bremmer AH, Hallet, CI. Degradation muscle fibre-connective tissue junctions in the Spotted Trevalla (Seriolella punctata) Examined by Scanning Electron Microscopy. J. of Sci. Food and Agri. 1986; 37: 1011-1018. [ Links ]
14. Graef EW, Resende EK, Petry P, Storti Filho A. Policultivo de matrinchã (Brycon sp) y jaraqui (Semaprochilodus sp) en pequenas represas. Acta Amazônica, 1987; 16/17, No.único. 33-42. [ Links ]
15. Guimarães SF, Storti-Filho A. The effects of temperature on survival of young Matrinchã (Brycon cephalus) under laboratory conditions. In: Internacional Symposium Biology of Tropical Fishes, Manaus, AM. Livro de Resumos, 1997; 41. [ Links ]
16. Hallet CI, Bremmer AH. Fine estructure of the myocommata muscle fiber junction in hoki (Macruronus novaezelandie). J. of Sci. Food and Agri. 1988; 44: 245-261. [ Links ]
17. Hatae K, Lee K. H, Tsuchiya T, Shimada A. Textural properties of cultured and wild fish meat. Bull. Japan Society Sci. of Fish. 1989; 55: 363-368. [ Links ]
18. Hatae K, Tamari S, Miyanaga K, Matsumoto J. Species difference and changes in the physical properties of fish muscle as freshness decreases. Bull. Japan Society Sci. of Fish. 1985; 51: 1155-1161. [ Links ]
19. Hatae K, Tobimatsu A, Takeyama M, Matsumoto J. Contribution of connective tissues on the texture difference of varies fish species. Bull. Japan Society Sci. of Fish. 1986; 52: 2001-2007. [ Links ]
20. Kubota S, Sata k, Ohstsuki k, Kawabata M. Degradation de a-connectin in raw fish muscle and softening evaluated by breaking strength occur independently during one chilled storage. Fisheries Sci.1993; 3: 600-602. [ Links ]
21. Kubota M, Kinoshita M, Takeuchi K, Kubota S, Toyohara H, Sakaguchi M. Solubilization of type I collagen from fish muscle connective tissue by matrix metalloproteinase-9 at chilled temperature. Fisheries Scie. 69, 5, p1053-1059, 2003. [ Links ]
22. Kumano Y, Seki N. Change in a-connecting content during storage of iced, frozen, and thawed fish muscle. Nippon Suisan Gakkaishi. 1993; 59: 559-564. [ Links ]
23. Love RM. Biochemical dynamics and the quality of fresh and frozen fish, In: Fish Processing Technology, G. M. HALL. (Eds) Blache Academic G. Prossional. Glasgow (UK) 1992; 1-27. [ Links ]
24. Love RM, Haq M, Smith GL. The connective tissues of fish V. Gaping in cod of different sizes as influenced by la seasonal variation in the ultimate Ph. J. of Food Tech. 1972; 7: 281-290. [ Links ]
25. Love RM, Lavety J, Steel PJ. The connective tissues of fish ll. Gaping in commercial species of frozen fish in relation to rigor mortis. J. of Food Tech. 1969;4: 39-44. [ Links ]
26. Mochizuki S, Sato A. Effects of various killing procedures on post-mortem changes in the muscle of hose mackerel. Bull. Japan Society Sci. of Fish. 1996;.64: 276-279. [ Links ]
27. Montero P, Borderias J. Effect of rigor mortis and ageing on collagen in trout (Salmo irideus) muscle. J. Sci. Food Agri. 1990;.52: 141-146. [ Links ]
28. Oka H, Ohno K, Ninomiya J. Changes in texture during cold storage of cultured yellowtail meat prepared by different killing methods. Bull. Japan Society Sci. of Fish. 1990; 6: 1673-1678. [ Links ]
29. Pezzato LE, Barros MM, Del Carratore CR, Salaro AL, Oliveira MCB. Avaliação do matrinxã (Brycon cephalus) mantidos sob condições de clima sub tropical”, In: Simpósio brasileiro de aqüicultura, 8, Piracicaba. Livro de Resumos.1994; 62. [ Links ]
30. Sato K, Yoshinaka R, Itoh Y, Sato M. Molecular species of collagen in the intramuscular connective tissue of fish. Composition Bioche. and Physiolo. . 1988a; 92B (1): 87-91. [ Links ]
31. Sato K, Yoshinaka R, Sato M, Itoh Y, Shimizu Y. Isolation of types I and V Collagens from carp muscle. Compo. Bioche. and Physio. 1988; 90B (1): 155-158. [ Links ]
32. Sato K, Ando M, Kubota S, Origasa K, Kawase H, et al. Involvement of type V collagen in softening of fish muscle during short-term chilled storage. J. of Agri. Food Chemi. 1997; 45: 343-348. [ Links ]
33. Sato k, Ohashi C, Ohtsuki K, Kawabata M. Type V collagen in trout (Salmo gairdneri) muscle and its solubility change chilled storage of muscle. J. of Agri. Food Chemi. 1991; 39: 1222-1225. [ Links ]
34. Sato K, Yoshimaka R, Sato M, Shimizu Y. Collagen content in the muscle of fishes in association with their swimming movement and meat texture. Bull. Japan Society Sci. of Fish. 1986; 52: 1595-1600. [ Links ]
35. Skjervold P. O, Fjæra S O, Ostby P B, Einen O. Live-chilling and crowding stress before laughter of Atlantic salmon Salmo salar. Aquaculture, 192. p265–280, 2002. [ Links ]
36. Tachibana K, Misima T, Tsuchimoto M. Changes of ultrastructure and cytochemical Mg2+-ATPase activity in ordinary muscle of cultured and wild red sea bream during storage in ice. Bul. Japan Society Sci. of Fish. 1993; 59: 721-727. [ Links ]
37. Toyohara H, Shimizu Y. Relation of the rigor mortis of fish body and the texture of the muscle. Bull. Japan Society Sci. of Fish. 1988; 54:1795-1798. [ Links ]
38. Yamashita M, Kanagaya S. Hydrolytic of salmon cathepsins B and L to muscle structural proteins in respect of muscle softening. Bull. Japan Society Sci. of Fish. 1991a; 57: 1917-1922. [ Links ]
39. Yamashita M, Kanagaya S. Inmunohistochemical localization of cathepsins B and L in the white muscle of chum salmon (Oncorhynchus keta) in spawing migration: Probable participation of fagocytes rich in cathepsins in extensive muscle softening of the nature salmon. J. of Agri. Food Chemi. 1991b; 39: 1402-1405. [ Links ]