Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.3 Medellín July/Sept. 2006
Detección de antígenos de Dirofilaria immitis en caninos del Área Metropolitana del Valle de Aburrá.
Sonia C Orozco1, MV. Esp Clin; María Arango1, est MV; Wilder Cardona1, MV. 1Grupo de Investigación Centauro, Facultad de Ciencias Agrarias, Universidad de Antioquia, AA. 1226, Medellín, Colombia.
panimesp@agronica.udea.edu.co
(Recibido: 24 de octubre, 2005; aceptado: 17 julio, 2006)
Resumen
Con el fin de determinar la presencia o ausencia de antígenos del nemátodo Dirofilaria immitis en caninos del Valle de Aburrá mayores de un año, se muestrearon 300 perros mediante la técnica de inmunocromatografía de flujo lateral. 285 muestras cumplieron los criterios de inclusión y exclusión; de estas, una fue positiva a Dirofilaria immitis. Se correlacionaron las variables de edad, sexo, tipo de alojamiento, desparasitación en los últimos tres meses, historial de viajes y función zootécnica. No se encontró diferencia estadística significativa (p>0.05) entre la positividad a la dirofilariosis y cualquiera de las variables estudiadas. La frecuencia del parásito Dirofilaria immitis en el área Metropolitana del Valle de Aburrá fue del 0.35%, concluyéndose que esta enfermedad no es endémica en el área de estudio.
Palabras clave: diagnóstico, dirofilariosis, nemátodo, parásito, vector.
Introducción
La dirofilariosis es una enfermedad parasitaria causada por el nemátodo Dirofilaria immitis, el cual afecta perros (32, 53), lobos (31, 48, 53), zorros (7, 31, 35), coyotes, gatos domésticos (7, 48, 53) y salvajes (31, 53), pandas rojos (20), osos (20), leones marinos (20, 28, 53), primates no humanos (20) y humanos (7, 28, 52). Esta enfermedad es transmitida mediante la picadura de mosquitos de los géneros Aedes, Culex (29, 34, 39), Anopheles (38, 51, 62), Culiseta (59), Mansonia, Coquillettidia (9, 38), Psorophora (9, 38, 69), Myzorhynchus, Armigeres y Taeniothyncus (48). Los principales mosquitos transmisores son las especies Aedes scapularis, Aedes taeniorhynchus y Culex quinquefasciatus (2, 29, 53), los cuales están reportados en Colombia y particularmente en el departamento de Antioquia (34, 45). El Aedes scapularis está presente en todas las zonas boscosas del departamento de Antioquia, en el municipio de Amalfi y en el nordeste antioqueño (34, 45). El Aedes taeniorhynchus se encuentra en las costas atlántica y pacífica, incluyendo el Golfo de Urabá. El Culex quinquefasciatus se encuentra en todas las zonas de Colombia, ubicadas entre 0 y 2600 m.s.n.m. (34, 45). En el Valle de Aburrá existen el Aedes scapularis y el Culex quinquefasciatus (34, 45).
En Colombia se ha reportado la presencia de D. immitis en caninos en los departamentos de la costa atlántica, la costa pacífica, las regiones oriental y central del país (47), también en el Amazonas (66)y en la población de Santa Fe de Antioquia (65).
En estas dos últimas regiones se han encontrado anticuerpos específicos contra este nemátodo en la población humana (65, 66). Santa Fé de Antioquia es una región rural con vocación turística cercana al Valle de Aburrá frecuentada por numerosos turistas y sus perros
El Valle de Aburrá, ubicado en el departamento de Antioquia (Colombia), está situado a una altitud de 1538 m.s.n.m, posee una temperatura promedio de 24°C y una humedad relativa del 70%; su clima esta clasificado como tipo tropical (24). Este Valle cumple así con las condiciones medioambientales mínimas para el adecuado desarrollo del mosquito vector, de las microfilarias en éste y en consecuencia en el hospedero (32, 47, 57).
En el Valle de Aburrá existen diferentes usos del suelo, algunas zonas están totalmente urbanizadas, otras dedicadas a la industria, también hay zonas campestres que van desde áreas boscosas hasta áreas de agricultura y de ganadería (24). Debido a esta diversidad, se presenta una variación en la temperatura diurna y nocturna (24). En las áreas campestres, en especial en las de cultivo y en las de ganadería, hay una mayor presencia de cuerpos de agua, razón por la que se aumenta la probabilidad de la presencia del mosquito vector y la posibilidad del desarrollo de las larvas en éste y en el hospedero (45, 57, 60).
En el Valle de Aburrá, el número de perros infectados con este parásito podría ser alto debido a la presencia de factores predisponentes como las condiciones climáticas adecuadas para el desarrollo del ciclo vital del parásito en el vector y en el hospedero (31, 60, 63), la existencia de las especies de mosquitos transmisores (34, 45), y la falta de uso del tratamiento profiláctico en caninos. Adicionalmente, en el municipio de Medellín existen reportes de casos que confirman la presencia del parásito; tales como su hallazgo en la necropsia de un perro (42), la identificación incidental de microfilarias en un hemograma (46), una prueba de Knott modificada positiva (46), una prueba positiva de detección de antígenos (3, 46), pudiendo servir estos animales con dirofilariosis como fuente de transmisión.
Otro factor que puede influir en la transmisión de este parásito, es la población canina callejera en el Valle de Aburrá, la cual está en mayor riesgo de infestación por la alta exposición medioambiental (40, 48, 61) y por sus hábitos de alimentación, haciendo que sea frecuente el acceso a zonas de basureros, los cuales están infestados con moscas y mosquitos, favoreciendo así la picadura del vector (32, 48, 61). Esta población puede servir como fuente de infestación para el vector y este último como fuente de transmisión al resto de la población canina.
Los signos clínicos de la dirofilariosis canina se deben al daño causado por los vermes adultos y por las microfilarias (8,23,53). Los gusanos adultos residen principalmente en dichas arterias pulmonares (44, 26, 53), generando daño endotelial de las arterias pulmonares, hipertensión pulmonar (41) y neumonitis alérgica (33). También se producen alteraciones renales (26, 48, 58), dirofilariosis arterial sistémica (21, 25, 28), falla cardíaca e infestaciones ocultas (44, 48, 49). El asentamiento de un número elevado de vermes en la vena cava caudal es causa de un proceso agudo mortal, el cual se denomina síndrome de la vena cava (22, 48, 55); adicionalmente, la muerte de los vermes puede provocar complicaciones por tromboembolización (19, 26, 48). Debido a que la dirofilariosis canina es una enfermedad devastadora y de graves consecuencias en el sistema cardiovascular, debe de prevenirse mediante un tratamiento profiláctico (23, 28, 49), el cual se realiza mensualmente con dietilcarbamacina (26, 28, 49), ivermectina, milbemicina (26, 28, 48), moxidectina (21, 33) o selamectina (44, 37).
Los objetivos de esta investigación fueron: 1) determinar la presencia o ausencia de antígenos del nemátodo D. immitis mediante la técnica de inmunocromatografía de flujo lateral en caninos del Valle de Aburrá mayores de un año, 2) determinar la presencia de antígenos de D. immitis en caninos asintomáticos y con enfermedad clínica, 3) correlacionar las variables de edad, sexo, tipo de alojamiento, historia de viajes y función zootécnica de los caninos positivos a dirofilariosis, mediante la prueba de Chi-cuadrado, 4) establecer la frecuencia del parásito D. immitis en la población canina estudiada. Esta investigación corresponde a un estudio descriptivo.
Materiales y métodos
Animales objeto del estudio
Se obtuvieron muestras de sangre entera de caninos mayores de un año de edad de diferentes zonas del Valle de Aburrá, independientemente de su estado de salud o de enfermedad, plan de inmunización y de desparasitación, motivo de consulta, raza, sexo y función zootécnica. Para establecer el tamaño de la muestra se utilizó el muestreo aleatorio de proporciones con un nivel de confiabilidad del 95% y un error máximo permitido del5%. Seasumióelvalorde0.5comolaproporción de probabilidad de la presencia de antígenos de D. immitis, entendiéndose esto, que existe un 50% de probabilidad para que el resultado de una prueba sea positivo o un 50% para que el mismo, sea negativo. Esta proporción de probabilidad se definió debido a que no existen estudios previos que permitan tener este valor, y de esta manera se puede ampliar el tamaño muestral (Restrepo L, Docente de Estadística de la Facultad de Ciencias Agrarias, 2001). El tamaño definitivo de la muestra fue de 300 animales.
Criterios de inclusión y de exclusión de las muestras procesadas
Se incluyeron en el estudio las muestras de sangre entera, sangre entera con EDTA o con citrato de sodio, de los pacientes que tuvieran completa el cuestionario de la información básica del paciente. Las muestras de sangre podían ser recolectadas de las venas cefálica, yugular o safena y a cualquier hora del día. Las muestras de sangre podían ser depositadas desde la jeringa al orificio indicado en la prueba inmediatamente después de su extracción, o ser depositada en un recipiente con EDTA (ácido etil-diamino-tetra-acético)enunaproporciónde1ml de sangre por 1 mg de EDTA o en un recipiente con citratodesodio,conservandolaproporciónde1mlde éste por 10 ml de sangre. El procesamiento de cada prueba se realizó de acuerdo con los lineamientos establecidos por el laboratorio.
Se excluyeron las muestras de sangre hemolisadas, lipémicas, o con más de un mes de haber sido recolectadas. Adicionalmente, se excluyeron las muestras cuyas encuestas no estuvieron completamente diligenciadas.
Distribución de las pruebas
Se seleccionaron de manera aleatoria 20 centros veterinarios localizados en el área metropolitana del Valle de Aburrá, de los 113 registrados en el directorio telefónico del año 2001. Estos fueron enumerados del 1 al 113 para no conocer su nombre y mediante una selección al azar, de boletas marcadas, se obtuvieron los 20 centros veterinarios. En cada centro veterinario se muestrearon 15 perros, siguiendo los criterios de que fueran mayor o igual a un año de edad, independiente a su estado de salud o de enfermedad, plan de inmunización y de desparasitación, motivo de consulta, raza, sexo y función zootécnica. El orden de muestreo en cada centro veterinario fueron los primeros 15 mascotas que cumplieran los criterios de inclusión, y que su propietario aceptara mediante consentimiento escrito para la toma de las muestras sanguíneas. Se capacitaron a los Médicos Veterinarios en el manejo, procesamiento de la prueba y sobre la manera de recopilar la información necesaria para la encuesta.
En cada centro veterinario se entregaron pruebas y jeringas necesarias para la toma de la muestra. La encuesta identificaba al Médico Veterinario responsable y la información relacionada de cada perro muestreado: nombre, edad, raza, sexo, tipo de alojamiento, historia de viajes, medicación antiparasitaria en los últimos tres meses, función zootécnica, motivo de consulta, signos clínicos y resultado de la prueba.
Examen clínico
Los signos clínicos que se consideraron compatibles con dirofilariosis canina fueron: tos, disnea, intolerancia al ejercicio, sonidos anormales en los campos pulmonares, cardiomegalia, efusión pleural, ascitis, cianosis, hipertensión pulmonar, proteinuria de moderada a severa (100 a 2.000 mg/ dl), neumonitis alérgica, claudicaciones y alteración de los sonidos cardíacos.
Técnica de Inmunocromatografía de Flujo Lateral
La técnica de inmunocromatografía de flujo lateral tiene una membrana de nitrocelulosa, la cual permite visualizar la reacción antígeno-anticuerpo por la acumulación de oro coloidal conjugado, donde se han fijado previamente los anticuerpos de captura específicos de D. immitis. Si el antígeno está presente en la muestra, la solución de la prueba presenta una reacción de color rosa intenso generada por el oro coloidal conjugado, lo cual indica que el resultado del examen es positivo. La prueba tiene un formato individual por lo que no permite realizar un control negativo y positivo en cada procesamiento, pero tiene una medida de seguridad para las muestras indebidamente procesadas, donde si no aparece ninguna línea en la ventana o si aparece una sola línea en el lado derecho de la ventana, estas muestras deberán ser repetidas. La prueba (Laboratorio Symbiotics, Merial Colombia SA) utilizada detecta antígenos mediante la técnica de inmunocromatografía de flujo lateral, permitiendo el procesamiento intrahospitalario inmediato (30).
Análisis estadístico
Mediante la prueba de Chi-cuadrado se correlacionaron las variables edad, raza, sexo, tipo de alojamiento, historia de viajes, desparasitaciones en los últimos tres meses y función zootécnica. Adicionalmente, mediante un análisis estadístico descriptivo se evaluaron estas mismas variables. Por último, se estableció la frecuencia del parásito D. immitis en la población canina estudiada mediante la correlación de proporciones.
Resultados
Del total de las 300 muestras tomadas, sólo se procesaron 285, las restantes no cumplieron algún criterio de inclusión, o cumplían con algún criterio de exclusión.
Solamente en uno de los 285 pacientes se obtuvo un resultado positivo a la presencia de antígenos mediante la técnica de inmunocromatografía de flujo lateral. La encuesta diligenciada lo identificó como un Pastor Alemán, macho de 3 años de edad, que habitó el 80% del tiempo en San Andrés Isla y con historial de viaje al territorio continental colombiano, específicamente al Valle de Aburrá. Su hábitat en ambas localidades correspondía a un apartamento, cuyo fin zootécnico como animal de compañía. Había sido desparasitado en los últimos tres meses con pamoato de pirantel y prazicuantel. El motivo de consulta en el centro veterinario se debía a anorexia, pérdida de peso progresiva, jadeo constante y debilidad generalizada. Los signos clínicos encontrados por el MédicoVeterinario fueron: edema demiembros anteriores, intolerancia al ejercicio, baja condición corporal, ruidos respiratorios y cardíacos anormales.
Del total de animales muestreados, 146 fueron hembras (51%) y 139 machos (49%). No se encontró diferencia estadística significativa (p>0.05) para la positividad de las muestras analizadas (véase Tabla 1).
De las 285 muestras, 157 perros estaban en el rango de edad de uno a cuatro años (55%), 71 estaban en el rango de cinco a siete años (25%), 51 en el rango de más de ocho años (18%). A seis perros no se les conocia la edad (2%). No se encontró una correlación significativa (p>0.05) para la positividad de las muestras analizadas (véase Tabla 1).
Con respecto al hábitat de los animales el 53% de los animales vivía en casa, el 10% en apartamento, el 20% en finca, el 2% permanecía la mayor parte del tiempo en guardería, el 14% en albergues y para un perro (0.4%) no se especificó el hábitat. No se encontró correlación significativa (p>0.05) entre el hábitat y la positividad a la dirofilariosis (véase Tabla 1).
En relación al propósito de tenencia o función zootécnica de los caninos, el 71% de los pacientes eran animales de compañía, el 9% guardianes o perros de trabajo, el 5% de exposición y para un 14% no se especificó el propósito, debido a que eran perros de albergue. No se halló interdepencia significativa (p>0.05) entre la positividad a la dirofilariosis y el propósito o función zootécnica de los perros muestreados (véase Tabla 1).
Cuando se analizaron los hábitos de viaje de los caninos, se halló que un 70% de ellos permanecían dentro del área metropolitana del Valle de Aburrá, un 28% tenian historial de viaje, y de un 2% no se conocía si se desplazaban fuera del Área Metropolitana. Esto sugiere que un 28% de los pacientes muestreados estaban potencialmente en riesgo de ser infestados si llegaran a viajar a poblaciones endémicas, y consecuentemente cumplir con la función de hospedero reservorio. Es importante anotar que ninguno de los pacientes muestreados tenian vigente un plan profiláctico para evitar la microfilaremia. No se halló una correlación significativa (p>0.05) entre la positividad a la dirofilariosis y el hábito de viaje (véase Tabla 1).
Tabla 1. Resultado de la correlación mediante la prueba de Chicuadrado de las variables establecidas.
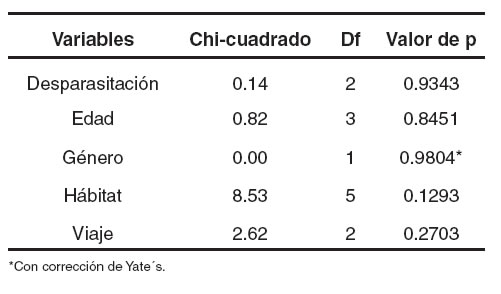
En lo referente al uso de antiparasitarios, 251 perros habían recibido algún antiparasitario en los últimos tres meses (88%), 30 no lo habían recibido (11%) y cuatro de los propietarios no respondieron (1%). En el hábito de desparasitación, no se halló interdependencia (p>0.05) a la positividad a la dirofilariosis (véase Tabla 1).
Finalmente, un total de 40 razas se incluyeron en el estudio, donde las más representadas, es decir aquellas que contaban con más de tres caninos en el estudio fueron en su orden: Mestizos (19%), Poodle (16%), Labrador (12%), Rottweiller (8%), Bóxer (7%) y Pasto Alemán (4%). Las razas que tuvieron tres ejemplares fueron: Fox terrier pelo duro, Cocker Spaniel, Weimaraner, Fox terrier pelo liso, Pastor Belga y Golden Retriver. Las que tuvieron dos ejemplares fueron: Bull Terrier, Shar Pei, San Bernardo, Pekinés, Yorkshire Terrier, Bull Mastif, Pastor Collie, Dálmata y las razas que tuvieron un sólo ejemplar fueron el Ovejero Inglés, Mastin Napolitano, Pomerania, Samoyedo, Shit-zu, Galgo Afgano, Gran Danés, Airdale Terrier, Chihuahueño, Fila Brasilero, Rhodesian Ridgeback, Pug. No se pudo establecer si existía alguna predisposición racial para desarrollar dirofilariosis canina (23, 26).
Discusión
Es importante resaltar que el único resultado positivo fue un perro macho de la raza Pastor Alemán de tres años con historial de viajes, donde el 80% del año permanecía en la isla de San Andrés, viajando ocasionalmente al territorio continental colombiano. Este paciente se encontraba en el Valle de Aburrá para atención médica debido a los signos clínicos que presentaba. Los dueños de esta mascota no conocían la trascendencia de la dirofilariosis sobre la salud de su mascota ni sobre la salud humana, por lo cual nunca implementaron un tratamiento profiláctico, ni sabían sobre las implicaciones de la movilización de éste a diferentes ciudades o países. Hasta el presente, no se tienen reportes de la frecuencia de la dirofilariosis canina en la Isla de San Andrés, siendo este un factor por el cual no se tienen medidas sanitarias, profilácticas ni programas de sensibilización para esta enfermedad.
De las 285 muestras de sangre de caninos incluidos en este estudio, el 28% de los perros muestreados viajan frecuentemente fuera del área Metropolitana, aunque no se estipuló en la encuesta a qué regiones; algunos propietarios viajaban con sus mascotas a áreas geográficas reportadas como endémicas, tales como Santa Fé de Antioquia (65) y Sur de la Florida (69), sin que los dueños tomaran medidas profilácticas para evitar la microfilaremia en ellos.
El paciente positivo en este estudio fue macho, se ha observado la tendencia a que los perros de género masculino esten más expuestos al medio ambiente, mientras que las hembras permanecen más en el interior de las viviendas, conllevando entonces a que los machos estén más predispuestos a la picadura del mosquito, por manejo más que por predisposición del género (67). A pesar de la diferencia en el manejo según el género, ni Montoya et al (40) en España ni Fan et al (17) en Taiwan hallaron diferencia estadística en la predisposición a la positividad en machos o en hembras.
Los alrededores de un domicilio constituyen un factor que influye sobre la posible infestación, y particularmente los animales que viven cerca del mar, en zonas boscosas o de cuerpos de agua están más predispuestos a sufrir picaduras del mosquito vector (67), tal como ocurrió en este caso. El paciente positivo, a pesar de vivir en un apartamento, estaba en cercanía al mar y a piscinas, que favorecen la formación de pequeños charcos o cuerpos de agua, sitios ideales para la reproducción y crecimiento de larvas, conllevando a que los mosquitos hembra esten en mayor abundancia, por lo que este paciente se encontraba altamente predispuesto a la picadura de mosquitos (62).
La presencia de antígenos en este paciente, las condiciones medioambientales y la presencia del mosquito vector sugieren que la Isla de San Andrés pueda ser una zona endémica para la dirofilariosis canina, quedando esto por confirmar en el futuro mediante un adecuado estudio epidemiológico.
La edad del paciente positivo no coincidió con lo descrito por Fan et al (17) y Montoya et al (40), quienes reportan que a mayor edad, mayor es el número de pacientes seropositivos (17, 40). Debido a que sólo se encontró una muestra positiva es difícil determinar que la enfermedad no se comportó según lo reportado por los autores. En este estudio no se hallaron antígenos del parásito en los perros guardianes, ni en los de albergue o los que están permanentemente en guardería, a pesar de su mayor exposición al medio ambiente, lo cual ha sido reportado como un importantefactorderiesgo(40,48,61).Cabeanotar que los 20 centros veterinarios participantes en la investigación reciben pacientes procedentes de los diferentes estratos socioeconómicos, entre ellos, perros de albergues como los de la Sociedad Protectora de Animales y los de la Universidad de Antioquia.
Es importante tener en cuenta que el 88% de los caninos muestreados habían sido desparasitados en los últimos tres meses, algunos propietarios reportaron como productos utilizados, la ivermectina, el pamoato de pirantel y el prazicuantel. De los antiparasitarios, la ivermectina fue el más usado, correspondiendo a un 14.4%. El empleo de ivermectina, milbemicina (10, 15) y moxidectina (21, 33) previenen la maduración de los estados larvarios de D. immitis evitando llegar hasta el estado adulto del parásito (10, 15, 21). Como microfilaricidas también está reportado el levamisol (28) y el uso de tetraciclinas (5, 54). Esto hace pensar que los propietarios que suministraron a su mascota este tipo de fármacos contra el parasitismo gastrointestinal pudieron haber disminuido de forma involuntaria la microfilaremia, en los casos que esta fuese existente (10, 26, 53). Se describe que el manejo de milbemicina e ivermectina durante seis meses disminuyen los niveles de microfilarias, en algunos casos hasta cero y en otros hasta niveles no detectables, pero al ser retirado el producto las filarias aumentan nuevamente de forma paulatina (10); no se conocen los efectos del uso contínuo de levamisol (28) ni de las tetraciclinas (5, 54). Esta situación genera entonces infestaciones ocultas, las cuales pueden ser amicrofilarémicas con presencia de parásitos adultos (10, 27) causadas por una reacción inmune del hospedero que destruye las microfilarias (26), o por la presencia de parásitos estériles o de parásitos inmaduros, es decir por una infestación prepatente (26, 60).
El uso indiscriminado de los antiparasitarios ya mencionados, tanto por parte de los Médicos Veterinarios como por los propietarios, hace probable que se realice un control involuntario de la enfermedad, o cree la situación de dirofilariosis oculta. Por lo tanto, las pruebas diagnósticas basadas en la visualización de las microfilarias arrojarían falsos negativos en este tipo de situaciones (15, 44, 26), por lo que no estan indicadas en poblaciones que usan de forma indiscriminada antiparasitarios (15); por esta razón en este estudio se utilizó una prueba serológica. También es posible que en las infestaciones ocultas sólo estén presentes machos adultos del parásito, no siendo estos detectados por las pruebas serológicas (27), ya que el útero gestante de las hembras es el productor de antígenos (10, 14).
La dirofilariosis oculta genera entonces la posible existencia de falsos negativos en este estudio. Según reporta la literatura, aproximadamente entre un 10 y un 20% de perros infectados son amicrofilarémicos (53), aunque esto varía según las características de las poblaciones y las técnicas utilizadas (12). Sin embargo, los autores de este artículo, consideran que este factor no es el responsable de la baja frecuencia encontrada en el área metropolitana del Valle de Aburrá, siendo poco probable que los 284 perros restantes padecieran de dirofilariosis oculta. Los resultados de esta investigación, sugieren que en el Valle de Aburrá no se rúnen todos los factores necesarios para que los mosquitos cumplan la función de vector.
Secundariamente, las pruebas serológicas basadas en la detección de antígenos no identifican a los pacientes que estuvieron expuestos al nemátodo a diferencia de las pruebas basadas en la detección de anticuerpos. El perro produce anticuerpos antiadultos y antimicrofilarias siendo la inmunoglobulina E la más específica, encontrándose en sueros desde dos semanas hasta un año después de la infección. Pero debido a la alta inducción de inmunidad duradera con un sólo contacto, este tipo de prueba presenta un alto porcentajedefalsos positivos, siendo entonces poco confiable para detectar pacientes con dirofilariosis canina; adicionalmente, puede tener reacciones cruzadas con el nemátodo Dipetalonema repens (4, 18,53). Por lo tanto, es probable que el tipo de prueba utilizado en este estudio, no haya detectado perros que tuvieron microfilaremia o gusanos adultos, y que por destrucción inmunológica o por tratamiento antiparasitario en el momento del muestreo, no estuvieron infestados con alguna forma de D. immitis.
La Asociación Americana de Dirofilariosis (American Heart worm Society) recomienda utilizar como prueba inicial las de detección de antígenos (12, 15, 27), debido a la poca sensibilidad de las que detectan anticuerpos (4, 18, 26) y microfilaremia (10). El tipo de prueba utilizada en este estudio se basa en la inmunocromatografía lateral, la cual posee una sensibilidad y especificidad respectivamente del 71 y 94%, según Courtney CH et al (11, 13), los cuales han comparado cuatro pruebas de uso intrahospitalario que detectan antígenos, estando incluida la usada en este estudio, y dos pruebas que detectan antígenos con formato de pozuelos. Dichos investigadores concluyeron que las pruebas basadas en la técnica de ELISA, independiente del formato, son más sensibles que las basadas en la inmunocromatografía de flujo lateral, pero no encontraron diferencia estadÍstica en la sensibilidad entre las pruebas evaluadas (11). Las pruebas serológicas tienen una probabilidad muy baja de obtener falsos positivos, en especial cuando las muestras sanguíneas no están lipémicas ni hemolisadas (64). Estas pruebas pueden arrojar falsos negativos cuando existen infestaciones exclusivas de machos adulto, y en infestaciones prepatentes debido a que no se produce suficiente antígeno hasta seis meses después de la infección, cuando los gusanos hembras han alcanzado la madurez reproductiva (27). Adicionalmente, Tarello (56), Wang (68) y Theis (64) sustentan que los falsos negativos pueden ser más frecuentes en las regiones no endémicas, teniendo dos posibles causas: una alta frecuencia de un bajo número de parásitos adultos, ya sean machos o hembras, y la ausencia de microfilaremia (dirofilariosis oculta) (56, 64, 68). Por lo tanto, los autores Tarello (56) y Theis (64) recomiendan que en regiones identificadas como no endémicas, tal como el área involucrada en este estudio, se deben conjugar las pruebas serológicas con las de visualización directa de microfilarias, ya sea por la prueba de Knott modificado o por pruebas de concentración.
Aunque el procesamiento de las muestras por diferentes operarios pudo influir en los resultados del estudio, nosotros consideramos que esto no ocurrió, debido a que el protocolo de la prueba es sencillo de efectuar, requiriendo sólo una gota de sangre entera con EDTA, o con citrato de sodio tomada directamente desde el tubo de recolección o desde la jeringa e inmediatamente colocada en el orificio indicado de la prueba. La prueba tiene una medida de seguridad para las muestras indebidamente procesadas, cuando no aparece ninguna línea en la ventana o si aparece una sola línea en el lado derecho de la ventana, estas muestras deberán de ser repetidas. Ninguna muestra procesada en esta investigación tuvo que ser repetida por esta razón.
La baja frecuencia de animales positivos para antígenos de D. immitis en este estudio, nos hacen cuestionar sobre cuál es el eslabón que se rompe en la triada vector-parásito -hospedero en el Valle de Aburrá. En cuanto al vector, existen referencias que confirman la presencia de los mosquitos Aedes scapularis, Aedes taeniorhynchus y Culex quinquefasciatus en este Valle.
Inclusive los Culex son endémicos en el Valle de Aburrá, ellos estan omnipresentes en sitios de aguas retenidas y en sitios donde existen malos hábitos higiénicos (34, 45). En cuanto al parásito, existen reportes de perros infestados, generándose la posibilidad de que estos cumplan la función de reservorios (3, 42, 46). En cuanto al hospedero, en el valle existe una alta población canina callejera, los cuales están en mayor exposición medioambiental, y que por sus hábitos de alimentación frecuentan zonas de basureros, los cuales están infestados con moscas y mosquitos, favoreciendo así la picadura del vector y la posible transmisión del parásito. Adicionalmente, en la región de estudio existen las condiciones climáticas adecuadas para el desarrollo del parásito en el vector (32, 47, 57), por tanto se esperaba que la frecuencia de la D. immitis no fuera tan baja como la hallada de 0.35%.
En el área Metropolitana del Valle de Aburrá se encontró una frecuencia de Dirofilaria immitis del 0.35%, frecuencia bastante baja teniendo en cuenta que existen varias condiciones necesarias para que la dirofilariosis canina sea endémica. No se encontró correlación (p>0.05) con las variables sexo, edad, propósito, hábitat y hábitos de viaje con la positividad de las muestras analizadas. Los signos clínicos que manifestaba el paciente positivo a dirofilariosis: intolerancia al ejercicio, disnea, ascitis, sonidos anormales de los pulmones y cardíacos, son todos compatibles con insuficiencia cardíaca congestiva consecuente por vermes en arterias pulmonares y en corazón.
Es indispensable continuar la vigilancia epidemiológica de la presencia de la D. immitis en el área de estudio, para así poder tomar medidas sanitarias, de manejo y profilácticos en caso dado de que la prevalencia de este parásito cambie. Para los autores es importante que sea evaluada la función vectorial, ya que sólo así se podría entender la ausencia de D. immitis en el área Metropolitana del Valle de Aburrá, y determinar si este parásito podría llegar a establecerse en el área de estudio, convirtiéndose en una amenaza para los perros, gatos e inclusive hasta para las personas.
Agradecimientos
Los autores dan sus agradecimientos a los Médicos Veterinarios que colaboraron tomando las muestras a sus pacientes y a Laboratorios Merial por su aporte con las pruebas de Witness®.
Summary
Detection of Dirofilaria immitis Antigens in dogs from the Metropolitan area of the Aburra Valley Our goal was to determine the presence or absence of the nematode Dirofilaria immitis in over-one-year old dogs of the Metropolitan area of the Aburra Valley. 300 dogs were tested with an inmunochromatography lateral flow kit. 285 samples fulfilled the inclusion and exclusion criteria, finding only one dog positive. It was concluded that this disease is not endemic in the studied area.
Key words: diagnosis, dirofilariosis, nematode, parasite, vector.
Referencias
1. Acevedo RA. Potential vector of Dirofilaria immitis in San Mateo Co, California. Mosquito News 1982; 42:272-4. [ Links ]
2. Ahid SM, Lorenço-de-Oliveira R. Mosquitos vetores potenciais de dirofilariose canina na Regiao Nordeste do Brasil. Rev Saude Publica 1999; 33:560-5. [ Links ]
3. Alzate G. Entrevista personal. Profesor de Medicina Veterinaria Facultad de Ciencias Agrarias. Médico Veterinario. Abril 2002. [ Links ]
4. Arias SP, Monsalve RE. Estudio serodiagnóstico de dirofilariasis canina en una población cautiva de la sociedad protectora de animales de Medellín. Trabajo de Grado, Facultad de Ciencias Agrarias, Universidad de Antioquia, Medellín, 1998. 41p. [ Links ]
5. Bandi C, McCall JW, Genchi C, Corona S, Venco L, Sachi L. Effects of tetracycline on the filarial worms Brugia pahangi and Dirofilaria immitis and their bacterial endosymbionts Wolbachian. Int J Parasitol 1999; 29:357-64. [ Links ]
6. Bautista, CR, Arroyo M, Velasco O, Canto L. Comparación de las pruebas quantitative buffy coat, frotis grueso de sangre y observación directa para el diagnóstico de la infección por Dirofilaria immitis en perros de tres zonas geográficas de México. Vet México 2001; 32:153-6. [ Links ]
7. Bielawski BC, Harrington D, Joseph E. A solitary pulmonary nodule with zoonotic implications. Chest 2001; 119:1250-2. [ Links ]
8. Calvert AC, Rawlings AC. Tratamiento de la dilofilariasis en el perro. Canine Practice 1993; 18:110-6. [ Links ]
9. Carvalho de Macêdo F, Labarthe N, Lourenço-de-Oliveira R. Susceptibility of Aedes scapularis (Rondani, 1848) to Dirofilaria immitis (Leidy, 1856), an Emerging zoonosis. Mem Inst Oswaldo Cruz, Rio de Janeiro 1998; 93:435- 7. [ Links ]
10. Courtney CH, Zeng QY, Maler MM. The Effect of Chronic Administration of Milbemycin Oxime and Ivermectin on Microfilaremias in Heartworm-Infected Dogs. En: Seward, R.L. and Knight, D.H. (eds.) Recent Advances in Heartworm Disease: Symposium ‘98. Am Heartworm Soc 1999; 193- 9. [ Links ]
11. Courtney CH, Zeng QY. Comparison of heartworm antigen test kit performance in dogs having low heartworm burdens. Vet Parasitol 2001; 96:317-22. [ Links ]
12. Courtney CH, Zeng QY. Relationship between microfilaria count and sensitivity of the direct smear for diagnosis of canine dirofilariosis. Vet Parasitol 2001; 94:199-204. [ Links ]
13. Courtney CH, Zeng QY. Sensititvity and Specificity of Two Heartworm Antigen Test. Canine Practice 1995; 20:15-17. [ Links ]
14. Courtney CH, Zeng QY. Sensititvity and Specificity of Two Heartworm Antigen Test. Canine Practice 1993; 18:20-22. [ Links ]
15. Courtney CH. Guidelines for The Use of Parasitologic and Serologic Screening for Heartworm Infection. En: Knight, D.H. (ed.) Proceedings of the Heartworm Symposium ‘92, Am Heartworm Soc 1993. [ Links ]
16. Echeverri A, Long RF, Check W, Burnet CM. Pulmonary dirofilariasis. Annals Thoracic Surg 1999; 67:201-2. [ Links ]
17. Fan CK, Su KE, Lin YH, Liao CW, Du WY, Chiou HY. Seroepidemiologic survey of Dirofilaria immits infection among domestic dogs in Taipei city and mountain aboriginal districts in Taiwain (1998-1999). Vet Parasitol 2001; 102:113-20. [ Links ]
18. Frank GR, Mondesire RR, Brandt KS, Wisnewski. Antibody to the Dirofilaria immitis aspartyl inhibitor homologue is a diagnostic marker for feline heartworm infections. J Parasitol 1998; 84:1231-6. [ Links ]
19. Frank JR, Nutter FB, Kyles AE, Atkins CE, Sellon RK. Systemic arterial dirofilariasis in five dogs. J Vet Intern Med 1997; 11:189-94. [ Links ]
20. Gamble KC, Fried JJ, Rubin GJ. Presumptive dirofilariasis in a pale-headed saki monkey (Pithecia pithecia). J Zoo Wildl Med 1998; 29:50-4. [ Links ]
21. Genchi C, Poglayen G, Kramer LH, Venco L, Agostini A. Efficacy of moxidectin for the prevention of adult heartworm (Dirofilaria immitis) infection in dogs. Parassitologia 2001; 43:139-41. [ Links ]
22. Goggin JM, Biller DS, Rost CM, DeBay BM, Ludlow CL. Ultrasonographic identification of Dirofilaria immitis in the aorta and liver of a dog. J Am Vet Med Assoc 1997; 210:1635-7. [ Links ]
23. Grubissich JA. Dirofilariasis Canina. Holliday News 1999; 2:8-12. [ Links ]
24. Instituto de Hidrología, Metereología y Estudios Ambientales de Colombia (IDEAM). URL: http://www.ideam.gov.co [ Links ]
25. Juárez BF, Silva HG, Lopez BM, Gaxiola CS, Carcamo AN, Quintero MMT. Larvas de Dirofilaria immitis como hallazgo incidental en punciones con aguja delgada en canideos. En: Memorias del VII Congreso Nacional de Patología Veterinaria, México, 1998. [ Links ]
26. Kittleson MD, Kienle RD. Heartworm infestation (Dirofilariasis). En: Kittleson MD, Kienle RD. Small Animal Cardiovascular Medicine, vol 1, St. Louis, Mosby, 1998; 370-401. [ Links ]
27. Knight DH. Actualización de TV: Pruebas para gusano del corazón y prevención en caninos. En: Bonagura JD. Kirk Terapéutica Veterinaria de pequeños animales, vol II, XIII ed. Madrid, McGraw Hill Interamericana 2001; 830-5. [ Links ]
28. Knigth, D. Heartworm infection. Vet Clin North Am Small Animal Practice 1987; 17:1463-519. [ Links ]
29. Labarthe N, Serrão ML, Melo YF, de Oliveira SJ, Lourençode- Oliveira R. Potential vectors of Dirofilaria immitis (Leidy, 1856) in Itacoatiara, Oceanic Region of Niterói Municipality, State of Rio de Janeiro, Brazil. Mem Inst Oswaldo Cruz, Rio de Janeiro 1998; 93:425 -32. [ Links ]
30. Laboratorio Symbiotics, Merial Colombia SA. Inserto de la prueba. Witness®. [ Links ]
31. Lai CH, Tung KC, Ooi HK, Wang JS. Competence of Aedes albopictus and Culex quinquefaciatus as vector of Dilofilaria immitis after blood meal with different microfilarial density. Vet Parasitol 2000; 90:231-7. [ Links ]
32. Lai CH, Tung KC, Ooi HK, Wang JS. Suceptibility of mosquitoes in central Taiwan to natural infections of Dirofilaria immitis. Med Vet Entomol 2001;15:64-7. [ Links ]
33. Lok JB, Knight DH, Wang GT, Doscher ME, Nolan TJ, Hendrick MJ, Steber W, Heaney K. Activity of an inyectable, sustained-release formulation of moxidectin administered prophilactically to mixed-breed dogs to prevent infection with Dirofilaria immitis. Am J Vet Res 2001; 62:1721-6. [ Links ]
34. López Y. Entrevista personal. Profesora Bacteriología Universidad de Antioquia, Ex funcionaria Laboratorio Departamental Sección Entomología. Medellín, 20 Marzo, 2002. [ Links ]
35. Marks CA, Bloomfield TE. Canine heartworm (Dirofilaria immitis) detected in red foxes (Vulpes vulpes) in urban Melbourne. Vet Parasitol 1998; 78:147-54. [ Links ]
36. McGonigle S, Yoho E, James E. Immunisation of mice with fractions derived from the intestines of Dirofilaria immitis. Int J Parasitol 2001; 31:1459-66. [ Links ]
37. McTier TL et al. Prevention of experimentally induced heartworm (Dirofilaria immitis) infections in dogs and cats with a single topical application of selemectin. Vet Parasitol 2000; 91:259-68. [ Links ]
38. Mendes SM, Silva PS, Lourenço de Oliveira R. Vector Competence of Culex quinquefasciatus Say from Different Regions of Brazil to Dirofilaria immitis. Mem Inst Oswaldo Cruz 2000; 95:769-75. [ Links ]
39. Miranda ML, Reyes DF, Núñez OL, Hernández GJ. Determinación de dirofilariasis en Xochimilco. Rev AMMVEPE 2000;11:12-15. [ Links ]
40. Montoya JA, Morales M, Ferrer O, Molina JM, Corbera JA. The prevalence of Dirofilaria immitis in Gran Canaria, Canary Islands, Spain (1994-1996). Vet Parasitol 1998; 75:221-6. [ Links ]
41. Muponamunda M, Williams JF, Mackenzie CD, Kaiser L. Dirofilaria immitis: heartworm infection alters pulmonary artery endothelial cell behavaior. Am Physiol Society 1997; 389-98. [ Links ]
42. Naranjo R. Entrevista personal. Médico Veterinario. Abr. 2002. [ Links ]
43. Narine K, Brennan B, Gilfillan I, Hodge A. Pulmonary presentation of Dirofilaria immitis (canine heartworm) in man. Eur J Cardiothorac Surg 1999;16 :475 -7. [ Links ]
44. Nelson CT. 2005 Guidelines for the diagnosis, prevention and management of heartworm (Dirofilaria immitis) infection in dogs. American Heartworm Society 2005.; URL: http://www.heartwormsociety.org [ Links ]
45. Olano V. Comunicación personal. Entomólogo Instituto Nacional de Salud. Medellín. 11 Abr., 2002. [ Links ]
46. Orozco S. Entrevista personal. Profesora Medicina Veterinaria, Universidad de Antioquia. Medellín, 8 Abril, 2002. [ Links ]
47. Parker BM. Density and distribution of Dirofilaria immits (Nematoda: Filarioidea) third stage larvae in Aedes sollicitans and Aedes taenorinchus (Diptera: Culicidae). J Med Entomol 2000; 37:695-700. [ Links ]
48. Patiño F, Uribe LF, Mendoza JT, Guerrero J, Newcomb KM. Levantamiento de la frecuencia del parásito del corazón (Dirofilaria immitis) en la población canina colombiana. MSD AGVET Merial 1989; 1-5. [ Links ]
49. Pérez G, Rosa A, Ribicich M, Meyer P, Welch E, Casalonga O, Reino P. Dirofilariasis canina (Resumen). Parte II. Rev Med Vet 1999; 76:228-40. [ Links ]
50. Pérez G, Rosa A, Ribicich M, Meyer P, Welch P, Casalonga O, Reino P. Dirofilariasis canina (Resumen). Parte I. Rev Med Vet 1999; 76:191-8. [ Links ]
51. Ríos JF. Comunicación personal. Biólogo-Entomólogo, Consultorio Departamental. Medellín. 20 Abril, 2005. [ Links ]
52. Rosy L, Ollono F, Meneguz PG, Cancrini G. Quattro specie di culicidi come possibili vettori di Dirofilaria immits nella risaia piemontese. Parassitologia 1999; 41:537-42. [ Links ]
53. Sako T et al. Human pulmonary dirofilariasis presenting as a small nodule with cavity. J Med Invest 2000; 47:161-3. [ Links ]
54. Schrey CF, Trautvetter, E. Dirofilariosis canina y felinadiagnóstico y tratamiento. Waltham Focus 1998; 8:23-30. [ Links ]
55. Smith HL, Rajan TV. Tetracycline inhibits development of the infective stage larvae of filarial nematodes in vitro. Exp Parasitol 2000; 95:265-70. [ Links ]
56. Strickland KN. Canine and Feline Caval Syndrome. Clin Tech Small Anim Pract 1998; 13:88-95. [ Links ]
57. Tarello W. Importance in the dog concentration test for the diagnosis heartworm disease in nonendemic areas. http://www.priory.com/vet.htm [ Links ]
58. Theis JH, Cass PH, Stevens F. Effects of Drought and Chemoprofilaxis on Heartworm Transmission in Domestic Dogs in California (1983-1991). En: Seward, R.L. and Knight, D.H. (eds.) Recent Advances in Heartworm Disease: Symposium ‘98. American Heartworm Society 1999; 37-50. [ Links ]
59. Theis JH, et al. Case Report: Unusual location of Dirofilaria immitis in a 28-years-old man necessitates orchiectomy. Am J Trop Med Hig 2001; 64:317-322. [ Links ]
60. Theis JH, Kovaltchouk JG, Fujioka KK, Saviskas B. Vector competence of two species of mosquitoes (Diptera: Culicidea) from southern California for Dirofiliria immitis (Filariidea: Onchocercidae). J Med Entomol 2000; 37:295- 7. [ Links ]
61. Theis JH, Stevens F, Law M. Distribution, prevalence, and relative risk of filariasis in dog from the State of Washington (1997-1999). J Am Hosp Assoc 2001; 37:339-47. [ Links ]
62. Theis JH, Stevens F, Theodoropoulos G, Ziedins AC. Studies of the prevalence and distribution of filariasis in dogs from Los Angeles County, California (1996-1998). Canine Practice 1999; 24:1-8. [ Links ]
63. Theis JH, Stevens F. An evaluation of factors affecting heartworm prevalence and distribution in Nothern California reveals the need for more aggressive educational and control programs to combat this parasite. Canine Practice 1998; 23:10-7. [ Links ]
64. Theis JH, Stevens F. Filariasis in Dogs. California Veterinarian 2000:23-24. [ Links ]
65. Theis JH. Occult rate of heartworm infected dogs in California appears to be significantly lower than that of infected dogs from Florida and Texas. Canine Practice 1997; 22:5-7. [ Links ]
66. Vélez I, Rodríguez MA, Herrera LA, Mejía LF, Naquira LF. Seropositividad para Dirofilaria immitis en población canina. Municipio de Santa Fe de Antioquia 1998. [ Links ]
67. Vieira C, Vélez ID, Montoya MN, Agudelo S, Álvarez MI, Genchi C, Simón F. Dirofilaria immitis in Tikuna Indians and their dogs in the Colombian Amazon. Ann Trop Med Parasitol 1998 Jan;92:123-5[ [ Links ]STANDARDIZEDENDPARAG]
68. Wang LC. Canine filarial infections in north Taiwan. Acta Tropica 1997; 68:115-20. [ Links ]
69. Wang LC. Comparison of a whole blood test and an ELISA for the antigens of Diroffilaria immitis agglutination detection in dogs. Ann Trop Med Parasitol 1998; 92:73-7. [ Links ]
70. Watts KJ, Reddy GR, Holmes RA, Lok JB, Knigth DH, Smith G, Courtney CH. Seasonal prevalence of third-stage larvae of Dirofilaria immitis in mosquitoes from Florida and Louisiana. J Parasitol 2001; 87:322-9. [ Links ]














