Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.19 no.3 Medellín July/Sept. 2006
Carlos A Errecalde 1, MV, Esp Cs Clin; Guillermo F Prieto1, MV, Esp Cs Clin; Carlos F Lüders1 MV, MS; Hugo García Ovando1 MV, Dr Cs Biol
1Farmacología, Departamento Clínica Animal, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto. Ruta Nacional 36, Km 601 (5800) RIO CUARTO, Córdoba, República Argentina.
cerrecalde@ayv.unrc.edu.ar
( Recibido: 14 julio, 2005; aceptado: 23 junio, 2006 )
Resumen
Se determinaron parámetros farmacocinéticos de ceftiofur sódico con dosis única de 2.2 mg/kg por vía intravenosa e intramuscular, en un diseño cruzado de tratamiento en hembras caprinas adultas no gestantes (n= 6). Las concentraciones plasmáticas en función del tiempo se determinaron por el método microbiológico de difusión en agar utilizando medio Mueller-Hinton y Providencia alcalifaciens, cuyo límite de cuantificación se estableció en 0.039 μg/ml. Los datos de concentración plasmática de ceftiofur en función del tiempo se analizaron por el modelo farmacocinético no compartimental utilizando el sofware PK Solution 2.0. Los parámetros obtenidos para la vía intravenosa fueron: vida media de eliminación (t1/2 b)= 1.63 ± 0.04 horas, clearance total (Cltot)= 3.3 ± 1.1 ml/kg/min, volumen de distribución (Vdss)= 0.38 ± 0.19 L/kg, área bajo la curva (ABC)= 716.5 ± 225.5 μg/min/ml. Estos valores no difieren significativamente de los obtenidos del ensayo intramuscular (p < 0.05) y son similares a los informados en otras especies animales con ceftiofur. En el ensayo intramuscular se obtuvo una concentración máxima (Cmáx) de 3.6 ± 0.5 μg/ml, con un tiempo máximo (tmáx) de 0.53 ± 0.31 horas y elevada biodisponibilidad (97.6 ± 0.1%). Los resultados indican que la aplicación intramuscular provee rápida absorción y óptima biodisponibilidad, generando niveles plasmáticos que exceden la concentración inhibitoria mínima (CIM) de patógenos respiratorios sensibles durante 12 horas. Considerando estos resultados y la CIM90 (£ 0.06 μg/ml) frente a bacterias como Pasteurella haemolitica y multocida, se propone como tratamiento de este tipo de cuadros infecciosos en caprinos, una dosis de mantenimiento de 1.3 mg/kg cada 12 horas por vía intramuscular, cuyo predictor de eficacia (t > CIM) se calculó en 77.8 %.
Palabras clave: cabras, cefalosporinas, ceftiofur, farmacocinética, Pasteurella spp.
Introducción
El ceftiofur es una cefalosporina de tercera generación indicada en la terapéutica de infecciones bacterianas respiratorias de animales domésticos debido a las óptimas concentraciones alcanzadas en pulmón (4, 11, 13) y a la susceptibilidad de las bacterias implicadas (1, 21, 25). Se reportan valores de concentración inhibitoria mínima (CIM90) de £ 0.06 μg/ml para el género Pasteurella (25). El ceftiofur ejerce su acción antibacteriana modificando laintegridad de la pared celular, mediante el bloqueo de la transpeptidasa o por la unión a proteínas fijadoras de penicilinas (PBPs), ubicadas en la superficie de la membrana citoplasmática, vitales para el crecimiento bacteriano, pues controlan los procesos de elongación y división, comportándose como transpeptidasas, d-carboxipeptidasas e indirectamente como transglicolasas, incrementado la actividad autolítica y destrucción del microorganismo. El ceftiofur exhibe un amplio espectro de actividad frente a patógenos Gram positivos y Gram negativos tales como Pasteurella multocida, Pasteurella haemolytica, Haemophilus somnus y Escherichia coli, inclusive cepas productoras de betalactamasas (12, 21, 27). In vivo e in vitro es más eficaz que la ampicilina y las cefalosporinas precedentes (27), debido a la incorporación en su estructura del grupo aminotiazol, que intensifica la afinidad por PBPs de Gram negativas y el grupo metoximino, que le confiere estabilidad frente a las betalactamasas (14, 16, 18). El ceftiofur, así como los demás antibióticos betalactámicos, desarrolla una actividad bactericida que es dependiente del tiempo de exposición, el cual se define como el porcentaje del intervalo de dosis durante el cual la concentración libre del antibiótico excede el valor del CIM, relación que se expresa como t >CIM y que para este grupo de antibióticos constituye el mejor predictor del efecto bactericida in vivo y de eficacia clínica (7). Un resultado exitoso con cefalosporinas de amplio espectro se lograría si éstas consiguiesen niveles superiores al CIM durante un 60-70 % del tiempo del intervalo de dosificación, para la mayoría de los patógenos sensibles y del 40-50 % cuando se considera S. aureus, diferencia debida al efecto post-antibiótico in vivo que ejerce sobre bacterias Gram positivas (17, 24). En general, las cefalosporinas muestran una absorción intramuscular rápida y variable en cantidad, según el compuesto considerado y distribución limitada al espacio extracelular. Las concentraciones obtenidas en fluidos como el pleural, peritoneal y sinovial,son menores que las plasmáticas, pero es mayor el tiempo que los niveles exceden la CIM en estos fluidos(7). Presentan, además vida media plasmática que oscila entre 0.5-5 horas, según la cefalosporina considerada y eliminación activa por orina (15, 21, 28). Los antecedentes del ceftiofur por aplicación intramuscular de 2.2 mg/kg en bovinos (26), ovinos (6), equinos (3, 11, 12) y caprinos (5) indican absorción rápida y completa (5, 6), obteniéndose picos plasmáticos de 4.46-7.98 μg/ml entre 0.81 y 1.33 horas (11, 12), respectivamente. Presenta un volumen de distribución al estado estacionario de 0.22 -0.25 L/kg (5, 26) y una vida media de eliminación que fluctúa en 4 horas en ovinos (6), caprinos (5) y equinos (3) a 7.12 horas en bovinos (26). En distintos tejidos, el ceftiofur es transformado rápidamente en desfuroil ceftiofur (9, 10, 20), metabolito primario que retiene la actividad de su precursor (20, 23), además posee marcada afinidad por proteínas tisulares y albúmina (9, 20), si bien el metabolismo y la fracción libre difieren según la especie (9, 10). Los antecedentes microbiológicos del ceftiofur y las escasas referencias en caprinos justificaron este estudio con los propósitos de cuantificar niveles plasmáticos, determinar parámetros farmacocinéticos y en función de los datos obtenidos, proponer una dosis de mantenimiento por vía intramuscular y establecer, no obstante la actividad bactericida y de amplio espectro exhibida por el ceftiofur, el parámetro predictor de eficacia clínica sobre Pasteurella spp, patógeno relevante del árbol respiratorio en varias especies animales incluidos los caprinos, único microorganismo del cual se disponen datos que indican su sensibilidad al ceftiofur (25).
Materiales y métodos
El experimento se realizó en un establecimiento dedicado a la crianza de caprinos, próximo a la ciudad de Río Cuarto, provincia de Córdoba, Argentina, en los meses de verano del año 2005, en los cuales se registró una temperatura media de 23 ºC y humedad relativa ambiente del 68 %. Como sujetos experimentales se utilizaron hembras caprinas adultas (n= 6) no gestantes, de raza criolla, seleccionadas al azar de una población homogénea (n= 75), clínicamente sanas, con un peso corporal de 35 ± 9 kg, sin antecedentes de tratamientos con antimicrobianos y sometidas a un sistema de crianza de semi estabulado consistente en acceso libre a pasturas naturales durante el día, encierre nocturno en corrales cubiertos y agua ad libitum. Los animales se separaron en dos grupos. El grupo I (n= 3), recibió una dosis única de 2.2 mg/kg de ceftiofur sódico en solución inyectable al 5% en forma de bolo en la vena yugular derecha, y el grupo II (n= 3), recibió la misma dosis en el músculo semitendinoso izquierdo. Diez días después el grupo I recibió igual dosis del antibiótico por vía intra muscular y el grupo II por vía intravenosa. De cada animal se colectaron 3 ml de sangre de la vena yugular izquierda en tubos heparinizados, previo al suministro del antibótico y en distintos tiempos hasta 12 horas siguientes a la administración del antibiótico, los tubos se centrifugaron a 1200 g durante 15 minutos, para obtener los plasmas que se conservaron a -20 °C hasta su análisis. La determinación de ceftiofur en plasma se efectuó por el método microbiológico clásico de difusión en agar de acuerdo a Bennett et al (2). Las muestras y una curva de calibración confeccionada con 10 diluciones estándares de ceftiofur patrón (20 a 0.039 μg/ml) en plasma caprino, se sometieron simultáneamente y por triplicado al ensayo microbiológico, utilizando un medio Mueller-Hinton y un cultivo fresco de 18 horas de Providencia alcalifaciens con una densidad óptica equivalente a Mc Farland 1 al 0.5%, como microorganismo detector. Las placas sembradas se refrigeraron a 4 °C durante 60 minutos y luego se incubaron a 33 °C durante 12 horas. Al término de este período se midieron los diámetros de los halos de inhibición producidos con un calibrador digital.
La cuantificación plasmática de ceftiofur se estableció confrontando diámetros de halos de inhibición versus los generados por la dilución estándar, empleando una curva de regresión semilogarítmica (r2= 0.98), utilizando el procedimiento propuesto por Nouws y Ziv (19). Los datos individuales de concentraciones plasmáticas en los distintos tiempos se sometieron a un análisis farmacocinético no compartimental, utilizando el programa PK Solution 2.0 (8). La dosis de mantenimiento (DM) para la aplicación intramuscular se estimó según Ritchel (22), de acuerdo a la siguiente fórmula:
DM= Css-av . t . Vd ss / 1.44 . t½ b . f
considerando la concentración deseada en estado de equilibrio (Css-av = 0.5 μg/ml) y los valores obtenidos de volumen de distribución al estado estacionario (Vdss), vida media de eliminación (t½ b), biodisponibilidad (f), y 12 horas como intervalo de dosificación (t). La fracción de tiempo entre el intervalo de dosis (% t > CIM) en que los niveles plasmáticos exceden la CIM se determinó por la ecuación propuesta por Turnidge (24):
t >CIM= ln (DM / Vd . CIM) x t½b / ln 2 . 100 / t
donde ln= es el logaritmo natural, DM= dosis de mantenimiento, Vd= volumen de distribución, y t = intervalo de dosis expresado en horas.
Resultados
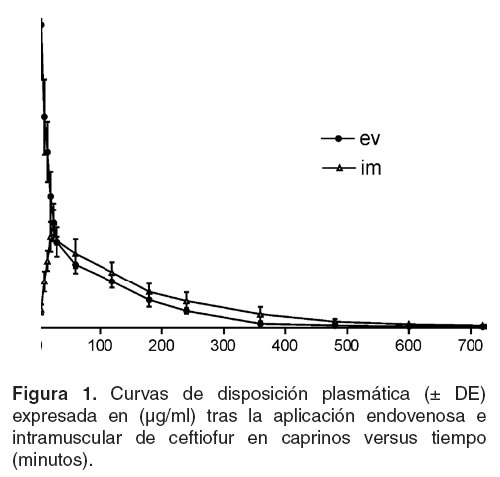
La figura 1 representa las curvas generadas por las concentraciones plasmáticas promedio (± DE) en función del tiempo, tras la aplicación endovenosa e intramuscular. Los parámetros farmacocinéticos calculados y los respectivos coeficientes de determinación de las curvas teóricas de disposición para cada vía estudiada se señalan en la tabla 1. Con estos datos, se determinó como dosis de mantenimiento la administración intramuscular de 1.3 mg/kg de ceftiofur sódico cada 12 horas. Considerando la CIM90 requerida por Pasteurella spp (25), el predictor de eficacia (t > CIM) se estimó en 77.8 %.
Tabla 1. Parámetros farmacocinéticos (± D.E.) luego de la administración endovenosa e intramuscular de 2.2 mg/kg de ceftiofur sódico en caprinos.

Discusión
En las vías estudiadas y luego de la administración única, el método implementado resultó sensible para cuantificar las concentraciones plasmáticas del antibiótico que subsisten 12 horas por encima de la CIM90 requerida por patógenos susceptibles del árbol respiratorio; no obstante, los niveles son inferiores a los reportados por cromatografía líquida de alta performance (HPLC) (4, 6, 13). Esta discrepancia deriva en que el método HPLC estima la totalidad del fármaco (4, 13), en tanto la valoración microbiológica, si bien no discrimina entre el antibiótico y su metabolito activo, sólo determina la actividad microbiológica del fármaco libre, no unido a macromoléculas (4,12). Los valores de los parámetros farmacocinéticos obtenidos por vía intravenosa no difieren significativamente de los obtenidos del ensayo intramuscular (p<0.05) y son similares a los informados en otras especies animales para esta droga (15, 21, 28). Las curvas de disposición y el área bajo la curva (ABC) son comparables, en consecuencia es posible optar por la vía intramuscular, que ofrece óptima biodisponibilidad (97.6 ± 0.1%), en consonancia con experiencias realizadas en ovinos (6) y caprinos (5). Similar a lo informado en equinos (3) y caprinos (5), en el ensayo intramuscular se comprueba una rápida absorción, generando una concentración máxima (Cmáx) de 3.6 ± 0.5 μg/ml, inferior al encontrado en ovinos (6), caprinos (5) y equinos (3, 11, 12); en tanto el tmáx (0.53 ± 0.31 horas) es cercano al comunicado en equinos (3, 11, 12) y ovinos (6). De acuerdo con Courtin et al (5), el ceftiofur se distribuye pronto desde el compartimiento central por las vías estudiadas y revela limitada permanencia en el organismo, tal como indican los parámetros de t½ b(1.63 ± 0.26 horas por vía endovenosa y 1.71 ± 0.37 horas por aplicación intramuscular) inferiores a lo comunicado en bovinos (26), equinos (3) y el tiempo medio de residencia (TMR= 1.85 ± 0.34 horas por vía endovenosa y 2.74 ± 0.83 horas por administración intramuscular), significativamente menor a las 3.67 (12), 6.10 ± 1.27 horas informada en equinos (11), 4.78 horas en caprinos (5) y 6.48 horas en bovinos (26). Los reducidos valores de tb y TMR obtenidos serían consecuencia de la ½rápida eliminación, según expresa el Cltot (3.3 ml/min/kg) que supera al informado en caprinos por Courtin et al (5) (1.1 ml/min/kg) o también puede deberse a la menor afinidad del ceftiofur ó su metabolito por proteínas plasmáticas con respecto a tisulares (26), lo que explicaría el Vdárea (0.49 ± 0.07 L/kg) encontrado por vía intramuscular que excede al comunicado para el ceftiofur (26), y otras cefalosporinas en animales domésticos (1, 4, 28), insinuando mejor difusión tisular. Aunque la tercera generación de cefalosporinas es más liposoluble y en consecuencia su farmacocinética es más conveniente (1, 14), en general las características del ceftiofur sódico en caprinos concuerdan con el perfil exhibido por el conjunto de las cefalosporinas (15, 21, 28). Contemplando la excelente biodisponibilidad obtenida, una relación Cmax / CIM90 Pasteurella spp favorable (7, 17), y que el satisfactorio t > CIM obtenido (77.8 %) vaticina un resultado clínico-bacteriológico exitoso en presencia de patologías respiratorias producidas por este microorganismo (24), se propone la aplicación intramuscular de 1.3 mg/kg de ceftiofur sódico cada 12 horas como dosis de mantenimiento en caprinos.
Summary
Pharmacokinetics and bioavailability of ceftiofur sodium in goats
Pharmacokinetic parameters of ceftiofur sodium were determined with a unique dose of 2.2 mg/kg either by the intravenous on the intramuscular routes, in a crossed design treatment in non pregnant adult female goats (n= 6). Variations in plasmatic concentrations over time were determined by the microbiological assay in Mueller-Hinton agar, with Providencia alcalifaciens as indicator. The limit of quantification was set in 0.039 mg/ml. The plasmatic concentrations of Ceftiofur were determined by the non compartimental pharmacokinetic model using sofware PK Solution 2.0. The parameters obtained when the intravenous route was used were: average elimination time (t1/2 b) = 1.63 ± 0.04 hours, total clearance (Cltot) = 3.3 ± 1.1 ml/kg/min, volume of distribution (Vdss) = 0.38 ± 0.19 L/Kg, area under the curve (ABC) = 716.5 ± 225.5 mg/min/ml. These values did not differ significantly from those obtained by the intramuscular test (P < 0.05) and are similar to those informed in other animal species for the same drug. When the intramuscular route was used , the maximum concentration (Cmáx) of 3.6 ± 0.5 mg/ml was obtained at a maximum time (tmáx) of 0.53 ± 0.31 min, and the bioavailability was high (97.6 ± 0.1%). The results indicate that the intramuscular application provides fast absorption and optimal bioavailability, generating plasmatic levels that exceed the MIC90 for sensitive respiratory pathogens for a period of 12 hours. Considering these results and a MIC (£0.06 mg/ml) for bacteria like Pasteurella haemolitica and multocida, the treatment of this type of infections in goats, requires 1.3 mg/Kg every 12 hours by intramuscular route, to obtain a predictive effectiveness (t> MIC) of 77.8%.
Key words: ceftiofur, cephalosporins, goats, Pasteurella spp, pharmacokinetics.
Referencias
1. Barragry T, editor. Veterinary drug therapy. Philadelphia: Lea & Febiger; 1994. [ Links ]
2. Bennett J, Brodie J, Brenner E, Kirby W. Simplified accurate method for antibiotic assay of clinical specimens. Appl Microbiol 1966;14:170-177. [ Links ]
3. Cervantes C, Brown M, Gronwall R, Merritt K. Pharmacokinetics and concentrations of ceftiofur sodium in body fluids and endometrium after repeated intramuscular injections in mares. Am J Vet Res 1993;54:573-575. [ Links ]
4. Clarke C, Brown S, Streeter R, Clarke J, Hamlow P. Penetration of parenterally administered ceftiofur into sterile vs. Pasteurella haemolytica-infected tissue chambers in cattle. J Vet Pharmacol Therap 1996;19:376-381. [ Links ]
5. Courtin F, Craigmill A, Wetzlich S, Gustafson C, Arndt T. Pharmacokinetics of ceftiofur and metabolites after single intravenous and intramuscular administrations and multiple intramuscular administration of ceftiofur sodium to dairy goats. J Vet Pharmacol Therap 1997;20:368-373. [ Links ]
6. Craigmill A, Brown S, Wetzlich S, Gustafson C, Arndt T. Pharmacokinetics of ceftiofur and metabolites after single intravenous and intramuscular administrations of ceftiofur sodium to sheep. J Vet Pharmacol Ther 1997;20:139-144. [ Links ]
7. Drusano G, Craig W. Relevance of pharmacokinetics and pharmacodynamics in the selection for respiratory tract infections. J Chemother 1997;9:38-44. [ Links ]
8. Farrier A. PK Solution 2.0 non compartmental pharmacokinetic analysis. Ashland: SummitPK Co; 1999. [ Links ]
9. Jaglan P, Kubicek M, Arnold T, Cox B, Robins R et al. Metabolism of ceftiofur. Nature of urinary and plasma metabolites in rats and cattle. J Agric Food Chem 1989; 37:1112-1118. [ Links ]
10. Jaglan P, Cox B, Arnold T, Kubicek M, Stuart D et al. Liquid chromatographic determination of desfuroylceftiofur metabolite of ceftiofur as residue in cattle plasma. J Assoc Anal Chem 1990;73:26-30. [ Links ]
11. Jaglan P, Roof R, Yein F, Arnold T, Brown S et al. Concentration of ceftiofur metabolites in the plasma and lung of horses following intramuscular treatment. J Vet Pharmacol Therap 1994;17:24-30. [ Links ]
12. Guglick M, Mac Allister G, Clarke C, Pollet R, Hague C et al. Pharmacokinetics of cefepime and comparison with those of ceftiofur in horses. Am J Vet Res 1998;59: 458-463. [ Links ]
13. Halstead S, Walker R, Baker J, Holland R, STein G et al. Pharmacokinetics evaluation of ceftiofur in serum, tissue chambers fluid and bronchial secretions from healthy beef-bred calves. Can J Vet Res 1992;56:269-274. [ Links ]
14. Klein N, Cunha B. Third-generation cephalosporins. Med Clin North Am 1995;79:705-719. [ Links ]
15. Klepser M, Marangos M, Patel K, Nicolau D, Quintiliani R et al. Clinical pharmacokinetics the newer cephalosporins. Clin Pharmacok 1995;28:361-384. [ Links ]
16. Lancini G, Parenti F, Gallo G, editors. Antibiotics. a multidisciplinary approach. New York: Plenum Press; 1995; 277p. [ Links ]
17. Lees P, Shojaee F. Rational dosing: animals versus humans. 8 ed. ISAP Symp. Nijmegen, The Netherlands; 2001. [ Links ]
18. Livermore D. b-Lactamase-mediated resistance and opportunities for its control. J Antimicrob Therap 1998;41(Suppl D):25-41. [ Links ]
19. Nouws J, Ziv G. The effect of storage at 4°C with antibiotic residues in kidney and meat tissues of dairy cows. Tijdschr Diergeneesk 1976;101:119-127. [ Links ]
20. Olson S, Beconi-Barker M, Smith E, Martin R, Vidmar T et al. In vitro metabolism of ceftiofur in bovine tissues. J Vet Pharmacol Therap 1998;21:112-120. [ Links ]
21. Prescott J. Antibióticos betalactámicos: penicilinas y cefalosporinas. En: Prescott J, Baggot J, Walker R. Terapéutica antimicrobiana en medicina veterinaria. 3 ed. Buenos Aires: Intermédica; 2002; p.118-141. [ Links ]
22. Ritschel WA. Kinetic model and dosage regime. En: Kuammerle H & Brenkel P, Eds. Clinical pharmacology and pregnacy. Ames: MTP Press; 1984. [ Links ]
23. Salmon S, Watts J, Yancey R. In vitro activity of ceftiofur and its primary metabolite, desfuroylceftiofur, against organisms of veterinary importance. J Vet Diagn Invest 1996;8:332-336. [ Links ]
24. Turnidge J. The pharmacodynamics of b-lactams. Clin Infect Dis 1998;27:10-22. [ Links ]
25. Watts J, Yancey R, Salmon S, Case C. A 4-year survey of antimicrobial susceptibility trends from cattle with bovine respiratory disease in North America. J Clin Pharmacol 1994;32:725-731. [ Links ]
26. Whittem T, Freeman D, Hanlon D, Parton K. The effects on the pharmacokinetics of intravenous ceftiofur sodium in dairy cattle of simultaneous intravenous acetyl salicylate (aspirin) or probenecid. J Vet Pharmacol Therap 1995; 18:61-67. [ Links ]
27. Yancey R, Kinney M, Roberts B, Goodenough K, Hamel J et al. Ceftiofur sodium, a broad-spectrum cephalosporin: evaluation in vitro and in vivo in mice. Am J Vet Res 1987;48:1050-1053. [ Links ]
28. Vaden S, Riviere J. Penicillins and related b-lactam antibiotics. En: Adams R, editor. Veterinary pharmacology and therapeutics, 7 ed. Ames: State University Press; 1995; p. 774-784. [ Links ]














