Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Colombiana de Ciencias Pecuarias
versión impresa ISSN 0120-0690versión On-line ISSN 2256-2958
Rev Colom Cienc Pecua v.19 n.4 Medellín oct./dic. 2006
Tomografía axial computarizada y resonancia magnética para la elaboración de un atlas de anatomía segmentaria a partir de criosecciones axiales del perro
Héctor F Aguinaga1, MV; Jairo A Rivera1, MVZ, PhD; Lynda J Tamayo1, MV, Esp; Mauricio Tobón R2, Est. MV; Roberto C Osorno Ch2, Est. MV.
1Docentes , Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia.
2Estudiantes de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia. Apartado aéreo 1226, aguinaga@agronica.udea.edu.co
(Recibido: 13 diciembre, 2005; aceptado: 12 octubre, 2006)
Resumen
El artículo describe el método ara la elaboración de un atlas digital de la anatomía segmentaria del perro, por crioseccionamiento, mediante las técnicas de tomografía axial computarizada y de resonancia magnética. Dicho atlas es una herramienta didáctica y de apoyo diagnóstico para estudiantes de pre y posgrado, y para los profesionales del área. Para el procedimiento se utilizó una hembra canina, adulta, criolla, de color negro, clínicamente sana, de aproximadamente 4 años de edad, 22 kg de peso y de tamaño mediano (50 cm de altura a la cruz). Los exámenes imagenológicos de tomografía axial computarizada y de resonancia magnética se llevaron a cabo en el Hospital San Vicente de Paúl y en el Instituto de Alta Tecnología Médica de Antioquia (IATM), respectivamente. Se obtuvieron imágenes segmentarias de la estructura corporal total del animal en sus planos frontal, sagital y transverso o axial. Con base en estas imágnes se compararon las estructuras anatómicas con los cortes del cadáver del animal. Además de la utilidd para el atlas digital, las imágenes formarán parte de una base de datos a utilizar en el laboratorio de anatomía animal de la Universidad de Antioquia.
Palabras clave: diagnóstico, hounsfield, imagenología, sagital, spin.
Introducción
Las técnicas médicas de imagenología de más avanzada tecnología, como la tomografía computarizada (TC) y la resonancia magnética (RMN), han tomado auge en la medicina veterinaria, gracias a que ha aumentado su disponibilidad y disminuido su costo. Estas técnicas tienen grandes ventajas sobre la técnica de rayos X convencional, ya que permiten una diferenciación superior de los tejidos blandos y evitan la superposición de estructuras subyacentes (10).
La TC se ha establecido como un procedimiento radiográfico importante para la detección y localización de lesiones intracraneales en personas. La capacidad de resolución, carácter no invasivo y la representación de la anatomía en cortes transversales inherentes a la TC facilitan la obtención de una visualización exacta de las relaciones morfológicas y ofrecen muchas ventajas sobre las técnicas radiográficas convencionales (10).
La disponibilidad de la TC y la RMN esta aumentando para los médicos veterinarios, particularmente para aquellos dedicados a los pequeños animales. (9, 13, 17) Según lo reportan Stickle y Hatchcock (17), muchos colegios veterinarios y centros de referencia especializados están ofreciendo estas ayudas diagnósticas. Esto ha ocurrido por las ventajas diagnósticas que tienen la TC y la RMN para ciertos pacientes (16). En nuestro medio se están empezando a utilizar estas técnicas, mediante convenios con centros médicos de imagenología, especialmente para el diagnóstico de ciertos problemas neurológicos comunes en pequeños animales, como las hernias discales (12), y para la localización de neoplasias, aunque tiene un gran potencial para el diagnóstico de una gran variedad de patologías.
La tecnología ha avanzado hasta el punto que pueden crearse modelos gráficos en tres dimensiones de gran calidad, de diversas estructuras anatómicas. Esto permite la visualización, manipulación y edición de reconstrucciones anatómicas de alta fidelidad (14). Esto es de gran ayuda en pedagogía, para crear nuevos modelos de enseñanza-aprendizaje de la anatomía veterinaria.
La interpretación de las imágenes requiere, como en cualquier técnica radiográfica, de un conocimiento muy profundo de la anatomía de la estructura que esta siendo analizada, (1, 7, 13). La imagen del cuerpo en secciones transversales requiere del entendimiento de la anatomía topográfica. Se debe tener la habilidad de reconocer las estructuras en los diferentes planos (dorsal, transversal y sagital); al igual que las características de los diferentes tejidos en la imagen, según la técnica y los parámetros escogidos (1). Sin embargo, la anatomía rara vez se enseña mediante este tipo de cortes y en la literatura existen pocas ilustraciones de esta forma del cuerpo canino (3).
Los médicos veterinarios en nuestro medio no han sido entrenados para pensar en términos de anatomía en secciones transversales, y esto representa un problema para la interpretación de la TC y RMN. Teniendo en cuenta que estos profesionales deben revisar a diario la anatomía en radiografías de rutina y que este método diagnóstico no permite una clara identificación de las estructuras anatómicas sobre todo de carácter tridimensional, hace necesario y justificable el conocimiento de la anatomía por tomografía y resonancia magnética. (17).
Para analizar las imágenes obtenidas por TC y RMN, el médico veterinario se apoya en la interpretación que de dichas imágenes realiza el médico, quien se basa en sus conocimientos de la anatomía y la patología humana. Es en este punto donde se ve la necesidad de elaborar un atlas de anatomía segmentaria canina comparativa (criosecciones axiales, TC y RMN), para establecer diagnósticos más ajustados a este tipo de especie.
La interpretación fidedigna de las imágenes diagnósticas por TC y RMN, requiere por lo tanto, de un conocimiento profundo de la anatomía, especialmente de la anatomía topográfica, por ello, debe estar apoyada en atlas y modelos animales.
Hasta el momento sólo existe un atlas de TC y RMN en el perro (2, 4), pero no incluye crio secciones axiales. Adicionalmente, no se encuentra en el medio, lo que lo hace demasiado costoso.
Este trabajo permitirá ofrecer a los estudiantes de pregrado, postgrado, docentes y médicos veterinarios practicantes un nuevo modelo de aprendizaje, con el cual podrán identificar las estructuras anatómicas de manera eficiente en imágenes de TC y RMN. De esta manera se puede mejorar la capacidad diagnóstica.Una publicación de este tipo realizada por la Universidad de Antioquia, sería la primera a nivel latinoamericano.
Principios de tomografía computarizada
La tomografía computarizada (TC) es el proceso de producción de secciones de imágenes de un cuerpo usando rayos – X y computadores (11). Un examen completo de TC consiste en un número de cortes de imágenes continuas a través de un área de interés (11), con lo que se pueden visualizar de forma directa, las estructuras internas de dicha área.
Los principios básicos de la TC son similares a los de la radiografía convencional, donde se utilizan rayos-X para crear un mapa de atenuación de los tejidos de una determinada área de estudio en un paciente y esta atenuación se traduce en datos matemáticos que son organizados por un computador y a los cuales se les aplica un algoritmo matemático (11, 18). La imagen capturada por el tomógrafo no es mas que una matriz conformada por cuadros dispuestos en filas y columnas, donde cada cuadro es un píxel, y de acuerdo al grado de atenuación, a este píxel se le asocia un color sea negro, blanco o alguno de la escala de grises (véase Figura 1) (2, 18).
Cada cuadro o píxel tiene una profundidad determinada por el grosor con que se está realizando la tomografía en el paciente en cada corte y a este grado de profundidad se le denomina el vóxel. Cuando el computador reconstruye las imágenes, los valores del vóxel de la imagen se normalizan al coeficiente de atenuación lineal del agua. Estos valores se expresan en Unidades Hounsfield (UH) (Véase Figura 2). El agua tiene una UH de 0, el hueso cortical tiene una UH de +1000 y el aire una UH de -1000. Los diferentes órganos y tejidos dentro del cuerpo tienen valores UH característicos (18).
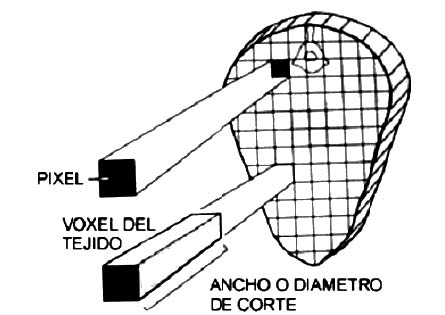
Figura 1. Diagrama que muestra la representación de los píxeles y los voxels de un corte en la tomografía computarizada (11).
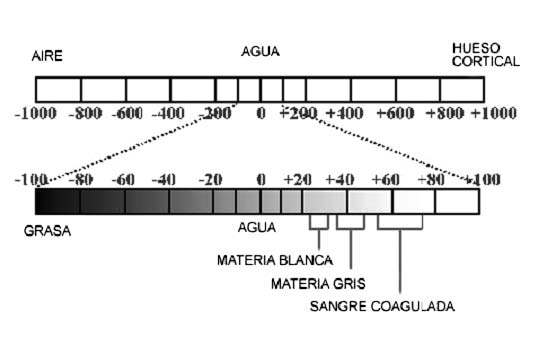
Figura 2. Esquema que representa la escala de Hounsfield utilizada para establecer la medida de contraste de los píxeles de una imagen de tomografía computarizada (11).
El Proceso de tomografía computarizada
La realización de la tomografía se compone de varios pasos que se indican a continuación (5, 11):
Recolección de datos. La intensidad relativa con la que el haz de rayos X emergen del paciente, es la forma de adquisición de datos. Este paso involucra la mesa del paciente y Gantry, las cuales son porciones de un escáner de tomografía computarizada (véase Figura 3). La mesa facilita el movimiento del paciente dentro del Gantry de acuerdo a la porción del cuerpo que se desee estudiar (6, 11, 18).
El Gantry esta constituido por un tubo de rayos X, un colimador y un detector de rayos X. El tubo gira 360º alrededor del paciente, emitiendo un haz de rayos X. El colimador determina el grosor del corte (usualmente 1 – 10 mm) (11, 16). Los rayos X son atenuados por el paciente y esta atenuación depende del grosor del corte y las estructuras que estén en el camino del rayo a través del paciente. El detector juega un papel similar al de una película convencional de rayos X. Los fotones que salen del paciente son absorbidos por los detectores y son transformados en un signo electrónico y ampliados, y luego este es convertido a un número según su intensidad (calidad y cantidad) (6, 11, 16).
La computadora usa estos números para calcular el coeficiente de atenuación lineal de cada vóxel y asignarle un rango de color de la escala de grises al pixel. El número es lo que la computadora entiende y el procesamiento de estos números es el paso siguiente para la producción de la imagen final (11, 18).
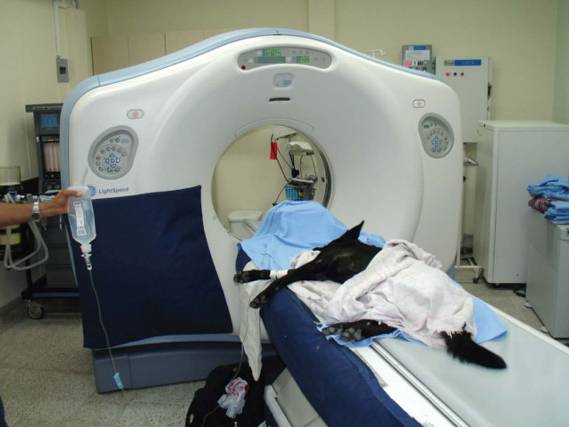
Figura 3. Tomógrafo del Hospital San Vicente de Paúl (Medellín, Colombia). En la imagen se observa el Gantry y la mesa del paciente, donde se realiza la recolección de datos.
Procesamiento computarizado de los datos. La imagen final se hace por numerosas filas y columnas de píxeles, que representan un pequeño bloque de tejido (vóxel). El coeficiente de atenuación lineal para los tejidos del bloque son determinados al realizar proyecciones múltiples a través del mismo bloque, esto es logrado ya que el tubo gira alrededor del paciente y los datos se recolectan de todos los ángulos posibles con lo que se forma un método matemático complejo que se usa para determinar el coeficiente de atenuación lineal de cada voxel en la matriz (6, 8, 11,). Se requiere entonces de cientos de miles de cálculos matemáticos simultáneos para lograr lo que se conoce como reconstrucción primaria de la imagen (11, 16).
El resultado de los cálculos es asignar a cada píxel un número que representa el coeficiente de atenuación lineal, estos números son llamados números de tomografía computarizada (6, 11, 16). El rango de estos números varía de +1000 a -1000 y se conoce como la escala de Hounsfield. En esta escala al hueso cortical se le asigna un valor de +1000, al aire -1000 y al agua cero. A los otros tejidos se le asigna un número de acuerdo a su densidad relativa (8, 11, 18).
Exposición de la imagen. Los colores de la escala de grises se les asignan a los tejidos de acuerdo al número de la escala de Hounsfield, el blanco brillante se le asigna al hueso (+ 1000 UH), el negro se le asigna al aire (- 1000 UH) y el agua se le asigna un gris central (cero UH) (6, 11, 18). El gran contraste logrado por la tomografía computarizada, se debe a que utiliza de 32 a 64 niveles de grises, estos son más que suficientes ya que el ojo humano sólo diferencia de 20 a 30 niveles de grises (11). Cuando hay muchos números del mismo grupo en una imagen, el contraste de los tejidos de la imagen disminuyen. El operador puede escoger que parte de la escala será el gris central y que rango de números tendrá la escala para esa imagen, esto se conoce como ancho de ventana (11, 15, 18). Todos los tejidos con números por encima del nivel superior de la nueva escala aparecerán blancos y aquellos por debajo aparecerán negros. Esta herramienta es útil para evaluar cierto tipo de tejidos (11, 16).
Almacenamiento de la imagen. La imagen mostrada puede ser grabada en una película de rayos X convencionales y los datos pueden ser guardados en un computador para revisiones y manipulaciones posteriores (11) (véase Figura 4).
Figura 4. Formación, manipulación y almacenamiento de la imagen en el computador. (Hospital San Vicente de Paúl, Medellín, Colombia).
Principios de resonancia magnética
La resonancia magnética nuclear (RMN o NMR de sus siglas en inglés) es un fenómeno físico basado en las propiedades magnéticas que poseen los núcleos atómicos. Permite alinear los campos magnéticos de diferentes átomos en la dirección de un campo magnético externo. La respuesta a este campo externo depende del tipo de núcleos atómicos por el que el campo magnético pasa a través de los diferentes tejidos (1, 18, 20).
Los fundamentos de la RMN dependen de varios fenómenos relacionados con el núcleo atómico, éste se compone de protones y neutrones y ambos tienen una propiedad denominada espinó momento angular intrínseco (1). El protón entonces, se comporta como un imán y crea un pequeño campo magnético en torno a sí; esta propiedad, de comportarse como un imán y generar un espin, se llama dipolo magnético (18). Si hay un número impar de protones, el protón desparejado ejercerá un dipolo magnético con una intensidad y dirección (una magnitud vectorial) discretas (1, 18). El átomo de hidrógeno es el núcleo mas abundante en el cuerpo presentando un protón desparejado, esto hace que se capte con mayor frecuencia en la RMN. Otros posibles núcleos con protones impares que podrían dar imagen en RMN son: Na, P, F (1, 9, 18).
La técnica de RMN usa equipos con potentes imanes capaces de generar campos magnéticos que oscilan desde 0.2 hasta 2 o más Tesla (10.000 Gauss, unidad de densidad de flujo magnético) (1, 20). Los campos así generados son capaces de alinear ordenadamente el momento magnético nuclear de los átomos con un número impar de nucleones del organismo que se estudia. Cuando el campo magnético cesa bruscamente, los momentos de los átomos del organismo se desalinean, orientándose cada uno en una dirección distinta, al azar, al tiempo que emiten radiaciones electromagnéticas en una banda de radiofrecuencia. Estas radiaciones son recogidas y procesadas por ordenador, y se emplean para reconstruir imágenes del interior del cuerpo en las cuales la intensidad mayor o menor de la señal corresponde a los átomos de hidrógeno de los tejidos y del agua corporal (1, 18, 20).
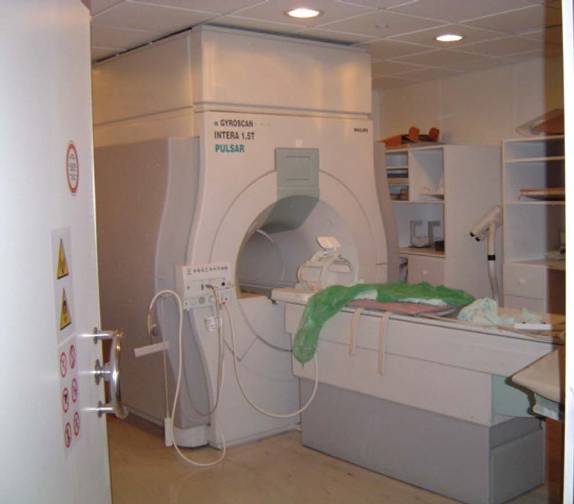
Figura 5. Escáner de resonancia magnética del Instituto de Alta Tecnología Médica de Antioquia (Colombia). En la foto se observa el gantry y la mesa del paciente
El Proceso de la resonancia magnética
Los componentes del sistema incluyen: El magneto, las bobinas receptoras y la computadora. El magneto y las bobinas se encuentran en el Gantry del equipo, y son los componentes que darán origen a los datos y que posteriormente serán analizados por la computadora (1, 9) (véase Figura 5).
El paciente es colocado sobre la mesa y deslizado hacia la abertura del Gantry, donde será sometido a las ondas electromagnéticas que darán origen a los datos que posteriormente formarán la imagen (véase Figura 6). Los magnetos están contenidos dentro de una cubierta metálica llena con helio líquido, estos magnetos están alrededor del Gantry. La estabilidad del campo magnético es permitida por un superenfriamiento de las bobinas magnéticas. Existen también unas bobinas de cobre ubicadas dentro del Gantry paralelas al campo magnético externo. La función de estas bobinas es detectar las señales de radiofrecuencia producidas por los cambios en el campo magnético del paciente. Estas señales son medidas y con ellas se construye la imagen (1, 9).
La computadora permite al programador instalar o crear parámetros para el estudio de las imágenes, formular y transmitir instrucciones para la producción de unos pulsos secuenciales de radiofrecuencia dirigidos a una región de interés y analizar los datos de la muestra para formar la imagen (9).
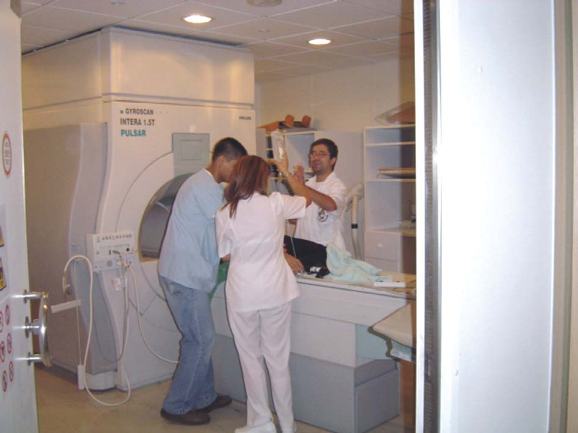
Figura 6. Ubicación del paciente en el escáner para la recolección de datos.
Tiempos de Relajación T1 y T2
El pulso secuencial magnético usado mas a menudo para formar las imágenes es el pulso secuencial espin – eco. Inicialmente se aplica un pulso magnético para girar el campo nuclear 90º, luego de cierto tiempo se produce un segundo pulso para girarlo hacia 180º (9).
Ocurre una relajación antes del próximo pulso de 90º y durante la relajación se producen ondas de radiofrecuencias que son detractados por las bobinas. El tiempo entre el pulso de 90º y la detección de la ondas de radiofrecuencia por las bobinas es llamado tiempo eco o TE. El tiempo que pasa entre cada frecuencia pulsátil es llamado tiempo de repetición o TR (1,9).
El contraste de las imágenes se controla principalmente por TE y TR. Existen combinaciones apropiadas que pueden ser seleccionadas para producir imágenes contrastadas relacionadas con diferencias en la densidad del protón, estos son llamados tiempos de relajación T1 y T2. La gran diferencia esta en la magnitud del campo magnético durante la fase de relajación del proceso de realineación (luego del cese brusco del pulso magnético). Durante la relajación, el campo magnético tiene dos componentes llamados magnetización longitudinal y transversal (1).
La relajación T1 (relajación longitudinal); se puede definir como el tiempo (milisegundos, y segundos) que los protones necesitan para recuperar el 63.2% de su valor Mz (momento magnético neto) original, tras aplicar un pulso de radiofrecuencia que hace rotar 90º al momento magnético neto original. La relajación T2 (relajación transversal) se define como el tiempo necesario para reducir la magnetización transversal neta del 37% del valor original (18).
El contraste para T1 está controlado por el TR, mientras que las diferencias de contraste para el tejido en T2 son controladas por el TE. Los tiempos de relajación están relacionados con la tasa en la que ciertos tejidos pueden absorber o liberar ondas de radiofrecuencia. La relajación T1 está dada por la interacción espín – rejilla y la relajación T2 esta dada por la interacción espín –espín. El espín rejilla se refiere al intercambio de energía de los protones con las estructuras que la rodean que no son protones. El espín-espín se refiere al intercambio de energía con otros protones (1 , 9). Una imagen se considera en T1 cuando el TR y el TE son cortos, al contrario de la imagen en T2, donde estos tiempos son largos (1).
Al revisar una imagen de RMN, las estructuras se consideran por la intensidad de señal que se produce, considerándose el blanco como “hiperintenso” o con alta intensidad de señal, y el negro como “hipointenso” , o con baja amplitud de señal, o ausencia de la misma (1). Las diferencias de contraste entre estos dos tiempos de relajación permiten diferenciar tejidos que no se ven en una u otra, por ejemplo; El líquido cerebro espinal en los ventrículos laterales del cerebro; en T1, éste aparece oscuro (hipointenso), en T2 aparece blanco brillante (hiperintenso) (1, 9) (véanse Tabla 1 y Figura 7).
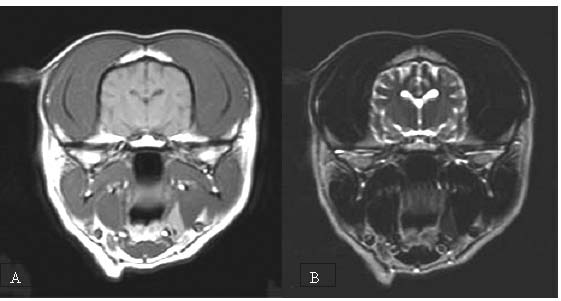
Figura 7. A, Tiempo de Relajación T1 y B, Tiempo de Relajación T2. Nótense las diferencias de apariencia del líquido cerebro-espinal en los ventrículos laterales. Los detalles anatómicos se ven con mejor claridad en la imagen T1, mientras que el contraste de densidades es más evidente en la imagen T2.
Tabla 1. Caracterización de algunos tejidos del cuerpo y su contraste en los tiempos de relajación T1 y T2.

Teniendo en cuenta las características de los tiempos de relajación T1 y T2 se concluye que T1 es bueno para observar detalles anatómicos y mejorar el contraste y T2 es bueno para identificar masas, edemas y otros fluidos.
Materiales y métodos
Se trabajó con una hembra canina, adulta, sana, de 22 kg de peso y tamaño mediano, ya que es más fácil el manejo y la obtención de los cortes.
El estudio de resonancia magnética se realizó en las instalaciones del Instituto de Alta Tecnología Médica de Antioquia (IATM) en un Sistema Gyroscan ACS-NT 1.5 TESLA PULSAR última versión 10.3 de siemens (véase Figura 3). El estudio de tomografía computarizada se realizó en las instalaciones del Hospital Universitario San Vicente de Paúl en un escanógrafo General Electric CT Prosped (véase Figura 1).
Para ambos procedimientos el animal fue transportado hasta las instalaciones respectivas, con la vena cefálica canulada con un catéter número 20 para la administración de una solución de cloruro de sodio al 0.9 %, a dosis de 50 ml/kg/24 horas. La inducción anestésica se realizó con maleato de acepromacina (Tranquilan®, Laboratorios Zoo Ltda), vía endovenosa, a dosis de 0.02mg/kg, y luego tiopental sódico (Tiopental®, laboratorios Biochemie), vía endovenosa a dosis de 20 mg/kg como anestésico general. Posteriormente fue colocado un tubo endotraqueal y una sonda uretral conectada a un equipo de venoclisis y bolsa colectora. El animal fue completamente envuelto en campos quirúrgicos. La profundidad de la anestesia se controló por medio de un fonendoscopio esofágico, para medición de frecuencia cardíaca y respiratoria. El animal fue colocado en la mesa móvil en posición decúbito esternal, con almohadillas en el cuello y la cabeza para un óptimo alineamiento. Posteriormente se introdujo en el Gantry del equipo.
El estudio se llevó a cabo con cortes axiales de 1mm de espesor. Se realizó un estudio simple y luego contrastado con gadopentato dimeglumina (viewgam®, laboratorio Bacon saic) para Resonancia Magnética; y Loversol (Optiray-320®, laboratorios Mallinckudt), que resalta la vasculatura y Iothamalato meglumine (Conray®, laboratorios Mallinckudt), que resalta el tracto gastrointestinal para la Tomografía Computarizada. Todas las imágenes obtenidas fueron almacenadas en discos compactos y con ellas será elaborado el atlas digital. Una vez terminado el estudio se vigiló la recuperación del estado anestésico del animal.
Después de realizados los estudios imagenológicos se procedió al sacrificio y conservación del animal, esto se realizó anestesiando al animal con tiopental sódico (10 mg/kg peso) luego se diseccionó y canuló la arteria carótida común, posteriormente el animal fue sacrificado por medio de una inyección endovenosa de pentobarbital y difenilhidantoina (Euthanex®, laboratorios Invet). A continuación, se realizó la perfusión arterial y venosa con solución fijadora compuesta de formaldehído al 1%, ácido fénico, glicerina y agua para fijar los tejidos.
Resultados Preliminares
La resonancia magnética dió como resultado imágenes de secciones transversales, sagitales y frontales del cuerpo del animal en cuestión, tanto en tiempos de relajación T1 como T2, y además de las secuencias contrastadas con gadopentato dimeglumina (viewgam®, laboratorio Bacon saic), para obtener un buen contraste vascular. Se obtuvieron entonces un total de 700 imágenes (véase Figura 8), en las que se aprecia toda la estructura anatómica del animal a un nivel corporal total, y con las propiedades de la resonancia magnética se puede obtener una imagen tridimensional de las estructuras del cuerpo. Estas imágenes serán correlacionadas con los cortes del animal y analizadas para reconocer las estructuras anatómicas vistas en ellas.
La tomografía computarizada arrojó un total de 400 imágenes (véase Figura 9) de secciones transversales del cuerpo del animal que, como las imágenes de resonancia magnética, serán correlacionadas con los cortes del animal y también con las imágenes de resonancia magnética para completar la información imagenológica total del atlas. Hasta el momento todas las imágenes se encuentran analizadas y listas para ser cargadas en el software, que se encuentra en elaboración.
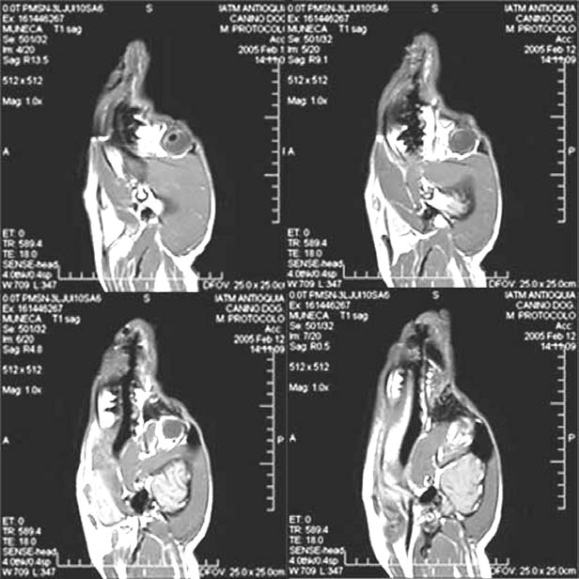
Figura 8. Secuencia sagital del cráneo por resonancia magnética en T1.
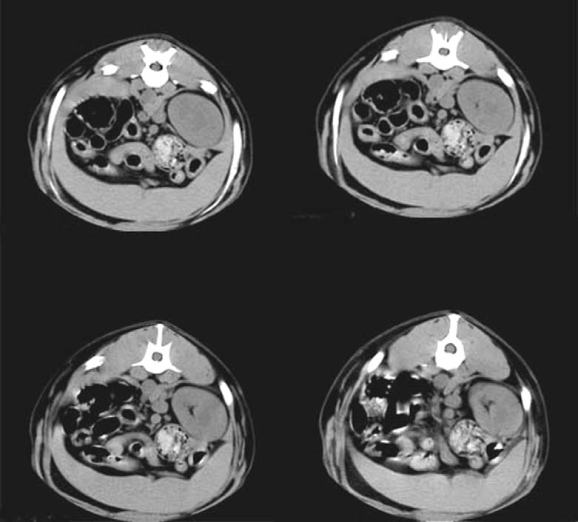
Figura 9. Secuencia transversal de abdomen por tomografía computarizada.
Conclusiones
La resonancia magnética y la tomografía computarizada son técnicas imagenológicas que se han constituido hasta el momento en una herramienta adicional usada por los médicos veterinarios para el diagnóstico de alteraciones orgánicas, tales como anormalidades estructurales, afecciones cardiovasculares, desórdenes del sistema nervioso central y neoplasias.
Es importante la relación que se puede establecer con la resonancia magnética, la tomografía computarizada y con los cortes anatómicos de un animal, ya que se constituyen en una fuente de información valiosa para el estudio de la anatomía imagenológica, sobre todo en el ámbito latinoamericano que carece de fuentes inmediatas de consulta de dicha anatomía, es pues de gran valor académico la construcción del atlas.
Summary
Computer axial tomografhy and magnetic resonance for elaborating a segmentary anatomy atlas of dogs
This article describes the process of creation of a digital atlas of canine anatomy by criosectioning with computed tomography and magnetic resonance. The atlas is intended to be of help for students and practitioners. A medium size, adult, healthy creole, black colored bitch was used, weighing 22 Kg. Computed tomography and magnetic resonance were performed at the San Vicente de Paul Hospital and at the Instituto de Alta Tecnología Médica de Antioquia (IATM), respectively. Segmentary images (frontal, sagital and transverse) of the complete body were obtained and analyzed by comparison with real cuts of the dog’s body. Besides its use for the atlas these images are available in the animal anatomy laboratory at the Universidad de Antioquia.
Key words: diagnosis, hounsfield, images, sagital, spin.
Referencias
1. Amaro E Jr, Barker GJ. Study design in fMRI: basic principles. 2006; 60:220-232.
2. Assheuer J, Sager M. MRI and CT Atlas of the dog. Oxford: Backwell Science; 1997. [ Links ]
3. Bakker NH, Lohuis PJ, Menger DJ, Nolst Trenite GJ, Fokkens WJ, et al. Objective computerized determination of the minimum cross-sectional area of the nasal passage on computed tomography. Laryngoscope 2005; 115: 1809-1812. [ Links ]
4. Bottcher P, Maierl J. Macroscopic cryosectioning: a simple new method for producing digital, three dimensional database in veterinary anatomy. Anat Histol Embryol 1999; 28: 97 – 102.
5. Czernyc, Gstottner w, Imhof h. Computed tomography and magnetic resonante tomography of the normal temporal bone. Radiologe 2003; 43: 200-206. [ Links ]
6. Das M, Sauer F, Schoepf UJ, Khamene A, Vogt SK, et al. Augmented reality visualization for CT-guided interventions: system description, feasibility, and initial evaluation in an abdominal phantom. Radiology. 2006; 240: 230-235. [ Links ]
7. Fike JR, Druy EM, Zook BC, Davis DO, Thompson JE, Chaney E, Bradley EW. Canine anatomy as assessed by computerized tomography. Am J Vet Res 1980; 41: 1823 – 1832.
8. Fishman EK, Lawler LP. CT angiography: principles, techniques and study optimization using 16-slice multidetector CT with isotropic datasets and 3D volume visualization. Crit Rev Comput Tomogr. 2004;45: 355-388[ [ Links ]STANDARDIZEDENDPARAG]
9. Friedman BR, Jones JP, Chaves Muñoz G. Principles of MRI. New York: McGraw-Hill; 1990. p. 69. [ Links ]
10. Fuchs C, Meyer-Lindenberg A, Wohlsein P, Nolte I. Computertomographic characteristics of primary brain tumors in dogs and catsBerl Munch Tierarztl Wochenschr. 2003; 116: 436-442. German. Erratum in: Berl Munch Tierarztl Wochenschr. 2003; 116: 527. [ Links ]
11. Hatchcock JT, Stickle RL. Principles and concepts of computed tomography. Vet Clin North Am: Small Anim Pract 1993; 23:399 – 416.
12. Oliver JE, Lorenz ND, Kornegay JN. Pelvic limb paresis, paralysis or ataxia. En: Handbook of veterinary neurology. Oliver JE, Lorenz ND, Kornegay JN (Eds). Philadelphia: Saunders, 1997. [ Links ]
13. Sande RD. Radiography, myelography, computed tomography, and magnetic resonance imaging of the spine. Vet Clin North Am: Small Anim Pract 1992; 22: 811-831. [ Links ]
14. Shores A. New and future advanced imaging techniques. Vet Clin North Am Small Anim Pract 1993; 23: 461-469. [ Links ]
15. Snyder JM, Shofer FS, Van Winkle TJ, Massicotte C. Canine intracranial primary neoplasia: 173 cases (1986-2003). J Vet Intern Med 2006; 20: 669-675. [ Links ]
16. Sprawls P. CT image formation. In: Physical Principles of Medical Imaging. Rocksville, Aspen, 1987. p 327, 330 – 335, 339 – 341, 346.
17. Stickle RL, Hatchcock JT. Interpretation of computed tomographic images. Vet Clin North Amer: Small Anim Pract 1993; 23: 417 – 435.
18. Thrall, DE. Manual de diagnostico radiológico veterinario. 4ta ed. Madrid (Esp): Saunders; 2003. p. 28 – 34.
19. Tucker RL, Gavin PR. Brain imaging. Vet Clin North AM: Small Anim Pract 1996; 26: 735 – 758.
20. Wales J. Sanger L. Wikipedia, encyclopedia libre 2001; [fecha de acceso: 28 de octubre de 2005]. Resonancia magnética nuclear URL: http://es.wikipedia.org/wiki/resonancia_magn%C3%A9tica_nuclear[ [ Links ]STANDARDIZEDENDPARAG]
Héctor F Aguinaga1, MV; Jairo A Rivera1, MVZ, PhD; Lynda J Tamayo1, MV, Esp; Mauricio Tobón R2, Est. MV; Roberto C Osorno Ch2, Est. MV.
1Docentes , Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia.
2Estudiantes de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia. Apartado aéreo 1226, aguinaga@agronica.udea.edu.co
(Recibido: 13 diciembre, 2005; aceptado: 12 octubre, 2006)
Resumen
El artículo describe el método ara la elaboración de un atlas digital de la anatomía segmentaria del perro, por crioseccionamiento, mediante las técnicas de tomografía axial computarizada y de resonancia magnética. Dicho atlas es una herramienta didáctica y de apoyo diagnóstico para estudiantes de pre y posgrado, y para los profesionales del área. Para el procedimiento se utilizó una hembra canina, adulta, criolla, de color negro, clínicamente sana, de aproximadamente 4 años de edad, 22 kg de peso y de tamaño mediano (50 cm de altura a la cruz). Los exámenes imagenológicos de tomografía axial computarizada y de resonancia magnética se llevaron a cabo en el Hospital San Vicente de Paúl y en el Instituto de Alta Tecnología Médica de Antioquia (IATM), respectivamente. Se obtuvieron imágenes segmentarias de la estructura corporal total del animal en sus planos frontal, sagital y transverso o axial. Con base en estas imágnes se compararon las estructuras anatómicas con los cortes del cadáver del animal. Además de la utilidd para el atlas digital, las imágenes formarán parte de una base de datos a utilizar en el laboratorio de anatomía animal de la Universidad de Antioquia.
Palabras clave: diagnóstico, hounsfield, imagenología, sagital, spin.
Introducción
Las técnicas médicas de imagenología de más avanzada tecnología, como la tomografía computarizada (TC) y la resonancia magnética (RMN), han tomado auge en la medicina veterinaria, gracias a que ha aumentado su disponibilidad y disminuido su costo. Estas técnicas tienen grandes ventajas sobre la técnica de rayos X convencional, ya que permiten una diferenciación superior de los tejidos blandos y evitan la superposición de estructuras subyacentes (10).
La TC se ha establecido como un procedimiento radiográfico importante para la detección y localización de lesiones intracraneales en personas. La capacidad de resolución, carácter no invasivo y la representación de la anatomía en cortes transversales inherentes a la TC facilitan la obtención de una visualización exacta de las relaciones morfológicas y ofrecen muchas ventajas sobre las técnicas radiográficas convencionales (10).
La disponibilidad de la TC y la RMN esta aumentando para los médicos veterinarios, particularmente para aquellos dedicados a los pequeños animales. (9, 13, 17) Según lo reportan Stickle y Hatchcock (17), muchos colegios veterinarios y centros de referencia especializados están ofreciendo estas ayudas diagnósticas. Esto ha ocurrido por las ventajas diagnósticas que tienen la TC y la RMN para ciertos pacientes (16). En nuestro medio se están empezando a utilizar estas técnicas, mediante convenios con centros médicos de imagenología, especialmente para el diagnóstico de ciertos problemas neurológicos comunes en pequeños animales, como las hernias discales (12), y para la localización de neoplasias, aunque tiene un gran potencial para el diagnóstico de una gran variedad de patologías.
La tecnología ha avanzado hasta el punto que pueden crearse modelos gráficos en tres dimensiones de gran calidad, de diversas estructuras anatómicas. Esto permite la visualización, manipulación y edición de reconstrucciones anatómicas de alta fidelidad (14). Esto es de gran ayuda en pedagogía, para crear nuevos modelos de enseñanza-aprendizaje de la anatomía veterinaria.
La interpretación de las imágenes requiere, como en cualquier técnica radiográfica, de un conocimiento muy profundo de la anatomía de la estructura que esta siendo analizada, (1, 7, 13). La imagen del cuerpo en secciones transversales requiere del entendimiento de la anatomía topográfica. Se debe tener la habilidad de reconocer las estructuras en los diferentes planos (dorsal, transversal y sagital); al igual que las características de los diferentes tejidos en la imagen, según la técnica y los parámetros escogidos (1). Sin embargo, la anatomía rara vez se enseña mediante este tipo de cortes y en la literatura existen pocas ilustraciones de esta forma del cuerpo canino (3).
Los médicos veterinarios en nuestro medio no han sido entrenados para pensar en términos de anatomía en secciones transversales, y esto representa un problema para la interpretación de la TC y RMN. Teniendo en cuenta que estos profesionales deben revisar a diario la anatomía en radiografías de rutina y que este método diagnóstico no permite una clara identificación de las estructuras anatómicas sobre todo de carácter tridimensional, hace necesario y justificable el conocimiento de la anatomía por tomografía y resonancia magnética. (17).
Para analizar las imágenes obtenidas por TC y RMN, el médico veterinario se apoya en la interpretación que de dichas imágenes realiza el médico, quien se basa en sus conocimientos de la anatomía y la patología humana. Es en este punto donde se ve la necesidad de elaborar un atlas de anatomía segmentaria canina comparativa (criosecciones axiales, TC y RMN), para establecer diagnósticos más ajustados a este tipo de especie.
La interpretación fidedigna de las imágenes diagnósticas por TC y RMN, requiere por lo tanto, de un conocimiento profundo de la anatomía, especialmente de la anatomía topográfica, por ello, debe estar apoyada en atlas y modelos animales.
Hasta el momento sólo existe un atlas de TC y RMN en el perro (2, 4), pero no incluye crio secciones axiales. Adicionalmente, no se encuentra en el medio, lo que lo hace demasiado costoso.
Este trabajo permitirá ofrecer a los estudiantes de pregrado, postgrado, docentes y médicos veterinarios practicantes un nuevo modelo de aprendizaje, con el cual podrán identificar las estructuras anatómicas de manera eficiente en imágenes de TC y RMN. De esta manera se puede mejorar la capacidad diagnóstica.Una publicación de este tipo realizada por la Universidad de Antioquia, sería la primera a nivel latinoamericano.
Principios de tomografía computarizada
La tomografía computarizada (TC) es el proceso de producción de secciones de imágenes de un cuerpo usando rayos – X y computadores (11). Un examen completo de TC consiste en un número de cortes de imágenes continuas a través de un área de interés (11), con lo que se pueden visualizar de forma directa, las estructuras internas de dicha área.
Los principios básicos de la TC son similares a los de la radiografía convencional, donde se utilizan rayos-X para crear un mapa de atenuación de los tejidos de una determinada área de estudio en un paciente y esta atenuación se traduce en datos matemáticos que son organizados por un computador y a los cuales se les aplica un algoritmo matemático (11, 18). La imagen capturada por el tomógrafo no es mas que una matriz conformada por cuadros dispuestos en filas y columnas, donde cada cuadro es un píxel, y de acuerdo al grado de atenuación, a este píxel se le asocia un color sea negro, blanco o alguno de la escala de grises (véase Figura 1) (2, 18).
Cada cuadro o píxel tiene una profundidad determinada por el grosor con que se está realizando la tomografía en el paciente en cada corte y a este grado de profundidad se le denomina el vóxel. Cuando el computador reconstruye las imágenes, los valores del vóxel de la imagen se normalizan al coeficiente de atenuación lineal del agua. Estos valores se expresan en Unidades Hounsfield (UH) (Véase Figura 2). El agua tiene una UH de 0, el hueso cortical tiene una UH de +1000 y el aire una UH de -1000. Los diferentes órganos y tejidos dentro del cuerpo tienen valores UH característicos (18).

Figura 1. Diagrama que muestra la representación de los píxeles y los voxels de un corte en la tomografía computarizada (11).

Figura 2. Esquema que representa la escala de Hounsfield utilizada para establecer la medida de contraste de los píxeles de una imagen de tomografía computarizada (11).
El Proceso de tomografía computarizada
La realización de la tomografía se compone de varios pasos que se indican a continuación (5, 11):
Recolección de datos. La intensidad relativa con la que el haz de rayos X emergen del paciente, es la forma de adquisición de datos. Este paso involucra la mesa del paciente y Gantry, las cuales son porciones de un escáner de tomografía computarizada (véase Figura 3). La mesa facilita el movimiento del paciente dentro del Gantry de acuerdo a la porción del cuerpo que se desee estudiar (6, 11, 18).
El Gantry esta constituido por un tubo de rayos X, un colimador y un detector de rayos X. El tubo gira 360º alrededor del paciente, emitiendo un haz de rayos X. El colimador determina el grosor del corte (usualmente 1 – 10 mm) (11, 16). Los rayos X son atenuados por el paciente y esta atenuación depende del grosor del corte y las estructuras que estén en el camino del rayo a través del paciente. El detector juega un papel similar al de una película convencional de rayos X. Los fotones que salen del paciente son absorbidos por los detectores y son transformados en un signo electrónico y ampliados, y luego este es convertido a un número según su intensidad (calidad y cantidad) (6, 11, 16).
La computadora usa estos números para calcular el coeficiente de atenuación lineal de cada vóxel y asignarle un rango de color de la escala de grises al pixel. El número es lo que la computadora entiende y el procesamiento de estos números es el paso siguiente para la producción de la imagen final (11, 18).

Figura 3. Tomógrafo del Hospital San Vicente de Paúl (Medellín, Colombia). En la imagen se observa el Gantry y la mesa del paciente, donde se realiza la recolección de datos.
Procesamiento computarizado de los datos. La imagen final se hace por numerosas filas y columnas de píxeles, que representan un pequeño bloque de tejido (vóxel). El coeficiente de atenuación lineal para los tejidos del bloque son determinados al realizar proyecciones múltiples a través del mismo bloque, esto es logrado ya que el tubo gira alrededor del paciente y los datos se recolectan de todos los ángulos posibles con lo que se forma un método matemático complejo que se usa para determinar el coeficiente de atenuación lineal de cada voxel en la matriz (6, 8, 11,). Se requiere entonces de cientos de miles de cálculos matemáticos simultáneos para lograr lo que se conoce como reconstrucción primaria de la imagen (11, 16).
El resultado de los cálculos es asignar a cada píxel un número que representa el coeficiente de atenuación lineal, estos números son llamados números de tomografía computarizada (6, 11, 16). El rango de estos números varía de +1000 a -1000 y se conoce como la escala de Hounsfield. En esta escala al hueso cortical se le asigna un valor de +1000, al aire -1000 y al agua cero. A los otros tejidos se le asigna un número de acuerdo a su densidad relativa (8, 11, 18).
Exposición de la imagen. Los colores de la escala de grises se les asignan a los tejidos de acuerdo al número de la escala de Hounsfield, el blanco brillante se le asigna al hueso (+ 1000 UH), el negro se le asigna al aire (- 1000 UH) y el agua se le asigna un gris central (cero UH) (6, 11, 18). El gran contraste logrado por la tomografía computarizada, se debe a que utiliza de 32 a 64 niveles de grises, estos son más que suficientes ya que el ojo humano sólo diferencia de 20 a 30 niveles de grises (11). Cuando hay muchos números del mismo grupo en una imagen, el contraste de los tejidos de la imagen disminuyen. El operador puede escoger que parte de la escala será el gris central y que rango de números tendrá la escala para esa imagen, esto se conoce como ancho de ventana (11, 15, 18). Todos los tejidos con números por encima del nivel superior de la nueva escala aparecerán blancos y aquellos por debajo aparecerán negros. Esta herramienta es útil para evaluar cierto tipo de tejidos (11, 16).
Almacenamiento de la imagen. La imagen mostrada puede ser grabada en una película de rayos X convencionales y los datos pueden ser guardados en un computador para revisiones y manipulaciones posteriores (11) (véase Figura 4).

Figura 4. Formación, manipulación y almacenamiento de la imagen en el computador. (Hospital San Vicente de Paúl, Medellín, Colombia).
Principios de resonancia magnética
La resonancia magnética nuclear (RMN o NMR de sus siglas en inglés) es un fenómeno físico basado en las propiedades magnéticas que poseen los núcleos atómicos. Permite alinear los campos magnéticos de diferentes átomos en la dirección de un campo magnético externo. La respuesta a este campo externo depende del tipo de núcleos atómicos por el que el campo magnético pasa a través de los diferentes tejidos (1, 18, 20).
Los fundamentos de la RMN dependen de varios fenómenos relacionados con el núcleo atómico, éste se compone de protones y neutrones y ambos tienen una propiedad denominada espinó momento angular intrínseco (1). El protón entonces, se comporta como un imán y crea un pequeño campo magnético en torno a sí; esta propiedad, de comportarse como un imán y generar un espin, se llama dipolo magnético (18). Si hay un número impar de protones, el protón desparejado ejercerá un dipolo magnético con una intensidad y dirección (una magnitud vectorial) discretas (1, 18). El átomo de hidrógeno es el núcleo mas abundante en el cuerpo presentando un protón desparejado, esto hace que se capte con mayor frecuencia en la RMN. Otros posibles núcleos con protones impares que podrían dar imagen en RMN son: Na, P, F (1, 9, 18).
La técnica de RMN usa equipos con potentes imanes capaces de generar campos magnéticos que oscilan desde 0.2 hasta 2 o más Tesla (10.000 Gauss, unidad de densidad de flujo magnético) (1, 20). Los campos así generados son capaces de alinear ordenadamente el momento magnético nuclear de los átomos con un número impar de nucleones del organismo que se estudia. Cuando el campo magnético cesa bruscamente, los momentos de los átomos del organismo se desalinean, orientándose cada uno en una dirección distinta, al azar, al tiempo que emiten radiaciones electromagnéticas en una banda de radiofrecuencia. Estas radiaciones son recogidas y procesadas por ordenador, y se emplean para reconstruir imágenes del interior del cuerpo en las cuales la intensidad mayor o menor de la señal corresponde a los átomos de hidrógeno de los tejidos y del agua corporal (1, 18, 20).

Figura 5. Escáner de resonancia magnética del Instituto de Alta Tecnología Médica de Antioquia (Colombia). En la foto se observa el gantry y la mesa del paciente
El Proceso de la resonancia magnética
Los componentes del sistema incluyen: El magneto, las bobinas receptoras y la computadora. El magneto y las bobinas se encuentran en el Gantry del equipo, y son los componentes que darán origen a los datos y que posteriormente serán analizados por la computadora (1, 9) (véase Figura 5).
El paciente es colocado sobre la mesa y deslizado hacia la abertura del Gantry, donde será sometido a las ondas electromagnéticas que darán origen a los datos que posteriormente formarán la imagen (véase Figura 6). Los magnetos están contenidos dentro de una cubierta metálica llena con helio líquido, estos magnetos están alrededor del Gantry. La estabilidad del campo magnético es permitida por un superenfriamiento de las bobinas magnéticas. Existen también unas bobinas de cobre ubicadas dentro del Gantry paralelas al campo magnético externo. La función de estas bobinas es detectar las señales de radiofrecuencia producidas por los cambios en el campo magnético del paciente. Estas señales son medidas y con ellas se construye la imagen (1, 9).
La computadora permite al programador instalar o crear parámetros para el estudio de las imágenes, formular y transmitir instrucciones para la producción de unos pulsos secuenciales de radiofrecuencia dirigidos a una región de interés y analizar los datos de la muestra para formar la imagen (9).

Figura 6. Ubicación del paciente en el escáner para la recolección de datos.
Tiempos de Relajación T1 y T2
El pulso secuencial magnético usado mas a menudo para formar las imágenes es el pulso secuencial espin – eco. Inicialmente se aplica un pulso magnético para girar el campo nuclear 90º, luego de cierto tiempo se produce un segundo pulso para girarlo hacia 180º (9).
Ocurre una relajación antes del próximo pulso de 90º y durante la relajación se producen ondas de radiofrecuencias que son detractados por las bobinas. El tiempo entre el pulso de 90º y la detección de la ondas de radiofrecuencia por las bobinas es llamado tiempo eco o TE. El tiempo que pasa entre cada frecuencia pulsátil es llamado tiempo de repetición o TR (1,9).
El contraste de las imágenes se controla principalmente por TE y TR. Existen combinaciones apropiadas que pueden ser seleccionadas para producir imágenes contrastadas relacionadas con diferencias en la densidad del protón, estos son llamados tiempos de relajación T1 y T2. La gran diferencia esta en la magnitud del campo magnético durante la fase de relajación del proceso de realineación (luego del cese brusco del pulso magnético). Durante la relajación, el campo magnético tiene dos componentes llamados magnetización longitudinal y transversal (1).
La relajación T1 (relajación longitudinal); se puede definir como el tiempo (milisegundos, y segundos) que los protones necesitan para recuperar el 63.2% de su valor Mz (momento magnético neto) original, tras aplicar un pulso de radiofrecuencia que hace rotar 90º al momento magnético neto original. La relajación T2 (relajación transversal) se define como el tiempo necesario para reducir la magnetización transversal neta del 37% del valor original (18).
El contraste para T1 está controlado por el TR, mientras que las diferencias de contraste para el tejido en T2 son controladas por el TE. Los tiempos de relajación están relacionados con la tasa en la que ciertos tejidos pueden absorber o liberar ondas de radiofrecuencia. La relajación T1 está dada por la interacción espín – rejilla y la relajación T2 esta dada por la interacción espín –espín. El espín rejilla se refiere al intercambio de energía de los protones con las estructuras que la rodean que no son protones. El espín-espín se refiere al intercambio de energía con otros protones (1 , 9). Una imagen se considera en T1 cuando el TR y el TE son cortos, al contrario de la imagen en T2, donde estos tiempos son largos (1).
Al revisar una imagen de RMN, las estructuras se consideran por la intensidad de señal que se produce, considerándose el blanco como “hiperintenso” o con alta intensidad de señal, y el negro como “hipointenso” , o con baja amplitud de señal, o ausencia de la misma (1). Las diferencias de contraste entre estos dos tiempos de relajación permiten diferenciar tejidos que no se ven en una u otra, por ejemplo; El líquido cerebro espinal en los ventrículos laterales del cerebro; en T1, éste aparece oscuro (hipointenso), en T2 aparece blanco brillante (hiperintenso) (1, 9) (véanse Tabla 1 y Figura 7).

Figura 7. A, Tiempo de Relajación T1 y B, Tiempo de Relajación T2. Nótense las diferencias de apariencia del líquido cerebro-espinal en los ventrículos laterales. Los detalles anatómicos se ven con mejor claridad en la imagen T1, mientras que el contraste de densidades es más evidente en la imagen T2.
Tabla 1. Caracterización de algunos tejidos del cuerpo y su contraste en los tiempos de relajación T1 y T2.

Teniendo en cuenta las características de los tiempos de relajación T1 y T2 se concluye que T1 es bueno para observar detalles anatómicos y mejorar el contraste y T2 es bueno para identificar masas, edemas y otros fluidos.
Materiales y métodos
Se trabajó con una hembra canina, adulta, sana, de 22 kg de peso y tamaño mediano, ya que es más fácil el manejo y la obtención de los cortes.
El estudio de resonancia magnética se realizó en las instalaciones del Instituto de Alta Tecnología Médica de Antioquia (IATM) en un Sistema Gyroscan ACS-NT 1.5 TESLA PULSAR última versión 10.3 de siemens (véase Figura 3). El estudio de tomografía computarizada se realizó en las instalaciones del Hospital Universitario San Vicente de Paúl en un escanógrafo General Electric CT Prosped (véase Figura 1).
Para ambos procedimientos el animal fue transportado hasta las instalaciones respectivas, con la vena cefálica canulada con un catéter número 20 para la administración de una solución de cloruro de sodio al 0.9 %, a dosis de 50 ml/kg/24 horas. La inducción anestésica se realizó con maleato de acepromacina (Tranquilan®, Laboratorios Zoo Ltda), vía endovenosa, a dosis de 0.02mg/kg, y luego tiopental sódico (Tiopental®, laboratorios Biochemie), vía endovenosa a dosis de 20 mg/kg como anestésico general. Posteriormente fue colocado un tubo endotraqueal y una sonda uretral conectada a un equipo de venoclisis y bolsa colectora. El animal fue completamente envuelto en campos quirúrgicos. La profundidad de la anestesia se controló por medio de un fonendoscopio esofágico, para medición de frecuencia cardíaca y respiratoria. El animal fue colocado en la mesa móvil en posición decúbito esternal, con almohadillas en el cuello y la cabeza para un óptimo alineamiento. Posteriormente se introdujo en el Gantry del equipo.
El estudio se llevó a cabo con cortes axiales de 1mm de espesor. Se realizó un estudio simple y luego contrastado con gadopentato dimeglumina (viewgam®, laboratorio Bacon saic) para Resonancia Magnética; y Loversol (Optiray-320®, laboratorios Mallinckudt), que resalta la vasculatura y Iothamalato meglumine (Conray®, laboratorios Mallinckudt), que resalta el tracto gastrointestinal para la Tomografía Computarizada. Todas las imágenes obtenidas fueron almacenadas en discos compactos y con ellas será elaborado el atlas digital. Una vez terminado el estudio se vigiló la recuperación del estado anestésico del animal.
Después de realizados los estudios imagenológicos se procedió al sacrificio y conservación del animal, esto se realizó anestesiando al animal con tiopental sódico (10 mg/kg peso) luego se diseccionó y canuló la arteria carótida común, posteriormente el animal fue sacrificado por medio de una inyección endovenosa de pentobarbital y difenilhidantoina (Euthanex®, laboratorios Invet). A continuación, se realizó la perfusión arterial y venosa con solución fijadora compuesta de formaldehído al 1%, ácido fénico, glicerina y agua para fijar los tejidos.
Resultados Preliminares
La resonancia magnética dió como resultado imágenes de secciones transversales, sagitales y frontales del cuerpo del animal en cuestión, tanto en tiempos de relajación T1 como T2, y además de las secuencias contrastadas con gadopentato dimeglumina (viewgam®, laboratorio Bacon saic), para obtener un buen contraste vascular. Se obtuvieron entonces un total de 700 imágenes (véase Figura 8), en las que se aprecia toda la estructura anatómica del animal a un nivel corporal total, y con las propiedades de la resonancia magnética se puede obtener una imagen tridimensional de las estructuras del cuerpo. Estas imágenes serán correlacionadas con los cortes del animal y analizadas para reconocer las estructuras anatómicas vistas en ellas.
La tomografía computarizada arrojó un total de 400 imágenes (véase Figura 9) de secciones transversales del cuerpo del animal que, como las imágenes de resonancia magnética, serán correlacionadas con los cortes del animal y también con las imágenes de resonancia magnética para completar la información imagenológica total del atlas. Hasta el momento todas las imágenes se encuentran analizadas y listas para ser cargadas en el software, que se encuentra en elaboración.

Figura 8. Secuencia sagital del cráneo por resonancia magnética en T1.

Figura 9. Secuencia transversal de abdomen por tomografía computarizada.
Conclusiones
La resonancia magnética y la tomografía computarizada son técnicas imagenológicas que se han constituido hasta el momento en una herramienta adicional usada por los médicos veterinarios para el diagnóstico de alteraciones orgánicas, tales como anormalidades estructurales, afecciones cardiovasculares, desórdenes del sistema nervioso central y neoplasias.
Es importante la relación que se puede establecer con la resonancia magnética, la tomografía computarizada y con los cortes anatómicos de un animal, ya que se constituyen en una fuente de información valiosa para el estudio de la anatomía imagenológica, sobre todo en el ámbito latinoamericano que carece de fuentes inmediatas de consulta de dicha anatomía, es pues de gran valor académico la construcción del atlas.
Summary
Computer axial tomografhy and magnetic resonance for elaborating a segmentary anatomy atlas of dogs
This article describes the process of creation of a digital atlas of canine anatomy by criosectioning with computed tomography and magnetic resonance. The atlas is intended to be of help for students and practitioners. A medium size, adult, healthy creole, black colored bitch was used, weighing 22 Kg. Computed tomography and magnetic resonance were performed at the San Vicente de Paul Hospital and at the Instituto de Alta Tecnología Médica de Antioquia (IATM), respectively. Segmentary images (frontal, sagital and transverse) of the complete body were obtained and analyzed by comparison with real cuts of the dog’s body. Besides its use for the atlas these images are available in the animal anatomy laboratory at the Universidad de Antioquia.
Key words: diagnosis, hounsfield, images, sagital, spin.
Referencias
1. Amaro E Jr, Barker GJ. Study design in fMRI: basic principles. 2006; 60:220-232.
2. Assheuer J, Sager M. MRI and CT Atlas of the dog. Oxford: Backwell Science; 1997. [ Links ]
3. Bakker NH, Lohuis PJ, Menger DJ, Nolst Trenite GJ, Fokkens WJ, et al. Objective computerized determination of the minimum cross-sectional area of the nasal passage on computed tomography. Laryngoscope 2005; 115: 1809-1812. [ Links ]
4. Bottcher P, Maierl J. Macroscopic cryosectioning: a simple new method for producing digital, three dimensional database in veterinary anatomy. Anat Histol Embryol 1999; 28: 97 – 102.
5. Czernyc, Gstottner w, Imhof h. Computed tomography and magnetic resonante tomography of the normal temporal bone. Radiologe 2003; 43: 200-206. [ Links ]
6. Das M, Sauer F, Schoepf UJ, Khamene A, Vogt SK, et al. Augmented reality visualization for CT-guided interventions: system description, feasibility, and initial evaluation in an abdominal phantom. Radiology. 2006; 240: 230-235. [ Links ]
7. Fike JR, Druy EM, Zook BC, Davis DO, Thompson JE, Chaney E, Bradley EW. Canine anatomy as assessed by computerized tomography. Am J Vet Res 1980; 41: 1823 – 1832.
8. Fishman EK, Lawler LP. CT angiography: principles, techniques and study optimization using 16-slice multidetector CT with isotropic datasets and 3D volume visualization. Crit Rev Comput Tomogr. 2004;45: 355-388[ [ Links ]STANDARDIZEDENDPARAG]
9. Friedman BR, Jones JP, Chaves Muñoz G. Principles of MRI. New York: McGraw-Hill; 1990. p. 69. [ Links ]
10. Fuchs C, Meyer-Lindenberg A, Wohlsein P, Nolte I. Computertomographic characteristics of primary brain tumors in dogs and catsBerl Munch Tierarztl Wochenschr. 2003; 116: 436-442. German. Erratum in: Berl Munch Tierarztl Wochenschr. 2003; 116: 527. [ Links ]
11. Hatchcock JT, Stickle RL. Principles and concepts of computed tomography. Vet Clin North Am: Small Anim Pract 1993; 23:399 – 416.
12. Oliver JE, Lorenz ND, Kornegay JN. Pelvic limb paresis, paralysis or ataxia. En: Handbook of veterinary neurology. Oliver JE, Lorenz ND, Kornegay JN (Eds). Philadelphia: Saunders, 1997. [ Links ]
13. Sande RD. Radiography, myelography, computed tomography, and magnetic resonance imaging of the spine. Vet Clin North Am: Small Anim Pract 1992; 22: 811-831. [ Links ]
14. Shores A. New and future advanced imaging techniques. Vet Clin North Am Small Anim Pract 1993; 23: 461-469. [ Links ]
15. Snyder JM, Shofer FS, Van Winkle TJ, Massicotte C. Canine intracranial primary neoplasia: 173 cases (1986-2003). J Vet Intern Med 2006; 20: 669-675. [ Links ]
16. Sprawls P. CT image formation. In: Physical Principles of Medical Imaging. Rocksville, Aspen, 1987. p 327, 330 – 335, 339 – 341, 346.
17. Stickle RL, Hatchcock JT. Interpretation of computed tomographic images. Vet Clin North Amer: Small Anim Pract 1993; 23: 417 – 435.
18. Thrall, DE. Manual de diagnostico radiológico veterinario. 4ta ed. Madrid (Esp): Saunders; 2003. p. 28 – 34.
19. Tucker RL, Gavin PR. Brain imaging. Vet Clin North AM: Small Anim Pract 1996; 26: 735 – 758.
20. Wales J. Sanger L. Wikipedia, encyclopedia libre 2001; [fecha de acceso: 28 de octubre de 2005]. Resonancia magnética nuclear URL: http://es.wikipedia.org/wiki/resonancia_magn%C3%A9tica_nuclear[ [ Links ]STANDARDIZEDENDPARAG]














