Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.20 no.1 Medellín Mar./Jan. 2007
Martha R Chipatecua1, Zoot; Martha L Pabón1,2, Quím, PhD; Edgar A Cárdenas1, Zoot, MSc; Juan E Carulla1, Zoot, PhD;
1 Grupo de investigación en nutrición animal, Departamento de Ciencias para la Producción Animal, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Bogotá, Colombia. 2Departamento de Química, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá. Colombia.
jecarullaf@unal.edu.co
(Recibido: 5 abril, 2006; aceptado: 15 enero, 2007)
Resumen
En dos experimentos in vitro, se determinó el efecto de mezclar Lotus uliginosus cv Maku (anteriormente llamado L. pedunculatus) con Pennisetum clandestinum (kikuyo) sobre la degradación de la proteína en licor ruminal y de la materia seca en licor ruminal y licor ruminal con pepsina, en presencia o ausencia de polietilenglicol (PEG). Los tratamientos fueron: kikuyo, 70% de kikuyo y 30% de L. uliginosus con y sin PEG; 50% de kikuyo y 50% de L. uliginosus con y sin PEG y; L. uliginosus. La adición del L. uliginosus al kikuyo, al igual que la adición de PEG (inhibidor de la actividad de los taninos) aumentó la concentración y las tasas de acumulación de amonio en el sistema (p<0.01). Se encontró una estrecha relación entre los niveles de proteína soluble (r2=0.86) y los niveles de amonio en las primeras horas de incubación. La digestibilidad de la materia seca en licor ruminal sin y con pepsina (DIVMSr y DIVMSp) del L. uliginosus fue menor que la del kikuyo (p<0.01). En las mezclas hubo diferencias en la DIVMp pero no en la DIVMSr. La digestibilidad fue superior (p=0.0061) para la mezcla 70:30 que para la mezcla 50:50. La adición de PEG mejoró la DIVMSr y la DIVMSp en las mezclas. Se concluye que el L. uliginosus se podría incluir en la dieta de los rumiantes que pastorean kikuyo en bajas proporciones (30%) sin efectos negativos, pero mayores inclusiones reducirían la digestibilidad de la dieta debido al efecto de los taninos.
Palabras clave: amonio, digestibilidad, polifenoles, tanino.
Introducción
En Colombia, el sistema de producción de lechería especializada se caracteriza por un pastoreo rotacional, donde es común el uso de pasturas de kikuyo (Pennisetum clandestinum) y ryegrass (Lolium sp) que en algunos casos están asociadas con leguminosas como trébol (Trifolium sp.) y alfalfa (Medicago sativa) (15). Estas pasturas son normalmente ricas en proteína cruda (PC), nitrógeno no proteico (NNP) y nitrógeno soluble (NS) debido a la fertilización nitrogenada (32), lo cual puede resultar en elevadas concentraciones de amonio en el rumen y úrea a nivel sanguíneo (2) e implica un gasto energético asociado a la síntesis hepática de la urea (38).
El exceso de amonio ruminal puede disminuirse al reducir la degradación de la proteína en el rumen mediante el uso de taninos purificados (11) o con el uso de plantas forrajeras ricas en ellos (8, 29). Estudios en Nueva Zelanda han encontrado efectos positivos en producción y reproducción ovina mediante el uso de plantas taníferas del genero Lotus, asociados a un mayor flujo de aminoácidos al intestino (5, 28, 42). Varias especies de este género han sido introducidas para estudio en los sistemas de producción lechera intensiva de la Sabana de Bogotá (16).
Para estudiar el efecto de los taninos sobre las proteínas se han utilizado diferentes compuestos que ligan los taninos inhibiendo su efecto. El más utilizado es el polietilenglicol (PEG) que forma enlaces de hidrógeno con los OH fenólicos de los taninos (20, 35).
El objetivo de este trabajo fue determinar el efecto de mezclar Lotus uliginosus var. Maku con kikuyo sobre la degradación de la proteína en fluido ruminal y de la matería seca en fluido ruminal y fluido ruminal con pepsina en un sistema in vitro, en presencia y ausencia de PEG.
Materiales y métodos
Selección del material experimental
Se seleccionó la accesión L. uliginosus var. Maku (anteriormente llamado L. pedunculatus) (6) de una colección del género Lotus de la unidad de recursos genéticos forrajeros (URGF) de la Universidad Nacional de Colombia. La URGF se encuentra localizada en el municipio de Mosquera (Cundinamarca) a 4°42´ de latitud norte y 74°12´ de longitud oeste, con una altitud promedio de 2650 msnm y temperatura promedio de 13°C. Esta accesión se seleccionó entre cinco que fueron evaluadas, por su mayor contenido de taninos condensados y mejor adaptación a las condiciones ambientales. Las muestras de este ensayo fueron cosechadas en los meses de agosto y octubre.
Manejo de los forrajes y muestreo
Un área (2x5m) sembrada con la accesión de L. uliginosus var Maku fue cortada y fertilizada a razón (kg de elemento/ha) de 50 de fósforo (P), 25 de magnesio (Mg), 25 de azufre (S), 25 de potasio (K) y 1000 de cal dolomita. El kikuyo fue cortado y fertilizado (kg de elemento/ha) con 50 de nitrógeno (N), 25 de fósforo (P), 20 de potasio (K), 12 de magnesio (Mg) y 12 de azufre (S). A los 45 días de rebrote, se cosecharon los forrajes para determinar la composición nutricional, la concentración de taninos condensados (TC) y fenoles totales (FT). Las muestras de forraje fueron almacenadas, congeladas y posteriormente liofilizadas en la Corporación Colombiana de Investigación Agropecuaria (Corpoica) de Tibaitatá, después molidas en un molino de cuchillas (General Electric) con una criba de 1 mm.
Tratamientos
Se realizaron dos experimentos en diferentes periodos, el primero para determinar la concentración de N-NH3 a las horas 6, 12, 24, 36 y 48 de incubación in vitro como indicador indirecto de la degradación de la proteína de los forrajes (9) y el segundo para cuantificar digestibilidad in vitro de la materia seca en licor ruminal (DIVMSr) y digestibilidad in vitro de la materia seca en licor ruminal + pepsina (DIVMSp). Cada experimento tuvo seis tratamientos: 1) kikuyo, 2) 70% de kikuyo y 30% de L. uliginosus, 3) 70% de kikuyo y 30% de L. uliginosus más PEG, 4) 50% de kikuyo y 50% de L. uliginosus, 5) 50% de kikuyo y 50% de L. uliginosus más PEG, 6) L. uliginosus. En los tratamientos con PEG, se adicionaron 1.5 g de PEG (peso molecular 8000 Kd, Sigma P4463) por g de tanino.
Incubaciones
En los experimentos uno y dos, se utilizó un sistema in vitro que simula las condiciones del rumen y del abomaso (9) basado en la técnica de Tilley y Terry (37).
Experimento 1. Se utilizaron tres tubos plásticos de centrífuga de 100 ml por cada tratamiento, lo que corresponde a tres réplicas por tratamiento; cada tratamiento fue evaluado a seis horas diferentes (6, 12, 24, 36 y 48). En cada tubo fueron colocados 0.5 g del forraje solo o de una mezcla de kikuyo y L. uliginosus en relaciones 70:30 o 50:50; luego fueron adicionados 10 ml de tampón McDougall que contenía PEG (tratamientos 3 y 5) y sin PEG (tratamientos 1, 2, 4 y 6); posteriormente se dejó en reposo durante 12 horas a 39°C con el fin de permitir una interacción previa entre los compuestos. Transcurrido este tiempo se agregaron 40 ml del inóculo compuesto por fluido ruminal y tampón McDougall sin úrea, en relación 1:4. Inmediatamente se gasificaron los tubos con CO2 y se les colocó tapones de caucho provistos de válvulas de Bunsen; finalmente se incubaron y cumplida cada hora de evaluación fueron tomados 35 ml de fluido de cada tubo para cuantificar la concentración de amonio; después de tomada la muestra el residuo fue desechado.
Experimento 2. En este experimento se hicieron dos incubaciones simultáneas diferentes; la primera para hallar la DIVMSr y la segunda determinó la DIVMSp. Al igual que en el experimento uno se utilizaron tres tubos plásticos de centrifuga de 100 ml por cada tratamiento, lo que corresponde a tres réplicas por tratamiento y los pasos a seguir durante el proceso fueron los mismos descritos anteriormente. La diferencia consistió en que para determinar la DIVMSr se adicionó urea en el tampón y cumplidas las 48 horas de incubación los tubos fueron desmontados, el contenido lavado, filtrado y secado para obtener el peso en materia seca del residuo. Para hallar la DIVMSp se realizó el mismo proceso utilizado para determinar la DIVMSr y fueron incubados de igual forma por 48 horas inicialmente, luego de este tiempo se adicionó a cada tubo 6 ml de HCl al 7% p/v y 2 ml de solución acuosa de pepsina al 5% y fueron incubados por 24 horas adicionales. Cumplidas las 72 horas, el contenido de cada tubo fue lavado, filtrado y secado para determinar el peso en materia seca del residuo. El cálculo de la diferencia entre DIVMSp y DIVMSr permitió establecer la materia seca que no es degradable en rumen pero sí en el abomaso (MSndr).
Análisis Químicos
Caracterización nutricional de los forrajes. Los forrajes fueron analizados para proteína cruda (1), nitrógeno no proteico, nitrógeno soluble, nitrógeno insoluble en detergente ácido y nitrógeno insoluble en detergente neutro (19) y para fibra en detergentes neutro y ácido (39).
Extracción y cuantificación de fenoles totales y taninos condensados. Se realizó una extracción de cada muestra de acuerdo al método de Terrill et al (36), modificado por Carulla (7). Se pesaron 50 mg de cada muestra por duplicado, luego se adicionaron 2 ml de solución extractora compuesta de metanol al 70%, 0.5% de ácido fórmico y 0.05% de ácido ascórbico; posteriormente las muestras se colocaron en un agitador durante una hora y fueron centrifugadas a 4000 rpm durante 30 minutos separando el sobrenadante. Al precipitado se le adicionó más solución extractora, se agitó y se centrifugó dos veces más. Los sobrenadantes de cada duplicado fueron mezclados, los extractos fueron almacenados en frascos ámbar y puestos en refrigeración hasta ser utilizados para la cuantificación de fenoles totales (método de azul de Prusia modificado) (13) y taninos condensados (método del butanol-HCL) (36). Para la cuantificación de fenoles totales se usó como patrón el ácido gálico (Sigma G-8647). La cuantificación de taninos condensados se hizo en el Centro Internacional de Agricultura Tropical (CIAT) utilizando como patrón taninos purificados de la misma planta (12).
Análisis estadístico
Experimento 1. La tasa de acumulación de amonio se estimó por regresión lineal de las concentraciones de amonio durante las primeras horas de incubación (porción lineal de la curva) para cada tratamiento; el modelo es: Ŷ= βο + β1 donde Ŷ es el valor esperado en cada hora de evaluación, βο hace referencia al intercepto y β1 x es el valor de la pendiente con respecto a un tiempo equis. No fue posible usar otros modelos estadísticos como el de medidas repetidas en el tiempo ya que para cada hora evaluada se usaron tubos diferentes, de tal forma que las mediciones nunca se hicieron sobre la misma unidad experimental. Las regresiones fueron estimadas a través del procedimiento REG del programa estadístico SAS (Statistical Analysis System, versión 8.1), las tasas de acumulación (pendientes, β) se compararon por medio de un ANAVA y las diferencias entre tratamientos se determinaron por medio de la prueba t de Student. Se hicieron regresiones adicionales entre las concentraciones de proteínacruda, proteína soluble y los niveles de amonio usando el procedimiento stepwise de SAS (Statistical Analysis System, versión 8.1).
Experimento 2. El diseño de clasificación experimental corresponde a uno completamente al azar, con tres replicas por cada tratamiento; el modelo es el siguiente: Yij = µ + Ai + εj (i) donde Yij es la observación de la i-ésima unidad experimental, µ es la media general, Ai corresponde al efecto del tratamiento y εj (i) es el error experimental asociado con la i-ésima unidad experimental. Las digestibilidades de la materia seca con y sin pepsina se analizaron por medio de un ANAVA y se usaron contrastes ortogonales y la prueba de Tukey (p< 0.05) para determinar el efecto del forraje (kikuyo vs L. uliginosus), efecto de los taninos (PEG vs sin PEG) y efecto del nivel de la proporción gramínea leguminosa (70:30 vs 50:50) (paquete estadístico SAS versión 8.1). El modelo correspondiente es: Ho = µ1 = µ2 y Ha = µ1 ≠ µ2 donde, Ho es la hipótesis nula, Ha es la hipótesis alterna, µ1 la media de un tratamiento de interés y µ2 la media del tratamiento con el cual se quiere comparar µ1.
Resultados
Composición del material experimental
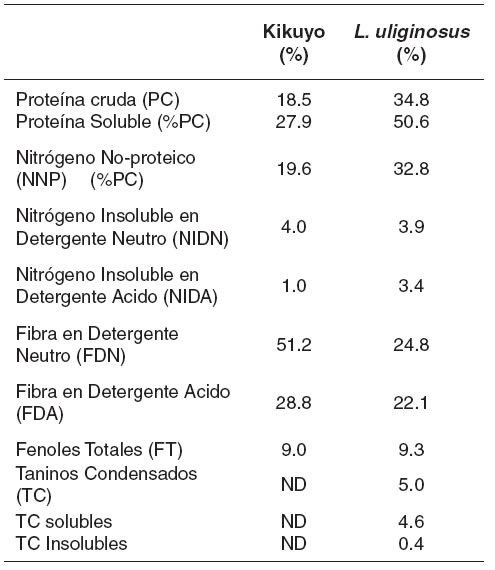
Se encontraron mayores niveles de proteína cruda en L. uliginosus que en el kikuyo. En la proteína del L. uliginosus las proporciones de proteína soluble y NNP fueron mayores, sugiriendo una mayor disponibilidad de proteína fácilmente degradable. Las concentraciones de fenoles totales fueron similares entre las dos especies y estas correspondieron principalmente a taninos condensados en el L. uliginosus (véase Tabla 1).
Liberación de amonio
Una vez iniciada la fermentación, L. uliginosus presentó mayores concentraciones de amonio que el kikuyo (p<0.01). La adición de PEG (usada para inhibir la actividad de los taninos) y el aumento de la inclusión de la leguminosa en la mezcla (30 vs 50%) aumentaron las concentraciones de amonio de las mezclas incubadas (p<0.01). La menor concentración de amonio en los diferentes tiempos de incubación fue para el tratamiento con kikuyo que presentó concentraciones de amonio similares a lo largo de la incubación (véase Figura 1).
Tabla 1. Composición química de los forrajes (% MS)
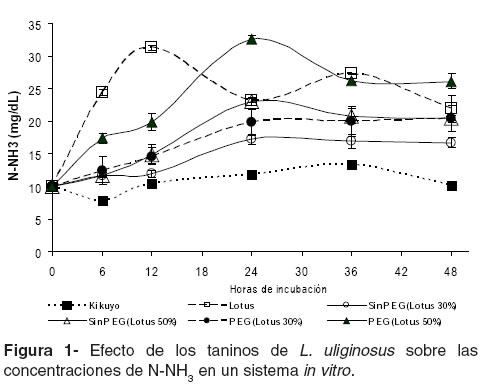
Tasas de acumulación de amonio
La tasa de acumulación de amonio estimada por regresión en la parte lineal de cada una de las curvas de concentración de amonio fue mayor para el tratamiento que contenía L. uliginosus solo (véase Tabla 2) (p<0.05).
Las tasas de acumulación de amonio aumentaron al incrementar la inclusión de leguminosa en las mezclas y al adicionar PEG a las mismas. El efecto de la inclusión de PEG fue más evidente para los tratamientos con mayores inclusiones de leguminosa en la mezcla (50:50) (véase Tabla 2).
El coeficiente de determinación para las tasas en la mayoría de tratamientos fue alto, mostrando una acumulación lineal de amonio asociada al tiempo de incubación para las primeras horas de incubación. Este no fue el caso del kikuyo, el cual presentó el coeficiente más bajo, indicando que no existió una acumulación de amonio en las primeras horas de fermentación (véase Tabla 2).
Digestibilidad in vitro de la materia seca (DIVMSr) con licor ruminal y licor ruminal seguido por pepsina (DIVMSp)
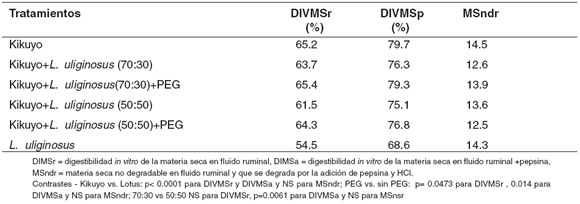
La DIVMSr y la DIVMSp fueron menores para el L. uliginosus que para el kikuyo. Sin embargo, la inclusión de Lotus no disminuyó significativamente la DIVMSr pero sí la DIVMSp. La adición de PEG aumentó la DIVMSr y la DIVMSp, mientras que la MSndr no fue afectada por la especie, los taninos o la inclusión de leguminosa en la mezcla (véase Tabla 3).
Tabla 2. Efecto de los taninos de L. uliginosus sobre la tasa de liberación de N-NH3 hasta las horas 12 y 24 de incubación in vitro.
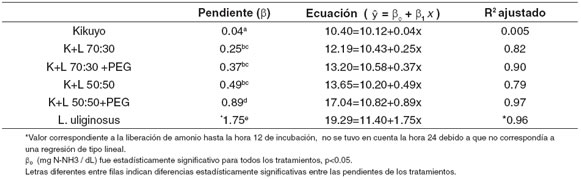
Tabla 3. Digestibilidad in vitro de la materia seca en fluido ruminal (48 h) y fluido ruminal más pepsina (72 h).
Discusión
Niveles y tasas de acumulación de amonio
Efecto de la especie. El kikuyo tuvo la menor concentración de amonio y esta fue más o menos constante a través del tiempo. La menor concentración de amonio se podría explicar porque este tratamiento presentó el menor nivel de PC de todos y se ha encontrado una estrecha relación entre el nivel de PC en los forrajes y la concentración de amonio ruminal en ausencia de taninos (14, 22).
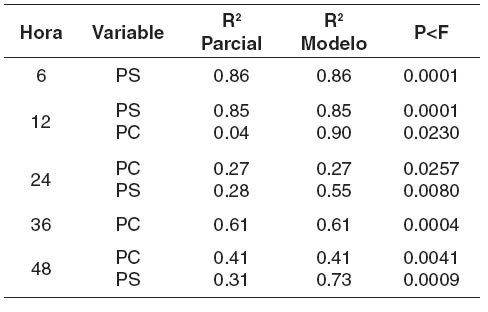
En este estudio se encontró una estrecha relación entre los niveles de proteína soluble con los niveles de amonio (véase Tabla 4). El grado de asociación entre proteína soluble y los niveles de amonio fue más fuerte en las primeras horas de incubación confirmando que esta fracción es la que se degrada primero como han sugerido otros autores (31, 40).
Tabla 4. Relación entre las concentraciones de PC, PS y NNP y la liberación de amonio in vitro.
Ha sido demostrado que la degradación ruminal de proteína en plantas tipo C4 como el kikuyo es más lenta que en especies C3 como el L. uliginosus (27,34). Esto se explica por la presencia de un tejido adicional denominado anatomía Kranz que hace que se presente una fase lag en la degradación de la proteína en el rumen (43). La extensión de una fase lag en la degradación de la proteína de plantas C4 podría explicar la disminución en la concentración de amonio en la hora 6 para el kikuyo mientras que la ausencia de estructuras tipo Kranz para el L. uliginosus explicaría las altas tasas deacumulación de amonio en las primeras horas de incubación para esta especie.
Efecto de las mezclas y de los taninos. La adición del L. uliginosus al kikuyo aumentó la concentración y las tasas de acumulación de amonio en el sistema debido a las altas concentraciones de proteína y nitrógeno soluble de la leguminosa. De la misma manera, la adición de PEG, que inhibe la actividad de los taninos, aumentó las concentraciones de amonio y las tasas de acumulación sugiriendo un efecto protector de los taninos sobre la degradación de la proteína como ha sido reportado en otros estudios (4, 10 ,24). Sin embargo, este efecto no fue suficiente para que las concentraciones de amonio en las mezclas fueran menores que en el tratamiento con kikuyo solo. Relaciones tanino/proteína mayores a las observadas en este estudio (6.4%) son necesarias para un mayor nivel de protección (3, 11, 30).
DIVMS en fluido ruminal con y sin pepsina
Efecto de la especie y los taninos. Contrario a lo esperado, la DIVMSr y DIVMSp del L. uliginosus fue menor que la del kikuyo. Una menor cantidad de FDN y FDA en el L. uliginosus debería reflejarse en una mayor digestibilidad (38). Esta aparente contradicción se podría explicar por la presencia de taninos en el Lotus ya que estos inhiben la degradación de la materia seca (17, 21) o por una mayor concentración de lignina que es característico de las leguminosas (18). La adición de PEG (inhibidor de la acción de los taninos) mejoró la DIVMSr y la DIVMSp confirmando que los taninos tienen un efecto inhibitorio sobre la degradación de la materia seca.
De otro lado, el efecto de proporciones L. uliginosus con kikuyo no fue claro, mientras no hubo diferencias a nivel ruminal, la digestibilidad fue superior para la mezcla 70:30. Esto sugeriría que el Lotus se podría usar en bajas proporciones en la dieta de los rumiantes consumiendo kikuyo sin efectos negativos.
Uno de los objetivos de este trabajo era el de estimar el efecto de L. uliginosus y de sus taninos sobre la degradación de la proteína al mezclarse con kikuyo. Aunque no se midió la digestibilidad de la proteína se podría asumir que una disminución en los niveles de amonio causados por los taninos del Lotus (tratamiento sin PEG) implica una menor degradación de la proteína. Los resultados de la DIVMSr y DIVMSp indicarían que este es el caso. Sin embargo, la materia seca pasante digerible no fue diferente entre tratamientos, lo que sugeriría que no hay una ventaja en el uso de plantas ricas en taninos sobre la utilización de la proteína como ha sido sugerido por otros autores (23, 28, 41). Es posible también que tanto los valores de la DIVMSr y la DIVMSp hayan sido subestimadas para los tratamientos con PEG ya que este compuesto ligado a los taninos permanece en el residuo (25). Si este es el caso del presente estudio, el impacto de los taninos sobre la degradación de la materia seca sería aún más negativo. Varios autores han sugerido que los efectos positivos de los taninos se presentan para ciertas especies vegetales pero no para otras. Los efectos positivos de los taninos han sido demostrados en el L. corniculatus pero no en L. pedunculatus (4, 26). Es más, la mayoría de estudios con L. uliginosus han sugerido que la presencia de estos compuestos en esta variedad trae consecuencias negativas para el animal (4, 23, 33). Las diferencias entre estas especies de un mismo género han sido atribuidas al tipo de tanino y a su concentración.
Tanto a nivel ruminal como abomasal el L. uliginosus puro presentó la menor degradabilidad y se encontró un aumento en la misma al adicionar PEG, lo que sugiere que la DIVMSr y la DIVMSp fue menor debido a la acción de los taninos.
Se concluye que los taninos presentes en el Lotus uliginosus var. maku no fueron suficientes para aumentar la proteína pasante (no degradada en rumen pero degradada en abomaso), sugiriendo que el complejo tanino-proteína no se disocia completamente en el abomaso a pesar del pH ácido.
Summary
Effect of mixing taniferus leguminose (Lotus uliginosus cv. Maku) whit Pennisetum clandestinum on the degradability protein and dry matter in vitro
Two in vitro experiments were performed to determine the effect of mixing Lotus uliginosus var. Maku (formerly named L. pedunculatus) and Pennisetum clandestinum (kikuyo) on protein degradation in ruminal liquor and of dry matter degradation in ruminal liquor and ruminal liquor plus pepsin, with or without polyethylene glycol (PEG). Treatments were: kikuyo, kikuyo 70% and L. uliginosus 30% with or without PEG, kikuyo 50% and L. uliginosus 50% with or without PEG and L. uliginosus. Addition of L. uliginosus to kikuyo or PEG addition (to inhibit tannin activity) increased both ammonia concentration and ammonia accumulation rates in the system (p<0.01). Ammonia levels were highly correlated with soluble protein (r=0.86) during the first hours of incubation. Dry matter digestibility in ruminal liquor without and with pepsin (IVDMDr and IVDMDp) for L. uliginosus was lower than for kikuyo (p<0.01). In the mixtures there was a difference in IVDMDp but not in IVDMDr being higher for the 70:30 than for the 50:50 mixtures (p=0.061). PEG addition improved IVDMDr and IVDMDp in the mixtures. We conclude that L uliginosus could be included in low proportion (30%) in ruminant diets of animals pasturing kikuyo without negative effects but higher inclusions may reduce diet digestibility due to the effects of tannins.
Key words: ammonia, digestibility, kikuyo, polyphenols, tannins
Referencias
1. AOAC (Association of Official Analytical Chemists) Official Methods of Analysis of the Association of Official Analytical Chemists. Ed. Sydney Williams 14th ed. Washington,D.C. 1984. [ Links ]
2. Abreu A, Petri H, Carulla J, Rey J. Uso de MUN (nitrógeno ureico en leche) para diagnosticar desequilibrios nutricionales en vacas lecheras. En: Memorias del IV encuentro Nacional de Investigadores de las Ciencias Pecuarias -ENICIP- Resumen. Rev Col Cien Pec 1997. [ Links ]
3. Aerts R, McNabb W, Molan A, Brand A, Barry T, et al Condensed tannins from Lotus corniculatus and Lotus pedunculatus exert different effects on the in vitro rumen degradation of ribulose-1,5 bisphosphate carboxilase/oxigenase (Rubisco) protein. J Sci Food Agricult 1999; 79-85. [ Links ]
4. Barry T, Manley T, Duncan S. The role of condensed tannins in the nutritional value of Lotus pedunculatus for sheep. 4. Sites of carbohydrate and protein digestion as influenced by dietary reactive tannin concentration. British J Nut. 1986; 55: 123-37. [ Links ]
5. Barry T, McNabb W, The implications of condensed tannins on the nutritive value of temperature forages fed to ruminants. Brit J of Nut. 1999; 81:263-272. [ Links ]
6. Beuselinck, PR Trefoil: The science and technology of Lotus. Crop Science Society of America, special publication No. 28. Madison, Wisconsin, USA 1999. 266 p. [ Links ]
7. Carulla, J. Forage intake and utilization by sheep as affected by condensed tannins. Thesis Doctoral. University of Nebraska. 1994. 96 p. [ Links ]
8. Carulla J, Lascano C, Klopfenstein T. Reduction of tannin level in a tropical legume (Desmodium ovalifolium) with polyethylene glycol (PEG): effects on intake and N balance, digestion and absorption by sheep. Arch Latin Prod Anim 2001; 9:17-24. [ Links ]
9. Carulla J, Pabón ML. Un sistema in vitro para evaluar el efecto de los taninos en la degradación de la proteína bajo condiciones ruminales y abomasales. En: Taninos en la nutrición de rumiantes en Colombia. CIAT. 2004. p.15-19. [ Links ]
10. Carulla J, Kreuzer M, Machmuller A, Hess, HD. Supplementation of acacia mearnsii tannins decreases methanogenesis and urinary nitrogen in forage-feed sheep. Aus J Agricult Res 2005; 56: 961-970. [ Links ]
11. González S, Pabón M, Carulla J. Effects of tannins on in vitro ammonia release and dry matter degradation of soybean meal. Archivos Latin Prod Anim 2002; 10: 97-101. [ Links ]
12. Hagerman AE, Butler LG. Condensed tannin purification and characterization of tannin-associated proteins. J Agric Food Chem 1980; 28:947-952. [ Links ]
13. Hagerman A. Tannin analysis. Department of Chemistry. Miami University. Ohio USA. 1995. p. 7-8. [ Links ]
14. Hess HD, Pardo O, Flórez H, Carulla JE, Díaz TE. Efectos de la suplementación con diferentes niveles de carbohidratos y nitrógeno soluble sobre amonio ruminal, consumo voluntario y niveles de nitrógeno ureico en sangre y leche en vacas doble proposito alimentadas con Brachiaria decumbens. Informe Técnico Final Corpoica Regional 8. 1998. [ Links ]
15. Holmann F, Rivas L, Carulla J, Rivera B, Giraldo L, Evolución de los sistemas de producción de leche en el trópico latinoamericano y su interrelación con los mercados: un análisis del caso colombiano. 2003. [ Links ]
16. Jaime G, Estudio exploratorio de la calidad nutricional de gramíneas, leguminosas y arbóreas de la Unidad de Recursos Genéticos de Forrajes (Universidad Nacional de Colombia - sede Bogotá). Trabajo de grado. Universidad Nacional de Colombia Facultad de Medicina Veterinaria y de Zootecnia. Departamento de Ciencias para la Producción Animal. Bogotá, D. C. 2002. [ Links ]
17. Julier B, Gines J, Emile F, Huyghe C. Variation in protein degradability in dried forage legumes. Anim Res 2003; 52:401-412. [ Links ]
18. Jung H, Allen MS. Characteristics of plant cell walls affecting intake and digestibility of forages by ruminants. J Anim Science 1995; 2774-2790. [ Links ]
19. Licitra G, Hernández T, Van Soest P. Standardization of procedures for nitrogen fractionation of ruminant feeds. Anim Feed Sci Techn 1996; 57: 347 - 358. [ Links ]
20. Makkar HP, Blummel M, Becker K.Formation of complexes between polyvinyl pyrrolidones or polyethylene glycols and tannins, and their implication in gas production and true digestibility in in vitro techniques. Brit J Nutr 1995;73:897-913. [ Links ]
21. Makkar HP. Effects and fate of tannins ins ruminant animals, adaptation to tannins and strategies to overcome detrimental effects of feeding tannin-rich feeds. Small Rumin Res 2003;49:241-256. [ Links ]
22. Mathis CP, Cochran RC, Heldt JS, Woods BC, Abdelgadir L, Olson KC, Titgemeyer EC, Vanzant ES. Effects of supplemental degradable intake protein on utilization of medium-to-low quality forages. J Anim Sci 2000; 78:224-232. [ Links ]
23. Mc Nabb W, Waghorn G, Barry TN, Shelton I. The effect of condensed tannins in Lotus pedunculatus on metabolism of methionine, cystine and inorganic sulphate for sheep. Brit J Nutr 1993; 70: 647 - 661. [ Links ]
24. McSweeney C, Palmer B, Kennedy P, Krause D. Effect of calliandra tannins on rumen microbial function. Proc Aust Soc Anim Prod 1998; 22: 289. [ Links ]
25. McSweeney CS, Palmer B, Bunch R, Krause DO. In vitro quality assessment of tannin-containing tropical shrub legumes: protein and fibre digestion. Anim Feed Sci Techn 1999; 82:227-241. [ Links ]
26. McSweeney C, Palmer B, McNeill D, Krause D. Microbial interactions with tannins: nutritional consequences for ruminants. Anim Feed Sci Techn 2001; 91: 83-93. [ Links ]
27. Miller M, Moser L, Waller, Klopfenstein T. Switchgrass escape protein as influenced by plant anatomy. Nebraska Beef Cattle Report. 1993. [ Links ]
28. Min B, Attwood G, Reilly K, Sun W, Peters J, Barry T, McNabb W. Lotus corniculatus condensed tannins decrease in vivo populations of proteolytic bacteria and affect nitrogen metabolism in the rumen of sheep. Can J Microbiol 2002; 48: 911-921. [ Links ]
29. Min BR, Barry TN, Attwood GT, McNabb WC. The effect of condensed tannins on the nutrition and health of ruminants fed fresh temperate forages: a review. Anim Feed Sci Techn 2003;106: 3-19. [ Links ]
30. Molan A, Attwood G, Min B, McNabb W. The effect of condensed tannins from Lotus pedunculatus and Lotus corniculatus on the growth of proteolytic rumen in vitro and their possible mode of action. Can J Microbiol 2001; 47:626-633. [ Links ]
31. Molano A. Producción de amonio in vitro como indicador de la relación energía proteína en forrajes del altiplano Cundiboyacense. Universidad Nacional de Colombia. Facultad de Medicina Veterinaria y de Zootecnia. Departamento de Ciencias para la Producción Animal. Bogotá, D. C. 2001. 135 p. [ Links ]
32. Rodríguez, E D. Caracterización de la respuesta a la fertilización en producción y calidad forrajera en los valles de Chiquinquirá y Simijaca. Universidad Nacional de Colombia, Facultad de Medicina Veterinaria y de Zootecnia, Departamento de Ciencias para la Producción Animal, Bogotá, D.C 1999. 89p. [ Links ]
33. Reed JD. Nutritional toxicology of tannins and related polyphenols in forage legumes. J Anim Sci 1995; 73:1516-1528. [ Links ]
34. Redfearn D, Moser L, Waller S, Klopfenstein T, Ruminal degradation of switchgrass, big bluestem, and smooth bromegrass leaf proteins. J Anim Sci 1995; 73: 598-605. [ Links ]
35. Silanikove N, Perevolotsky A, Provenza F. Use of tannin-binding chemicals to assay for tannins and their negative postingestive effects in ruminants. Anim Feed Sci Techn 2001; 91: 69-81. [ Links ]
36. Terrill TH, Rowan AM, Douglas GB, Barry TN. Determination of extractable and bound condensed tannin concentration in forage plants, protein concentrated meals and cereal grains. J Sci Food Ag 1992; 58:321-329. [ Links ]
37. Tilley JMA, Terry RA. A two stage technique for the in vitro digestion of forage crops. Br Grass Soc 1963; 18:104-111. [ Links ]
38. Van Soest, P. J. Nutrition ecology of the ruminant. Cornell University Press 1982. [ Links ]
39. Van Soest P Robertson J, Lewis B. Methods for Dietary Fiber, Neutral Detergent Fiber, and Nonstarch Polysaccharides in Relation to Animal Nutrition. J Dairy Sci 1991;74: 3583 - 3597. [ Links ]
40. Volden H, Mydland LT, Olaisen V. Apparent ruminal degradation and rumen escape of soluble nitrogen fractions in grass and grass silage administered intraruminally to lactating dairy cows. J Anim Sci. 2002; 80:2704-2716. [ Links ]
41. Waghorn G, Ulyatt M, Jhon A, Fisher M. The effect of condensed tannins on the site of digestion of amino acids and other nutrients in sheep fed on Lotus corniculatus L. Br J Nutr. 1987; 57:115-126. [ Links ]
42. Wang Y, Douglas G, Waghorn G, Barry TN, Foote A. Effect of condensed tannins in Lotus corniculatus upon lactation performance in ewes. J Agricul Sci, Cambridge 1996; 126: 356-362. [ Links ]
43. Wilson, R and Mertens, D. Cell wall accessibility and cell structure limitations to microbial digestion of forage. Crop Sci. 1995; 35:251-255. [ Links ]














