Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.20 no.3 Medellín July/Sept. 2007
ARTÍCULOS ORIGINALES
Actividad antiviral in vitro de extractos de Hura crepitans y Codiaeum variegatum en la replicación de herpes virus bovino tipo-1 y virus de estomatitis vesicular¶
In vitro antiviral activity of extracts from Hura crepitans y Codiaeum variegatum on bovine herpes virus type-1 and vesicular stomatitis virus replication
Natalia A Taborda1, Microbiol; Liliana Y Acevedo1, Microbiol; Claudia P Patiño1, Microbiol; Jorge E. Forero1*, Bact, MS; Albeiro López-Herrera2 Zoot, MV, MS, Dr. Sci.
1Grupo de Inmunovirología, Universidad de Antioquia. AA 1226. Medellín, Colombia.
2Grupo BIOGEM, Departamento de Producción Animal, Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia, Sede Medellín. Medellín, Colombia.
(Recibido: 3 mayo, 2006; aceptado: 5 julio, 2007)
Resumen
Hojas de las plantas Hura crepitans y Codiaeum variegatum se recolectaron en la ciudad de Medellín (Colombia), para determinar la actividad biológica (Actividad citotóxica [AC] y antiviral [AAV]) de cuatro extractos de éstas (hexánico, en acetato de etilo, metanólico y acuoso) sobre los virus de Estomatitis Vesicular (VSV) serotipos Indiana y New Jersey y Herpes Virus Bovino tipo-1 cepa Bogotá (BHV-1B). El tamizaje de actividad biológica de los extractos se realizó en monocapas de células BHK-21. Luego los extractos promisorios, pasaron a la fase cuantitativa de AAV por el ensayo de MTT [3-(4,5-dimethylthiazol–2-yl)-2,5-diphenyltetrazolium bromide] para determinar la concentración citotóxica 50 (CC50), la concentración inhibitoria 50 (IC50) y el índice de selectividad (IS). Ninguno de los extractos de las cuatro plantas presentó AAV contra VSV, mientras que los extractos hexánico, en acetato de etilo y metanólico de H. crepitans confirieron resistencia a la infección por BHV-1B con IC50 de 17.41, 7.87 y 2.75 µ g/ml, respectivamente. El extracto con mejor IS (relación entre IC50 y CC50) fue el hexánico de H. crepitans (IS > 17.4). Estos resultados sugieren que pueden existir compuestos en el extracto hexánico de H. crepitans con una actividad promisoria anti BHV-1B. Este estudio es pionero en demostrar actividad antiviral de extractos de plantas de la especie Euphorbiaceae contra BHV-1B.
Palabras clave: actividad biológica, citotoxicidad, extractos vegetales, MTT, porcentaje de inhibición, rinotraqueitis infecciosa.
Summary
Leaves from Hura crepitans and Codiaeum variegatum plants were collected in Medellín, Colombia to determine its cytotoxic [CA] and antiviral activity [AVA]. Four extracts were prepared using hexane, ethyl acetate, methanol and water; the antiviral activity was tested against Vesicular Stomatitis Virus (VSV), serotypes Indiana and New Jersey and Bovine Herpes Virus (type 1 Bogotá strain). The preliminary biological activity of each of the eight extracts was determined on BHK-21 cell monolayers using 96 well-plates. Then, promissory extracts were further tested using the MTT [3-(4,5-dimethylthiazol–2-yl)-2,5-diphenyltetrazolium bromide] assay to determine the cytotoxic concentration 50 (CC50), the inhibitory concentration 50 (IC50 ), and the selectivity index (SI). None of the evaluated plants exhibited AVA against VSV, whereas the extracts in hexane, ethyl acetate and methanol from Hura crepitans protected cell monolayer from infection against BHV-Bogotá with IC50 of 17.41, 7.87 and 2.75 µ g/ml respectively. The best IS was hexane of H. crepitans (SI > 17.4). These results suggest that this extract contains antiviral compounds. This research is pioneer demonstrating AVA against BHV-1B in extracts from plants of the Euphorbiaceae family.
Key Words: biological activity, citotoxicity, inhibition percentage, infectious rhinotracheitis, MTT, plant extracts.
Introducción
El herpes virus bovino tipo-1 (Bovine Herpes Virus: BHV-1), es un virus DNA, miembro de la familia Herpesviridae, subfamilia Alphaherpesvirinae; el BHV-1 es el agente etiológico de la rinotraqueitis infecciosa bovina (RIB), una patología respiratoria que genera complicaciones en el tracto respiratorio alto. El virus además produce vulvovaginitis y balanopostitis pustular infecciosa, las cuales son infecciones genitales en vacas y toros, respectivamente. Estas infecciones ocasionan grandes pérdidas económicas a la ganadería, debido a la disminución de la producción de carne y leche; algunas cepas son abortigénicas, complicando el cuadro patológico producido (25, 26). Este virus se caracteriza por hacer latencia en ganglios nerviosos y luego reactivarse en estados de inmunosupresión (13). Se han desarrollado vacunas comerciales que disminuyen la severidad de la sintomatología crónica, pero éstas no son útiles para prevenir la infección, la latencia o la reactivación del virus (25, 26). Estudios de seroprevalencia muestran que BHV-1 tiene una amplia distribución en todo el territorio colombiano y que recirculan cepas de baja virulencia que mantienen altos títulos de anticuerpos en el ganado (25, 26). En esta investigación se utilizó BHV-1 cepa Bogotá aislado en Colombia en 1996 (11, 12).
Por su parte, el virus de estomatitis vesicular (VSV) es un virus RNA miembro de la familia Rhabdoviridae, género Vesiculovirus, que causa vesículas y úlceras en la boca, borde coronario de los cascos y pezones de porcinos, equinos y bovinos. La enfermedad es clínicamente indiferenciable de la fiebre aftosa en el ganado vacuno y aunque no causa alta mortalidad, la morbilidad puede llegar al 66% en los bovinos (1). De este vesiculovirus, existen dos serotipos epidemiológicamente importantes: Indiana y New Jersey; la prevalencia para VSV serotipo New Jersey ha tenido un incremento en Colombia desde 1960, lo cual viene afectando la calidad de los productos agropecuarios y la economía ganadera del país (10).
Actualmente, existe una fuerte tendencia hacia la búsqueda de nuevos agentes terapéuticos, especialmente aquellos provenientes de plantas, debido a que éstas poseen una gran variedad de sustancias bioactivas con potencial antimicrobiano y han sido empleadas para tratar enfermedades de distinto origen, incluyendo las infecciosas de origen viral (6). Una de las familias de plantas más estudiadas es la Euphorbiaceae la cual comprende 8000 especies, muchas de las cuales han sido de gran utilidad para el tratamiento de diversas enfermedades (7), por lo que varios estudios se han enfocado en la evaluación de sus efectos, demostrando su potencial antiviral, antitumoral, antibacteriano y antioxidante (4, 14, 16). Varias especies de esta familia han mostrado actividad antiviral contra virus como Herpes simplex, Polio, Hepatitis B y Virus de la Inmunodeficiencia Humana, entre otros (19, 20, 23).
Algunos estudios realizados con H. crepitans, conocida como ceiba bruja o molinillo, han mostrado que el extracto de sus hojas aplicado sobre células Vero inhibe la replicación del Virus Herpes simplex tipo-1 (HSV-1) (17). El Croton (C. variegatum) tiene actividad larvicida contra Aedes aegypti y Culex quinquefasciatus (18) y es empleado principalmente con fines profilácticos y terapéuticos en enfermedades de origen no infeccioso (24). Hasta el momento, no hay reportes que evalúen los efectos antivirales de C. variegatum, pero estudios previos (datos sin publicar), mostraron que su extracto en acetato de etilo posee actividad anti HSV-2.
Dada la alta seroprevalencia de BHV-1 y VSV en Colombia y sus implicaciones económicas en el sector pecuario, sumado a la urgente necesidad de caracterizar las propiedades biológicas de las plantas empleadas en la medicina popular, el objetivo de este estudio fue evaluar la actividad biológica in vitro (antiviral y citotóxica) de los extractos hexánico, metanólico, acuoso y en acetato de etilo de H. crepitans y C. variegatum en cultivos de células infectadas con BHV-1B y VSV serotipo Indiana y New Jersey.
Materiales y métodos
Células y virus
Células de riñón de hámster clon 21 (BHK-21 ATCC CCL-10) fueron replicadas a partir de muestras del repositorio de células del Grupo de Inmunovirología de la Universidad de Antioquia. Las células fueron cultivadas en Medio Esencial Mínimo (MEM) suplementado al 10% con suero fetal bovino (SFB) y 1% de L- glutamina, aminoácidos, vitaminas, penicilina/estreptomicina (Sigma, St Louis MO). Los virus empleados fueron los VSV cepas Indiana y New Jersey y el BHV-1B obtenidos del repositorio de virus del Grupo de Inmunovirología, con los cuales se prepararon los lotes virales en monocapas de células BHK-21, que fueron titulados por la técnica DICC50 (15, 21, 25) y se almacenaron en alícuotas de 300 µl a –70 °C, hasta su uso.
Extractos de las plantas
Las plantas H. crepitans y C. variegatum, fueron colectadas en los predios de la Universidad de Antioquia, municipio de Medellín, ubicada a 1.538 msnm, con una temperatura promedio de 23 ºC. Estas especies de la familia Euphorbiaceae se identificaron con la asesoría de un botánico experto, por comparación con los registros ya existentes y el número de catálogo del herbario de la Universidad de Antioquia.
Para obtener los extractos de ambas plantas se trabajó con las hojas, basándose en los reportes realizados con las plantas de esta familia (4, 17, 22). Las plantas fueron colectadas manualmente, lavadas y secadas en estufa (Stokes modelo 38-B) a 40 °C/48 horas. Luego se procedió a la molienda del material vegetal mediante un molino de cuchillas (Willey Mill model Nº 3), utilizando tamiz Nº 80. Se emplearon 300 g del material seco y pulverizado, los cuales fueron percolados secuencialmente con 1000 ml de los siguientes solventes: hexano, acetato de etilo, metanol y agua. Los extractos en hexano, en acetato de etilo y en metanol fueron cuidadosamente evaporados a sequedad en un rotavapor (Buchi B-480) bajo presión reducida a 45 °C. El extracto acuoso se evaporó en un liofilizador (LabConco). Cada extracto fue almacenado en frascos de vidrio ámbar a -20ºC hasta su utilización.
Preparación de las diluciones a evaluar
Veinte miligramos de extracto se diluyeron en 500 µl de una solución que contenía 450 µl de dimetilsulfóxido (DMSO), 50 µl metanol y 10 mg Tween 20 (Sigma, St Louis MO). De esta solución se hizo una dilución 1:40 en medio esencial mínimo (MEM, Sigma, St Louis MO) suplementado al 5% con suero fetal bovino (SFB, Sigma, St Louis MO), obteniéndose una concentración final de 1.000 µg/ml, a partir de la cual se hicieron diluciones dobles para obtener las concentraciones a evaluar: 1.000, 500, 250, 125, 62.5 y 31.25 µg/ml.
Tamizaje primario de actividad antiviral
Para el efecto, se utilizó la técnica reportada previamente por Betancur et al (4), con algunas modificaciones. Brevemente: en platos de 96 pozos de fondo plano se sembraron 25.000 células BHK-21/pozo, resuspendidas en 100 µl de MEM suplementado con SFB al 10%; 24 horas después de incubarse a 37oC en atmósfera con CO2, se adicionó a los pozos para actividad antiviral (AAV) y actividad citotóxica (AC) 100 µl de la dilución de cada extracto en las concentraciones a evaluar (seis pozos por cada dilución). Una hora después del tratamiento con los extractos, los pozos destinados para AAV (tres pozos por dilución) se infectaron con 100 µl de 10 DICC50 del virus; en los pozos en los que se evaluó la AC se adicionaron 100 µl de MEM al 5% de SFB. Además cada plato contenía como controles tres pozos por cada uno de los siguientes tratamientos: 10, 1, 0.1 y 0.01 DICC50 del virus (controles de infección viral), células sin infectar (controles celulares); células + DMSO (dilución 1:40 en MEM) (control de citotoxicidad de DMSO); células + 10 DICC50 de virus + DMSO (1:40) (control de actividad antiviral de DMSO). Después de 72 h se inactivó el virus con una solución de formaldehído al 10% en PBS (tampón salino fosfatado), se tiñeron las monocapas con cristal violeta al 1% en formaldehido y se evaluó el porcentaje de destrucción de las monocapas de células comparando con los respectivos controles.
Con base en el tamizaje primario se determinó:
1. La actividad antiviral preliminar (AAVP), definida como la mínima concentración no tóxica del extracto que redujo el titulo viral.
2. La actividad citotóxica preliminar (ACP), definida como la mínima concentración que produjo un efecto tóxico sobre el 100% de las células.
3. El factor de Reducción (FR), definido como el logaritmo del cociente entre el titulo viral en ausencia del extracto y el titulo viral en presencia del extracto.
4. El Margen de Seguridad Preliminar (MSP), definido como el cociente entre concentración antiviral preliminar y la concentración citotóxica preliminar.

Determinación cuantitativa de AAV y AC (Ensayo de reducción del compuesto MTT).
Este ensayo se realizó a los extractos que mostraron MSP ≥ 2. La preparación de las monocapas de células en platos de 96 pozos, el tratamiento con los extractos y la infección se realizaron de igual forma que para tamizaje primario de actividad antiviral. Después del tratamiento y la infección, los sobrenadantes fueron removidos de los pozos y se agregaron 28 µl de una solución de MTT (3-(4, 5-dimetiltiazol-2-il) 2,5-bromuro difeniltetrazolio) (MP Biomédicas, Francia), a una concentración de 2 mg/ml en PBS. Los platos fueron incubados por 2 h a 37 oC. Para disolver los cristales de MTT se adicionaron 130 µl de DMSO/pozo y los platos se agitaron en un agitador orbital (Heidolph unimax 1010) durante 15 min a 150 rpm a temperatura ambiente; Por último se leyó la densidad óptica de los pozos a una longitud de onda de 492 nm (DO492) en un espectrofotómetro (Dynex Revelation MRX Versión 3.2 Serial Nº 1CXC1463).
Con las DO492 se calcularon los porcentajes de protección que tuvieron las diferentes concentraciones de los extractos de las plantas contra los virus en estudio utilizando la siguiente formula:

Donde A corresponde a la DO492 de células tratadas infectadas, B a la DO492 de células infectadas no tratadas y C a la DO492 de células no tratadas – no infectadas.
Una vez determinados los porcentajes de protección de las diferentes concentraciones de extracto, se halló la concentración que protegió el 50% de las células tratadas infectadas (Concentración inhibitoria 50%: IC50), ésta se obtuvo a partir de una curva dosis respuesta, con la que se graficó una curva de tendencia, aplicando regresión lineal (concentración vs porcentajes de protección).
Ensayo de citotoxicidad por la técnica MTT
La concentración citotóxica del 50% (CC50) fue obtenida a partir de las curvas de dosis respuesta correlacionando la concentración vs el porcentaje de citotoxicidad y aplicando regresión lineal; la CC50 se definió como la concentración de extracto que ejerce un daño del 50% de las células tratadas no infectadas. El porcentaje de citotoxicidad fue calculado así:
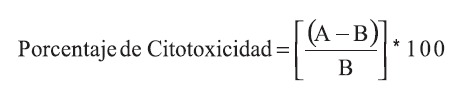
Donde A es la DO492 de células no tratadas y B corresponde a la DO492 de células tratadas.
Análisis estadístico
El análisis estadístico se realizó por medio de regresión lineal con un 95% de confiabilidad. La CC50 y el IC50 para cada extracto, se obtuvieron a partir de la curva concentración/efecto calculada con el programa GRAPH PAD PRISM 4.
Resultados
Tamizaje primario
Con el objetivo de seleccionar los extractos de H. crepitans y C. variegatum con una bioactividad relevante que justifique estudios más detallados, se empleo la estrategia del tamizaje primario reportada por Betancur et al (4), la cual permitió estimar la AAVP, la ACP y el MSP para los virus de VSV Indiana y New Jersey y BHV-1B. Se realizaron tres ensayos independientes (cada uno con tres replicas, para un total de nueve replicas) sobre células BHK-21. Para cada ensayo se evaluó el factor de reducción viral, es decir, la disminución de la replicación viral por el tratamiento con los extractos de las plantas, hallado mediante comparación entre el efecto citopático observado en los controles de infección viral y el efecto citopático observado en 10 DICC50 en presencia de extracto. Dicho factor permitió establecer la AAVP. De igual manera, la ACP se determinó por comparación entre la integridad de las monocapas de células tratadas con las diferentes concentraciones del extracto y la integridad de la monocapa de los controles celulares. Los resultados de AAVP y ACP obtenidos en el tamizaje primario permiten establecer una relación entre la mayor concentración del extracto no tóxica para las células y la menor concentración con AAV. Ésta relación se denomina margen de seguridad preliminar (MSP). En nuestra experiencia establecimos que extractos con MSP ≥ 2 eran relevantes para cuantificar su AAV y AC por medio del ensayo MTT.
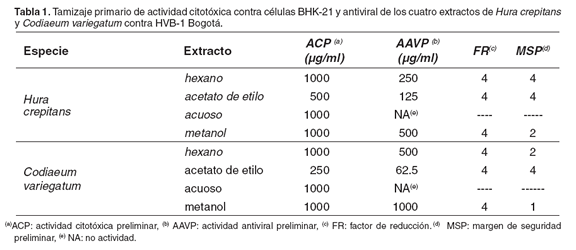
Para el caso de BHV-1B, los extractos evaluados de cada una de las plantas (excepto los acuosos), presentaron un FR de 4 (véase Tabla 1), es decir, a concentraciones no tóxicas para las células, los extractos redujeron aproximadamente en 10.000 veces la replicación del virus.
Por otra parte, los extractos hexánico, en acetato de etilo y metanólico de H. crepitans presentaron un MSP de 4, 4 y 2, respectivamente; mientras que, los extractos hexánico y en acetato de etilo de C. variegatum muestran un MSP de 2 y 4, respectivamente (véase Tabla 1). Los cinco extractos con MSP ≥ 2, fueron seleccionados para cuantificar su actividad biológica contra BHV-1B, por medio del ensayo MTT. Aunque el extracto metanólico de C. variegatum presentó un MSP de 1, redujo 10.000 veces la replicación de BHV-1B, por lo cual también fue seleccionado para la fase cuantitativa.
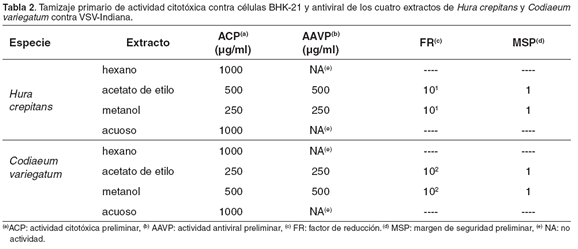
En el caso de VSV Indiana, sólo los extractos en acetato de etilo y metanólico de ambas plantas presentaron AAVP a concentraciones por encima de 250 μg/ml. Estos mismos extractos mostraron un FR de 1 en el caso de H. crepitans y de 2 en el caso de C. variegatum. Sin embargo, su MSP fue 1 (véase Tabla 2). Al igual que para VSV New Jersey, los demás extractos de ambas plantas no presentaron AAVP; por lo que los cuatro extractos de las dos plantas empleadas contra VSV Indiana y VSV New Jersey, no fueron seleccionados para la fase cuantitativa.
Evaluación de la CC50 de los extractos de H. crepitans y C. variegatum sobre las células BHK-21
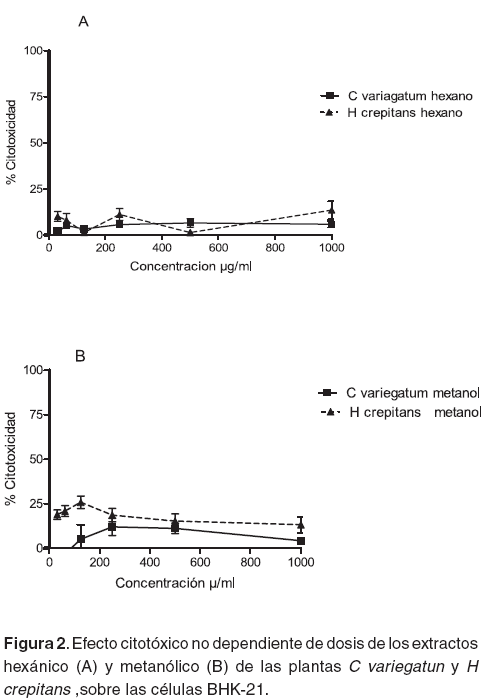
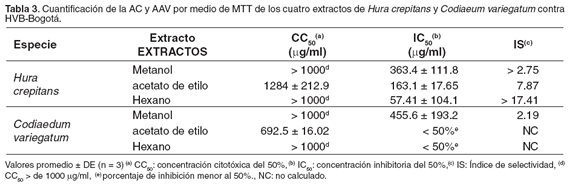
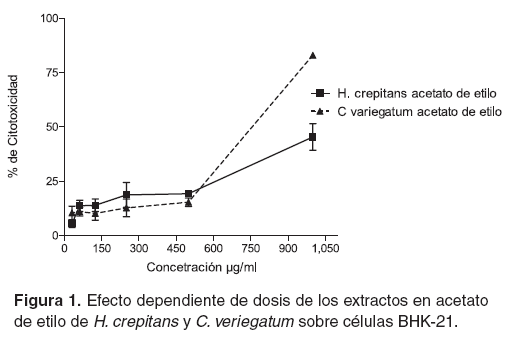
Según los resultados obtenidos por la técnica cuantitativa MTT, los extractos hexánicos y metanólicos de ambas plantas, tienen concentraciones citotóxicas muy bajas, (véase Tabla 3) con porcentajes de citotoxicidad que alcanzan valores menores del 25% y su efecto no depende de dosis (véanse Figuras 1 y 2). La CC50 más alta fue la del extracto en acetato de etilo de C. variegatum con un valor de 692.5 μg/ml (véase Tabla 3). Para éste extracto y para el de acetato de etilo de H. crepitans, se presentan porcentajes de citotoxicidad del 80% y 45%, respectivamente (véase Figura 1).
Cuantificación del efecto antiviral de los extractos de H. crepitans y C. variegatum sobre BHV-1 Bogotá
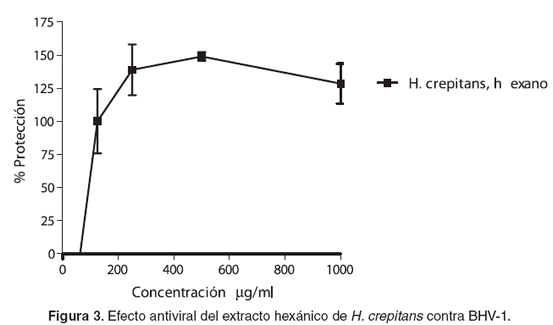
El IC50 más alto fue el del extracto metanólico de C variegatum, mientras que el extracto hexánico de H crepitans presentó la IC50 más baja (véase Tabla 3) con porcentajes de protección del 100% (véase Figura 3). En el caso de los extractos hexánico y en acetato de etilo de C. variegatum, a las concentraciones evaluadas el porcentaje de protección fue menor del 50% (datos no presentados).
La relación entre CC50 e IC50 permite establecer el Índice de Selectividad (IS), el cual es una medida relativa de las veces en que es posible concentrar el extracto obteniendo un efecto inhibitorio de la replicación viral, sin que se produzca efecto citotóxico. Así, el IS más bajo se obtuvo para el extracto metanólico de C. variegatum y el más alto fue el de hexano de H. crepitans, (véase Tabla 3). Aunque el extracto metanólico de H. crepitans presenta un IS bajo, es posible que al evaluar concentraciones mayores y determinar la CC50, el IS aumente.
Discusión
La búsqueda de nuevos compuestos a partir de extractos de plantas con capacidad antiviral, requiere ensayos económicos e indicativos que permitan seleccionar aquellos con actividad biológica relevante para ser sometidos a análisis más complejos (2). La combinación de un ensayo semicuantitativo como el tamizaje primario con cristal violeta, seguido de un método cuantitativo como el MTT, permitió establecer que las plantas H. crepitans y C. variegatum poseen actividad antiviral contra BHV-1B pero no contra VSV Indiana o New Jersey (véase Tabla 2).
Aunque ambos virus son envueltos, los resultados insinúan que el efecto antiviral que ejercen los extractos, está dirigido contra un componente específico de BHV-1B y no contra los componentes celulares de la envoltura (9, 13). Otra posibilidad para explicar la diferencia en la susceptibilidad de ambos virus a los extractos podría estar relacionada con la estrategia de replicación viral: el VSV es un virus RNA, que replica su material genético en el citoplasma (3), mientras que BHV es un virus DNA que se replica en el núcleo (13); estas diferencias hacen pensar que los extractos pueden contener sustancias que inhiben selectivamente factores virales específicos relacionados con la replicación.
Por medio del tamizaje primario fue posible seleccionar seis de los ocho extractos con AAV relevante contra BHV-1B para ser cuantificada por la técnica colorimétrica MTT. El bioensayo colorimétrico se basa en la reducción del compuesto MTT por la acción de las deshidrogenadas celulares, presentes en las células metabólicamente activas, lo que permite cuantificar la viabilidad celular después del tratamiento y la infección (8).
Los resultados obtenidos contra BHV-1B, mostraron que el extracto con mayor efecto antiviral es el hexánico de H. crepitans, ya que presentó el IS mas alto (>17.41) comparado con otros extractos y sustancias de origen vegetal (5, 17), lo cual lo postula como posible candidato para realizar estudios que permitan establecer la naturaleza química de los metabolitos presentes. Aunque los IS de los extractos en acetato de etilo de H. crepitans (IS = 7.87) y metanólico de C. variegatum (IS = 2.19) son bajos, también serían posibles candidatos para ensayos más elaborados, dado que su AC es aproximadamente ocho y dos veces menor que su AAV, respectivamente (véase Tabla 3).
Los resultados de la AC de los extractos en las células BHK-21 indican que la citotoxicidad de los extractos en acetato de etilo de ambas plantas presenta un efecto dependiente de la concentración (véase Figura 1), mientras que los extractos metanólicos y hexánicos no presentaron este efecto, pues el porcentaje de citotoxicidad fue menor del 25% y se mantuvo constante en todas las concentraciones (véanse Figuras 2A y 2B). Esto podría deberse a que el extracto no contiene sustancias tóxicas en proporciones suficiente para causar un daño.
Según los resultados obtenidos, podemos concluir que los extractos de H. crepitans y C. variegatum no poseen compuestos promisorios para el tratamiento de la infección con VSV Indiana o New Jersey, pero si podrían ser efectivos contra BHV-1B. Estos resultados incentivan a la realización de estudios que, no sólo determinen los metabolitos responsables de la AAV, sino que también conduzcan a determinar los pasos en el ciclo de replicación del BHV en los cuales estos extractos ejercen su acción antiviral. Además, podrían extenderse hacia otras especies de familia Herpesviridae, para saber si la acción es específica contra BHV.
Este estudio es pionero en demostrar la actividad antiviral de extractos de plantas contra BHV, el cual produce una infección de distribución enzoótica a nivel mundial y con alta seroprevalencia en las ganaderías colombianas. Además, para nuestro conocimiento, esta es la primera vez que se reporta AAV de la planta C. variegatum, lo que incrementa la importancia de continuar con otros estudios.
Agradecimientos
Los autores agradecen al Comité para el desarrollo de la investigación Universidad de Antioquia (CODI), por el apoyo a las Jóvenes Investigadoras Liliana Acevedo y Natalia Taborda y por la financiación del proyecto enviado al Fondo para el Apoyo a Pequeños Proyectos de Investigación convocatoria del 21 de Octubre de 2004, Código Corporación Biogénesis 9102-2010. También, agradecen a la Fundación para la Investigación del Banco de la República por la aprobación del proyecto 1972 y al Grupo de Inmunovirología, especialmente a su coordinadora María Teresa Rúgeles, ya que sin su decidido apoyo a la línea de investigación no hubiese sido posible la obtención de estos resultados.
Referencias
1. Arbeláez G, Pineda A, Quintero M, Sánchez C. Estomatitis vesicular en Colombia: 1989-1994. Rev Acovez 1995; 20:22-25.
[ Links ]2. Balunas MJ, Kinghorn AD. Drug discovery from medicinal plants. Life Sci 2005; 78:431-441.
[ Links ]3. Barik S. Control of nonsegmented negative-strand RNA virus replication by siRNA. Virus Res 2004; 102:27-35.
[ Links ]4. Betancur-Galvis LA, Morales GE, Forero JE, Roldan J. Cytotoxic and antiviral activities of Colombian medicinal plant extracts of the Euphorbia genus. Mem Inst Oswaldo Cruz 2002; 97:541-546.
[ Links ]5. Cheng HY, Lin TC, Yang CM, Wang KC, Lin LT, et al. Putranjivain A from Euphorbia jolkini inhibits both virus entry and late stage replication of herpes simplex virus type 2 in vitro. J Antimicrob Chemother 2004; 53:577-583.
[ Links ]6. Cowan M. Plant products as antimicrobial agents. Clin Microbiol Rev 1999; 12:564-582.
[ Links ]7. del Barrio G, Parra F. Evaluation of the antiviral activity of an aqueous extract from Phyllanthus orbicularis. J Ethnopharmacol 2000; 72:317-322.
[ Links ]8. Denizot F, Lang R. Rapid colorimetric assay for cell growth and survival. Modifications to the tetrazolium dye procedure giving improved sensitivity and reliability. J Immunol Methods 1986; 89:271-277.
[ Links ]9. Flint SJ, Enquist LW, Krug RM, Racaniello VR, Skalka AM. Principles of virology. Molecular biology, pathogenesis and control. 1st ed. Washington: ASM press; 2000. p.756-758.
[ Links ]10. Gómez G. Hasta cuando será la convivencia con la Estomatitis Vesicular? Rev Acovez 2002; 27:27-28.
[ Links ]11. Góngora A, Villamil L, Vera V, Parra J, Ramírez G, et al. Aislamiento de un Herpes Virus Bovino tipo 1 de secreción nasal y esmegma prepucial en un toro reproductor. Rev Med Vet Zoot 1996; 43:43-46.
[ Links ]12. Góngora A, Villamil L, Vera V, Ramírez G, Parra J. Diagnóstico de las principales enfermedades reproductivas en toros de la sabana de Bogotá. Énfasis en RIB. Rev Med Vet Zoot 1995; 43:37-41.
[ Links ]13. Jones C. Herpes simplex virus type 1 and bovine herpesvirus 1 latency. Clin Microbiol Rev 2003; 16:79-95.
[ Links ]14. Kloucek P, Polesny Z, Svobodova B, Vlkova E, Kokoska L. Antibacterial screening of some peruvian medicinal plants used in Calleria District. J Ethnopharmacol 2005; 99:309-312.
[ Links ]15. Leennette DA. General principles for laboratory diagnosis of viral, rickettsial, and chamydial infections. In: Lennette EH, Lennette DA, Lennette ET, editores. Diagnositic procedures for viral, rickettsial, and chamydial infections. 7 ed. Washington: American Public Health Association Press; 1995. p. 3-26.
[ Links ]16. Lin CC, Cheng HY, Yang CM, Lin TC. Antioxidant and antiviral activities of Euphorbia thymifolia L. J Biomed Sci 2002; 9:656-664.
[ Links ]17. Lipipun V, Kurokawa M, Suttisri R, Taweechotipart P, Pramyothin P, et al. Efficacy of thai medical plant extracts against herpes simples virus tipe-1 infection in vitro and in vivo. Antiviral Res 2003; 60:175-180.
[ Links ]18. Monzon RB, Alvior JP, Luczon LL, Morales AS, Mutuc FE. Larvicidal potential of five Philippine plants against Aedes aegypti (Linnaeus) and Culex quinquefasciatus (Say). Southeast Asian J Trop Med Public Health 1994; 25:755-759.
[ Links ]19. Ninomiya Y, Shimma N, Ishitsuka H. Comparative studies on the antirhinovirus activity and the mode of action of the rhinovirus capsid binding agents, chalcone amides. Antiviral Res 1990; 13:61-74.
[ Links ]20. Notka F, Meier G, Wagner R. Concerted inhibitory activities of Phyllanthus amarus on HIV replication in vitro and ex vivo. Antiviral Res 2004; 64:93-102.
[ Links ]21. Rovozzo G, Burke C. A Manual of basic virological technique. 1st ed. New Jersey: Prentice-Hall; 1973. p.64-93.
[ Links ]22. Samir A. Diterpedoids from Euphorbia paralias. Phytochemestry 2001; 58:1135-1139.
[ Links ]23. Unander DW, Webster GL, Blumberg BS. Usage and bioassays in Phyllanthus (Euphorbiaceae) IV. Clustering of antiviral uses and other effects. J Ethnopharmacol 1995; 45:1-18.
[ Links ]24. Vogg G, Mattes E, Rothenburger J, Hertkorn N, Achatz S, et al. Tumor promoting diterpenes from Euphorbia leuconeura L. Phytochemistry 1999; 51:289-295.
[ Links ]25. Zapata JC, Ossa JE, Bedoya G. Rinotraqueitis infecciosa Bovina (RIB). Caracterización molecular de una cepa colombiana de herpes virus bovino tipo-1. Rev Col Cienc Pec 2002; 15:92-99.
[ Links ]26. Zapata JC, Ossa JE, Zuluaga FN. Actualización de los viejos enigmas y visión de futuro de la RIB en Colombia. Rev Col Cienc Pec 2002; 15:155-159.
[ Links ]
¶ Para citar este artículo: Taborda NA, Acevedo LY, Patino CP, Forero JE, López-Herrera A. Actividad antiviral in vitro de extractos de Hura crepitans y Codiaeum variegatum en la replicación de Herpes Virus Bovino Tipo-1 y Virus de Estomatitis Vesicular. Rev Col Cienc Pec 2007; 20:241-249.
* Autor para el envío de la correspondencia y la solicitud de separatas: Grupo de Inmunovirología, Universidad de Antioquia. AA 1226. Medellín, Colombia. E-mail: jforeroduarte@gmail.com