Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.20 no.3 Medellín July/Sept. 2007
Vías implicadas en la luteólisis bovina¶
Bovine luteolysis: intracellular signals
Martha Olivera A, DMV, Dr. Sci. Agr.; Ariel Tarazona M, Zoot MS; Tatiana Ruíz C, MV, MS, PhD; Carlos Giraldo E*, MV, MS.
Grupo Fisiología y Biotecnología de la Reproducción, Facultad de Ciencias Agrarias, Universidad de Antioquia. Medellín, Colombia.
(Recibido: 18 septiembre, 2006; aceptado: 31 mayo, 2007)
Resumen
El cuerpo lúteo es una glándula endocrina transitoria que produce progesterona durante un tiempo determinado por la gestación. Cuando no hay preñez, el cuerpo lúteo sufre un proceso de regresión conocido como luteólisis, el cual divide en: funcional, por la pérdida de la capacidad de sintetizar progesterona; y estructural, por la pérdida de integridad celular. La luteólisis es inducida principalmente por la PGF2α, y de manera secundaria a través de otras rutas paralelas mediadas por calcio, citoquinas, especies reactivas de oxígeno y endotelinas. Todos estos factores conducen finalmente a la inhibición de la esteroidogénesis y/o en la inducción de la apoptosis. En este artículo tratamos de integrar la información disponible en la literatura y proponemos un mapa de los eventos celulares y moleculares que dan cuenta de este fenómeno fundamental en la reproducción de la especie bovina.
Palabras clave: apoptosis, inhibición de la esteroidogénesis, oxitocina, PGF2α.
Summary
The corpus luteum is a transient gland that produces progesterone during a period of time that is determined by the length of gestation. When there is no gestation the corpus luteum undergoes regression, a process commonly known as luteolysis. This process has been divided in: functional, since there is a lost of the capacity to synthesize progesterone; and structural, because there is a disruption of the cellular structure. PGF2α, is the principal luteolytic factor, but there are other parallel pathway mediated by calcium, cytokines, reactive oxygen species and endothelins. All these routes end up in inhibition of steroidogenesis and/or apoptosis. In this article we try to integrate the information present in the literature and propose a map depicting the major cellular and molecular events taking place in this process that is fundamental en bovine reproduction.
Key words: apoptosis, oxitocin, PGF2α, steroidogenesis inhibition.
Introducción
El folículo está compuesto por dos tipos de células: las células de la teca, productoras de androsteniediona a partir de la progesterona y, las células de la granulosa que reciben este metabolito, lo aromatizan y lo convierten en estradiol. Poco antes de la ovulación, durante el pico preovulatorio de la hormona luteinizante (LH), las células de la granulosa que recubren el folículo preovulatorio adquieren la capacidad de producir progesterona a partir de colesterol y pierden la capacidad de producir estrógenos debido a la inhibición de la producción de la enzima aromatasa. A este fenómeno de diferenciación celular se le conoce como luteinización. Luego de la ovulación se forma el cuerpo lúteo (CL) a partir de la hipertrofia de las células de la granulosa y de la teca que por su cambio morfológico comienzan a denominarse células luteales grandes (GCL) y células luteales pequeñas (PCL), respectivamente. Entre los dos a tres días post-ovulación, el CL desarrolla una intensa angiogénesis (12), lo que lo convierte, proporcionalmente, en uno de los órganos más vascularizados del organismo.
El cuerpo lúteo es una glándula endocrina transitoria, cuyo principal producto de secreción es la progesterona y participa en múltiples procesos como el reconocimiento, la adhesión e implantación del conceptus, el mantenimiento de la gestación en sus estadios tempranos y la regulación de la dinámica folicular.
La producción de progesterona es estimulada principalmente por la actividad luteotrópica de la LH y en menor proporción por otras hormonas como la GnRH, la prolactina y la catecolamina. El receptor para LH tiene siete segmentos transmembranales y pertenece al grupo de receptores acoplados a proteína G. Cuando la LH se une al receptor se activa la adenilil ciclasa (AC), lo que aumenta los niveles de AMPc y este estimula quinasas para la fosforilación de la aromatasa p450scc, induciendo la producción de progesterona. La vida media del cuerpo lúteo en bovinos es de 12 a 15 días después de los cuales pierde su funcionalidad y su morfología; a este último proceso se le denomina luteólisis.
La luteólisis ha sido analizada en dos pasos, aparentemente consecutivos: a) luteólisis funcional, que es la pérdida de la capacidad de sintetizar progesterona; y b) luteólisis estructural, que es la involución del CL acompañada de la pérdida en la integridad de sus células (19). La PGF2α, que es la principal luteolisina, se produce en las células endometriales y también en el cuerpo lúteo en menor concentración; es transportada a través de un mecanismo de contracorriente de la vena uterina, a la arteria ovárica ipsilateral al ovario donde se ha formado el cuerpo lúteo. Para que el CL sea sensible a la PGF2α debe alcanzar cierto estado de madurez, caracterizado por una amplia vascularización y por la producción de progesterona que lleva a niveles por encima de 1ng/mL; esto ocurre hacia el día 5 del ciclo estral. La acción de la prostaglandina que conduce a la luteólisis consiste en la inhibición de la esteroidogénesis y la inducción de la apoptosis, mediante el desencadenamiento de cascadas de señalización que involucran hormonas como la prolactina; citoquinas como el Factor de Necrosis Tumoral alpha (TNFα), el Interferón gamma (IFNγ) y el Fas ligando (FasL); especies reactivas de oxígeno (ROS), endotelina-1(E1) y la proteína 70 (HSP70) de choque térmico, entre otros (9).
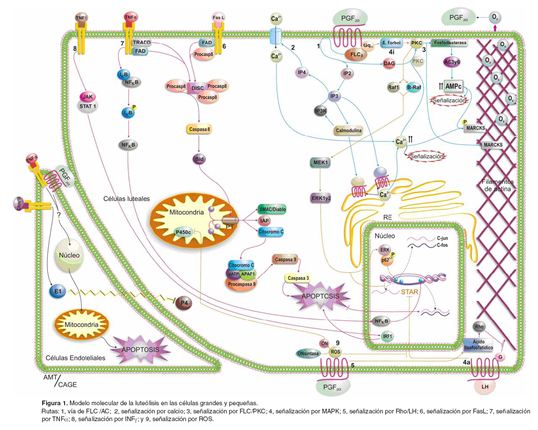
El receptor de PGF2α (rPGF), es miembro de la familia de receptores acoplados a proteína G y consta de siete dominios transmembranales. En el cuerpo lúteo de bovinos se han encontrado receptores en las GCL y PCL, así como en células del endotelio microvascular. El rPGF existe en dos formas, de alta y baja afinidad, cuya expresión depende de la cantidad de oxitocina producida por las GCL; niveles bajos de oxitocina estimulan la exposición de los rPGF de alta afinidad a los que se unen pequeñas concentraciones de PGF2α que en ese momento produce el endometrio. A medida que transcurre el ciclo estral, aumenta la secreción de oxitocina, lo que induce la producción de niveles altos de PGF2α con lo que se activan los receptores de baja afinidad que, a su vez, incrementan la secreción cada vez mayor de oxitocina con la consecuente activación de la cascada que induce la reducción en la secreción de progesterona (rutas 1, 3 y 4) (véase Figura 1).
En la literatura existe información sobre los mecanismos asociados a la luteólisis pero hace falta un tratamiento integrado y tal es el objetivo del presente artículo.
Regulación de la exocitosis de la oxitocina
En las GCL y PCL, la unión de la PGF2α al rPG (ruta 1) activa la fosfolipasa C β (FLC β), mediante el acoplamiento a la proteína Gq/11, lo que causa la hidrólisis del fosfatidilinositol-4,5-fosfato (IP2) para formar diacilglicerol (DAG) e inositol trifosfato (IP3) como segundos mensajeros. El IP3 se une a sus receptores en el retículo endoplásmico (RE) y estimula la liberación de iones de Ca2+ que elevan la concentración de Ca intracitoplasmático, induciendo rutas internas de señalización como las MARKS (ruta 1 y 3) y otras desconocidas.
En contraste con otras especies, donde la PGF2α inhibe la acumulación de AMPc por la acción de las gonadotropinas sobre la AC, en bovinos la capacidad de la PGF2α de amplificar la acumulación de AMPc inducido por agonistas está mediado por proteína quinasa C (PKC) (ruta 3).
La enzima IP3-3-quinasa (IP3K), es una de las enzimas dependientes de Ca-calmodulina (CaM) activada luego del tratamiento con PGF2α; esta enzima fosforila a IP3 para producir una isoforma de IP4 que puede regular la entrada de Ca a través de la membrana de las células luteales bovinas (ruta 2). Algunos efectos de la PGF2α requieren la activación de las enzimas dependientes de CaM, que son activadas por el calcio intracelular.
La PGF2α estimula la exocitosis de oxitocina in vivo e in vitro mediante la activación del sistema de señalización FLC/PKC (proteína quinasa C) (rutas 1 y 3). Las GCL bovinas contienen grandes cantidades de vesículas transportadoras de gránulos densos de oxitocina durante la fase media del ciclo estral (días 7 a 14), dispuestos en grupos cercanos al núcleo, diferente al patrón difuso observado en ovejas y cerdas. La administración de PGF2α estimula la exocitosis de oxitocina luteal, incrementando sus niveles séricos (5).
Para la exocitosis de oxitocina se propone un modelo que involucra a la proteína MARCKS (sustrato de PKC rico en alanina myristoilada); el dominio efector de MARCKS está unido a la actina del citoesqueleto (ruta 3) y cuando es fosforilado por la PKC, se libera, induciendo la remodelación del mismo al incrementar la polimerización de los filamentos de actina, lo que conlleva a la migración de los gránulos de oxitocina hacia la membrana plasmática y a su exocitosis.
Vías de inhibición de la esteroidogénesis
La unión de PGF2α a su receptor puede activar mediante ésteres de forbol (e-forbol) a una PKC, desencadenando la cascada luteolítica mediada por fosforilaciones secuenciales de proteína quinasa activada por mitógenos (MAPK) (ruta 4i). La PKC que es sensible a e-forbol, fosforila y activa a Raf-1 y B-Raf (MAPKKKs), las cuales a su vez fosforilan a MEK1 (MAPKK) lo que promueve, por fosforilación, la translocación al núcleo de Erk1 y Erk2 (MAPKs). En el núcleo, Erk1 y Erk2 inhiben la trascripción de ARNm para StAR (Proteína reguladora aguda de la esteroidogénesis) (15, 14). Durante la luteinización la producción de StAR es inducida por la LH (ruta 4a), cumpliendo funciones de señalización para la producción de progesterona. La vía de señalización por MAPK mediada por PGF2α puede conducir a la expresión de oncogenes de respuesta inmediata-temprana como c-fos y c-jun (ruta 4i). El factor de transcripción p62 se activa al ser fosforilado por Erk, induciendo la trascripción de c-fos y c-jun (9). Las proteínas Fos y Jun traducidas son factores de trascripción para la proteína activadora 1 (AP-1), la cual regula la trascripción de numerosos genes, posiblemente involucrados en la apoptosis inducida por PGF2α (9).
La PGF2α a través de un mecanismo aún desconocido y mediado por ácido lisofosfatídico, (ruta 5) activa las proteínas Rho, proteínas involucradas en la regulación de la actina, que hacen perder la arquitectura del citoesqueleto con la posible incapacidad de que la progesterona sea secretada por la célula luteal (17).
Se ha propuesto que el tratamiento con PGF2α puede inducir un incremento en las especies reactivas de oxígeno (ROS) (4) a nivel de células luteales, con la subsecuente inhibición de el citocromo P450c (ruta 9). Las ROS se producen bajo condiciones fisiológicas en todas las células y cumplen funciones de señalización, ocasionando cambios en la citoarquitectura, que conllevan a la pérdida de funcionalidad celular y disminuyen además la esteroidogénesis al inhibir la señalización para STAR, mediada por LH (ruta 5 y 9) (2). En células luteales bovinas en regresión, ocurre un cambio en la fase de transición liquida-gel de la membrana, probablemente por reorganización de los fosfolípidos (3), lo que conllevaría al aumento de la peroxidación y producción de ROS que favorecen, a su vez, la luteólisis por el efecto sobre los componentes citoplásmicos.
Vías que desencadenan procesos apoptóticos
En bovinos, la proteína y el ARNm para FAS y FasL (ruta 6) parecen mediar también la luteólisis por apoptosis (11), a través de la activación de caspasa-3, una caspasa efectora central (6). El receptor de FasL es un dímero proteico con un solo segmento transmembranal que en su porción intracitoplasmática tiene un dominio de unión de muerte celular (DD), al cual se une la proteína FADD, que a su vez tiene un dominio efector de muerte (DED), que es el sitio de unión de la procaspasa-8 para formar el complejo señalizador para la inducción de muerte (DISC). Las procaspasas-8 reclutadas, se clivan para activarse en caspasa-8. La ruta apoptótica (13) se desencadena cuando la caspasa-8 activa a la proteína Bid para formar el poro de transición de permeabilidad mitocondrial (PTP) que permite la salida de citocromo c (cit-c), SMAC/Diablo e IAP. En las células luteales bovinas se forma el complejo apoptosoma (cit-c, Apaf 1, dATP y procaspasa-9) que media la apoptosis a través de la activación consecutiva de caspasa 9 y caspasa 3.
Receptores para TNFα se ha encontrado de dos tipos: TNFRI o TNFRII, tanto en las GLC y PLC como en las células endoteliales; en estas últimas con sitios de unión de baja y alta afinidad. Se sabe que hay un incremento de ARNm para TNFRI en las células luteales bovinas, durante toda la fase lútea del ciclo estral y en la luteólisis mediada por PGF2α.
Al igual que FAS, la activación del receptor de TNFα está asociada con un DD que recluta a la proteína TRADD; ésta puede servir como adaptadora con FADD para unir la señal de muerte del TNFα a la ruta por FAS/FasL. A su vez, TNFα puede amplificar la señal de muerte celular inducida por IFNγ (ruta 8) en las células luteales bovinas. Durante la respuesta inflamatoria mediada por TNFα, se produce la activación de dos factores de transcripción (ruta 7), el factor nuclear kappa B (NFκB) y la proteína activadora 1 (AP-1), que median la trascripción de genes pro o anti apoptóticos y genes relacionados con inflamación. El NFκB se encuentra en el citoplasma en forma inactiva ligado a IκB, la que tiene que fosforilarse y así la NFkB se libera y trasloca al núcleo.
La ruta 8 muestra cómo el Interferón gama (IFNγ) induce la muerte en células luteales bovinas, fosforilando al traductor de señal y activador de transcripción (STAT-1), se trasloca al núcleo, en donde se une a los promotores de genes de respuesta a interferón. Además, se produce un incremento en el factor de regulación de la transcripción de interferón (IRF-1), debido a la señalización por citoquinas que utilizan la vía de STAT-1 o NFκB. El IRF-1 ha sido asociado con la activación de genes reguladores de apoptosis.
Las especies reactivas de oxígeno además de inhibir la esteroidogénesis, son moduladores de la apoptosis luteal durante el ciclo estral. La PGF2α genera condensación nuclear y activación de caspasa-3, se relaciona además con la acumulación de ARNm para p53, Bax y COX2. En la fase final del ciclo estral, la apoptosis mediada por H2O2 es consecuencia de la disminución en los niveles de Glutation Peroxidasa, mientras que en la fase inicial y media se encuentra controlada por niveles altos de dos isoenzimas de superóxido dismutasa (tipo Mn y tipo Cu/Zn) y por catalasas (16).
Prostaglandina y endotelio del cuerpo lúteo
El CL por su característica de órgano endocrino altamente vascularizado, está compuesto celularmente en un 50% por células endoteliales. La PGF2α sérica, induce el aumento del flujo sanguíneo a nivel de arteriolas periféricas del cuerpo lúteo maduro, a través de la producción de ON (4). Ese aumento en el flujo sanguíneo es inmediatamente anterior a la disminución de las concentraciones séricas de progesterona (7). El aumento en el flujo sanguíneo induce la expresión de Endotelina 1 y Angiotensina II potentes vasoconstrictores (8). Esto aparentemente induce la disminución de la producción de progesterona. No se conoce aún con claridad la ruta metabólica que induce la inhibición de la producción de progesterona (3).
Apoptosis como factor luteolítico estructural
Durante la luteólisis mediada por PGF2α (días 11-21), y una vez declina la producción de progesterona, en las células luteales se forman oligonucleosomas (pequeñas porciones de ADN fragmentado); las células disminuyen de tamaño, y disminuyen las cantidades totales de proteína luteal, de ADN y de progesterona, esto significa que las células han entrado en proceso de apoptosis. La progesterona cumple funciones antiapoptóticas locales (10), lo que apoya la teoría de que la apoptosis en las células luteales es una consecuencia de la luteólisis funcional (12).
Otra vía de acción de las citoquinas como el TNFα y IFNγ aparte de la descrita en las rutas 7 y 8, sería desencadenar la apoptosis a través de la generación de ROS (5) por una vía que no está completamente dilucidada, pero de la cual se sabe que no involucran las rutas del ácido araquidónico ni del óxido nítrico (ON). La ceramida y la esfingomielina son otras rutas propuestas para inducir apoptosis en el CL, a través de Fas/FasL, ruta que no se desencadena hasta cuando no haya disminuido los niveles de progesterona (18).
Referencias
1. Budnik LT, Mukhopadhyay AK. Lysophosphatidic acid antagonizes the morphoregulatory effects of the luteinizing hormone on luteal cells: possible role of small Rho-G-proteins. Biol Reprod 2001; 65:180-187.
[ Links ]2. Chen DB, Fong HW, Davis SJ. Induction of c-fos and c-jun messenger ribonucleic acid expression in prostaglandine F2a is mediated by a proteine kinase c-dependent extracellular signal-regulated kinase mitogenactivated proteine kinase pathway in bovine luteal cells. Endocrinology 2001; 142:887-895.
[ Links ]3. Carlson JC, Buhr MM, Wentworth R, Hansel W. Evidence of membrane changes during regression in the bovine corpus luteum. Endocrinology 1982; 110:1472-1476.
[ Links ]4. Hanke CJ, Drewett JG, Myers CR, Campbell WB. Nitric oxide inhibits aldosterone synthesis by a guanylyl cyclase-independent effect. Endocrinology 1998; 139:4053-4060.
[ Links ]5. Jaroszewski JJ, Hansel W. Intraluteal administration of a nitric oxide synthase blocker stimulates progesterone and oxytocin secretion and prolongs the life span of the bovine corpus luteum. Proc Soc Exp Biol Med 2000; 224:50-55.
[ Links ]6. Juengel JL, Garverick HA, Johnson AL, Youngquist RS, Smith MF. Apoptosis during luteal regression in cattle. Endocrinology 1993; 132:249-254.
[ Links ]7. Kobayashi S, Berisha B, Amselgruber WM, Schams D, Miyamoto A. production and localization of angiotensin II in the bovine early corpus luteum: a possible interaction with luteal angiogenic factors and prostaglandine F2a. Endocrinology 2001; 170:369-380.
[ Links ]8. Miyamoto A, Shirasuna K, Wijayagunawardane MP, Watanabe S, Hayashi M, et al. Blood flow: a key regulatory component of corpus luteum function in the cow. Domest Anim Endocrinol 2005; 29:329-339.
[ Links ]9. Nakamura T, Sakamoto K. Reactive oxygen species up-regulates cyclooxygenase-2, p53, and Bax mRNA expression in bovine luteal cells. Biochem Biophys Res Commun 2001; 284:203-210.
[ Links ]10. Okuda K, Korzekwa A, Shibaya M, Murakami S, Nishimura R, et al. Progesterone is a suppressor of apoptosis in bovine luteal cells. Biol Reprod 2004; 71:2065-2071.
[ Links ]11. Pru JK, Hendry IR, Davis JS, Rueda BR. Soluble Fas ligand activates the sphingomyelin pathway and induces apoptosis in luteal steroidogenic cells independently of stress-activated p38(MAPK). Endocrinology 2002; 143:4350-4357.
[ Links ]12. Reynolds LP, Grazul-Bilska AT, Redmer DA. Angiogenesis in the corpus luteum. Endocrine 2000; 12:1-9.
[ Links ]13. Rueda BR, Hendry IR, Hendry IW, Stormshak F, Slayden OD, et al. Decreased progesterone levels and progesterone receptor antagonists promote apoptotic cell death in bovine luteal cells. Biol Reprod 2000; 62:269-276.
[ Links ]14. Salli U, Saito N, Stormshak F. Spatiotemporal interactions of myristoylated alanine-rich C kinase substrate (MARCKS) protein with the actin cytoskeleton and exocytosis of oxytocin upon prostaglandin F2alpha stimulation of bovine luteal cells. Biol Reprod 2003; 69:2053-2058.
[ Links ]15. Salli U, Supancic S, Stormshak F. Phosphorylation of myristoylated alanine-rich C kinase substrate (MARCKS) protein is associated with bovine luteal oxytocin exocytosis. Biol Reprod 2000; 63:12-20.
[ Links ]16. Sugino N, Nakamura Y, Okuno N, Ishimatu M, Teyama T, et al. Effects of ovarian ischemia-reperfusion on luteal function in pregnant rats. Biol Reprod 1993; 49:354-358.
[ Links ]17. Tsai S, Wiltbank M. Prostaglandin F2a regulates distinct physiological changes in early and mid-cycle bovine corpora lutea. Biol Reprod 1998; 58:346-352.
[ Links ]18. Wright MF, Sayre B, Keith Inskeep EK, Flores JA. Prostaglandin F(2alpha) regulation of the bovine corpus luteum endothelin system during the early and midluteal phase. Biol Reprod 2001; 65:1710-1717.
[ Links ]19. Zheng J, Fricke PM, Reynolds LP, Redmer DA. Evaluation of growth, cell proliferation, and cell death in bovine corpora lutea throughout the estrous cycle. Biol Reprod 1994; 51:623-632.
[ Links ]
¶ Para citar este artículo: Olivera-A M, Tarazona-M A, Ruíz-C T, Giraldo-E C. Modelo de luteólisis bovina. Rev Col Cienc Pec 2007; 20:387-393.
* Autor para el envío de la correspondencia y la solicitud de separatas: Facultad de Ciencias Agrarias, Universidad de Antioquia. AA 1226, Medellín, Colombia. E-mail: cargiraldo@gmail.com