Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.21 no.1 Medellín Jan./Mar. 2008
ARTÍCULOS ORIGINALES
Aislamiento de Paramphistomidae en vacas de leche y en el hospedador intermediario (Lymnaea truncatula y Lymnaea columella) en una granja del trópico alto en el occidente de Colombia¶
Paramphistomidae isolation from dairy cows and its intermediate host (Lymnaea truncatula and Lymnaea columella) in a dairy farm in western Colombian high tropical region.
Isolamento de Paramphistomidae em vacas leiteiras e no hospedeiro intermediário (Lymnaea truncatula y Lymnaea columella) numa fazenda do trópico alto no ocidente da Colômbia
Laura P López1, MB; Johanna Romero1, MB; Luz E Velásquez1,2, MS.
1Grupo de Microbiología Ambiental, Universidad de Antioquia, AA1226, Medellín, Colombia.
2 Programa de Estudio y Control de Enfermedades Tropicales, PECET, Universidad de Antioquia, Medellín, Colombia.
(Recibido: 6 agosto, 2007; aceptado: 24 enero, 2008)
Resumen
Algunos Paramphistomidae (Trematoda: Digenea) parasitan el sistema digestivo de rumiantes de importancia económica en el mundo. En Colombia han sido reseñadas dos especies en bovinos de la costa Caribe y de los llanos orientales. Esta investigación tuvo como objetivo determinar la frecuencia de un paramfistómido en bovinos y caracoles de una hacienda localizada en Rionegro, Antioquia. En ésta se hicieron cuatro muestreos trimestrales entre julio de 2004 y julio de 2005. Se colectaron heces de los vacunos en ordeño para hacer diagnóstico mediante la técnica de Dennis. Los caracoles se capturaron en diversos ecosistemas acuáticos del lugar y su infección fue establecida mediante disección. Los huevos y los estadíos intramolusco del parásito fueron descritos y fotografiados. La frecuencia del paramfistómido fue del 100% en los 71 bovinos evaluados; de estos, el 80% (51 vacunos) presentaron además un fasciólido. Los huevos de ambos digeneos se diferenciaron mediante su coloración y la familia se confirmó mediante la eclosión de los miracidios. Se colectaron 1.146 caracoles determinados como Lymnaea truncatula y 335 determinados como Lymnaea columella, cuyas frecuencias de infección por el paramfistomido fueron 25, 47 y 1.79%, respectivamente. La morfología de los estadíos intramolusco obtenidos fue compatible con las familias Paramphistomidae y Fasciolidae. Este constituye el primer registro de un foco de paramfistomosis bovina en una zona alto andina, al occidente de Colombia, donde se destaca la presencia en simpatría con Fasciola hepatica y de dos especies de moluscos hospedadoras de ambos digéneos. Las frecuencias de infección en los caracoles, sugieren a L. truncatula como hospedador intermediario principal del paramfistómido y a L. columella como hospedador intermediario alterno del mismo. La alta frecuencia del paramfistomido puede obedecer al desconocimiento de su presencia en el hato y por ende a la ausencia de medidas para su control.
Palabras clave: Bos taurus, Fasciola hepatica, Lymnaea columella, Lymnaea truncatula, Paramphistomidae.
Summary
Some Paramphistomidae (Region Trematoda: Digenea) parasitize the digestive system of economically important ruminants worldwide. Two species of these flukes have been recorded in cattle from the Caribbean Coast and eastern plains of Colombia. The objective of this study was to determine the frequency of paramphistomids in both dairy cattle (n = 71) and snails on a dairy farm in Rionegro (Antioquia), located in the western Andes. Four quarterly fecal samples were taken in the farm from July 2004 to July 2005. Faeces were collected from lactating dairy cows for diagnosis by using the Dennis technique. Snails were captured in diverse aquatic ecosystems of the locality and their infection status was confirmed by dissection under stereoscopic exam. The eggs and intra-mollusc stages of the parasite were described and photographed. The frequency of the paramphistomid was 100% in the 71 cows evaluated, of which 51 (80%) also presented fasciolid flukes. Eggs of the two digeneid species were differentiated based on their coloration, and the identity of the family confirmed through eclosion of the miracidia. In all 1146 snails were collected and identified as Lymnaea truncatula and a further 335 as L. columella, whose rates of infection to the paramphistomid were 25, 47 and 1.79% respectively. The morphologies of the intra-mollusc stages obtained were compatible with members of the families Paramphistomidae and Fasciolidae. This constitutes the first record of a focus of bovine paramphistomosis in the high Andean zone of western Colombia. The presence in sympatry of the paramphistomid with Fasciola hepatica is noteworthy, as is the finding of two host snail species for both digeneids. The frequencies of infection in the snails indicate that L. truncatula acts as the principal intermediate host of the paramphistomid and L. columella as its alternate intermediate host. Although the frequency of paramphistomids in the herd was very high, presence of the parasite was unsuspected until the present study. This explains the absence of measures for its control.
Key words: Bos taurus, Paramphistomidae, Fasciola hepatica, Lymnaea columella, Lymnaea truncatula
Resumo
Alguns Paramphistomidae (Trematoda: Digenea) parasitam o sistema digestivo de ruminantes de importância econômica no mundo. Na Colômbia têm sido identificadas duas espécies em bovinos da Costa Caribe e dos Llanos Orientais Nacionais. Este trabalho de pesquisa teve como objetivo determinar a freqüência de um paramfistómido em bovinos e caracóis de uma fazenda localizada em Rionegro, Antioquia. Nesta fazenda foram feitas quatro amostragens trimestrais entre julho de 2004 e julho de 2005 coletando fezes de bovinos em ordenho, para fazer o diagnóstico mediante a técnica de Dennis. Os caracóis foram capturados em diversos ecossistemas aquáticos do lugar e sua infecção estabelecida mediante dissecção. Os ovos e os estádios intramolusco do parasito foram descritos e fotografados. A freqüência do paramfistómido foi de 100% nos 71 bovinos avaliados, de estes, o 80% (51 bovinos) apresentaram ademais um fasciólido. Os ovos de ambos digêneos diferenciaram-se mediante sua coloração e a família se confirmou mediante a eclosão dos miracidios. Foram coletados 1.146 caracois catalogados como Lymnaea truncatula e 335 catalogados como Lymnaea columella, cujas freqüências de infeção pelo paramfistomido foram 25, 47 e 1.79%, respectivamente. A morfologia dos estádios intramolusco obtidos foi compatível com as familias Paramphistomidae e Fasciolidae. Isto constitui o primeiro registro de um foco de paramfistomosis bovina numa região alto andina, no ocidente da Colômbia, donde destaca-se a presença em simpatría com Fasciola hepatica e duas espécies de moluscos hospedeiros de ambos digêneos. As freqüências de infecção nos caracóis, sugerem L. truncatula como hospedeiro intermediário principal do paramfistómido e L. columella como hospedeiro intermediário alternativo do mesmo. A alta freqüência do paramfistomido pode obedecer ao desconhecimento de sua presença no rebanho e por tanto à ausência de medidas para seu controle.
Palavras chave: Bos taurus, Paramphistomidae, Fasciola hepatica, Lymnaea columella, Lymnaea truncatula
Introducción
Los Paramphistomidae (Trematoda: Digenea) son organismos endoparásitos con ciclo de vida indirecto, en el que interviene un hospedador intermediario (molusco) y uno definitivo, generalmente un mamífero. Los paramfistómidos son de distribución mundial, pero en las regiones tropicales y subtropicales tienen mayor impacto sobre la salud de bovinos y ovinos. Las formas adultas de los paramfistómidos se localizan en el rumen e intestino delgado de los rumiantes como bovinos, ovinos, cabras, búfalos y antílopes. Ocasionalmente se registran formas erráticas en el hígado (2).
Los rumiantes se infectan por vía oral al ingerir la forma quística de los Paramphistomidae, denominada metacercaria. En el abomaso se desenquistan, liberan los parásitos jóvenes que migran hacia el duodeno y el íleon, y se localizan en la submucosa, donde generan inflamación y edema. Aquí alcanzan la madurez sexual y migran al rumen, donde se inicia la liberación de huevos, los cuales salen del hospedador a través de las heces (12, 28).
El cuadro clínico que producen los paramfistómidos se denomina paramfistomosis, caracterizada por ocasionar enteritis severa, patología que se manifiesta durante la permanencia de las formas juveniles de los parásitos en la submucosa. Entre los síntomas más frecuentes de la paramfistomosis están la desnutrición y la pérdida de peso, que conllevan el deterioro de la salud de los rumiantes, y al mismo tiempo causan disminución en la producción de la leche y en la capacidad reproductiva, lo que genera pérdidas económicas. Los efectos más severos se han reseñado en bovinos mayores de un año, con una mortalidad del 90% (19).
En la familia Paramphistomidae se destacan las especies de los géneros Paramphistomum y Cotylophoron por su impacto en la salud de animales de importancia económica. La distribución de Cotylophoron en Colombia cubre los llanos orientales y el pie de monte llanero, entre los 0 y 1800 msnm (11). A su vez, las diferentes especies de Paramphistomum están asociadas a regiones con alta humedad y presencia de caracoles acuáticos(2). Ambas reseñas, mencionan la presencia de los géneros Cotylophoron y Paramphistomum, en ganado bovino, pero en ninguno de estos trabajos se estableció el hospedador intermediario.
Las especies de los géneros Paramphistomum y Cotylophoron presentan ciclos de vida complejos semejantes entre sí, puesto que el parásito pasa por varios estadíos de desarrollo que se cumplen en diferentes especies hospedadoras. Los huevos proceden de la reproducción sexual de los parásitos adultos y su desarrollo embrionario se inicia cuando caen en un ambiente húmedo; en uno de sus extremos poseen un opérculo, por el que sale el miracidio luego de 14 a 16 días. Este es el estadío larvario más joven. Su cuerpo ciliado facilita el desplazamiento en el agua, hasta encontrar el caracol hospedador (3). Cuando encuentra al molusco entra por su cavidad respiratoria y a través de la epidermis; si no logra colonizarlo, muere en un periodo de 24 horas. En el caracol, el miracidio se transforma en esporocisto o redia y se ubica en el hepatopáncreas del molusco (29).
Por cada miracidio se desarrollan de uno a cuatro esporocistos, son semejantes a un saco con células germinales; y presentan un poro de nacimiento por donde emergen generaciones subsecuentes de redias, las cuales migran a través de la hemolinfa y órganos del caracol. Las redias producen cercarias. Larvas que tienen el cuerpo pigmentado y opaco, con dos manchas oculares; presentan una cola larga sin coloración; salen del caracol 43 a 46 días después de la exposición al miracidio y, cuando lo hacen, nadan hacia la superficie del agua (16, 18, 21).
La cercaria pierde la cola al entrar en contacto con una superficie, como hojas, tallos y raíces de plantas, en las que se adhiere; se cubre de capas hasta transformase en un quiste denominado metacercaria (8). Esta es la forma infectante para los mamíferos, que se caracteriza por su resistencia a las condiciones ambientales (29).
Los rumiantes se infectan al ingerir plantas contaminadas con metacercarias. Durante el tránsito de los quistes por el abomaso, se liberan los parásitos jóvenes que migran hacia el duodeno y el íleon. El proceso irrita las mucosas, desencadenando una descamación que obliga a los parásitos a penetrar en la submucosa, en donde generan inflamación y edema. Aquí permanecen hasta alcanzar la madurez sexual, que puede tardar de seis semanas a cuatro meses, según la especie. Los parásitos adultos migran, se adhieren a las paredes del rumen y se observan como gránulos de forma cónica y color rojizo. Esta etapa en el ciclo de vida de los parásitos se caracteriza por la liberación de huevos, los cuales salen del hospedador a través de las heces (8, 12).
Los hospedadores intermediarios de los paramfistómidos son caracoles acuáticos, pulmonados. En África, Asia y Australia, predominan las familias Planorbidae y Bulinidae, y en América y Europa la familia Lymnaeidae (19). Los paramfistómidos cuentan entre sus hospederos definitivos a los bovinos y de ellos los más afectados pertenecen a la especie de la raza holstein (Bos taurus) (24).
El hallazgo de estadíos intramolusco compatibles con los registrados para los paramfistómidos en los lymneidos de una hacienda localizada en el municipio de Rionegro, Antioquia, motivó la realización de esta investigación, que tuvo como objetivo establecer el hospedador definitivo y la frecuencia del digeneo en este y en el hospedador intermediario.
Materiales y métodos
Autorización del Comité de ética
El protocolo del presente trabajo cumplió con los lineamientos establecidos por el Comité de Ética para experimentación con Animales de la Universidad de Antioquia, según el acta N° 17 de diciembre 2 de 2004.
Ubicación
El sitio de estudio corresponde a una hacienda ganadera ubicada a 6° 07´19" N y 75° 26´ 58" O, en la vereda Tablacito del municipio de Rionegro (Antioquia), sobre las riberas del Río Negro. El sector presenta una altitud de 2.140 m.s.n.m., con una temperatura y precipitación promedio anuales de 17.2 ºC y 1.600 mm, respectivamente. Según Holdridge (14), la zona de vida corresponde a bosque húmedo montano bajo (bh-MB) y bosque muy húmedo montano bajo (bmh-MB).
Recolección y clasificación de los moluscos
En los ecosistemas acuáticos lénticos y lóticos de la hacienda, se colectaron caracoles pulmonados. La captura fue realizada por cuatro personas durante dos horas, en cada ecosistema; la temperatura del agua se registró con un termómetro de mercurio (15, 22). Los moluscos se dispusieron en frascos plásticos con agua del medio para ser transportados al moluscario del Laboratorio de Malacología Médica del PECET (Universidad de Antioquia). Se realizaron cuatro muestreos en un año, con intervalos de tres meses entre cada uno.
Los moluscos capturados se instalaron separados por taxones, en acuarios acondicionados con agua declorinada y aireada, a 21 °C, con fotoperíodo de 12:12; se alimentaron con lechuga fresca y se les hizo recambio del agua cada tres días. Luego de dos días de aclimatación, en los caracoles capturados durante la primera salida de campo se estimuló la emisión cercariana, para establecer la presencia de digeneos. Los moluscos se individualizaron en recipientes con agua declorinada y aireada. Luego se pusieron bajo una fuente luminosa por ocho horas y se observaron en el estereomicroscopio cada cuatro horas (1). Los moluscos emisores fueron instalados en un acuario acondicionado para ellos y los no emisores se relajaron con nembutal al 0.05% durante cuatro horas, para disectarlos en busca de formas larvarias del tremátodo, bajo estereomicroscopio. A los caracoles colectados en las salidas posteriores no se les indujo la emisión cercariana, todos fueron relajados, disectados y analizados. El porcentaje de moluscos infectados se calculó de la siguiente manera: número de moluscos infectados, en relación al número de moluscos recolectados.
La determinación taxonómica de los caracoles se realizó por disección del aparato reproductor, basándose en las descripciones realizadas por Paraense (20) y por Samadi et al (27); se utilizaron 10 caracoles de cada morfotipo. Los caracoles se relajaron en nembutal al 0.05%/4 h; ya relajados se sacrificaron en agua a 70 °C/45 seg, y se fijaron en solución Railliet-Henry (20). Las observaciones se realizaron en un estéreomicroscopio. Ejemplares de cada especie se depositaron en la colección de referencia de moluscos vectores de la Universidad de Antioquia - VHET 37, adscrita al Instituto Alexander von Humboldt.
Para la obtención de cercarias y formas larvarias precercariales, 10 caracoles del acuario de los emisores se relajaron en nembutal al 0.05%. Después de 4 h se sacrificaron por desprendimiento de la concha; luego se diseccionaron bajo estereomicroscopio y se retiraron las diferentes formas larvarias del parásito. En el microscopio se montaron en fresco para observar las partes más relevantes de su anatomía interna y se fotografiaron para crear el archivo de imágenes.
Muestreo de los bovinos
Puesto que los paramfistómidos son parásitos de rumiantes, se realizaron cuatro muestreos trimestrales para colectar heces del recto de los bovinos de la raza holstein de la hacienda, durante el ordeño de la tarde. Las muestras se tomaron utilizando guantes obstétricos individuales para cada animal; se conservaron en recipientes herméticos y posteriormente se marcaron. Una vez en el laboratorio, se almacenaron a 4 °C hasta el análisis. Para establecer la frecuencia del parásito en los bovinos, se buscaron huevos en las heces por la técnica de Dennis modificada según parámetros del laboratorio de Malacología Médica. Cada muestra se procesó en un envase de vidrio de 1000 ml, donde 25 g de heces diluidas en 200 ml de agua corriente se depositaron a través de un embudo con una gasa doblada en cuatro; luego se añadieron 600 ml de agua y se dejaron reposar por 15 min. El sobrenadante se descartó y el procedimiento se repitió hasta que el agua del sobrenadante estuviera totalmente clara. El precipitado se vació en una caja de Petri y se agregaron 5 ml de agua destilada para su posterior observación al estereomicroscopio para buscar la presencia de huevos grises brillantes, típicos de los Paramphistomidae (13). El porcentaje de mamíferos infectados se estimó así: número de coprológicos positivos, en relación al número de coprológicos totales.
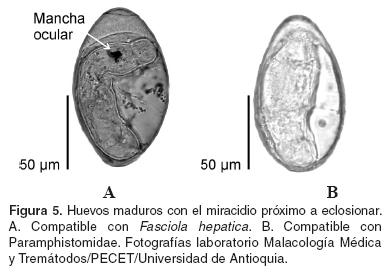
Los huevos fueron separados por el color, puesto que en el ganado de la hacienda investigada se conoce la presencia de Fasciola hepatica y el principal carácter para diferenciar los huevos de ambos grupos de digeneos, es la coloración. Los mismos fueron incubados durante 15 días, en agua destilada a 21 °C, en la oscuridad. Cada 4 días se hizo recambio de agua. Luego de este periodo, se estimuló la eclosión de los miracidios con una fuente luminosa (16). Los miracidios se observaron al microscopio con el fin de establecer características morfológicas que permitieran separar los paramfistómidos de F. hepatica. Este procedimiento sólo se realizó con las muestras de materia fecal obtenidas durante la primera salida de campo.
Resultados
Los bovinos en la hacienda investigada fueron vacas Bos taurus de la raza holstein. Del hato, se hizo diagnóstico parasitológico a los 71 ejemplares que estuvieron en ordeño durante las fechas de muestreo. El examen parasitológico demostró que el 100% de los bovinos analizados se encontraba parasitado por un digeneo de la familia Paramphistomidae. Sin embargo, es importante aclarar que durante el primer muestreo se diagnosticó un bovino como negativo, que posteriormente, durante el tercer muestreo fue diagnosticado como positivo (véase Tabla 1). Como era de esperarse, también se diagnosticó F. hepatica en las muestras examinadas. La frecuencia de este digeneo correspondió al 80%. Esto implica que de los bovinos diagnosticados, 51 ejemplares se hallaron infectados por los dos parásitos.
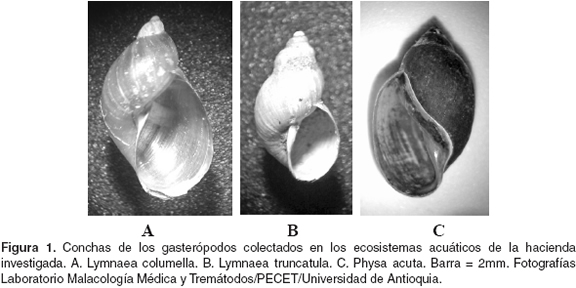
Durante esta investigación se colectaron dos especies de moluscos de la familia Lymnaeidae, que fueron determinadas como Lymnaea columella (véase Figura 1A) y Lymnaea truncatula (véase Figura 1B). Además, se colectaron especímenes de la familia Physidae, determinados como Physa acuta (véase Figura 1C), los cuales fueron negativos para digeneos; por lo tanto, no se incluyeron en las tablas de datos. Las tres especies se capturaron tanto en las acequias como en los bebederos artificiales de la hacienda.
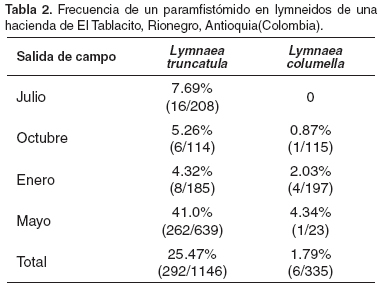
Respecto de la abundancia de los lymneidos, se observó como las poblaciones de ambas especies variaban a través del tiempo. En la primera salida de campo, por ejemplo, sólo se colectaron L. truncatula, mientras que en los demás muestreos se colectaron ejemplares de ambas. Sin embargo, se destacó la población de L. truncatula por ser la más abundante durante todas las colectas (véase Tabla 2).
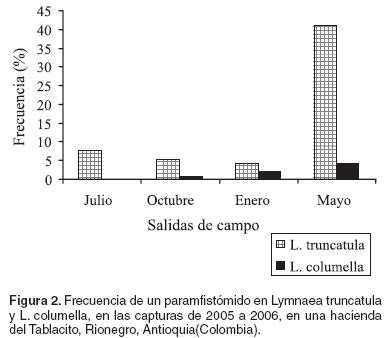
Sobre las frecuencias de la infección del paramfistómido en los lymneidos, se señala que estas siempre fueron mayores en L. truncatula que en L. columella y el rango de infección fue muy amplio, como por ejemplo el de L. truncatula que osciló entre 4.32 y 41.0% (véanse Tabla 2 y Figura 2).
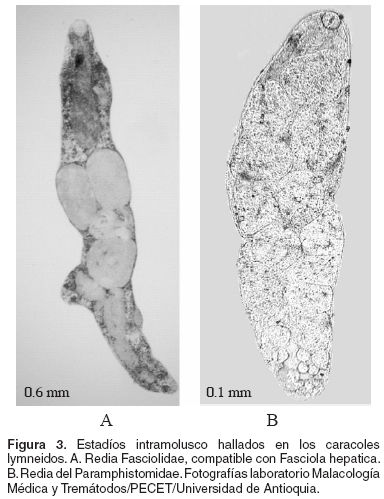
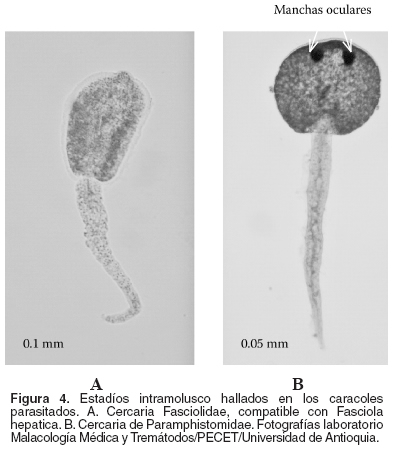
Otro aporte de importancia epidemiológica fue el hallazgo de estadíos intra-molusco, pertenecientes a digeneos cuyas características morfológicas permitieron asignarlos a las familias Paramphistomidae y Fasciolidae. Ambos tipos de larvas se encontraron en las dos especies de lymneidos, pero en ninguno de los moluscos se presentó doble infección. La frecuencia del fasciólido no se estableció por ser objeto de otra investigación simultánea. Sin embargo, los rasgos morfológicos que permitieron diferenciar las larvas se describen a continuación.
La redia del fasciólido es alargada, y posee una ventosa oral seguida de un saco digestivo desarrollado, el cual se destaca por una coloración amarillo ocre. Presenta además dos o cuatro proyecciones laterales a lo largo de su cuerpo (véase Figura 3A). A su vez, la redia del paramfistómido, mide un tercio de la anterior, no presenta saco digestivo diferenciable por tamaño y coloración, y su cuerpo carece de proyecciones laterales (véase Figura 3B).
Ambos tipos de cercarias presentan morfología a primera vista semejante, sin embargo, bajo el microscopio se precisaron diferencias que permitieron establecer la familia a la que pertenecían. En el caso del fasciolido la cercaria carecía de manchas oculares, pero eran muy evidentes las glándulas cistógenas (véase Figura 4A). Por su parte, la cercaria del Paramphistomidae presentó dos manchas oculares y el acetábulo en el extremo posterior del cuerpo (véase Figura 4B).
A partir de los miracidios eclosionados, se confirmó la presencia de dos digeneos parasitando los bovinos examinados. De acuerdo con sus características morfológicas, el miracidio procedente de los huevos amarillos pertenecía a la familia Fasciolidae, ya que presentaba una mancha ocular oscura (véase Figura 5A), mientras que el miracidio eclosionado de los huevos plateados carecía de ella, lo que lo hace compatible con los Paramphistomidae (véase Figura 5B).
Discusión
En este estudio se demuestra por primera vez la presencia de un foco de paramfistomosis en un hato de ganado lechero (Bos taurus) situado en la región del trópico alto en el occidente de Colombia. Los trabajos anteriores señalan la presencia de paramfistómidos para la costa norte y los llanos orientales (11, 23), regiones localizadas en el trópico bajo colombiano.
De otro lado, en este trabajo se comprobó la eficacia de la técnica de Dennis para diagnosticar dos digeneos en simpatría, usando como parámetro de comparación la coloración de los huevos, rasgo que se sugiere como herramienta útil para diferenciar infecciones por fasciolidos y por paramfistómidos. Para confirmar estas familias se propone separar los huevos por colores hasta obtener los miracidios.
Con esta investigación se estableció la presencia del primer foco de paramfistomosis bovina en Colombia, donde están involucrados dos moluscos hospedadores en simpatría, L. columella y L. truncatula. Las frecuencias del paramfistómido en los caracoles permiten considerar a L. truncatula como el hospedador intermediario principal, y a L. columella como el hospedador intermediario alterno. Este no es un caso aislado puesto que en Méjico (7), y en Francia (9) también han sido reseñados dos lymneidos en simpatría, como hospedadores de Fasciola hepatica y de Paramphistomum daubney, respectivamente. Además, se confirma la importancia de la familia Lymnaeidae en la transmisión de paramfistómidos en América (6): es así como en Venezuela se ha notificado a Fossaria spp. y a Lymnaea humilis como hospedadores de Cotylophoron cotylophorum (10). A su vez, en México se ha señalado a Lymnaea palustris como hospedadora de Paramphistomum cervi (5). A diferencia de estos países, en Colombia se reseñó a Physa sp. como el hospedador de Cotylophoron cotylophorum en un sector de los llanos orientales (25). Sin embargo, los Physa acuta capturados durante el presente estudio no se encontraron parasitados con digeneos.
En cuanto al fasciólido, las evidencias permiten considerar que se trata de F. hepatica, pues la morfología de huevos y larvas corresponden con la descrita para dicho digeneo; a esto se suma el hecho que por más de una década en la hacienda investigada se viene haciendo extracción post mortem de adultos de dicho parásito, en el hígado de los bovinos sacrificados (León Pérez, médico veterinario, comunicación personal 2007). Por consiguiente, el presente es el primer registro de un foco doble de trematodiasis (fasciolosis y paramfistomosis) en un hato ganadero de América. Hasta el momento se desconoce el impacto que generan los digeneos en simpatría, F. hepatica y el paramfistómido, en la producción de carne y leche y en la reproducción de los vacunos (6, 11).
Con esta investigación se suma L. truncatula a la lista de hospedadores de F. hepatica en Colombia, puesto que solo se hallaron referencias acerca de L. columella y L. cousini como sus hospedadores intermediarios en el país. Este molusco es referenciado como el principal hospedador intermediario de F. hepatica en Europa, de donde es originario (4, 17, 26, 30).
El registro del 100% de los animales vivos infectados con el paramfistómido, contrasta con el desconocimiento de este parásito, por parte del personal que tiene a su cargo los vacunos del predio. Finalmente, el alto número de bovinos infectados así como la frecuencia de los parásitos en los caracoles, evidencian la falta de estrategias para su control y el riesgo de infección con F. hepatica, para las personas que laboran en el sector.
Agradecimientos
Las autores expresan su agradecimiento al Dr. Iván Darío Vélez Bernal, director del Programa de Estudio y Control de enfermedades Tropicales -PECET- (Universidad de Antioquia, Medellín, Colombia), por su apoyo a los estudios en trematodiasis. A León Pérez, médico veterinario de la hacienda la Alborada, por facilitar el acceso a los predios y a los animales en ordeño. A las personas de la hacienda que tienen a su cargo el manejo de los bovinos. A los médicos veterinarios José Ignacio Calle y Esteban Arroyave, por colaborar con la toma de las muestras de materia fecal y al personal del laboratorio de Malacología Médica y Tremátodos, por su apoyo permanente. Este proyecto fue financiado por Comité para el Desarrollo de la Investigación -CODI- Universidad de Antioquia (Medellín, Colombia).
Referencias
1. Abrous M, Rondelaud D, Dreyfuss G. Influence of low temperatures on the cercarial shedding of Paramphistomum daubneyi from the snail Lymnaea truncatula parasite; J Helminthol 2000; 6:85-88. [ Links ]
2. Benavides OE, Romero NA. Manejo integrado de plagas y enfermedades. El control de los parásitos internos en del ganado en los sistemas de pastoreo en el trópico colombiano 2001.URL:http://www.fedegan.org.co/71manual.html. [ Links ]
3. Cheng TC. General parasitology. New York: Academic Press College Division; 1986. [ Links ]
4. Carrada-Bravo T. Fasciola hepatica: ciclo biológico y potencial biológico. Rev Mex Pat Clin 2007; 54:12-22. [ Links ]
5. Castro Z, García J, Casildo L. The susceptibility of lymnaeid snails to Paramphistomum cervi infections in Mexico. Vet Parasitol 1990; 35:157-161. [ Links ]
6. Cordero del CM, Rojo VF. Parasitología Veterinaria. 3ª reimpresión. Madrid: McGraw-Hill Interamericana; 2002. p.225-228. [ Links ]
7. Cruz-Mendoza I, Figueroa JA, Correa D, Ramos-Martínez E, Lecumberri-López J, et al. Dynamics of Fasciola hepatica infection in two species of snails in a rural locality of Mexico. Vet Parasitol 2004; 121:87-93. [ Links ]
8. Dinnik JA, Dinnik NN. The life cycle of Paramphistomum microbothrium Fischoeder, 1901 (Trematoda, Paramphistomatidae). East African Veterinary Research Organization. Muguga, Kenya; 1953. p.285-299. [ Links ]
9. Dreyfuss G, Vignoles P, Rondelaud D. Natural infections of Omphiscola glabra (Lymnaeidae) with Fasciola hepatica in central France. Parasitol Res 2003; 91:458-461. [ Links ]
10. Forlano MD, Henríquez HR, Meléndez RD. Incidencia y prevalencia de Cotylophoron spp. (Trematoda: Digenea) en bovinos del asentamiento campesino "Las Majaguas". Portuguesa, Venezuela, 1996-1997. Gac Vet 2001; 7:51-58. [ Links ]
11. Griffiths IB, Parra DG, Vizcaíno OG, Gallego MI. Prevalence of parasite eggs and cysts in faeces from dairy cows in Colombia. Trop Anim Health Prod 1986; 18:155-157. [ Links ]
12. Guzmán CH, Hernández HA. Prevalencia de Paramphistomum sp. en bovinos del municipio de Medina, Casanare. Trabajo de grado, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional de Colombia, Bogotá, 1992. 73p. [ Links ]
13. Happich FA, Boray JC. Quantitative diagnosis of chronic fasciolasis. 1 Comparative studies on quantitative faecal examinations for chronic Fasciola hepatica infection in sheep. Aust Vet J 1969; 45:326-328. [ Links ]
14. Holdridge LR. Ecología basada en zonas de vida. Servicio editorial IICA, Costa Rica; 1987. [ Links ]
15. Leimbacher, F. Epidémiologie de la fasciolose dans le centre ouest de la France. Essais d´adaptation d´une technique de prévision. Mémoire Ingénieur CNAM. Paris; 1975 p.1-11. [ Links ]
16. Malek EA, Cheng TC. Medical and economic malacology. New York, London: Academic Press; 1974. p.374. [ Links ]
17. Malek E, Congswell FB. Lymnaea (Pseudosuccinea) columella in Colombia. Nautilus 1980; 94:112-114. [ Links ]
18. Manga GM. Trematodos. En: Cordero del CM, Rojo VF (Eds). Parasitología Veterinaria. 3ª reimpresión. Madrid: McGraw-Hill Interamericana; 2002. p.225-228. [ Links ]
19. Muro AA, Ramajo MV. Paranfistomosis. En: Cordero del CM, Rojo VF (Eds). Parasitología Veterinaria. 3ª reimpresión. Madrid: McGraw-Hill Interamericana; 2002. p.225-228. [ Links ]
20. Paraense WL. Lymnaea columella in northern Brazil. Mem Inst Oswaldo Cruz 1983. 79:75-81. [ Links ]
21. Pinheiro AJ, Maldonado JM. Morphology of the rediae of Echinostoma paraensei (Trematoda: Echinostomatidae) from its intermediate host Lymnaea columella (Mollusca: Gastropoda). Parasitol Res 2004; 93:171-177. [ Links ]
22. Pino LA, Morales G, Márquez A. Presencia de Lymnaea cubensis hospedador intermediario de Fasciola hepatica en el municipio de La Cañada de Urdaneta, Estado de Zulia. Vet Trop 1995; 20:85-93. [ Links ]
23. Rivera B, Aragón R, Parra D. Estudio preliminar sobre la paranfistomiasis bovina en los llanos orientales de Colombia. Rev Col Cienc Pec 1979; 2:93-99. [ Links ]
24. Rinaldi L, Perugini AG, Capuano F, Fenizia D, Musella V, et al. Characterization of the second internal transcribed spacer of ribosomal DNA of Calicophoron daubneyi from various hosts and locations in southern Italy. Vet Parasitol 2005; 131:247-253. [ Links ]
25. Rodríguez H. Determinación de un huésped intermediario de la paramphistomiasis bovina en condiciones de piedemonte llanero. Trabajo de grado, Facultad de medicina veterinaria y zootecnia, Universidad Tecnológica de los Llanos Orientales, Villavicencio, 1984. 61 p. [ Links ]
26. Salazar L, Estrada VE, Velásquez LE. Effect of the exposure to Fasciola hepatica (Trematoda: Digenea) on life history traits of Lymnaea cousini and Lymnaea columella (Gastropoda: Lymnaeidae). Exp Parasitol 2006; 114:77-83. [ Links ]
27. Samadi S, Roumegoux A, Bargues MD, Mas-Coma S, Yong M, et al. Morphological studies of lymnaeid snail from the human fascioliasis endemic zone of Bolivia. J Mol Stud 2000; 66:31-44. [ Links ]
28. Sarmiento JI. Sistema digestivo de rumiantes y aves. 1997. URL: http://www.monografias.com/trabajos10/ruav/ruav.shtml [ Links ]
29. Tatcher VE. Trematódeos neotropicais. Manaus: Instituto Nacional de Pesquisas da Amazonia; 1993. [ Links ]
30. Velásquez LE. Synonymy between Lymnaea bogotensis Pilsbry, 1935 and Lymnaea cousini Jousseaume, 1887 (Gastropoda: Lymnaeidae). Mem Inst Oswaldo Cruz 2006; 101:795-799. [ Links ]
¶ Para citar este artículo: López LP, Romero J, Velásquez LE. Aislamiento de Paramphistomidae en vacas de leche y en el hospedador intermediario (Lymnaea truncatula y Lymnaea columella) en una granja del trópico alto en el occidente de Colombia. Rev Colomb Cienc Pecu 2008; 21:9-18.
Autor para el envío de correspondencia y la solicitud de separatas: Sede de Investigación Universitaria -SIU, Universidad de Antioquia. Calle 62 N° 52-59, Torre 2, laboratorio 730. Medellín, Colombia. E-mail: luzelena333@yahoo.com