Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.21 no.1 Medellín Jan./Mar. 2008
Casos clínicos
Hemangioma cavernoso, tumor mamario mixto maligno y un proceso leucémico simultáneos en una perra. Reporte de un caso¶
Simultaneous cavernous hemangioma, mixed malignant mammary tumor and leukaemia in a bitch. A case report
Hemangioma cavernoso, tumor mamário misto maligno e um processo leucêmico simultâneos numa cadela. Reporte de um caso
José F Ortíz Álvarez1, MV; Fabio Ramírez Coral1, MV.
1Centro Veterinario Génesis, Medellín, Colombia.
(Recibido: 11 abril, 2007; aceptado: 24 enero, 2008)
Resumen
Una hembra de raza poodle presentó unos signos clínicos compatibles con una enfermedad producida por Rickettsia (ehrlichiosis) y al mismo tiempo tenía una masa de gran tamaño en la glándula mamaria. Al realizar las pruebas diagnósticas se halló un tumor ubicado en el hígado, compatible con un hemangioma o un hemangiosarcoma; luego de aplicar la eutanasia a la paciente y de realizar los estudios histopatológicos respectivos, se diagnosticó un hemangioma cavernoso, un tumor mamario mixto maligno y, un proceso compatible con una leucemia.
Palabras clave: ascitis canina, examen por ultrasonido, glándula mamaria, hígado canino.
Summary
A poodle female dog presented clinical and haematological signs compatible with an illness produced by Rickettsia, at the same time a big size mass was found in the mammary gland. After the diagnostic tastes, a big tumour was also found in the liver being compatible with haemangioma. After the euthanasia was done to the patient and histhopathological studies were done, a cavernous haemangioma was diagnosed, a mixed malignant mammary tumour and a process compatible with leukaemia.
Key words: canine ascites, canine liver, canine mammary gland, ultrasound examination
Resumo
Uma fêmea da raça poodle apresentou sintomas clínicos compatíveis com uma doença produzida por Rickettsia (ehrlichiosis) e ao mesmo tempo tinha uma massa de grande tamanho na glândula mamaria. Ao realizar as provas de diagnóstico foi encontrado um tumor localizado no fígado, compatível com um hemangioma o um hemangiosarcoma; logo de aplicar a eutanásia na paciente e de realizar os estudos histopatológicos respectivos, foi diagnosticado um hemangioma cavernoso, um tumor mamário misto maligno e um processo compatível com uma leucemia.
Palavras chave: ascite canina, exame por ultrasom, glândula mamaria, fígado canino.
Introducción
El hemangioma y el hemangiosarcoma son tumores del endotelio de vasos sanguíneos (8). El hemangioma se puede observar entre un 0.3 y un 2% de las necropsias caninas y constituye el 5% de todas las neoplasias del perro (1, 2). Los animales más afectados son perros gerontes (8 a 13 años); aún no está clara la predisposición sexual (2, 13); entre las razas más comúnmente encontradas en los reportes están: pastor alemán, golden retriever, bóxer, labrador retriever, gran danés, poodle y husky siberiano (2, 13). Los sitios habituales de presentación son el bazo (50%), la aurícula derecha (25%), el tejido subcutáneo (13%), el hígado (5%), y otros órganos (1-2%) (11); sin embargo, como derivan de células endoteliales, puede originarse en cualquier parte del cuerpo como: huesos, vejiga, aorta, próstata, músculos, riñones o útero (2, 8, 13).
El hemangioma que presenta espacios sanguíneos pequeños, se designa hemangioma capilar y el que tiene grandes espacios, hemangioma cavernoso (4, 11), la mayoría son benignos; en muchos casos cuando se evalúa una zona diferente de una masa que inicialmente se consideraba benigna, se pueden encontrar células anaplásicas que lo convierten en maligno (11, 13). Las leucemias, por su parte, son neoplasias malignas que se originan a partir de las células de la medula ósea; estas células están incapacitadas para experimentar la diferenciación terminal, por ello se autoreplican como clones de células en general inmaduras y afuncionales (1, 8).
Por su parte, las neoplasias de la glándula mamaria son una enfermedad de perras de edad avanzada, en promedio 10 años de edad, aunque también se puede presentar en perros machos. Representan casi la mitad de todos los tumores de las perras (1); la mayoría de las pacientes son enteras o con ovario histerectomías (OVH) tardías (1, 8); el 41.7% de los tumores mamarios se presentan en perras sin esterilizar (3). La OVH temprana es una firme protección contra el desarrollo de los tumores mamarios y las perras esterilizadas antes del primer celo no tienen menor riesgo que los machos para su presentación (8). Alrededor del 50% de los tumores mamarios en la perra son malignos (3, 12). En las hembras tratadas con progestágenos y estrógenos para el control del celo y por montas indeseadas, se ha encontrado que tienen una probabilidad mayor de presentar tumores mamarios (12); también se ha encontrado que el factor genético influye en su presentación, razón por la cual es más común en ciertas razas como poodle, springer spaniel, cocker spaniel, pointeers, pastor alemán, maltes y dachshund (3, 12).
Los estudios sobre mutaciones genéticas no arrojan resultados contundentes que permitan establecer la causalidad de la enfermedad; en este sentido, la supresión del gen P53 que es la mutación genética más frecuente en los tumores mamarios humanos, se ha investigado en los tumores mamarios caninos encontrándose en algunos casos sobreexpresión y en otros reportes de baja incidencia de la mutación. Existen reportes de sobre expresión del oncogene c-erb B2 y mutaciones en el BCRA1, este último reportado hasta en el 10% de los tumores mamarios humanos (3).
En el presente artículo se expone el caso clínico de una perra que presentó tres patologías simultáneas (hemangioma cavernoso, tumor mixto mamario maligno y un proceso compatible con una leucemia), dos de ellos con signos clínicos y hematológicos similares a los que ocurren en el hemoparasitismo, lo cual no permite diferenciarlos clínicamente, el otro, un tumor maligno de muy mal pronóstico. Debido a la alta cantidad de casos de ehrlichiosis canina en nuestro medio, la cual puede presentar una sintomatología similar a las patologías comentadas anteriormente imposibilitando su diagnóstico solamente por la clínica y también al alto número de casos de tumores mamarios sobre todo en la raza poodle en nuestro medio, los autores vieron la importancia de documentar este caso. También es objetivo de la presentación de este caso, mostrar la gran dificultad que se tiene en el momento para el diagnóstico, correcto tratamiento y seguimiento de los pacientes con cáncer; aunque no hay estudios sobre la incidencia de estas patologías en la ciudad, los veterinarios sabemos por nuestro ejercicio clínico que es un problema frecuente y de difícil manejo, por esto se ilustra el caso para que pueda ser incluído como diagnóstico diferencial por los médicos veterinarios dedicados a las pequeñas especies.
Evaluación del paciente
Anamnesis
Al Centro veterinario Génesis (Medellín, Colombia) fue llevada para consulta una perra de la raza poodle de 11 años de edad, esterilizada un año atrás por un piómetra, con el plan de vacunación y desparasitación no vigentes desde varios años atrás y con pérdida del apetito desde dos días atrás; además, presentaba disnea inspiratoria, polidipsia y poliuria.
Hallazgos al examen clínico
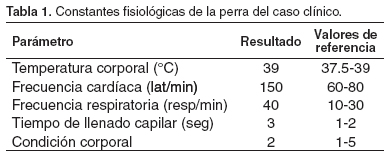
La paciente presentaba decaimiento marcado, intolerancia al ejercicio, tos, disnea inspiratoria; también presentaba pulso fuerte y rápido, mucosa oral extremadamente pálida, petequias y hemorragias gingivales, mucosa vaginal cianótica, se auscultó un soplo cardiaco mitral grado III y estertores de burbuja fina en la zona ventral de ambos campos pulmonares; abdomen en "plancha" lo cual dificultó su palpación detallada. Las constantes fisiológicas halladas se presentan en la tabla 1. A la auscultación del abdomen se escucharon sonidos de movilidad gástrica aparentemente normales, dolor a la palpación de la región lumbar y en la glándula mamaria craneal izquierda se encontró una masa en forma de placa, de aproximadamente 10 x 5 cm de diámetro, de consistencia dura y granular, no desplazable.
Al indagar al propietario por la presencia de ectoparásitos este respondió que aproximadamente un mes antes, la paciente había presentado una leve infestación de garrapatas que fue controlada con un producto del mercado, que la masa en la glándula mamaria se encontraba desde hacía varios años, y que su crecimiento era lento; sin embargo, al revisar detalladamente la piel no se logró encontrar ninguna clase de parásitos.
Ayudas diagnósticas
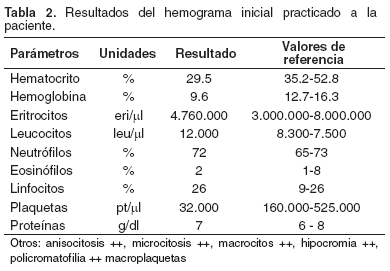
Inicialmente se realizó un hemograma completo (véase Tabla 2). Por el resultado del hemograma se sospecho una rickettsiosis y se aconsejó al dueño que autorizara la realización de una prueba específica para descartar Erlichia canis; además, se comenzó el tratamiento inmediato con doxiciclina (10 mg/kg) intravenosa, c/12 h, flunixin meglumina (0.5 mg/kg) intravenoso, c/24 h, y complejo B (10). La prueba para descartar E. canis no se pudo realizar por la negativa del dueño al ver la satisfactoria respuesta de la paciente al tratamiento, por esto se continuó el tratamiento con doxiciclina vía oral, a la misma concentración, c/12 h/30 d. Luego de tres días de tratamiento la paciente presentó vómito y anorexia, por esto se modificó la aplicación de la doxiciclina c/24 horas y se utilizó ranitidina (3mg/kg) vía oral, c/12 h (10); a los 8 días de tratamiento, la paciente se encontraba en recuperación, con apetito normal y con una leve intolerancia al ejercicio.
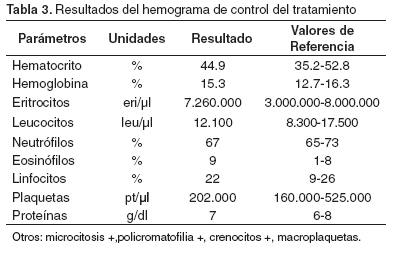
Al terminar el tratamiento se realizó un examen clínico completo en el cual se encontró que las constantes fisiológicas estaban dentro de los parámetros normales y la condición corporal mejoró de 2 a 3. También se realizó un hemograma de control (véase Tabla 3).
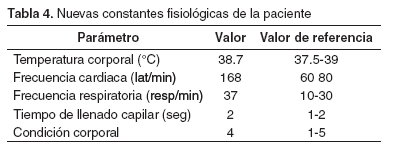
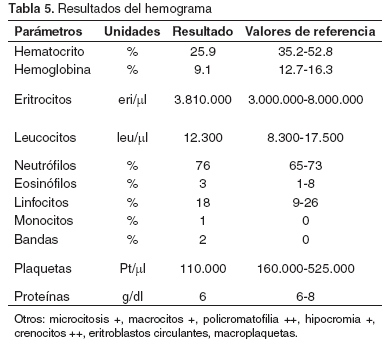
Por el resultado del examen que muestra crenocitos y macroplaquetas, se continuó el tratamiento por 10 días más. Dos meses después la paciente regresó a consulta con un cuadro similar al anterior, al indagar al propietario por nuevas infestaciones de garrapatas este contestó que no había vuelto a ver ninguna y que mensualmente estaba aplicando el producto para su control. Se realizó el examen clínico (véase Tabla 4). También se encontró un pulso fuerte, mucosas pálidas, orina de color amarillo oscuro, anorexia y una leve distensión abdominal. Se realizó una prueba de laboratorio (véase Tabla 5) y la prueba para detectar títulos de anticuerpos contra E. canis en sangre. Antes de conocer los resultados, se inició el tratamiento inmediatamente con dipropionato de imidocarb (5mg/kg) (10) vía subcutánea, una sola vez y enrofloxacina (5mg/kg) (10) vía subcutánea, c/12 h y luego vía oral, a la misma dosis.
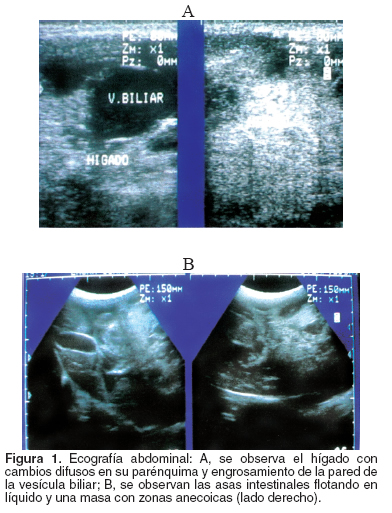
Al día siguiente, la paciente pudo comer, defecó y orinó normalmente, se programó la realización de una ecografía abdominal (véase Figura 1), en la que se encontró una ascitis con cambios en la ecoarquitectura hepática compatibles con una neoplasia.
Luego del resultado, se recomendó realizar una biopsia por aspiración con aguja fina, del hígado y de la masa encontrada para diagnosticar el tipo de tumor, pero los propietarios no aceptaron la sugerencia; la paciente regreso a su casa con el tratamiento anteriormente instaurado y una alimentación alta en proteína y grasa, complementada con vitaminas, minerales y ácidos grasos omega 3. Luego de 20 días de haberse realizado la ecografía y por petición de los dueños al ver las continuas recaídas en el estado de ánimo de la paciente, se le aplicó la eutanasia y se realizó la necropsia.
Hallazgos de necropsia
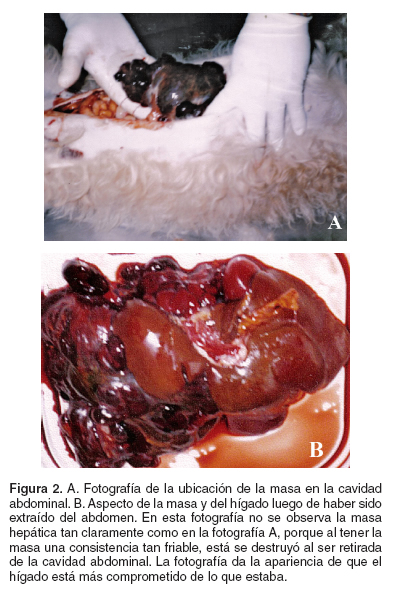
En la necropsia se observó una intensa palidez de los tejidos, la cavidad abdominal estaba llena de líquido sanguinolento (aproximadamente 300 - 400 ml) y se encontró una masa de gran tamaño (15 x 10 cm de diámetro) al lado derecho del abdomen, con punto de inicio en el lóbulo caudado del hígado; esta masa era de color rojo oscuro de forma lobulada y alargada, muy friable, rodeada por una cápsula aunque en algunas partes esta se encontraba rota; los demás lóbulos del hígado presentaban coloración color café clara y borde redondeados (véase Figura 2).
Macroscópicamente no hubo evidencia de metástasis, ni en los ganglios, ni órganos de la cavidad abdominal y torácica, pero al encontrarse ruptura de la cápsula del tumor, no se descarta micrometastasis; se tomaron muestras del hígado de la masa abdominal, y de la glándula mamaria para estudios histopatológicos.
En el resultado del estudio histopatológico se encontró en la muestra de hígado, alteración severa de la arquitectura, los hepatocitos presentaban degeneración hidrópica difusa severa y colestasis intracelular. Los sinusoides estaban severamente dilatados con presencia de abundantes megacariocitos, células inmaduras de la línea mieloide y eritroide tales como rubriblastos, rubricitos y bandas, encontrándose un proceso compatible con una leucemia. La glándula mamaria presentaba proliferación celular neoplásica de células epiteliales y mioepiteliles. Las células epiteliales distribuidas formando túbulos displásicos de tamaño variable, sus núcleos presentaban anisocariosis y pleomorfismo moderado, las células mioepiteliales eran fusiformes y estrelladas, había metapalsia ósea y focos de calcificación lo que corresponde a un tumor mixto mamario maligno. En la masa hepática se observó una proliferación de estructuras vasculares de diferentes tamaños, pletóricas de eritrocitos y rodeadas por cantidad variable de tejido conectivo compatible con un hemangioma cavernoso.
Discusión
Los tumores hepáticos primarios de origen mesodérmico son poco comunes e incluyen fibroma, fibrosarcoma, hemangiomas, hemangiosarcomas, leiomiosarcomas y osteosarcomas (4). Los tumores metastáticos son una causa significativa de enfermedades hepáticas en el perro, estos son más comunes que las neoplasias hepáticas primarias (8, 11); en este caso clínico, como no se observó macroscopicamente ninguna otra masa y el tumor mamario encontrado era histopatológicamente diferente, se puede considerar este tumor como de origen primario del hígado.
Los hemangiomas cavernosos son tumores de células endoteliales y se clasifican por el tamaño de las estructuras vasculares formadas, la mayoría de las veces son benignos y su tratamiento es la extracción quirúrgica de la masa; cuando este es muy voluminoso, es muy difícil extraerlo completamente, lo que provocará recidivas en el tumor que luego de esto puede tornarse maligno; además, con el tiempo las masas muy grandes pueden sufrir ruptura de su cápsula lo cual provocará en el paciente colapsos circulatorios por hemorragias intracavitarias. Otros pacientes pueden sufrir coagulación intravascular diseminada o trombocitopenia secundaria a microangiopatía. El tratamiento, cuando se presenta alguna de estas complicaciones es difícil y en la mayoría de las veces, la respuesta es mínima (4, 11).
Los signos clínicos en los pacientes con hemangiomas son inespecíficos como anorexia, decaimiento marcado, mucosas pálidas, disnea, efusión abdominal (9, 11). Otros signos asociados son hipovolemia causada por hemorragias, taquicardia, taquipnea, soplos cardiacos y cuagulopatías (8). Entre los signos hematológicos más comunes, encontramos anemia y leucocitosis; la anemia es no regenerativa, pero puede ser regenerativa si se asocia a sangrado excesivo por rotura del tumor (11).
La química sanguínea mostró un aumento de actividad de las enzimas hepáticas (ALT, FA) que variaban de leve a moderado, pero podrían ser normales (1, 4). En la paciente del caso clínico se encontraron la mayoría de los signos clínicos y hematológicos compatibles con la presencia de un hemangioma: en cuanto a la química sanguínea, en nuestro caso sólo se presentó un leve aumento en la ALT (véase Tabla 7), cabe recordar que esta sintomatología es común y se puede presentar en varias patologías incluyendo la ehrlichiosis.
Uno de los signos más importantes que llevó en un principio a sospechar de una ehrlichiosis, fue el bajo recuento plaquetario encontrado en el hemograma inicial y su posterior ascenso a los valores de referencia, luego del primer tratamiento instaurado para la posible ehrlichiosis. La reducción del número de plaquetas circulantes puede relacionarse con uno o más de los siguientes mecanismos de hipoproducción plaquetaria (aplasia idiopática de la médula ósea, trombocitopenia cíclica, etc) y con el incremento de la destrucción, consumo o secuestro de plaquetas (trombocitopenia inmunomediada, coagulación intravascular diseminada, neoplasias). La ehrlichiosis produce una trombocitopenia con trombocitolisis periférica (presumiblemente inmunomediada) (4, 8).
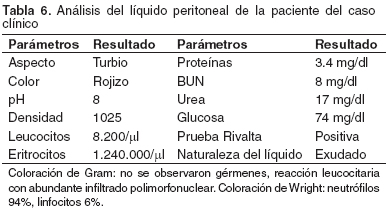
Los síndromes paraneoplásicos también pueden ocasionar trombocitopenias que pueden ser cíclicas o permanentes (8). El líquido abdominal fruto de procesos neoplásicos suele clasificarse como transudado o exudados asépticos: su color puede ser transparente, rojo o amarillo oscuro, el recuento celular es menor de 20.000 µl, el contenido proteico es mayor de 2.5 g/dl y su densidad 1.017-1.031 (8). Aunque las células de los hemangiomas son de identificación relativamente sencilla en los aspirados o improntas de tejidos, son de reconocimiento muy difícil en efusiones abdominales; el diagnóstico citológico en estos derrames sólo se logra en un 25% de los casos (8). En el caso clínico, la evaluación del líquido abdominal muestra grandes similitudes con lo reportado en la literatura y con la citología del líquido; no fue posible realizar el diagnóstico definitivo del tipo de neoplasia presente.
La ecografía constituye un método confiable para evaluar perros con hemangiomas o hemangiosarcomas sospechosos a nivel intra abdominal, las lesiones cancerosas aparecen como nódulos de ecogenicidad variable que van de anecoicas a hiperecoicas y cambios en la ecoarquitectura del órgano donde esté presente (8, 11). En este caso la ecografía fue fundamental en el diagnóstico de la patología, además ayudó a evaluar los de órganos de la cavidad abdominal, para descartar una posible metástasis en alguno de ellos.
En las leucemias las células neoplásicas pueden o no aparecer en la circulación periférica cuando sólo prosperan dentro de la medula ósea (7, 8) y pueden clasificarse según su filogenética por la línea celular de origen, en dos amplias categorías mieloides (o no linfoides) y linfoides; y de acuerdo con su curso clínico y rasgos citológicos se pueden clasificar en agudas ó crónicas (8). En el caso clínico del reporte sólo aparecieron células neoplásicas (eritroblastos) en el último hemograma realizado (véase Tabla 5), pero esto no descarta que el proceso ya estuviera presente. Varios factores están implicados en la presentación de las leucemias en perros y gatos tales como cambios genéticos con daños en el ácido desoxirribonucleico (ADN) que pueden acelerar su presentación (7, 14). Si se sabe que en los gatos hay un componente viral en la presentación de la enfermedad; en los perros tampoco se descarta su existencia, porque en algunos casos de leucemias linfoblásticas se han aislado retrovirus nuevos. En el momento se investiga su papel (7). En el perro, las leucemias representan menos del 10% de todas las neoplasias hemolinfáticas y por ende se las consideran raras (1, 8).
Los signos clínicos en las leucemias agudas son inespecíficos hay letargia, anorexia, fiebre persistente, pérdida de peso, esplenomegalia, hepatomegalia, palidez, linfadenopatia generalizada leve; puede haber petequias y equimosis, la ictericia se puede presentar si hay compromiso hepático o hemólisis (7, 8); en las crónicas solo el 50% de los casos muestran estos síntomas; el otro 50% de los casos son asintomáticos y su diagnóstico es incidental (7, 8).
La infiltración de órganos como el hígado va a producir anormalidades metabólicas y diferente sintomatología por los síndromes neoplásicos como hipercalcemia, hiperproteinemia e hiperviscocidad de la sangre (7). El diagnóstico se realiza a partir de la información reunida; el hemograma completo suele confirmar la patología, pero se necesita un aspirado o biopsia de medula ósea para clasificarla. Siempre se debe realizar un diagnóstico diferencial con patologías que involucren los sistemas mononuclear fagocítico y hematopoyético como la histiocitosis, mastocitomas, rickettsiosis (ehrlinchiosis) y babesiosis (1, 8). El tratamiento en general es infructuoso dado que la mayoría de los enfermos apenas responden a la terapia y las recaídas son muy frecuentes, sin embargo existen varios protocolos con quimioterapia que utilizan la combinación de varios fármacos incluidos los corticoides (7, 8). En la paciente de este reporte, el hallazgo de una posible leucemia fue incidental luego de los análisis postmortem de patología. Al examen clínico no se encontraron signos como la linfadenitis u otro signo que nos hiciera sospechar de esta patología, por esto, no se realizaron exámenes complementarios como la evaluación de la médula ósea que hubiera ayudado a confirmar y a clasificar el tipo de leucemia.
Las neoplasias de la glándula mamaria se presentan más en perras de edad avanzada. Al examen físico se encuentra una masa en la región ventral torácica o abdominal; esta masa puede ser nodular y firme, de tamaño variable, ser móvil o estar adherida a la pared corporal (en su mayoría son malignas) y pueden estar intactas o ulceradas e inflamadas, hay linfadenitis axilar o inguinal; si hay metástasis a pulmón, puede haber disnea (1). La biopsia escisional es el método de elección para confirmar el diagnóstico, siempre antes de realizar el muestreo se debe realizar rayos X de tórax, la presencia de metástasis pulmonar es de pronóstico grave (1, 3). El tratamiento ideal es retirar quirúrgicamente todo el tejido afectado, la única contraindicación para no realizar el procedimiento es la presencia de carcinoma inflamatorio porque el tumor es muy agresivo, hace metástasis muy rápido y las pacientes mueren rápidamente luego del diagnóstico (3, 12).
Hay varios métodos para la extirpación del tumor y dependerá del tamaño y del número de tumores; en los tumores pequeños (menores de 5 mm) la cirugía en la mayoría de los casos es curativa (12), también se puede complementar el tratamiento con la utilización de quimioterapia aunque los resultados son muy variables (3, 8, 12). El pronóstico de los tumores mamarios depende de varios factores como el tamaño del tumor, el tipo, el estado en que se encuentra y la diferenciación histológica (12). El sarcoma y el carcinoma inflamatorio tienen muy mal pronóstico (12); lo mismo ocurre con el tumor mamario mixto maligno y lo más probable es que haga metástasis rápidamente (3, 12).
Al indagar a los propietarios de la paciente sobre el tiempo de evolución y los tratamientos realizados para combatir el tumor mamario, ellos argumentaron varias razones por las cuales no tomaron la decisión de realizar un tratamiento agresivo como el quirúrgico, antes de haber dejado avanzar el problema. Primero, le tenían miedo al procedimiento quirúrgico; segundo, no fueron ampliamente informados sobre el pronóstico y las consecuencias al no realizar ningún tipo de tratamiento y por último, la opinión de un médico veterinario que les dijo: «si no crece rápidamente es mejor dejarlo así». Luego de diagnosticar cualquier tipo de neoplasia hay que clasificarla para saber en qué estadio se encuentra, dar un pronóstico y recomendar o no un tratamiento (véanse Tablas 9 y 10) (11).
En la actualidad existen varios tratamientos para tumores hepáticos que se encuentran en el estadio 1 y en algunos en estadio 2 y varían desde la remoción total del tumor en el estadio 1, dependiendo de la ubicación, con un promedio de sobrevivencia entre 19 y 86 días (9, 11).
Otros tratamientos complementan la cirugía con la administración de quimioterapia (monoterapia o politerapia con varios fármacos). La combinación de vincristina, doxorubicina y ciclosfosfamida ha dado buen resultado con un promedio de supervivencia entre 140 y 166 días en pacientes con tumores en bazo en estadio 1; en los hepáticos la respuesta es menos favorable (11). Cabe recordar que la combinación de varios agentes antineoplásicos puede aumentar la probabilidad de que se presenten efectos indeseados como una ligera neutropenia o una toxicidad gastrointestinal severa (9, 11), por esto, antes de iniciar un tratamiento contra el cáncer se debe colocar en una balanza los efectos del tratamiento contra los posibles beneficios del mismo (11).
Actualmente, la quimioterapia en perros y gatos no es un medio eficaz para controlar tumores hepáticos primarios; y en los secundarios, la respuesta puede ser solo temporal (1). Por ello hay otros tipos de tratamiento como la radiación y la terapia inmunológica, pero se tiene muy poca experiencia con ellos y con este tipo de cáncer; en el momento son motivo de estudio (11). A pesar de realizar cirugías agresivas de utilizar quimioterapia y radiación, o una combinación de estas, se ha encontrado que sólo el 10% de los perros, llegan a sobrevivir en promedio un año de vida (9).
En el caso del hemangioma cavernoso y del tumor mamario de este reporte se pueden clasificar un estadio III - IV, porque son tumores de más de 5 cm de diámetro y uno de ellos (el hemangioma), presentaba ruptura de la cápsula, aunque no se observó compromiso ganglionar aparente, ni metástasis macroscópicas a distancia; la sola ruptura tumoral facilita la diseminación del proceso. Un factor que se debe tener en cuenta es la nutrición, esta es una parte fundamental para aumentar la probabilidad de éxito en el tratamiento de cualquier caso de cáncer (11). La presencia de desnutrición es signo de mal pronóstico, esta afecta negativamente el funcionamiento de los tejidos, de la reparación y la funcionalidad del sistema inmunológico; los pacientes mal alimentados toleran la cirugía, la quimioterapia o la radioterapia, pero con desventaja respecto a los pacientes bien nutridos (5).
Los pacientes con cáncer muestran un perfil alterado en el metabolismo de los carbohidratos, las proteínas y los lípidos; algunos tumores utilizan glucosa como fuente de energía; si la ingesta de carbohidratos no es adecuada, el resultado es una pérdida de energía neta (5, 11). Las proteínas también son utilizadas como energía por algunos tumores. Si la cantidad de proteína absorbida no es igual al consumo de las mismas, ocurrirá una alteración en la respuesta inmunológica, en la función gastrointestinal y en la recuperación de las heridas, el tumor compite con el perro por los aminoácidos, en consecuencia estos pacientes presentan disminución de su masa muscular (11).
Las células tumorales son deficientes en la utilización de los lípidos por lo que el animal se ve forzado a utilizarlos como única fuente de energía, provocando disminución corporal de las mismas, lo que produce disminución del peso; por esto la alteración en el metabolismo de los carbohidratos, las proteínas y las grasas conduce a la caquexia por cáncer (5). Una dieta para un paciente con cáncer debe tener un adecuado nivel de calorías que incluya una disminución en los carbohidratos simples, proteína de muy buena calidad y en niveles adecuados, moderados niveles de grasa y fibra (soluble e insoluble) y debe ser suplementada con altas cantidades de ácidos grasos omega 3 y vitaminas E y C, que sirven como antioxidantes naturales y para la captación de radicales libres, y ante todo, debe ser una dieta muy palatable y de fácil asimilación por parte del paciente (5, 11).
Los segundos o terceros cánceres constituyen un fenómeno bien descrito en los pacientes humanos con cáncer y su ocurrencia puede o no estar relacionada con la malignidad de la primera patología (6). Algunos segundos cánceres se desarrollan por casualidad, pero se cree que otros están asociados con la exposición continuada a carcinógenos ambientales, con otras neoplasias, con factores de riesgo del hospedador como alteraciones genéticas o inmunosupresión o por la carcinogenicidad del tratamiento antineoplásico por si mismo (6).
En los pacientes animales, la presentación de un segundo cáncer no está muy bien documentada; los gatos con linfoma son tratados con agentes alquilantes; estos son conocidos por provocar leucemias agudas, no linfoides, en los humanos, años después de que su terapia inicial haya sido completada, lo cual también podría ocurrir en el gato; la ciclofosfamida también es capaz de inducir carcinoma de células transicionales de la vejiga urinaria en los caninos y en lo seres humanos (6).
Para este caso, si se tiene en cuenta lo antes expuesto, la presentación de las tres patologías simultáneas pudo haber sido fruto de la exposición continua y prolongada a un carcinógeno, si se conoce que el tumor mamario es la primera de las patologías de la cual se tiene referencia y por el comentario de los propietarios esta tiene varios años de evolución. Por histopatología se encontró que era un tumor mixto maligno y se podría especular que este pudo ser el origen de sustancias carcinogénicas que a lo largo de mucho tiempo estuvieron circulando por el cuerpo de la paciente. El hígado además de cumplir funciones metabólicas, también tiene alguna función de desintoxicación del organismo y este pudo haber sido el blanco de estas sustancias carcinogénicas que al final pudieron ser las causantes de las otras dos neoplasias encontradas en este mismo órgano.
El plan diagnóstico que se siguió en este caso se realizó con los recursos disponibles en el momento. Afortunadamente, la implementación de estudios ecográficos pasó de ser solamente utilizada para el diagnóstico ginecológico, a ser pieza fundamental en el diagnóstico de patologías que provoquen daños o cambios en la estructura de los órganos dentro de las cavidades. Por otra parte, el diagnóstico y clasificación de las neoplasias intracavitarias se debe hacer postmorten en la mayoría de las veces. El diagnóstico antemorten sólo se da luego de realizar un procedimiento invasivo como una biopsia; la aspiración con aguja fina que en la actualidad se puede guiar por ecografía, es poco utilizada ya sea porque los veterinarios no están muy familiarizados con la correcta forma de obtener una buena muestra, o porque los laboratorios de referencia no están especializados en el análisis citológico proveniente de estas muestras. No queda claro en este caso por qué al realizar el primer tratamiento se presentó una mejoría tanto de los signos clínicos como hematológicos, si como se presume para una de las dos patologías (quizás las dos), ya se encontraban presentes al momento de instaurar el primer tratamiento y en ningún momento se utilizo un fármaco que hiciera parte de los protocolos estandarizados para el manejo de dichas entidades, como es el caso de los corticoides.
Conclusión
La decisión de seguir un tratamiento para un segundo cáncer depende de un gran número de factores y el veterinario debe comparar con cuidado el pronóstico del segundo cáncer con respecto al primero y los esfuerzos terapéuticos deberán dirigirse hacia la neoplasia con mayor probabilidad de ser riesgosa para la vida del paciente (6). La realización de un tratamiento para las neoplasias encontradas en este caso es bastante compleja y depende de muchos factores: primero, el tumor mamario y la posible leucemia, son dos entidades extremadamente malignas y de muy mal pronóstico; segundo, el hemangioma cavernoso, cuando fue diagnosticado, presentaba ruptura de la cápsula con la posible micro siembra de células tumorales en la cavidad abdominal y a distancia; y tercero, la base del tratamiento oncológico en nuestro medio, es la utilización de quimioterapia acompañada algunas veces de la cirugía oncológica. Otras medidas terapéuticas existentes como la radioterapia, no se pueden utilizar por la falta de centros de referencia que posean los equipos y el personal indicado para el procedimiento. La mayor tasa de remisiones de tumores solitarios que se reportan en la literatura es lograda con la combinación de varias formas de tratamiento como por ejemplo quimioterapia más radioterapia; en los segundos cánceres ni siquiera con la combinación de tratamientos, se logran resultados satisfactorios.
En nuestro medio en el momento, el tratamiento de algunos tipos de neoplasias solitarias continua siendo difícil; el tratamiento de un segundo cáncer resultaría casi imposible por todos los factores mencionados anteriormente; además se tiene muy poca información sobre la incidencia de estas enfermedades y son escasos o nulos los trabajos investigativos y los reportes sobre la utilización y estandarización de tratamientos para las patologías tratadas. Con este reporte se quiere hacer un llamado al estudio y la atención del paciente geronte, pues se ha visto que el cuidado de las mascotas ha mejorado ostensiblemente en los últimos años, tanto en la parte de medicina preventiva, como de diagnóstico, de tratamientos y de nutrición, lo cual redunda en una mejor calidad de vida y una mayor longevidad de los animales, que a su vez incrementará la presencia de enfermedades degenerativas, neoplásicas y de comportamiento, propias de la vejez.
Referencias
1. Birchard SJ, Sheerding RG. Manual clínico de pequeñas especies. 1ª ed. México: McGraw-Hill - Interamericana; 1996. p.230-247. [ Links ]
2. Carlyle TJ. Patología veterinaria. Montevideo: Hemisferio sur; 1996. p.1307-1308. [ Links ]
3. Giraldo GE. Tumores mamarios. Memorias seminario VEPA, oncología canina. Medellín; 2006. p.17-23. [ Links ]
4. Jubb KVF. Pathology of domestic animals. 4th ed. California: Academic Press; 1993. p.98-99. [ Links ]
5. Lerner C. El cáncer en los caninos. Rev New Holliday 2000; 5:4-7. [ Links ]
6. Mauldin GE. Manejo del paciente con linfoma y enfermedad concurrente. In: August JR (ed). Consultas en medicina intena felina. Buenos Aires: Intermédica; 2004; p.508-521. [ Links ]
7. Morris J. Leukemia. In: Day MJ (ed). Manual of canine and feline haematology and transfusion medicine. London: British Small Animal Veterinary Asociation; 2000. p.139-154. [ Links ]
8. Nelson RW, Couto CG. Pilares de medicina interna en animales pequeños. Buenos Aires: Intermedica; 1995. p.779-831. [ Links ]
9. Pastor J. Neoplasias abdominales. Memorias seminario VEPA, oncología Canina. Medellín; 2006. p.24-35. [ Links ]
10. Plumb D. Manual de farmacologia veterinaria. 5ª ed. Buenos Aires: Intermedica; 2006. p. 837-978. [ Links ]
11. Smith AN. Hemangiosarcoma in dog and cats. Vet Clin North Am Small Anim Pract 2003; 33:534-547. [ Links ]
12. Sorenmo K. Canine mammary gland tumors. Vet Clin North Am Small Anim Pract 2003; 33:573-596. [ Links ]
13. Trigo F. Patología sistemica veterinaria. México: McGraw-Hill - Interamericana; 1996. p.354-355. [ Links ]
14. Workman HC. Lymphocytic leukemia in dog and cats: The veterinary perspective. Vet Clin North Am Small Anim Pract 2003; 33:650-665. [ Links ]
¶ Para citar este artículo: Ortíz A, JF y Ramírez C, F. Hemangioma cavernoso, tumor mamario mixto maligno y un proceso leucémico simultáneos en una perra, reporte de un caso. Rev Colomb Cienc Pecu 2008; 21:66-76.
* Autor para el envío de la correspondencia y la solicitud de separatas: Centro Veterinario Génesis Carrera 72 N° 29 - 69 Medellín, Colombia. E-mail: cvgenesis1@yahoo.com.ar