Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.21 no.1 Medellín Jan./Mar. 2008
Revisiones
Efectos de la leptina en el inicio de la pubertad en animales machos¶
Effects of the leptin in the onset of puberty in animal males
Efeitos da leptina no inicio da puberdade em animais machos
Juan C Quintero V1*, MV, Z; Zulma T Ruíz Cortez2,3, MV, MS, PhD.
1Grupo de investigación GRICA, y 2Grupo de investigación Fisiología y Biotecnología de la Reproducción, 3Facultad de Ciencias Agrarias, Universidad de Antioquia, AA 1226, Medellín, Colombia.
(Recibido: 19 octubre, 2006; aceptado: 21 enero, 2008)
Resumen
La leptina es una hormona de 16 KDa producida principalmente por el tejido adiposo, codificada por el gen ob y compuesta por 146 aminoácidos. Cumple sus funciones en la periferia del organismo en el eje hipotálamo - hipófisis - gónadas. En varias especies se ha estudiado el efecto de esta hormona en la reproducción; los cambios en su concentración y en su expresión podrían estar asociados con el inicio de la pubertad en diferentes especies animales y en los humanos. El rol de la leptina en la reproducción del macho ha sido estudiado especialmente en ratas y ratones, pero también se han realizado investigaciones en humanos y otras especies animales. En las células de Leydig, en los túbulos seminíferos, las espermatogonias y los espermatozoides, entre otros tipos de células, hay expresión de los receptores y el RNAm de receptores de leptina, lo que indica que puede haber una función importante de la leptina en los testículos. En general, se ha hallado un efecto inhibitorio de la testosterona con la secreción de leptina y viceversa, lo cual indica que la leptina puede regular la esteroidogénesis en el testículo. La leptina también puede actuar en células no diferenciadas del testículo para permitir su diferenciación en espermatocitos y puede asistir a la célula a través de toda su diferenciación y maduración hacia espermátides. A través de todos estos resultados obtenidos, se observa a la leptina como una importante hormona que puede estar involucrada en funciones vitales del eje neuroendocrino y reproductivo del macho.
Palabras clave: esteroidogénesis en bovinos, hormona gonadotrópica, producción de estrógenos, producción de testosterona, receptor de gonadotropinas
Summary
The leptin is a 16 KDa hormone principally produced by the adipose tissue, codified by the ob gene and composed by 146 amino acids. This hormone carries out its functions at peripheral levels and in the hypothalamic- hypophysis - gonadal axis. In several species the effect of this hormone on reproduction and their concentration and expression changes might be associated with the onset of puberty in different animal species and in human beings. The role of leptin in male reproduction has been studied especially in rats, mice, human beings, and other animal species. Leptin receptor and mRNA expression has been found in Leydig cells, seminiferous tubules, spermatogonies, spermatozoa, among other cells, indicating that leptin could have an important role in testicular function. An inhibitory effect of testosterone on leptin secretion has been found and vice versa, which indicates that leptin can regulate testicular steroidogenesis. Leptin can also act in non differentiated cells of the testis, promoting spermiogenesis. Then, leptin appears to be an important hormone probably involved in vital functions of the male neuroendocrine and reproductive axis.
Key words: bovine steroidogenesis, estrogen production, gonadotropic hormone, gonadotropin receptor, testosterone production
Resumo
A leptina é um hormônio de 16 KDa produzida principalmente pelo tecido adiposo, codificada pelo gene ob e composta por 146 aminoácidos. Cumpre suas funções na periferia do organismo no eixo hipotálamo - hipófise - gônadas. Em varias espécies tem-se estudado o efeito deste hormônio na reprodução; as mudanças na concentração e em sua expressão poderiam estar associadas com o inicio da puberdade em diferentes espécies animais e em humanos. O papel da leptina na reprodução em machos tem sido estudado especialmente em ratas e ratos, porém também tem sido realizadas pesquisas em humanos e outras espécies animais. Nas células de Leydig, nos túbulos seminíferos, as espermatogônias e os espermatozóides, entre outros tipos de células, existe expressão dos receptores e o RNAm de receptores de leptina, o que indica que pode existir uma função importante da leptina nos testículos. Em geral, tem sido encontrado um efeito inibitório da testosterona com a secreção da leptina e vice versa, o qual indica que a leptina pode regular a esteroidogénese no testículo. A leptina também pode atuar nas células não diferenciadas do testículo para permitir sua diferenciação em espermatócitos e pode ajudar à célula a través de toda sua diferenciação e maturação até espermátides. A análise de todos estes resultados obtidos, permite considerar a leptina como um importante hormônio que pode estar envolvido em funções vitais do eixo neuroendócrino e reprodutivo do macho.
Palavras chave: esteroidogénese em bovinos, hormônio gonadotrófico, produção de estrógenos, produção de testosterona, receptor de gonadotrofinas
Introducción
La leptina es una hormona proteica de 16 KDa, está compuesta de 146 aminoácidos y es sintetizada principalmente por el tejido adiposo. Esta hormona es codificada por el gen ob, identificado originalmente en estudios conducentes a identificar las causas de la obesidad en el ratón obeso (ob/ob). Los ratones ob/ob sufren una mutación en la expresión del gen de leptina que los hace infértiles y la observación que recuperaban la fertilidad al ser tratados con leptina, permitió vincular esta hormona con los procesos de regulación de la reproducción (87).
Esta hormona proteica es producida por células grasas blancas y pardas que ejercen un efecto central en los núcleos hipotalámicos arcuato y ventromedial, alterando el consumo de alimento y el gasto energético (3, 41, 43). El mayor efecto de la leptina a nivel central es la regulación de la producción de péptidos oréxicos (anabólicos), entre los que se encuentran el neuropéptido Y (NPY), las orexinas, la hormona concentradora de melanina (MCH) y las galaninas; y la regulación de los péptidos anoréxicos (catabólicos), dentro de los que se incluyen la hormona liberadora de corticotropinas (CRH) y la hormona liberadora de tirotropinas (TRH) entre otros (4, 14, 16).
La leptina actúa a través de receptores específicos de membrana (Ob-R). Ellos tienen alta similaridad con los receptores de la familia de la Interleuquina 6 (IL-6) (12, 44, 77). Las isoformas de receptores de leptina, incluyen receptores de forma larga (OB-rb) y varios receptores de forma corta (OB-ra, OB-rc, el OB-rd y OB-rf), así como el receptor soluble (OB-re) que se encuentra en plasma circulante (77, 78).
La proteína o el RNAm de receptores de leptina han sido encontrados en gran variedad de tejidos incluyendo los tejidos adiposos blanco y pardo, el páncreas, intestino, hígado, músculo esquelético, placenta, cerebro, glándula mamaria, corteza adrenal, en las células de la granulosa, células de la teca y en el cuerpo lúteo del ovario y en los espermatocitos y células de Leydig de los testículos (66, 67, 68).
En el eje hipotálamo-hipófisis-gonadal (HHG), la leptina juega un papel muy importante en la regulación de la reproducción de los mamíferos. Esta hormona actúa en la regulación y secreción de la hormona liberadora de gonadotropinas (GnRH) por el hipotálamo (13, 84) y en la hipófisis modula la secreción de la hormona luteinizante (LH), como sucede en algunas especies animales tales como la oveja (59), los cerdos (10, 12), los primates (52) los roedores (50) y los rumiantes (84).
En las hembras de ganado bovino, la leptina está relacionada con la regulación del ciclo estral y probablemente involucrada en el control de la reproducción. Existe una relación positiva entre los niveles de leptina en el suero y los del fluido folicular. Además, hay una relación negativa entre el incremento de los niveles de leptina y los niveles de estrógenos (39). Según Williams et al (84), la leptina circulante disminuye durante la fase luteal y folicular del ciclo estral en vacas y novillas sexualmente maduras. Además, en algunos estudios se ha encontrado que las concentraciones sistémicas de leptina incrementan durante la pubertad en machos y hembras, tanto en humanos (42), como en muchas especies animales como cerdos (65), ratones (25) y ganado bovino (36); pero el incremento sólo se mantiene en las hembras, porque en los machos los niveles de leptina disminuyen después de la pubertad, disminución que puede ser debida a que la testosterona inhibe la secreción de la leptina (71).
El mecanismo de acción de la leptina en el sistema reproductivo de los machos ha sido muy discutido por diferentes autores (80, 81, 82), quienes indican su gran complejidad, no sólo por sus efectos inhibitorios sino también por sus efectos estimuladores del eje gonadal. El objetivo de esta revisión es contextuar en forma general y específica el papel de la leptina en el inicio de la pubertad de los machos.
Relación de la leptina con el inicio de la pubertad
Por definición, un macho o una hembra han llegado a la pubertad cuando son capaces de liberar gametos y mostrar un comportamiento sexual. El inicio de la pubertad está regulado por la madurez del eje hipotalámico-adenohipofisario más que por la incapacidad de la hipófisis para producir gonadotropinas o por una insensibilidad ovárica o testicular (54). Wolf et al (85), definieron la pubertad como la edad cuando el ternero produce el primer eyaculado que contiene al menos 50 x 106 espermatozoides y que estos posean una movilidad progresiva mayor al 10%.
La hembra prepúber responde a la secreción pulsátil de gonadotropinas, secretando estrógeno de manera gradual. En las ovejas y las vaquillas, aumentan la frecuencia de picos de LH, seguida de una elevación transitoria en la descarga preovulatoria de LH. Esto está asociado con el comportamiento estral durante este periodo (40).
Los machos prepúberes secretan testosterona progresivamente en respuesta a la estimulación de gonadotropinas. Cada pulso de gonadotropinas es seguido a intervalos de una hora por una elevación transitoria en la secreción de testosterona. Conforme la pubertad progresa, el incremento de testosterona en sangre causa un descenso en la secreción de gonadotropinas mediante un efecto de retroalimentación negativa (40).
Desde el punto de vista económico, la edad a la cual los animales alcanzan la pubertad es una de las características más importantes en producción animal; sin embargo, en el ganado Bos taurus indicus (B. indicus), la selección ha enfatizado las características de crecimiento dejando marginada la selección basada en la capacidad reproductiva. Varios estudios han demostrado diferencias significativas en la edad a la pubertad entre razas de ganado Bos taurus taurus (B. taurus) y B. indicus (35, 61). Estas diferencias están asociadas a la selección de los sementales, que en el ganado B. taurus, ha permitido mejorar apreciablemente las características reproductivas. Al contrario, en el ganado B. indicus la ausencia de selección con base en la precocidad sexual es responsable, en un alto grado, de la característica de pubertad retardada que se cita en este ganado (35, 75).
El desarrollo testicular se relaciona directamente con la producción de espermatozoides, la calidad del eyaculado y la fertilidad; la medida de la circunferencia escrotal (CE) es el mejor indicador del tamaño testicular en toros. La medida de CE tiene una asociación negativa con la edad a la pubertad y positiva con la capacidad de producción de espermatozoides de los sementales (29, 30, 45) y la edad a la pubertad de las hijas del toro (69). La medida de CE es fácil de obtener, confiable y repetible. Además presenta un coeficiente de heredabilidad entre moderado y alto (30, 53).
En toros jóvenes (toritos), el periodo prepúber se caracteriza por el inicio de la espermiogénesis, que está influenciada gradualmente por aumentos en los pulsos de secreción de LH. La espermatogénesis se inicia cuando las células germinales se dividen y forman la espermatogonia, luego se da un aumento en la diferenciación hacia otro tipo de células como los espermatocitos. Cuando el espermatozoide, la célula germinal más diferenciada, se presenta por primera vez en el lumen de los túbulos seminíferos, el animal alcanza la pubertad (6, 32).
Al parecer, el consumo de calorías, la condición corporal o la relación tejido graso y músculo, ejercen de algún modo un control sobre la secreción hipotalámica de la GnRH y pueden constituir un factor permisivo en el inicio de la pubertad y su completo desarrollo tanto en las diferentes especies animales como en los humanos (2). Este tejido graso se comporta como un gran órgano endocrino, en el que se sintetiza en su mayor parte la hormona leptina, esta hormona se encuentra muy relacionada, según varios autores, con el inicio de la pubertad (18, 25).
Leptina y sus efectos en la pubertad
Un adelanto significativo del inicio de la pubertad se ha logrado con la administración de leptina en ratones hembras normales, lo que ha permitido proponer que la leptina sería una señal metabólica para el inicio de la pubertad (8, 24). En ratas hembras se ha observado que las concentraciones plasmáticas de leptina aumentan durante el desarrollo puberal y que la administración central en ratas hembras con restricción alimenticia severa, es capaz de inducir la pubertad a pesar de la restricción alimenticia y de la pérdida de peso corporal, lo que sugiere que en esta especie, la leptina sería una poderosa señal para el inicio de la pubertad (25). Otros estudios no han permitido relacionar los cambios en la leptina circulante y la pubertad, tanto en machos primates como en roedores (18, 26, 63).
El posible papel de la leptina en el inicio de la pubertad, también se ha estudiado en humanos. Horlick et al (42), cuando estudiaron la leptina en el suero y su relación con la pubertad en niños y niñas, encontraron que la leptina disminuye significativamente en los jóvenes y aumenta en las jóvenes después de la pubertad. Estos estudios confirman que existe un dimorfismo sexual con la llegada a la pubertad, en donde están involucradas las concentraciones circulantes de leptina.
Estudios similares encontraron, en niños de ambos sexos, entre los 5 y los 15 años, que los niveles circulantes de leptina aumentan tanto en los unos como en los otros, antes de que se eleven otras hormonas relacionadas con el comienzo de la pubertad, acorde con el aumento del índice de masa corporal. Dicho incremento es similar en ambos sexos hasta aproximadamente a los 10 años de edad, época cuando los niveles de leptina disminuyen en el varón a medida que se elevan las concentraciones de testosterona (37).
García et al (36), estudiaron la leptina en el suero y la expresión del gen de la leptina en el desarrollo puberal, durante el ciclo estral y diferentes estaciones en ganado bovino, encontrando un marcado incremento, durante el desarrollo puberal en hembras bovinas, tanto de la hormona leptina en la circulación como de la expresión del gen de la leptina en los adipocitos, lo que estaba asociado con incrementos del peso corporal y del factor insulinoide de crecimiento tipo I (IGF-I, del inglés Insulin- like growth factor I) en el suero. También se ha reportado que la edad al inicio de la pubertad está afectada por el consumo de energía en la dieta, la tasa de crecimiento y la adiposidad. Las concentraciones de leptina incrementan linealmente de la semana 16 hasta la semana 1, antes de la ovulación en novillas primíparas, lo que coincide con el inicio de su madurez sexual (84).
Ponzo et al (64), propusieron un estudio para determinar el efecto de la leptina en la liberación de GnRH, LH y de aminoácidos inhibitorios y excitatorios en machos de rata prepúberes y peripúberes. Estos autores encontraron que en las dos edades la leptina incrementa el nivel plasmático de LH y también aumenta la liberación de GnRH. Además, los machos en ambas edades tratados con leptina mejoraron la liberación de glutamato, en tanto que en los individuos peripúberes sólo aumentaron la liberación de aspartato. Los autores concluyeron que la leptina estimula el eje GnRH/LH durante el desarrollo sexual de machos de rata, aumentando la secreción de ambas hormonas. El sistema neurotransmisor aminoácido excitatorio hipotalámico, parece estar envuelto en este cambio.
Qian et al (65), encontraron que durante el desarrollo puberal en la cerda, las concentraciones de leptina en suero se aumentan, concomitantemente con el aumento de los niveles de LH y de estrógenos. Los autores formularon como hipótesis que el estradiol modula la respuesta hipotálamo-hipofisiaria de la leptina y la expresión del gen de la leptina durante el desarrollo puberal.
La administración intracerebroventricular de leptina, estimula la secreción de LH en cerdas prepúberes, pero suprime el consumo de alimento (9). Sin embargo, la administración de leptina que ocurre durante el periodo de más alta retroalimentación negativa por parte del estradiol para la liberación de LH, bloquea la acción de la leptina en la generación de la liberación GnRH/LH. Así, el efecto de la leptina en la secreción de LH está asociado con el estado de madurez sexual en la cerda, lo que sugiere que la leptina podría servir como señal metabólica permisiva, que podría ser necesaria para la activación del eje reproductivo pero no desencadena el inicio de la pubertad (11).
Función de la leptina en el sistema nervioso central (SNC)
Sitios de acción y función hipotalámicas de la leptina
El hipotálamo presenta unos sitios de acción de la leptina, cuyos Ob-R, están localizados en áreas hipotalámicas asociadas con el control del apetito, la reproducción y el crecimiento (56, 78). De ahí que, la distribución de los receptores OB-rb se ha detectado en los núcleos ventromedial y arcuato del hipotálamo, los cuales han sido propuestos como un importante sitio de acción de la leptina, acción que es suficiente para mediar la homeostasis de la glucosa y la actividad locomotora (28, 31). En la porción anterior de la hipófisis en el cerdo (57), la oveja (33), la rata (86) y el ratón (78), también han sido hallados estos receptores OB-rb. De esta manera, la leptina puede actuar en forma directa en el sistema nervioso central, regulando la expresión y secreción de muchos neurotransmisores, neuropéptidos y hormonas hipotalámicas, incluyendo el neuropéptido Y (NPY), las orexinas, el factor regulador de la transcripción de anfetaminas (CART), la cocaína, la galanina (Gal), la hormona concentradora de melanina (MCH) (5, 46), la GnRH (70), la hormona liberadora de corticotropinas (CRH), la hormona liberadora de la hormona del crecimiento (GHRH), la somastostatina (SS) y la TRH (12, 43). La leptina regula también la neurotensina (NT), la propiomelanocortina (POMC) y el ácido gama aminobutírico (GABA) (31, 47, 76).
La leptina y su relación con la secreción de hormonas hipofisiarias
En la hipófisis la leptina modula la LH (23, 70), la hormona del crecimiento (GH), la prolactina (PRL), la FSH y la hormona estimulante de la tiroides (TSH) (13, 43, 84). En mamíferos, los cambios agudos en el balance energético afectarían el eje HHG. Es así como en varias especies, el ayuno y la restricción calórica han sido encontradas como causa de la supresión de la secreción pulsátil de la LH, lo que ocurre por la inhibición de la secreción de la GnRH regulada por la leptina. Dichos mecanismos probablemente previenen el gasto energético para la reproducción. En contraste, la excesiva energía almacenada y la obesidad interfieren con la correcta regulación del eje reproductivo (20).
La actividad del gen leptina y la concentración en la circulación sanguínea de la leptina en ganado bovino, cambian asociadas con la respuesta a estímulos ambientales, nutricionales y de maduración sexual. Sin embargo, estudios descriptivos indicaron que tanto la actividad del gen (transcripción y traducción) como las concentraciones de leptina en el suero, aumentaron antes de la pubertad en novillas. Otros estudios informan acerca de la habilidad de la leptina exógena para estimular la secreción de LH en ganado con ayuno pero no en ganado con un consumo óptimo de alimento, y demuestran que estos efectos están mediados principalmente en la adenohipófisis (84).
Resistencia a la leptina
Según Ladyman y Grattan (55), la preñez en las ratas causa un estado de resistencia a la leptina asociado con una interrupción en la transducción de la señal de la leptina en el hipotálamo. Estos autores determinaron que el estado de resistencia a la leptina es mediado por un cambio en los niveles de los receptores de leptina en el hipotálamo, encontrando una significante reducción en los niveles del RNAm Ob-Rb. Esta reducción fue observada en el núcleo ventromedial del hipotálamo durante el estado de preñez y fue comparada con grupos controles de animales no preñados. Estos datos implican que el núcleo ventromedial es el sitio clave en el desarrollo de la inducción de la resistencia a la leptina en ratas preñadas.
La expresión de los receptores de leptina y su función en la esteroidogénesis ovárica
Varias investigaciones indican que la leptina tiene una acción directa en el ovario. Las células de la granulosa y las células de la teca expresan fuertemente receptores de leptina. Los RNAm de receptores de leptina han sido identificados en el ovario de humanos adultos (27), en el ovario de la rata (86), en las células de la granulosa y de la teca de humanos (1, 51), en oocitos de ratón (60), y en porcinos en el cuerpo lúteo, células de la teca y en células de la granulosa (67). Colectivamente, estos estudios indican que el ovario es un órgano blanco para la leptina.
En el ovario bovino, la leptina antagoniza directamente el efecto estimulatorio de la insulina en la esteroidogénesis de células de la granulosa, y en la ausencia de insulina, la leptina tiene poco o ningún efecto en la esteroidogénesis de células de la granulosa (72, 73). Brannian et al (17), encontraron que el efecto inhibitorio de la leptina sobre la gonadotropina coriónica humana (hCG) para la estimulación de la producción de progesterona (P4) por células de la granulosa luteinizadas de humano, se manifestó sólo en presencia de la insulina.
La leptina además antagoniza en forme directa el efecto estimulatorio de la insulina en la esteroidogénesis de células de la teca en vacas. La concentración inhibitoria 50 (IC50) de la leptina en la células de la teca para la producción de androstenediona es más o menos 10 ng/ml (74). La leptina también inhibe el IGF-I y además la LH, hormona inductora de la producción de androstenediona por células de la teca humanas (1), pero no en células de la teca bovinas (72). Otros estudios, mostraron un efecto bifásico de la leptina en el ovario, en los cuales las concentraciones fisiológicas (10 ng/ml), estimularon la síntesis de P4 en las células de la granulosa en cerdas, mientras que una dosis alta (1000 ng/ml) generó un efecto inhibitorio de la esteroidogénesis, sin haber afectado la viabilidad de las células (66). En el folículo ovárico, la leptina en concentraciones fisiológicas, estimuló la actividad aromatasa ejercida por la enzima citocromo P450, pero las altas concentraciones de leptina en el folículo ovárico y en líquido folicular, pueden llegar a bloquear la esteroidogénesis y relacionarse con bajas concentraciones de oxígeno intrafolicular, impidiendo al oocito desarrollar su competencia o clivaje temprano en el embrión (66).
Gurbuz et al (39), estudiaron la relación de la leptina en el suero y el fluido folicular y los niveles de esteroides ováricos en respuesta a la inducción de la ovulación en ciclos de fertilización in vitro, encontrando un incremento en los niveles de leptina en el suero durante la hiperestimulación ovárica controlada, indicando otro papel de la leptina en la función reproductiva. El aumento en los niveles de leptina se correlaciona negativamente con la respuesta ovárica, evaluada mediante la producción de estrógenos y el número de oocitos recuperados. Esto puede ser debido a la reducción de la respuesta ovárica a través de una retroalimentación negativa de la leptina a niveles altos en los ovarios.
Expresión y función de la leptina en el testículo
Los ratones con la mutación ob/ob (con deficiencia total de leptina), sufren de hiperfagia, obesidad mórbida e infertilidad. En estos machos una vez que se les administra leptina exógena no sólo se obtiene una disminución del apetito y del peso corporal sino también un aumento del peso del testículo, de las vesículas seminales, y del número de espermatozoides en el eyaculado (8, 24).
En niños con pubertad precoz verdadera, la reducción de los niveles de testosterona como resultado del tratamiento con análogos de la GnRH, eleva las concentraciones de leptina (62). Por otro lado en hombres hipogonádicos se ha logrado una reducción de los niveles séricos de la leptina, tras la administración del tratamiento sustitutivo con testosterona (48). Esto permite sugerir que la interacción testosterona-leptina podrá ser parte del eje HHG-tejido adiposo, que involucra el mantenimiento del peso corporal y la función reproductiva.
Expresión de receptores de leptina en testículo
Los receptores de leptina y su RNAm en el testículo han sido encontrados en células de Leydig de ratón (34) y de rata (21, 22, 80) y en equinos (19), en el plasma seminal, los espermatozoides (38, 49) y en los túbulos seminíferos de humanos (38).
Tena-Sempere et al (83), estudiaron el desarrollo y la regulación hormonal del RNAm del Ob-R en el testículo de rata y encontraron que la expresión del RNAm de la isoforma específica Ob-Rb fue significativamente alta durante el periodo de desarrollo testicular puberal, pero disminuyó en los adultos. Además, hallaron una expresión abundante de RNAm de la isoforma Ob-Rb, una expresión moderada de los subtipos Ob-Ra, Ob-Rf, una expresión baja de la isoforma Ob-Rc; y no hallaron expresión de la isoforma Ob-Re.
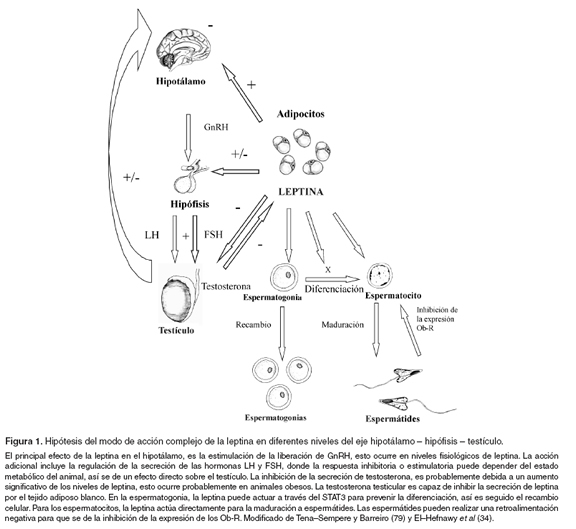
El-Hefnawy et al (34), hallaron la expresión del receptor de leptina durante el desarrollo de células germinales en el testículo de ratón y concluyeron que hay una distribución del Ob-R en el testículo de ratón y una relación de su expresión con el desarrollo y la diferenciación de las células germinales. La leptina puede actuar en células no diferenciadas (espermatogonia A) permitiendo su diferenciación en espermatocitos y puede asistir a la célula a través de toda su diferenciación y maduración hacia espermátides; además, induce la fosforilación de STAT3 en los túbulos seminíferos y la fosforilación de STAT3 y la proteína activadora - mitogénica (MAP) en las células intersticiales, lo que sugiere que tienen efectos biológicos en estas células (véase Figura 1).
Otros autores estudiaron el receptor soluble de leptina en el plasma seminal y en espermatozoides de humano, demostraron la presencia del Ob-R en espermatozoides humanos por inmunofluorescencia microscópica y la leptina y el receptor soluble en el plasma seminal por Western blot. Las muestras de semen con baja calidad de espermatozoides, además, contenían baja cantidad de receptores y baja capacidad de unión de la leptina. Estos resultados pueden ayudar a explicar la relación entre la leptina y los receptores de leptina en el plasma seminal y en los espermatozoides humanos (49).
Glander et al (38), encontraron leptina en el plasma seminal en humanos con o sin vasectomía y concluyeron que la circulación de leptina en el plasma seminal es demasiado compleja y está negativamente relacionada con el porcentaje de movilidad espermática y la velocidad en línea recta. Al parecer, la cantidad de leptina en el tracto genital, incluyendo en los túbulos seminíferos, podría influenciar los mecanismos involucrados en el desarrollo de la movilidad espermática. La secreción de leptina por el espermatozoide sugiere que el gameto macho puede ser capaz de modular su metabolismo de manera independiente, por el sistema leptina. Estos datos abren una nueva consideración acerca de la significancia de la leptina en la fertilidad del macho (7).
En un estudio de la expresión de Ob-R en células de Leydig de rata, se concluyó que la interacción leptina-Ob-R en diferentes sitios anatómicos es compleja y se indicó que este sistema puede regular la función de las células de Leydig. Este sistema Ob→Ob-R en el testículo puede servir para regular negativamente la producción de testosterona por las células de Leydig durante la vida adulta, pero no se presentó en la vida prepuberal y podría tener una función durante la embriogénesis testicular y en la maduración de las células de Leydig en la vida prenatal (21).
Efectos inhibitorios de la leptina en testículo
La leptina podría inhibir la esteroidogénesis en el testículo como similarmente lo realiza en la glándula adrenal, probablemente por medio de la disminución de la expresión de los genes P450scc y StAR tanto en el testículo como en la glándula adrenal (80). Los datos obtenidos por Tena-Sempere et al (81), proporcionaron evidencia de la función inhibitoria directa de la leptina en el control de la secreción de testosterona testicular estimulada por la hCG y basal, en ratas adultas. Esta acción inhibitoria se presenta de manera independiente del estado nutricional y no fue observada en el testículo de ratas prepúberes. La acción de la leptina en el sistema reproductivo es probablemente llevada a diferentes niveles del eje hipotálamo - hipofisiario - testicular. Tena-Sempere et al (82), utilizaron un péptido sintético de leptina 116-130 en ratas adultas, para demostrar la habilidad de la leptina para inhibir la secreción de testosterona in vitro, lo cual implica una acción positiva de esta molécula sintética en la función en el testículo.
Luukkaa et al (58), estudiaron el efecto de la administración de testosterona exógena en la producción de leptina en hombres y encontraron que las concentraciones de leptina en el suero vuelven a ser las mismas que en el periodo pretratamiento después de interrumpir el tratamiento con testosterona. Estos autores concluyeron que la testosterona suprime la producción de la hormona leptina y es reflejado por los niveles de esta hormona en la circulación. Por su parte, Tena-Sempere y Barreiro (79), concluyen que hay una evidencia compilada que la leptina participa en la regulación funcional del eje gonadal del macho. Esto parece ser por una acción regulada fuertemente, llevada a cabo en diferentes niveles del sistema hipotálamo - hipofisiario - testicular (véase Figura 1).
Bhat et al (15), estudiaron el efecto de la deficiencia de leptina en la morfología, el desarrollo de células germinales y la actividad apoptótica con células germinales de testículo de ratón, y sugirieron que la deficiencia de leptina en ratones está asociada con un daño en la espermatogénesis, un incremento de células germinales apoptóticas y una sobre regulación de la expresión de genes proapoptóticos en el testículo.
Conclusiones y perspectivas futuras
Según Tena-Sempere y Barreiro (71), la caracterización de los efectos y mecanismos de la acción de la leptina en el testículo de roedores puede ayudar a identificar el papel complejos de esta molécula en el control de la función reproductiva. Los estudios llevados a cabo por El-Hefnawy et al (32) en ratones, abrieron el campo de investigación con estudios descriptivos enfocados a elucidar la fisiología de la leptina en la espermatogénesis. Sin embargo, estos estudios deben ser realizados en diferentes especies animales de granja, para así poder extrapolar los resultados obtenidos en roedores y humanos en algunos animales como bovinos, porcinos, ovinos, caninos y equinos.
Una posible función de la leptina en los espermatozoides de animales de granja, como lo proponen Glander et al (35) y Bhat et al (15), pueden ser investigados para determinar el papel de la leptina en la movilidad e integridad morfológica del espermatozoide para una probable función en la acción fertilizadora del semen de estos animales en programas de inseminación artificial. Además, los resultados obtenidos sobre el papel de la leptina en el inicio de la pubertad deben ser estudiados en especies animales de importancia económica. El estudio y análisis de la expresión del gen de la leptina y de sus receptores en el testículo de animales en el inicio de la pubertad, sería de gran ayuda para la explicación de la función de esta hormona y su posible asociación con el peso y la condición corporal, el perímetro testicular, la circunferencia escrotal, y los niveles de testosterona, como puntos clave para garantizar lo que va a ser el desempeño productivo y reproductivo del animal.
Referencias
1. Agarwal SK, Vogel K, Weitsman SR, Magoffin DA. Leptin antagonizes the insulin-like growth factor-I augmentation of steroidogenesis in granulosa and theca cells of the human ovary. J Clin Endocrinol Metab 1999; 84:1072-1076. [ Links ]
2. Aguilar E, Pinilla L, Guisado R, González D, López F. Relation between body weight, growth rate, chronological age and puberty in male and female rats. Rev Esp Fisiol 1984; 40: 83-86. [ Links ]
3. Ahima RS Flier JS. Adipose tissue as an endocrine organ. Trends Endocrinol Metab 2000; 11:327-332. [ Links ]
4. Ahima RS Hileman SM. Postnatal regulation of hypothalamic neuropeptide expression by leptin: implications for energy balance and body weight regulation. Regul Pept 2000; 92:1-7. [ Links ]
5. Ahima RS, Saper CB, Flier JS, Elmquist JK. Leptin regulation of neuroendocrine systems. Front Neuroendocrinol 2000; 21:263-307. [ Links ]
6. Amann RP. Endocrine changes associated with onset of spermatogenesis in holstein bulls. J Dairy Sci 1983; 66:2606-2622. [ Links ]
7. Aquila S, Gentile M, Middea E, Catalano S, Morelli C, et al. Leptin secretion by human ejaculated spermatozoa. J Clin Endocrinol Metab 2005; 90:4753-4761. [ Links ]
8. Barash IA, Cheung CC, Weigle DS, Ren H, Kabigting EB, et al. Leptin is a metabolic signal to the reproductive system. Endocrinology 1996; 137:3144-3147. [ Links ]
9. Barb CR, Barrett JB, Kraeling RR. Role of leptin in modulating the hypothalamic-pituitary axis and luteinizing hormone secretion in the prepuberal gilt. Domest Anim Endocrinol 2004; 26:201-214. [ Links ]
10. Barb CR, Barrett JB, Kraeling RR, Rampacek GB. Serum leptin concentrations, luteinizing hormone and growth hormone secretion during feed and metabolic fuel restriction in the prepuberal gilt. Domest Anim Endocrinol 2001; 20:47-63. [ Links ]
11. Barb CR, Hausman GJ, Czaja K. Leptin: a metabolic signal affecting central regulation of reproduction in the pig. Domest Anim Endocrinol 2005; 29:186-192. [ Links ]
12. Barb CR, Hausman GJ, Houseknecht KL. Biology of leptin in the pig. Domest Anim Endocrinol 2001; 21:297-317. [ Links ]
13. Barb CR Kraeling RR. Role of leptin in the regulation of gonadotropin secretion in farm animals. Anim Reprod Sci 2004; 82-83:155-167. [ Links ]
14. Bartha T, Sayed-Ahmed A, Rudas P. Expression of leptin and its receptors in various tissues of ruminants. Domest Anim Endocrinol 2005; 29:193-202. [ Links ]
15. Bhat GK, Sea TL, Olatinwo MO, Simorangkir D, Ford GD, et al. Influence of a leptin deficiency on testicular morphology, germ cell apoptosis, and expression levels of apoptosis-related genes in the mouse. J Androl 2006; 27:302-310. [ Links ]
16. Bjorbaek C Kahn BB. Leptin signaling in the central nervous system and the periphery. Recent Prog Horm Res 2004; 59:305-331. [ Links ]
17. Brannian JD, Zhao Y, McElroy M. Leptin inhibits gonadotrophin-stimulated granulosa cell progesterone production by antagonizing insulin action. Hum Reprod 1999; 14:1445-1448. [ Links ]
18. Bronson FH. Puberty in female mice is not associated with increases in either body fat or leptin. Endocrinology 2001; 142:4758-4761. [ Links ]
19. Buff PR, Dodds AC, Morrison CD, Whitley NC, McFadin EL, et al. Leptin in horses: tissue localization and relationship between peripheral concentrations of leptin and body condition. J Anim Sci 2002; 80:2942-2948. [ Links ]
20. Caprio M, Fabbrini E, Isidori AM, Aversa A, Fabbri A. Leptin in reproduction. Trends Endocrinol Metab 2001; 12:65-72. [ Links ]
21. Caprio M, Fabbrini E, Ricci G, Basciani S, Gnessi L, et al. Ontogenesis of leptin receptor in rat Leydig cells. Biol Reprod 2003; 68:1199-1207. [ Links ]
22. Caprio M, Isidori AM, Carta AR, Moretti C, Dufau ML, et al. Expression of functional leptin receptors in rodent Leydig cells. Endocrinology 1999; 140:4939-4947. [ Links ]
23. Carbone S, Szwarcfarb B, Reynoso R, Bollero G, Ponzo O, et al. Leptin stimulates LH secretion in peripubertal male rats through NMDA receptors. Endocrinol Res 2005; 31:387-396. [ Links ]
24. Chehab FF, Lim ME, Lu R. Correction of the sterility defect in homozygous obese female mice by treatment with the human recombinant leptin. Nat Genet 1996; 12:318-320. [ Links ]
25. Cheung CC, Thornton JE, Kuijper JL, Weigle DS, Clifton DK, et al. Leptin is a metabolic gate for the onset of puberty in the female rat. Endocrinology 1997; 138:855-858. [ Links ]
26. Cheung CC, Thornton JE, Nurani SD, Clifton DK, Steiner RA. A reassessment of leptin's role in triggering the onset of puberty in the rat and mouse. Neuroendocrinology 2001; 74:12-21. [ Links ]
27. Cioffi JA, Shafer AW, Zupancic TJ, Smith-Gbur J, Mikhail A, et al. Novel B219/OB receptor isoforms: possible role of leptin in hematopoiesis and reproduction. Nat Med 1996; 2:585-589. [ Links ]
28. Coppari R, Ichinose M, Lee CE, Pullen AE, Kenny CD, et al. The hypothalamic arcuate nucleus: a key site for mediating leptin's effects on glucose homeostasis and locomotor activity. Cell Metab 2005; 1:63-72. [ Links ]
29. Coulter GH Foote RH. Relationship of testicular weight to age and scrotal circumference of holstein bulls. J Dairy Sci 1976; 59:730-732. [ Links ]
30. Coulter GH Foote RH. Bovine testicular measurements as indicators of reproductive performance and their relationship to productive traits in cattle: A review. Theriogenology 1979; 11:297-311. [ Links ]
31. Cunningham MJ, Clifton DK, Steiner RA. Leptin's actions on the reproductive axis: perspectives and mechanisms. Biol Reprod 1999; 60:216-222. [ Links ]
32. Curtis SK Amann RP. Testicular development and establishment of spermatogenesis in holstein bulls. J Anim Sci 1981; 53:1645-1657. [ Links ]
33. Dyer CJ, Simmons JM, Matteri RL, Keisler DH. Leptin receptor mRNA is expressed in ewe anterior pituitary and adipose tissues and is differentially expressed in hypothalamic regions of well-fed and feed-restricted ewes. Domest Anim Endocrinol 1997; 14:119-128. [ Links ]
34. El-Hefnawy T, Ioffe S, Dym M. Expression of the leptin receptor during germ cell development in the mouse testis. Endocrinology 2000; 141:2624-2630. [ Links ]
35. Fields MJ, Hentges JF, Jr., Cornelisse KW. Aspects of the sexual development of Brahman versus Angus bulls in Florida. Theriogenology 1982; 18:17-31. [ Links ]
36. Garcia MR, Amstalden M, Williams SW, Stanko RL, Morrison CD, et al. Serum leptin and its adipose gene expression during pubertal development, the estrous cycle, and different seasons in cattle. J Anim Sci 2002; 80:2158-2167. [ Links ]
37. Garcia-Mayor RV, Andrade MA, Rios M, Lage M, Dieguez C, et al. Serum leptin levels in normal children: relationship to age, gender, body mass index, pituitary-gonadal hormones, and pubertal stage. J Clin Endocrinol Metab 1997; 82:2849-2855. [ Links ]
38. Glander HJ, Lammert A, Paasch U, Glasow A, Kratzsch J. Leptin exists in tubuli seminiferi and in seminal plasma. Andrologia 2002; 34:227-233. [ Links ]
39. Gurbuz B, Yalti S, Ficicioglu C, Tasdemir S. The relation of serum and follicular fluid leptin and ovarian steroid levels in response to induction of ovulation in in vitro fertilization cycles. Eur J Obstet Gynecol Reprod Biol 2005; 118:214-218. [ Links ]
40. Hafez ESE Hafez B. Reproducción e inseminación artificial en animales. 7 ed. México: McGraw- Hill; 2000. [ Links ]
41. Halaas JL, Gajiwala KS, Maffei M, Cohen SL, Chait BT, et al. Weight-reducing effects of the plasma protein encoded by the obese gene. Science 1995; 269:543-546. [ Links ]
42. Horlick MB, Rosenbaum M, Nicolson M, Levine LS, Fedun B, et al. Effect of puberty on the relationship between circulating leptin and body composition. J Clin Endocrinol Metab 2000; 85:2509-2518. [ Links ]
43. Houseknecht KL, Baile CA, Matteri RL, Spurlock ME. The biology of leptin: a review. J Anim Sci 1998; 76:1405-1420. [ Links ]
44. Houseknecht KL Portocarrero CP. Leptin and its receptors: regulators of whole-body energy homeostasis. Domest Anim Endocrinol 1998; 15:457-475. [ Links ]
45. Hueston WD, Monke DR, Milburn RJ. Scrotal circumference measurements on young Holstein bulls. J Am Vet Med Assoc 1988; 192:766-768. [ Links ]
46. Ingvartsen KL Boisclair YR. Leptin and the regulation of food intake, energy homeostasis and immunity with special focus on periparturient ruminants. Domest Anim Endocrinol 2001; 21:215-250. [ Links ]
47. Iqbal J, Pompolo S, Murakami T, Grouzmann E, Sakurai T, et al. Immunohistochemical characterization of localization of long-form leptin receptor (OB-Rb) in neurochemically defined cells in the ovine hypothalamus. Brain Res 2001; 920:55-64. [ Links ]
48. Jockenhovel F, Blum WF, Vogel E, Englaro P, Muller-Wieland D, et al. Testosterone substitution normalizes elevated serum leptin levels in hypogonadal men. J Clin Endocrinol Metab 1997; 82:2510-2513. [ Links ]
49. Jope T, Lammert A, Kratzsch J, Paasch U, Glander HJ. Leptin and leptin receptor in human seminal plasma and in human spermatozoa. Int J Androl 2003; 26:335-341. [ Links ]
50. Kalra SP. Mandatory neuropeptide-steroid signaling for the preovulatory luteinizing hormone-releasing hormone discharge. Endocr Rev 1993; 14:507-538. [ Links ]
51. Karlsson C, Lindell K, Svensson E, Bergh C, Lind P, et al. Expression of functional leptin receptors in the human ovary. J Clin Endocrinol Metab 1997; 82:4144-4148. [ Links ]
52. Kaynard AH, Pau KY, Hess DL, Spies HG. Third-ventricular infusion of neuropeptide Y suppresses luteinizing hormone secretion in ovariectomized rhesus macaques. Endocrinology 1990; 127:2437-2444. [ Links ]
53. Knights SA, Baker RL, Gianola D, Gibb JB. Estimates of heritabilities and of genetic and phenotypic correlations among growth and reproductive traits in yearling Angus bulls. J Anim Sci 1984; 58:887-893. [ Links ]
54. Knobil E Neill J. The physiology of reproduction. New York: Raven; 1988. [ Links ]
55. Ladyman SR Grattan DR. Suppression of leptin receptor messenger ribonucleic acid and leptin responsiveness in the ventromedial nucleus of the hypothalamus during pregnancy in the rat. Endocrinology 2005; 146:3868-3874. [ Links ]
56. Lin J, Barb CR, Matteri RL, Kraeling RR, Chen X, et al. Long form leptin receptor mRNA expression in the brain, pituitary, and other tissues in the pig. Domest Anim Endocrinol 2000; 19:53-61. [ Links ]
57. Lin J, Richard Barb C, Kraeling RR, Rampacek GB. Developmental changes in the long form leptin receptor and related neuropeptide gene expression in the pig brain. Biol Reprod 2001; 64:1614-1618. [ Links ]
58. Luukkaa V, Pesonen U, Huhtaniemi I, Lehtonen A, Tilvis R, et al. Inverse correlation between serum testosterone and leptin in men. J Clin Endocrinol Metab 1998; 83:3243-3246. [ Links ]
59. Malven PV, Haglof SA, Degroot H. Effects of intracerebral administration of neuropeptide-Y on secretion of luteinizing hormone in ovariectomized sheep. Brain Res Bull 1992; 28:871-875. [ Links ]
60. Matsuoka T, Tahara M, Yokoi T, Masumoto N, Takeda T, et al. Tyrosine phosphorylation of STAT3 by leptin through leptin receptor in mouse metaphase 2 stage oocyte. Biochem Biophys Res Commun 1999; 256:480-484. [ Links ]
61. Morris DL, Tyner CL, Morris PG, Forgason RL, Forgason JL, et al. Correlation of scrotal circumference and age in American Brahman bulls. Theriogenology 1989; 31:489-494. [ Links ]
62. Palmert MR, Radovick S, Boepple PA. The impact of reversible gonadal sex steroid suppression on serum leptin concentrations in children with central precocious puberty. J Clin Endocrinol Metab 1998; 83:1091-1096. [ Links ]
63. Plant TM Durrant AR. Circulating leptin does not appear to provide a signal for triggering the initiation of puberty in the male rhesus monkey (Macaca mulatta). Endocrinology 1997; 138:4505-4508. [ Links ]
64. Ponzo OJ, Reynoso R, Rimoldi G, Rondina D, Szwarcfarb B, et al. Leptin stimulates the reproductive male axis in rats during sexual maturation by acting on hypothalamic excitatory amino acids. Exp Clin Endocrinol Diabetes 2005; 113:135-138. [ Links ]
65. Qian H, Barb CR, Compton MM, Hausman GJ, Azain MJ, et al. Leptin mRNA expression and serum leptin concentrations as influenced by age, weight, and estradiol in pigs. Domest Anim Endocrinol 1999; 16:135-143. [ Links ]
66. Ruiz-Cortes ZT, Martel-Kennes Y, Gevry NY, Downey BR, Palin MF, et al. Biphasic effects of leptin in porcine granulosa cells. Biol Reprod 2003; 68:789-796. [ Links ]
67. Ruiz-Cortes ZT, Men T, Palin MF, Downey BR, Lacroix DA, et al. Porcine leptin receptor: molecular structure and expression in the ovary. Mol Reprod Dev 2000; 56:465-474. [ Links ]
68. Schneider JE, Zhou D, Blum RM. Leptin and metabolic control of reproduction. Horm Behav 2000; 37:306-326. [ Links ]
69. Smith BA, Brinks JS, Richardson GV. Relationships of sire scrotal circumference to offspring reproduction and growth. J Anim Sci 1989; 67:2881-2885. [ Links ]
70. Smith GD, Jackson LM, Foster DL. Leptin regulation of reproductive function and fertility. Theriogenology 2002; 57:73-86. [ Links ]
71. Spicer LJ. Leptin: a possible metabolic signal affecting reproduction. Domest Anim Endocrinol 2001; 21:251-270. [ Links ]
72. Spicer LJ, Chamberlain CS, Francisco CC. Ovarian action of leptin: effects on insulin-like growth factor-I-stimulated function of granulosa and thecal cells. Endocrine 2000; 12:53-59. [ Links ]
73. Spicer LJ Francisco CC. The adipose obese gene product, leptin: evidence of a direct inhibitory role in ovarian function. Endocrinology 1997; 138:3374-3379. [ Links ]
74. Spicer LJ Francisco CC. Adipose obese gene product, leptin, inhibits bovine ovarian thecal cell steroidogenesis. Biol Reprod 1998; 58:207-212. [ Links ]
75. Stewart TS, Long CR, Cartwright TC. Characterization of cattle of a five-breed diallel. III. Puberty in bulls and heifers. J Anim Sci 1980; 50:808-820. [ Links ]
76. Sullivan SD Moenter SM. Gamma-aminobutyric acid neurons integrate and rapidly transmit permissive and inhibitory metabolic cues to gonadotropin-releasing hormone neurons. Endocrinology 2004; 145:1194-1202. [ Links ]
77. Tartaglia LA. The leptin receptor. J Biol Chem 1997; 272:6093-6096. [ Links ]
78. Tartaglia LA, Dembski M, Weng X, Deng N, Culpepper J, et al. Identification and expression cloning of a leptin receptor, OB-R. Cell 1995; 83:1263-1271. [ Links ]
79. Tena-Sempere M Barreiro ML. Leptin in male reproduction: the testis paradigm. Mol Cell Endocrinol 2002; 188:9-13. [ Links ]
80. Tena-Sempere M, Manna PR, Zhang FP, Pinilla L, Gonzalez LC, et al. Molecular mechanisms of leptin action in adult rat testis: potential targets for leptin-induced inhibition of steroidogenesis and pattern of leptin receptor messenger ribonucleic acid expression. J Endocrinol 2001; 170:413-423. [ Links ]
81. Tena-Sempere M, Pinilla L, Gonzalez LC, Dieguez C, Casanueva FF, et al. Leptin inhibits testosterone secretion from adult rat testis in vitro. J Endocrinol 1999; 161:211-218. [ Links ]
82. Tena-Sempere M, Pinilla L, Gonzalez LC, Navarro J, Dieguez C, et al. In vitro pituitary and testicular effects of the leptin-related synthetic peptide leptin(116-130) amide involve actions both similar to and distinct from those of the native leptin molecule in the adult rat. Eur J Endocrinol 2000; 142:406-410. [ Links ]
83. Tena-Sempere M, Pinilla L, Zhang FP, Gonzalez LC, Huhtaniemi I, et al. Developmental and hormonal regulation of leptin receptor (Ob-R) messenger ribonucleic acid expression in rat testis. Biol Reprod 2001; 64:634-643. [ Links ]
84. Williams GL, Amstalden M, Garcia MR, Stanko RL, Nizielski SE, et al. Leptin and its role in the central regulation of reproduction in cattle. Domest Anim Endocrinol 2002; 23: 339-349. [ Links ]
85. Wolf FR, Almquist JO, Hale EB. Prepuberal Behavior and Puberal Characteristics of Beef Bulls on High Nutrient Allowance. J Anim Sci 1965; 24:761-765. [ Links ]
86. Zamorano PL, Mahesh VB, De Sevilla LM, Chorich LP, Bhat GK, et al. Expression and localization of the leptin receptor in endocrine and neuroendocrine tissues of the rat. Neuroendocrinology 1997; 65:223-228. [ Links ]
87. Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, et al. Positional cloning of the mouse obese gene and its human homologue. Nature 1994; 372:425-432. [ Links ]
¶ Para citar este artículo: Quintero JC, Ruíz Cortez T. Efectos de la leptina en el inicio de la pubertad de animales machos. Rev Colomb Cienc Pecu 2008; 21:97-108.
* Autor para el envío de la correspondencia y la solicitud de separatas: Escuela de Medicina Veterinaria, Facultad de Ciencias Agrarias, Universidad de Antioquia, AA 1226. Medellín, Colombia. E-mail: jkquintero@gmail.com