Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Pecuarias
Print version ISSN 0120-0690On-line version ISSN 2256-2958
Rev Colom Cienc Pecua vol.21 no.1 Medellín Jan./Mar. 2008
Residuos de fármacos en alimentos de origen animal: panorama actual en Colombia¶
Drugs residues in foods of animal origin: actual prospect in Colombia
Resíduos de fármacos nos alimentos de origem animal: panorama atual na Colômbia
María C Lozano A1, MV, MS; Diana C. Arias M1, QF.
1Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá, Colombia.
(Recibido: 29 marzo, 2007; aceptado: 28 febrero 2008)
Resumen
De acuerdo con los organismos mundiales de referencia, los residuos de fármacos en alimentos de origen animal son considerados como un factor de riesgo en la salud pública y como limitante en el desarrollo económico de cualquier país. Estas razones junto con el avance de metodologías analíticas cada vez más sensibles, han hecho que los requisitos de sanidad e inocuidad exigidos en los alimentos sean cada vez más estrictos, especialmente cuando el destino de los productos es la exportación. Colombia, en su continua intención por aumentar las ventas de sus productos en el exterior, se ha visto en la necesidad de reformar normas existentes, generar nuevas reglamentaciones, y renovar su capacidad tecnológica, con el fin de controlar los residuos de fármacos en alimentos de origen pecuario y de esta forma cumplir con las exigencias demandadas por los países con los que desea negociar. La presente revisión, expone aspectos importantes relacionados con esta clase de residuos: su regulación nacional e internacional, los principales efectos potenciales que tienen sobre la salud humana, la evaluación del riesgo, los métodos más comunes con los cuales pueden ser detectados y el estado actual de la investigación y el control de estos residuos en Colombia.
Palabras clave: inocuidad de alimentos, medicamentos veterinarios, residuos de fármacos
Summary
According to worldwide reference organizations, drugs residues in animal products are risk factors in public health and economic limit on any country. Besides, quality requirements demanded in exported food are higher with development of more sensible analytical methods. Promotion of native products to international markets is fundamental in Colombian policies; in deed it has been necessary reforming procedures, generating new regulations, and renewing technological capacity to control drug residues in food of animal origin in order to fulfill requirements demanded from interested countries. This review exposes several aspects related to drug residues on animal tissues: national and international regulations, effects on human health, analytical methods for detect them, risk assessment, control and current research in Colombia.
Key Words: drug residues, food quality, veterinary drugs.
Resumo
De acordo com os órgãos mundiais de referência, os resíduos de fármacos nos alimentos de origem animal são considerados como um fator de risco na saúde publica como limitante no desenvolvimento econômico de quaisquer pais. Estas razões junto com avanço das metodologias analíticas, tem feito que as exigências a sanidade e na inocuidade dos alimentos sejam mais severas, especialmente quando o destino dos produtos é a exportação. Colômbia, na sua procura por aumentar suas vendas no exterior, tem visto a necessidade de mudar as normas existentes, gerar novas regras e renovar sua tecnologia, com o propósito de controlar os resíduos de fármacos nos alimentos de origem animal e assim preencher com as exigências dos países consumidores dos seus produtos. Esta revisão apresenta aspectos relacionados com este tipo de resíduos: sua normatividade nacional e internacional, os efeitos potenciais que eles têm sobre a saúde humana, a avaliação do risco, os métodos mais freqüentes com que podem ser determinados e o estado atual das pesquisas no controle destes resíduos na Colômbia.
Palavras chave: droga veterinária, qualidade do alimento, resíduos de fármacos.
Introducción
El uso de medicamentos veterinarios es esencial durante la crianza de animales productores de alimentos. Estos productos son empleados con fines terapéuticos y preventivos en caso de infecciones o enfermedades no contagiosas y en otros casos se aplican como promotores del crecimiento (39). En los últimos años el sector agroalimentario en todo el mundo se ha enfrentado a la diseminación de brotes de enfermedades transmitidas por alimentos en los que intervienen, entre otros agentes, residuos de medicamentos veterinarios; lo cual pone de manifiesto el manejo indebido de los fármacos durante las prácticas agropecuarias y el incumplimiento de los tiempos de retiro de los medicamentos (39).
Los residuos de medicamentos veterinarios en los alimentos de origen animal generan productos de baja calidad y constituyen un riesgo para la salud de los consumidores, produciendo toxicidad aguda o crónica, efectos mutagénicos y carcinogénicos, desórdenes en el desarrollo corporal, reacciones alérgicas y fenómenos de resistencia bacteriana, entre otros (15). Estos efectos adversos han hecho que organizaciones internacionales regulen con fundamento científico los residuos de fármacos de uso veterinario potencialmente peligrosos para la salud (67).
A pesar de la antigüedad de las regulaciones internacionales existentes (32), sólo hasta hace poco en Colombia, dada la actual situación económica y comercial, se está prestando atención a esta problemática sanitaria y se han comenzado a adoptar nuevas medidas para reconocer la residualidad de fármacos y de otras sustancias en los alimentos de origen animal producidos en el país, con lo cual se pretende lograr mayor competitividad de los productos pecuarios en los mercados internacionales (13).
La presente revisión, da a conocer aspectos importantes relacionados con los residuos de fármacos en alimentos de origen animal, su regulación nacional e internacional, los efectos que desencadenan en la salud humana, la evaluación del riesgo para estas sustancias, los principales métodos a través de los cuales pueden ser detectados y el estado actual de la investigación y control de estos residuos en Colombia.
Regulación internacional de fármacos de uso veterinario
La regulación de medicamentos de uso veterinario se orienta a controlar el uso y residualidad de estas sustancias en las especies en las cuales son administradas; estos aspectos son mundialmente vigilados por diferentes organizaciones, dentro de las cuales se destacan: 1) la comisión del Codex Alimentarius, que se encarga de proteger la salud de los consumidores, facilitar prácticas justas en el comercio de alimentos y promover la coordinación de normas alimentarias acordadas por diversas organizaciones (14); 2) el Programa Internacional de Seguridad de las Sustancia Químicas (IPCS, por sus siglas en inglés) establecido por la Organización Mundial de la Salud (OMS), la Organización Internacional del Trabajo (OIT) y el Programa de las Naciones Unidas para el Medio Ambiente (PNUMA), que establece bases científicas para el uso seguro de los químicos (32); 3) el Comité mixto FAO/OMS de Expertos en Aditivos Alimentarios (JECFA) que proporciona asesoramiento científico mediante la publicación de monografías y reportes técnicos acerca de la inocuidad de los aditivos alimentarios, la evaluación de los contaminantes, las sustancias tóxicas naturales y los residuos de medicamentos veterinarios (40); 4) la administración de alimentos y drogas de los Estados Unidos (Food and Drug Administration - FDA) que además de regular la fabricación y distribución de los medicamentos de uso veterinario a través del CVM (Centro de Medicina Veterinaria), protege la salud de los consumidores garantizando la seguridad de los aditivos alimentarios, productos cosméticos y medicamentos de uso humano y veterinario (6); 5) la Agencia Europea de Medicamentos (EMEA) cuya misión principal es proteger y promover la salud pública y animal mediante diversas actividades, entre ellas el establecimiento de límites de seguridad para los residuos de medicamentos veterinarios en animales productores de alimentos (17); 6) la Autoridad Australiana en Pesticidas y Medicina Veterinaria (Australian Pesticides and Veterinary Medicines Authority - APVMA) responsable de la evaluación, registro y regulación de plaguicidas y medicamentos veterinarios (3); y 7) la Autoridad Europea para la Seguridad Alimentaria (EFSA, por sus siglas en inglés) que participa activamente en la evaluación del riesgo asociada a alimentos (16).
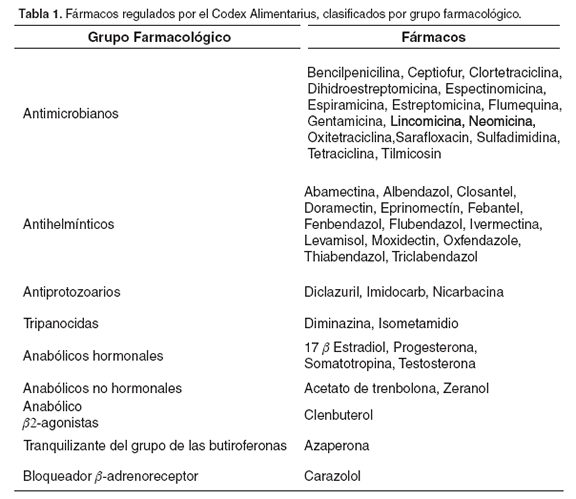
Tanto el Codex Alimentarius como la EMEA han elaborado su propia lista de fármacos regulados, esta incluye los límites de residuos máximos (LMRs) para cada principio activo detallando en qué especie animal (avícola, bovina, caprina, cunícola, ovina, piscícola o porcina) y tejido o subproducto de esta (leche, huevos, grasa, músculo, hígado o riñón) se establece dicho límite. En la Tabla 1 se presenta una lista de los fármacos regulados por el Codex Alimetarius clasificados por grupos farmacológicos (2, 8).
La Organización Mundial del Comercio (OMC) considera como instancia orientadora en materia de inocuidad de alimentos al Codex Alimentarius. Colombia acoge jurídicamente estos lineamientos y por lo tanto los LMRs empleados en el país se rigen bajo el listado de esta comisión (53).
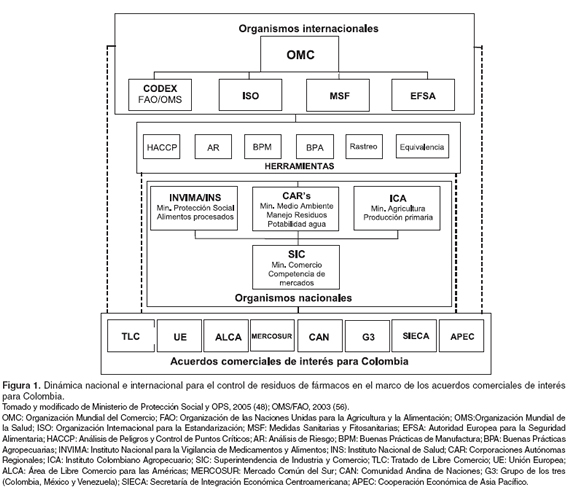
Son varios los organismos y las normativas internacionales que sugieren reglamentaciones y promueven la producción de alimentos inocuos a nivel global. El seguimiento de estas disposiciones por parte de diferentes países fortalece la capacidad de comercialización mundial de los alimentos. En la Figura 1 se ilustran los diferentes elementos, aplicados al contexto nacional, que hacen parte de esta dinámica.
Efectos potenciales de los residuos de fármacos en salud humana
En el estudio de los residuos de fármacos en alimentos de origen animal, los compuestos sobre los cuales se han reportado más reacciones adversas son los antiinfecciosos y los anabolizantes.
Fármacos antiinfecciosos
Dentro de los efectos adversos de estos residuos en humanos están, entre otros, las reacciones alérgicas y la generación de cepas bacterianas resistentes y su transmisión (7).
Reacciones alérgicas. Varios antibióticos han sido reportados cuyos residuos en alimentos pueden desencadenar reacciones alérgicas, causar hipersensibilidad, o ambas situaciones, entre ellos la penicilina, las sulfonamidas y la estreptomicina. Respecto de la penicilina se han dado casos en los que personas sensibles experimentan reacciones alérgicas por el consumo de residuos presentes en carne o leche, estimándose que 10 UI (0.6 μg) pueden causar reacciones como prurito general, dificultad para tragar y hablar, disnea, dermatitis por contacto y urticaria (15, 69). Las reacciones alérgicas generadas por la penicilina y sus derivados, fueron consideradas por el comité JECFA como factores determinantes para la evaluación y establecimiento de niveles de residuos seguros en alimentos (34).
La residualidad de las sulfonamidas (sulfadimetoxina, sulfametazina, sulfametoxazol) que se emplean en el tratamiento de infecciones coccidiales, bacterianas y también como agentes promotores de crecimiento, puede causar reacciones de hipersensibilidad principalmente rash cutáneo; sin embargo, se desconocen manifestaciones anafilácticas ocasionadas por este tipo de residuos (57). Sobre la estreptomicina existen algunos reportes de reacciones alérgicas por consumo de carnes con este tipo de residuos y solamente se ha registrado un caso de reacción anafiláctica por consumo de ternera contaminada de esta manera (57, 69).
Resistencias bacterianas y transmisión de bacterias resistentes. El uso incorrecto de antibióticos es un factor que puede generar el desarrollo de resistencias bacterianas en los animales tratados. Estas bacterias resistentes podrían transmitirse al hombre causando dificultades en el momento de tratar infecciones humanas, por ejemplo se han encontrado microorganismos coliformes antibiótico-resistentes en carne cruda y cocida. Así mismo, los antibióticos consumidos por seres humanos provenientes de residuos presentes en alimentos de origen animal, generan una alteración de la flora intestinal y como consecuencia una disminución de bacterias que compiten con microorganismos patógenos, aumentando así el riesgo de enfermedad (15).
Las tetraciclinas pueden generar resistencias bacterianas, particularmente, la oxitetraciclina induce resistencia de antibióticos en microorganismos coliformes presentes en el intestino humano (34). El reconocimiento de este efecto ha sido usado por el comité JECFA como el punto de referencia para definir los niveles de consumo aceptable de diferentes antibióticos.
Otras reacciones. A pesar de que muchos antibióticos tienen potencial tóxico, no se ha demostrado que los residuos de estos sean suficientes para desencadenar estas respuestas; a pesar de ello para JECFA este ha sido un tema objeto de interés. Por ejemplo, este comité ha revisado las lesiones óticas, hepáticas y renales que pueden causar la gentamicina y la neomicina (35, 36, 69); la presentación de sordera congénita en hijos de mujeres embarazadas tratadas con estreptomicina (35, 36); las afecciones endocrinas, particularmente en tiroides y pituitaria ocasionadas por las sulfonamidas (34), y la genotoxicidad y generación de anemia aplásica en humanos generada por el cloranfenicol (35).
Otros compuestos como los nitrofuranos, empleados en el tratamiento de infecciones gastrointestinales en bovinos y porcinos, han sido prohibidos como medicamentos de uso veterinario en producción animal debido a los efectos carcinogénicos y mutagénicos ocasionados por sus metabolitos que, adicionalmente, pueden permanecer almacenados por semanas o meses enlazados a las proteínas del animal, incluida la de los huevos de aves de corral, especies en las que este compuesto fue usado como anticoccidial (62).
Fármacos anabolizantes
A excepción del clenbuterol, no se han reportado efectos adversos en humanos relacionados con el consumo de residuos de fármacos anabolizantes en alimentos de origen animal; sin embargo el comité JECFA, a lo largo de su labor y como medida preventiva ha evaluado los resultados que se obtienen de estudios de fármacos realizados en animales y en el hombre, con los cuales establece conclusiones sobre efectos potenciales que estos residuos puedan tener (33).
Hormonales. Estudios in vivo han demostrado rompimiento del ADN y daños oxidativos desencadenados por el 17-β estradiol, por lo cual se considera que esta hormona tiene efecto genotóxico desencadenando, por ejemplo, la proliferación de células cancerígenas mamarias, sin embargo las dosis para que estas alteraciones ocurran son superiores a las que generan efectos endocrinos en los animales (38). Los efectos adversos de la testosterona, por su parte, se deben a su actividad hormonal, particularmente en la glándula prostática. Adicionalmente, la testosterona se considera potencialmente embriotóxica y su consumo en dosis terapéuticas ha resultado en la inducción de cistitis hepática (38).
La utilización de somatotropina recombinante bovina ha generado controversia en los últimos años. Aunque el Codex Alimentarius no especifica LMR para este promotor de la producción láctea, el comité FAO/JECFA ha revisado información relacionada con sus posibles efectos adversos, dentro de los que se destacan la posibilidad de desarrollar cáncer y diabetes, ambos efectos relacionados con el IGF-1 (factor de crecimiento insulinoide tipo - 1) que aumenta en los tejidos animales por acción de la somatotropina (37).
A pesar de estos efectos, el Codex Alimentarius considera innecesario establecer un LMR para estas hormonas pues es improbable que los residuos derivados del uso correcto de estas sustancias como estimuladores del crecimiento, representen peligro para la salud humana. Además, se ha demostrado que la concentración endógena de estas hormonas es mayor que cuando se administran exógenamente. Otra razón que desestima el riesgo potencial de este tipo de sustancias es la disponibilidad de rutas metabólicas que las degradan rápidamente, de esta manera, los residuos que puede contener la carne de los animales tratados, no afectan el sistema endocrino del consumidor (8). Sin embargo, las disposiciones en Europa con respecto a estas sustancias son más estrictas no permitiendo ningún nivel residual de fármacos anabolizantes en cárnicos (12).
β2 agonistas. El clenbuterol es el principal fármaco de este grupo sobre el cual se han reportado reacciones adversas en humanos por consumo de carne contaminada. Además de ser usado como anabolizante, el clenbuterol es empleado como tocolítico en hembras bovinas lo que supone un riesgo adicional. En España y Francia se reportó que el consumo de hígado de ternera con residuos de clenbuterol generó trémores musculares, taquicardia, dolor muscular, nerviosismo, dolor de cabeza, vértigo, nauseas, vómito y fiebre (55, 60).
A raíz de estos eventos se ha generado una polémica acerca de aceptar o prohibir el uso del clenbuterol en producción animal. Este fármaco aumenta el rendimiento de la canal, no es potencialmente oncogénico, ni mutagénico y es embriotóxico sólo a grandes dosis; mientras que los efectos adversos en el consumidor se hacen evidentes al no respetar los tiempos de retiro señalados y al emplear dosis excesivas, bien sea por un inadecuado manejo o para incrementar aún más la ganancia de peso en los animales (64).
Lo anterior ha llevado a que hoy en día el clenbuterol sea un fármaco altamente controlado en varios países, que han desarrollado programas y mecanismos para su vigilancia y seguimiento (55). Sin embargo, a pesar de estos controles y signos de alerta, aún se presentan eventos infortunados de reacciones adversas como el sucedido en noviembre de 2005 en Jalisco, México, donde alrededor de 225 personas experimentaron temblor, dolor de cabeza y malestar después de haber consumido carne de res que contenía residuos de este tipo (15).
Evaluación del riesgo
El riesgo que implica el consumo de contaminantes presentes en alimentos, entre ellos los residuos de fármacos, debe ser valorado y de esta manera evitar, a través de reglamentaciones, el consumo de dosis tóxicas de sustancias adversas a la salud. Este proceso conocido como evaluación del riesgo consta de cuatro componentes que son: 1) identificación del peligro, en el que se determina si una sustancia genera efectos adversos; 2) evaluación de la curva dosis-respuesta, donde se cuantifica esta relación; 3) estimación de la exposición, en la que se reconocen niveles de exposición potencialmente nocivos; y 4) caracterización del riesgo, que estudia toda la información recopilada en las etapas anteriores y genera recomendaciones para manejar el riesgo (19). A través de la información generada en estas etapas puede determinarse la ingesta diaria admisible (IDA) que se usa para calcular los LMR de los contaminantes (1).
Identificar límites máximos de exposición es posible si se trata de compuestos no carcinogénicos para los que se consideran curvas dosis-respuesta con umbral y por lo tanto existen dosis mínimas a las cuales la sustancia no genera efectos adversos. Para el caso de contaminantes genotóxicos y carcinógenos, para los que se consideran curvas dosis-respuesta sin umbral, la evaluación del riesgo es más compleja ya que se asume que al consumir dosis mínimas se generan alteraciones inductoras de cáncer (19).
Recientemente la EFSA y la OMS convocaron una reunión de expertos para discutir la evaluación del riesgo de sustancias genotóxicas y carcinógenas presentes en los alimentos (4). En este encuentro se reconocieron diversos aspectos que pueden ayudar a mejorar la valoración del riesgo de este tipo de sustancias, entre ellos: 1) el análisis de información referente a toxicocinética, metabolismo y biología de los tumores generados; 2) la optimización en el uso de biomarcadores en humanos; 3) el mejoramiento de los modelos de estudio; y 4) la diseminación de la información obtenida. Adicionalmente, se enfatizó en la importancia de incorporar un nuevo valor, el margen de seguridad (MOE, por sus siglas en inglés) para estudiar el riesgo que implica el consumo a través de alimentos de sustancias genotóxicas y carcinógenas. Si se tienen en cuenta las incertidumbres inherentes al cálculo del MOE, que es la relación entre un punto de referencia en la curva dosis-respuesta y la exposición humana estimada, este será una herramienta útil para evaluar el riesgo que implica el consumo de este tipo de sustancias (4).
Metodologías para determinar residuos de fármacos
Al igual que las metodologías de detección para cualquier tipo de sustancia, el análisis de fármacos en alimentos de origen animal demanda costos, tiempo, equipos, reactivos y personal entrenado. Las técnicas destinadas a tal fin deben ser de fácil manipulación, económicas y con las cuales se obtengan resultados en poco tiempo; además deben ser reproducibles, sensibles y específicas (66). Otro aspecto que se debe tener en cuenta es la preparación de las muestras, en especial las correspondientes a los alimentos sólidos, ya que son pocos los kits comerciales existentes que están diseñados para este tipo de muestras. Por lo tanto se hace necesario utilizar técnicas de extracción adecuadas que puedan asegurar mayor sensibilidad durante el análisis (63).
De las diferentes técnicas disponibles para la detección de residuos de fármacos en alimentos de origen animal, las más usadas son las técnicas inmunológicas, cromatográficas y microbiológicas (7, 63, 66). Las técnicas inmunológicas más utilizadas son ELISA, radioinmunoensayo (RIA) y biosensores (66). Los principales métodos cromatográficos que se emplean son cromatografía de gases y cromatografía líquida, ambas acopladas a espectroscopía de masas (63). Las técnicas microbiológicas in vitro, particularmente aplicadas a residuos de antibióticos, son primordialmente la incubación de organismos anaerobios provenientes de heces, la determinación en cultivos bacterianos de la concentración mínima inhibitoria y la simulación de modelos intestinales (7).
Residuos de fármacos en alimentos de origen animal: situación en Colombia
Fármacos veterinarios comercializados en Colombia y regulados por el Codex Alimentarius
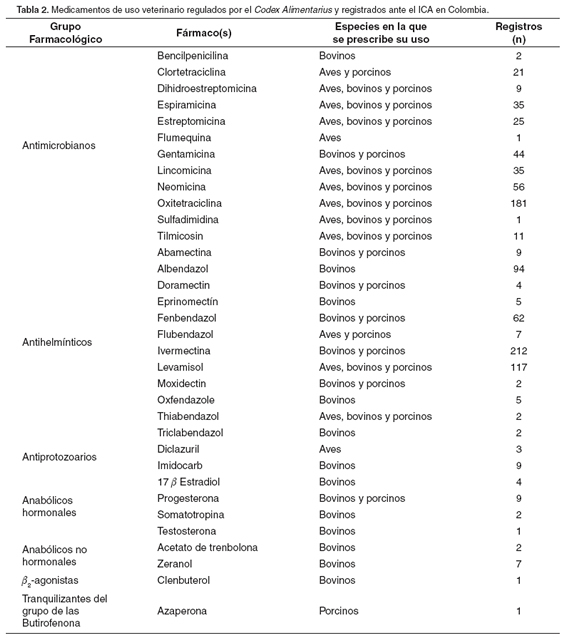
En la Tabla 2 se señalan los medicamentos veterinarios que están registrados en Colombia (28) y a la vez son regulados por el Codex Alimentarius (8). El total de productos registrados para los fármacos regulados por esta comisión es de 981, de los cuales la mayor parte del mercado está distribuida entre los fármacos antiinfecciosos, principalmente antimicrobianos y antihelmínticos.
Tomado y modificado de ICA, 2005 (28).
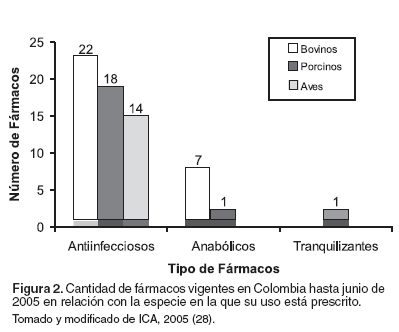
La cantidad de fármacos vigentes en Colombia hasta junio de 2005 se señala en la Figura 2. Esta información se relaciona de acuerdo al tipo de fármaco y a las especies animales de mayor consumo y comercialización en Colombia. Los antiinfecciosos son las sustancias con mayor prescripción en bovinos, aves y porcinos. El uso de anabólicos es recomendado para porcinos y especialmente para bovinos, y finalmente los tranquilizantes sólo se prescriben para porcinos.
Si se tienen en cuenta las especies en las cuales se prescriben los fármacos registrados en Colombia y los principales productos de origen animal consumidos por los colombianos, puede hacerse una aproximación del riesgo de exposición a residuos de fármacos por parte de la población. Los fármacos antimicrobianos y antihelminticos, que cuentan con un mayor número de productos y registros, son altamente empleados en bovinos cuyos subproductos son consumidos por la población colombiana a razón de 15 kg/habitante/año para la carne y 112.4 litros de leche/habitante/año (47). Aunque la cantidad de fármacos regulada en aves no es equivalente a la regulada en bovinos, sus productos y derivados tienen mayor consumo en el país, el consumo per cápita de pollo es de 15.6 kg y el de huevos de 165 (47) y al igual que en el caso de los fármacos antimicrobianos y antihelmínticos utilizados en bovinos, son sustancias que también presentan LMRs tanto en carne de pollo como en huevos. A pesar de que el consumo per capita de carne de cerdo no es tan extenso como el de los otros productos (2.6 kg) (47), existen fármacos regulados y registrados para su uso en el país, por tanto sus residuos también poseen un riesgo potencial frente a los consumidores de este tipo de carne.
Control de residuos de fármacos en Colombia
Desde 1998 Colombia crea oficialmente el Comité Nacional del Codex Alimentarius para formular políticas relacionadas con los procesos adelantados en la Comisión Mixta FAO/OMS de este organismo (53), en la que se incluye la regulación de residuos de medicamentos en productos animales. Sin embargo, desde hace mas de dos décadas el control de fármacos en alimentos de origen animal establecía disposiciones para el uso de productos antimicrobianos veterinarios empleados como promotores de crecimiento o mejoradores de la eficiencia alimenticia, sugiriendo que el control de residuos en el país se venía realizando a través de disposiciones relacionadas con los tiempos de retiro (22, 23).
Otro aspecto que indirectamente está relacionado con el control de residuos de fármacos es lo dispuesto en la cuarentena agropecuaria que regula la producción, importación o comercialización de animales y sus productos cuyos residuos tóxicos excedan los niveles aceptados en los contextos nacional e internacional (43). En este mismo sentido, desde 1997 se solicita a los comercializadores, distribuidores y expendedores exigir la prescripción escrita de un médico veterinario, para la venta de compuestos que puedan dejar algún nivel de residualidad en los alimentos de origen animal (25). Respecto de los medicamentos de control especial o aquellos que puedan generar farmacodependencia, el Ministerio de Protección Social (en Colombia) los considera de estricto control por el Estado y aunque la mayoría de estos fármacos son de uso humano, algunos se emplean frecuentemente en la práctica veterinaria en la que su prescripción y adquisición debe hacerse a través del Consejo Profesional de Medicina Veterinaria y de Zootecnia de Colombia (COMVEZCOL) (29).
La vigilancia de residuos de fármacos en Colombia también comprende la prohibición del uso en animales de algunos nitrofuranos (furazolidona, nitrofurazona y furaltadona) y la importación, comercialización y uso del dimerazol (24, 27). Desde 2003 se exigen requisitos sanitarios para fincas que produzcan bovinos, ovinos y caprinos con destino a la exportación demandando el uso adecuado de medicamentos veterinarios y plaguicidas pecuarios y la participación en el programa oficial de control de residuos de medicamentos veterinarios (26). Estas disposiciones también hacen parte del reglamento técnico para la leche bovina, caprina y bufalina destinada al consumo humano, en el cual se señalan las "buenas prácticas en el uso de medicamentos veterinarios" (BPMV) que reducen la posibilidad de residuos en alimentos de origen animal (50). De igual forma, para contribuir con la calidad de los productos de origen vacuno, en 2004 se crea por Ley de la República el Sistema Nacional de Identificación e Información de Ganado Bovino (SINIGAN); esta iniciativa pretende de manera gradual lograr la identificación plena del hato nacional y reconocer la procedencia de un bovino o de sus productos apoyando así la salud pública nacional (11).
Gran parte de la normatividad actual del país relacionada con la residualidad de medicamentos, está en proceso de creación y reforma con el fin de orientar esfuerzos para asegurar que, ante eventuales exportaciones, las mercancías pecuarias obedezcan los estándares sanitarios internacionales demandados. Actualmente existen planes concretos de exportación de carne y leche bovina hacia Estados Unidos (a través del Tratado de Libre Comercio -TLC), Honduras, Nicaragua y Salvador (a través del Merconorte), Chile, Trinidad y Tobago, Rusia, Israel y la Unión Europea (Comunicación Personal, Grupo inocuidad de las cadenas alimentarias pecuarias-ICA, 2006). Dentro de estas posibilidades de comercialización la más representativa para el país la constituye el TLC en el que se establece una solicitud actual contingente de 10000 Ton de carne y 15000 Ton de productos lácteos (46). Para que Colombia alcance estas metas deben garantizarse, entre otros aspectos, la calidad sanitaria de los productos pecuarios incluyendo el cumplimiento de los LMRs de medicamentos veterinarios.
Existen varias reglamentaciones que, aunque no sean específicas acerca de residualidad de medicamentos, propenden por la calidad de los alimentos producidos y consumidos en el país regulando indirectamente en esta materia. Es así como se dictamina el control de calidad en establecimientos dedicados a la cría de animales de abasto (9), se controlan las actividades que puedan generar factores de riesgo por el consumo de alimentos (52), se incentiva la calidad de los alimentos de origen animal a través de promover la sanidad e internacionalización de los productos agropecuarios y pesqueros (10) y se instituye el "Sistema de análisis de peligros y puntos de control crítico" (HACCP) para asegurar la inocuidad de los alimentos (54), entre otros. Respecto de los residuos de plaguicidas las regulaciones nacionales han sido más específicas orientando la detección y cuantificación y los LMR de acuerdo con los indicados en el Codex Alimentarius (51).
El ICA, como entidad responsable de la calidad de los alimentos de origen pecuario producidos en Colombia, en 2001 crea el "Grupo de inocuidad de las cadenas agroalimentarias pecuarias" (GICAP) (44, 45), que junto con el Laboratorio Nacional de Insumos Pecuarios (LANIP), también dependencia del ICA, vienen adelantando acciones destinadas a fomentar la inocuidad de los alimentos a través del control de residuos de fármacos utilizados en animales productores.
El Consejo Nacional de Política Económica y Social de Colombia (CONPES) formuló en 2005 una política sanitaria y de inocuidad para las cadenas de carne bovina y de leche con la que pretende mejorar las condiciones de sanidad e inocuidad, aumentar la competitividad y fortalecer la capacidad de comercialización del país. Para cumplir estos lineamientos se plantea el fortalecimiento institucional y de la capacidad científica y tecnológica en los próximos años (13). Respecto de la vigilancia de residuos de fármacos este documento establece el desarrollo de programas oficiales de control de residuos y contaminantes químicos en leche, carne y sus derivados, a cargo del INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos) y del ICA estableciendo las funciones que cada uno de estos entes debe cumplir dentro del mismo. Adicionalmente, se planea mejorar la capacidad diagnóstica de factores biológicos y químicos en inocuidad con la disposición de técnicas de referencia actualizadas, armonizadas y validadas así como con planes de muestreo y equipos de alta tecnología que amplíen el espectro de detección (13).
Estas políticas han comenzado a generar nuevos decretos relacionados con el control específico de residuos de fármacos. Por ejemplo, se creó el reglamento técnico que debe cumplir la leche exigiendo la ausencia de residuos de antibióticos en niveles superiores a los LMRs determinados por la autoridad sanitaria competente (50). Igualmente, existen en la actualidad legislaciones relacionadas con los residuos de fármacos en camarones y peces para consumo humano con destino a la exportación en la que se exige a los productores disponer de registros, del uso de medicamentos veterinarios los cuales deben ser de origen biológico y tener registro ante el ICA (30).
Para coordinar y orientar la ejecución de la política de sanidad agropecuaria en Colombia en 2006 fue creada la "Comisión intersectorial de medidas sanitarias y fitosanitarias" (Comisión MSF) que debe armonizar las actividades de las instituciones miembro, dentro de las cuales se encuentra la vigilancia de los residuos de fármacos en alimentos de origen animal. Se promueve además la cooperación entre los sectores público y privado y los organismos internacionales y la recomendación de normas relacionados con medidas de este tipo (59).
Además de las acciones ya mencionadas, varias otras se están adelantando en la actualidad, entre ellas campañas educativas dirigidas a la comunidad para fomentar el BPMV, construcción de políticas CONPES para el sector porcino y avícola, reglamentación técnica sobre los requisitos que debe cumplir la carne bovina para consumo humano, creación y puesta en funcionamiento del Plan Nacional de Residuos, reglamentación acerca de medicamentos veterinarios y contaminantes químicos no autorizados en ganado que son regulados con base en el Codex, la APVMA y la EMEA (Comunicación Personal, Grupo inocuidad de las cadenas alimentarias pecuarias-ICA, 2006).
Todas las medidas anteriores permitirán que el país continúe mejorando en el control de residuos de fármacos en alimentos de origen animal y pueda ampliar las ventas de sus productos en el exterior, tanto en cantidad como a países destino.
Investigación de residuos de fármacos en Colombia
En Colombia han sido varios los estudios que se han desarrollado con respecto a la residualidad de fármacos en alimentos de origen animal, sin embargo, muchos de estos no han sido divulgados masivamente a través de comunicaciones científicas, lo que impide vislumbrar claramente el avance real del país en esta materia. Una parte importante de las investigaciones en el tema de residualidad de fármacos, ha sido adelantada en forma de tesis de grado por diferentes universidades; a continuación se reseñan algunas de las investigaciones más significativas.
Gutiérrez (1978), estudió aspectos relacionados con los tiempos de retiro del zeranol y los LMRs de esta sustancia y su efecto en la producción de carne (21). Muchas investigaciones se han centrado en sustancias antiinfecciosas como: la ampicilina, mediante el estudio de su residualidad y tiempo de retiro en aves de corral (20); el cloranfenicol, por la determinación de residuos por cromatografía en pollos previamente dosificados (42); antibióticos beta-lactámicos, mediante la determinación de su presencia en leche comercializada en Bogotá a través de técnicas inmunoenzimáticas (5) o por cromatografía, lo que ha permitido encontrando residualidad en carne de pollo cruda y asada de expendios del Valle de Aburrá, (41). Adicionalmente, a través de pruebas microbiológicas, Tapia y Paz (2007) encontraron presencia de antibióticos en el 2.1% de la leche analizada, correspondiente a muestras comercializadas en la ciudad de Pasto (65). También se han hecho revisiones de literatura en temas relacionados con los residuos de bencilpenicilinas (61) y los aspectos regulatorios de los medicamentos veterinarios registrados en Colombia e incluidos en el Codex Alimentarius (69), entre otras. Igualmente, en la actualidad se vienen ejecutando investigaciones que buscan determinar residuos de antimicrobianos, a través de técnicas microbiológicas, en musculatura de bovinos sacrificados en la ciudad de Bogotá (68). De esta manera se observa que los principales trabajos de investigación desarrollados por insituciones académicas han estado orientados a la determinación de residuos de antimicrobianos, sustancias ampliamente empleadas en producción animal. Las universidades han hecho un importante aporte en este tópico y podrán seguir suministrando información relevante, máxime si se tienen en cuenta los avances reglamentarios, institucionales y económicos que el Estado viene desarrollando al respecto.
Además de las investigaciones adelantadas por las instituciones académicas, el grupo de "Inocuidad de las cadenas alimentarias pecuarias" del ICA, en la actualidad está desarrollando esfuerzos que buscan implementar y emplear técnicas orientadas a determinar, vigilar, y controlar la presencia de medicamentos veterinarios en alimentos de origen animal. Actualmente, el interés se centra en el análisis de subproductos bovinos dada la posibilidad de su exportación, considerando la declaración de la zona norte y suroccidental de Colombia como libre de aftosa y libre con vacunación, respectivamente (58).
De los análisis realizados, se han encontrado residuos de algunos fármacos, como ivermectina, zeranol y acetato de trenbolona, que no superan los LMRs de fármacos en bovinos; es decir, son residuos aceptables para el consumo humano de acuerdo al Codex Alimentarius (Comunicación personal, "Grupo inocuidad de las cadenas alimentarias pecuarias-ICA, 2006); sin embargo, la presencia de estos fármacos anabolizantes es una limitante para la exportación de carnes, particularmente hacia Europa puesto que allí se prohíbe la presencia de estos residuos, sin importar la cantidad en la que se encuentren (12).
La investigación en residuos de fármacos en alimentos de origen animal tiende a fortalecerse en el país, además de los avances ya anotados, el Ministerio de Protección Social creó por decreto el Sistema de Vigilancia en Salud Pública (SIVIGILA), con el que se puede recopilar información concerniente a la inocuidad de alimentos y evaluar sistemática y oportunamente eventos en salud para la orientación de la acción. SIVIGILA contempla diferentes campos de vigilancia reconocidos como "modelos", dos de los cuales proporcionarán información relevante en el campo de residualidad de fármacos en alimentos, ellos son el modelo de vigilancia de los medicamentos y el modelo de vigilancia de la inocuidad de los alimentos (49). La estructura organizacional de este sistema permitirá conocer la situación desde el nivel municipal hasta el nacional, considerando a los municipios como actores principales en la vigilancia de la inocuidad de los alimentos, lo cual es de suma importancia dado que las reglamentaciones no se cumplen a este nivel, siendo esta una debilidad en la vigilacia y control de los factores de riesgo de consumo de alimentos en los municipios colombianos (48).
Consideraciones finales
Hasta el pasado reciente, la investigación y determinación de la residualidad de medicamentos veterinarios en Colombia no ha correspondido a una política de estado sino a esfuerzos particulares por parte de algunos organismos, incluyendo al ICA y a diferentes universidades. Estas investigaciones, a pesar de haber hecho aportes significativos al estudio de la problemática, corresponden a estudios aislados y esporádicos que impiden reconocer el estado real del país en esta materia. Sin embargo, es evidente el esfuerzo legislativo que se viene adelantando en torno a la reglamentación de residuos de fármacos en alimentos de origen animal, que de cumplirse adecuadamente, contribuiría a la producción y consumo de alimentos con altos índices de calidad.
El fortalecimiento legislativo e institucional enfocado a la producción de alimentos inocuos que está ocurriendo en Colombia, surge por la posibilidad de exportación de productos cárnicos y lácteos, particularmente de origen bovino, que se da en el marco de los actuales y futuros acuerdos comerciales que suscribe el país. Sin embargo, la gran cantidad de fármacos veterinarios de tipo antiinfeccioso registrados en Colombia y los índices de consumo per capita de productos pecuarios, justifican la necesidad de atención que el país debe prestar a estos residuos y de esta manera contribuir con la producción y el consumo de alimentos inocuos por parte de los colombianos. En este sentido, las políticas en salud pública que se vienen adoptando, tienen la capacidad de promover la calidad de los productos de origen animal, no solamente aquellos que tienen potencial de exportación si no también los destinados al consumo interno.
Para que el control de los residuos de fármacos en alimentos pueda ser una realidad, es necesaria la disposición de recursos económicos, tecnológicos y humanos, ya que la modificación de regulaciones existentes y la formulación de nuevas políticas, no serán medidas suficientes para enfrentar esta problemática. Además, para garantizar el cumplimiento de los LMRs sugeridos internacionalmente, se hace necesario emplear los fármacos veterinarios de manera adecuada y así, más que controlar la residualidad, poder prevenirla.
Finalmente, el interés por reconocer y dado el caso reducir este tipo de residualidad, debe empezar por la vigilancia y control de los factores de riesgo en la producción de alimentos, particularmente en las empresas pecuarias e industrias procesadoras. En este sentido, la rastreabilidad, definida como la capacidad para seguir el desplazamiento de un alimento a través de una o varias etapas especificadas de su producción, transformación y distribución (18), ofrece una oportunidad para reconocer, establecer y controlar la fuente de residuos en la producción primaria campesina. Así mismo, las industrias procesadoras de alimentos están en la obligación de determinar la calidad de sus insumos y de exigir la misma a sus proveedores. Todos estos aspectos deben ir en consonancia con las reglamentaciones promulgadas por las diferentes instituciones estatales.
Referencias
1. Anadón A, Martínez-Larrañaga MR. Residues of antimicrobial drugs and feed additives in animal products: regulatory aspects. Liv Prod Sci 1999; 59:183-98. [ Links ]
2. APROVET (Asociación Nacional de Laboratorios de Productos Veterinarios). Vademécum Veterinario Aprovet. Bogotá: Aprovet; 2002. [ Links ]
3. APVMA (Australian Pesticides and Veterinary Medicines Authority). About the APVMA 2006; [Octubre 2006] URL: http://www.apvma.gov.au/about_us/subpage_about.shtml. [ Links ]
4. Barlow S, Renwick AG, Kleiner J, Bridges JW, Busk J, et al. Risk assessment of substances that are both genotoxic and carcinogenic. Report of an International Conference organized by EFSA and WHO with support of ILSI Europe. Food Chem Toxicol 2006; 44:1636-50. [ Links ]
5. Boada G, Valencia D. Estudio sobre la presencia de residuos de antibióticos beta-lactámicos en leche para consumo en Santafé de Bogotá. Tesis Zootecnista, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Bogotá, 1998. 66 p. [ Links ]
6. Bren L. Animal health and consumer protection. FDA Consumer 42. 2006; [Octubre 2006] URL: http://www.fda.gov/fdac/features/2006/106_cvm.html. [ Links ]
7. Cerniglia CE, Kotarski S. Approaches in the safety evaluations of veterinary antimicrobial agents in food to determine the effects on the human intestinal microflora. J Vet Pharmacol Therap 2005; 28:3-20. [ Links ]
8. Codex Alimentarius. Límites máximos de residuos para medicamentos veterinarios en los alimentos, Actualizado en la 28a sesión de la comisión del Codex Alimentarius. 2005; [Agosto 2006] URL: http://www.codexalimentarius.net/download/standards/45/MRL2_pdf. [ Links ]
9. Congreso de la República de Colombia, Ley N° 9 de 24 de Enero de 1979, Colombia; 1979. [ Links ]
10. Congreso de la Républica de Colombia, Ley N° 10 de 4 de Noviembre de 1993, Colombia; 1993. [ Links ]
11. Congreso de la Républica de Colombia, Ley N° 914 de 21 de Octubre de 2004, Colombia; 2004. [ Links ]
12. CEE. Consejo de las Comunidades Europeas, Reglamento (CEE) N° 2377/90, Luxemburgo: CEE; 1990. [ Links ]
13. CONPES. Consejo Nacional de Política Económica y Social, República de Colombia, Departamento Nacional de Planeación, Documento Conpes 3376: Política Sanitaria de Inocuidad para las Cadenas de la Carne Bovina y de la Leche. 2005; [Agosto 2006] URL: http://www.dnp.gov.co/archivos/documentos/Subdireccion_Conpes/3376.pdf. [ Links ]
14. Correa R. La Comisión del Codex Alimentarius y sus Lineamientos. ACOVEZ 2001; [Septiembre 2006] URL: http://www.encolombia.com/veterinaria/acovez26201-comision.htm. [ Links ]
15. Doyle ME. Veterinary drug residues in processed meats - potential health risk. Food Research Institute (FRI Briefings); [Agosto 2006] URL: http://www.wisc.edu/fri/briefs/FRIBrief_VetDrgRes.pdf. [ Links ]
16. EFSA. European Food Safety Authority, 2007; [Diciembre 2007] URL: http://www.efsa.europa.eu/EFSA/efsa_locale-1178620753812_home.htm. [ Links ]
17. EMEA. European Medicines Agency, EMEA Mission Statement 2006; [Agosto 2006] URL: http://www.emea.europa.eu/mission.htm. [ Links ]
18. FAO. Seminario Latinoamericano sobre rastreabilidad/rastreo de productos. 21 al 23 de marzo de 2006; [Enero 2008] URL: ftp://ftp.fao.org/ag/agn/agns/informe.pdf [ Links ]
19. Faustman E, Ommen G. Risk assessment. In: Klaasen C (editor). Casarett and Doull's Toxicology: the basic science of poisons. 6th ed. New York: McGraw Hill; 2001. p107-27. [ Links ]
20. García LF, Marín S. Ampicilina en pollos de engorde. Concentracion, en sangre, músculo y pulmón y residuos en músculo. Tesis químico farmacéutico, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, 1985. 106p. [ Links ]
21. Gutiérrez AF. Efecto del zearanol en la producción, rendimientos y residuos en la carne. Tesis Zootecnista, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Bogotá, 1978. 101p. [ Links ]
22. ICA Instituto Colombiano Agropecuario. Resolución N° 1326 de 30 de Junio de 1981. Bogotá: ICA; 1981. [ Links ]
23. ICA Instituto Colombiano Agropecuario. Resolución N° 1966 de 5 de Septiembre 1984. Bogotá: ICA; 1984. [ Links ]
24. ICA Instituto Colombiano Agropecuario. Resolución N° 1082 de 20 de Abril de 1995. Bogotá: ICA; 1995. [ Links ]
25. ICA Instituto Colombiano Agropecuario. Resolución N° 1023 de 28 de Abril de 1997. Bogotá: ICA; 1997. [ Links ]
26. ICA Instituto Colombiano Agropecuario. Resolución N° 889 de 10 de Abril de 2003. Bogotá: ICA; 2003. [ Links ]
27. ICA Instituto Colombiano Agropecuario. Resolución N° 994 de 19 de Mayo de 2004, Bogotá: ICA; 2004. [ Links ]
28. ICA Instituto Colombiano Agropecuario. Registro de Productos Vigentes en Medicamentos Veterinarios a Junio 30 de 2005; [Agosto 2006] URL: http://www.ica.gov.co/servicios/RCMVeterinarios/registros/productos.pdf. [ Links ]
29. ICA Instituto Colombiano Agropecuario. Resolución N° 001478 de 10 de Mayo de 2006, Bogotá; 2006. [ Links ]
30 ICA Instituto Colombiano Agropecuario. Resolución N° 1414 de 26 de Mayo de 2006, Bogotá: ICA; 2006. [ Links ]
31 IPCS. International Program for Chemical Safety, 2007; [Diciembre 2007] URL: http://www.who.int/ipcs/en. [ Links ]
32 JECFA Joint FAO/WHO Expert Committee on Food Additives. Evaluation of the toxicity of a number of antimicrobials and antioxidants, WHO Technical Report Series, N 228, Geneve: JECFA; 1962. [ Links ]
33 JECFA Joint FAO/WHO Expert Committee on Food Additives. Evaluation of certain veterinary drug residues in food, WHO Technical Report Series N 763, Geneve: JECFA; 1988. [ Links ]
34. JECFA Joint FAO/WHO Expert Committee on Food Additives. Evaluation of certain veterinary drug residues in food, WHO Technical Report Series N 799, Geneve: JECFA; 1990. [ Links ]
35. JECFA Joint FAO/WHO Expert Committee on Food Additives. Evaluation of certain veterinary drug residues in food, WHO Technical Report Series N 855, Geneve: JECFA; 1995. [ Links ]
36. JECFA Joint FAO/WHO Expert Committee on Food Additives, WHO Technical Report Series N 864, Geneve: JECFA; 1996. [ Links ]
37. JECFA. Joint FAO/WHO Expert Committee on Food Additives, Evaluation of certain veterinary drug residues in food, WHO Technical Report Series N 888, Geneve: JECFA; 1999. [ Links ]
38. JECFA Joint FAO/WHO Expert Committee on Food Additives, Evaluation of certain veterinary drug residues in food, WHO Technical Report Series N 893, Geneve: JECFA; 2000. [ Links ]
39. Kabir J, Umoh VJ, Audu-okoh E, Umoh JU, Kwaga JKP. Veterinary drug use in poultry farms and determination of antimicrobial drug residues in commercial eggs and slaughtered chicken in Kaduna State, Nigeria. Food Control 2004; 15:99-105. [ Links ]
40. MacNeil JD. The Joint Food and Agriculture Organization of the United Nations/World Health Organization Expert Committee on Food Additives and Its Role in the Evaluation of the Safety of Veterinary Drug Residues in Foods. The AAPS J 2005; 7:E274-E280. [ Links ]
41. Materón M, Guzmán O, Losada L, Carvajal M. Investigación de penicilina en carnes de pollo crudas y asadas a nivel de mataderos y expendios en el Valle de Aburrá. Tesis Magister en Salud Pública, Facultad Nacional de Salud Pública, Universidad de Antioquia, Medellín, 1980. 74p. [ Links ]
42. Medina SJ, Salamanca K. Evaluación de residuos de cloranfenicol en músculo, hígado y riñón de pollos por cromatografía. Tesis Químico Farmacéutico, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, 1994. 47p. [ Links ]
43. Ministerio de Agricultura y Desarrollo Rural. Decreto N° 1840 del 3 de agosto de 1994, Bogotá; 1994. [ Links ]
44. Ministerio de Agricultura y Desarrollo Rural, Decreto N° 1454 de 19 de Julio de 2001, Bogotá; 2001. [ Links ]
45. Ministerio de Agricultura y Desarrollo Rural, Resolución N° 2950 de 25 de Octubre de 2001, Bogotá; 2001 [ Links ]
46. Ministerio de Agricultura y Desarrollo Rural. La Negociación Agrícola en el TLC con los Estados Unidos 2005; [Diciembre 2007] URL: http://www.presidencia.gov.co/cctl/noticias/minagricultura.pdf [ Links ]
47. Ministerio de Agricultura y Desarrollo Rural. Observatorio Agrocadenas Colombia. [Diciembre 2007] URL: http://www.agrocadenas.gov.co/home.htm [ Links ]
48. Ministerio de Protección Social, Organización Panamericana de la Salud. Modelo de Vigilancia en Salud Pública de la Inocuidad de los Alimentos, Bogotá, 2005. [ Links ]
49. Ministerio de Protección Social, Decreto N 3518 de 9 de Octubre de 2006, Bogotá; 2006. [ Links ]
50. Ministerio de Protección Social, Decreto N 616 de 28 de Febrero de 2006, Bogotá; 2006. [ Links ]
51. Ministerio de Salud, Decreto N° 1843 de 22 de Julio de 1991, Bogotá; 1991. [ Links ]
52. Ministerio de Salud, Decreto N° 3075 de 23 de Diciembre de 1997, Bogotá; 1997. [ Links ]
53. Ministerio de Salud, Decreto N° 977 de 29 de Mayo de 1998, Bogotá; 1998. [ Links ]
54. Ministerio de Salud, Decreto N° 60 de 24 de Enero de 2002, Bogotá; 2002. [ Links ]
55. Mitchell GA, Dunnavan G. Illegal Use of b-Adrenergic Agonists in the United States, J Anim Sci 1998; 76: 208-211. [ Links ]
56. OMS/FAO. Organización Mundial de la Salud, Organización de las Naciones Unidas para la Agricultura y la Alimentación. Garantía de la calidad y la inocuidad de los alimentos: directrices para el fortalecimiento de los sistemas nacionales de control de los alimentos, Estudio Alimentación y Nutrición N 76, Roma: FAO/OMS; 2003. [ Links ]
57. Paige JC, Tollefson L, Miller MA. Health implications of residues of veterinary drugs and chemicals in animal tissues. Vet Clin North Am Food Anim Pract 1999; 15:31-43. [ Links ]
58. Presidencia de la República de Colombia. Servicio de Noticias del Estado (SNE), ICA Pone al Servicio Laboratorio de análisis de Residuos Veterinarios 2003; [Agosto 2006] URL: http://www.presidencia.gov.co/sne/cne.htm. [ Links ]
59. Presidencia de la República de Colombia. Servicio de Noticias del Estado (SNE), Creada Comisión Intersectorial de Medidas Sanitarias 2006; [Septiembre 2006] URL:http://www.presidencia.gov.co/prensa_new/sne/2006/agosto/28/04282006.htm. [ Links ]
60. Pulce C, Lamaison D, Keck G, Bostvironnois C, Nicolas J, et al. Collective human food poisonings by clenbuterol residues in veal liver. Vet Hum Toxicol 1991; 33:480-481. [ Links ]
61. Restrepo JG. Bencipenicilinas y su importancia como residuos en los alimentos de origen animal. Tesis Especialista en Farmacología, Facultad de Ciencias Básicas, Universidad de Antioquia, Medellín, 1996. 62p. [ Links ]
62. Stachel CS, Bock C, Hamann F, Gowik P. Residues of several nitrofurans in egg. J Vet Pharmacol Therap 2006; 29:143. [ Links ]
63. Stolker AA, Brinkman UA. Analytical strategies for residue analysis of veterinary drugs and growth-promoting agents in food-producing animals. A review. J Chromatogr A 2005, 1067:15-53. [ Links ]
64. Sumano H, Ocampo L, Gutiérrez L. Clenbuterol, et al. β-agonistas, ¿Una opción para la producción pecuaria o un riesgo para la salud pública?. Vet Mex 2002; 33:137-160. [ Links ]
65. Tapia CF, Paz LS. Determinación de la presencia de residuos de antibióticos beta lactámicos en leche pasteurizada y comercializada en bolsa de origen bovino mediante la prueba Delvotest en la ciudad de Pasto. Tesis Medicina Veterinaria, Facultad de Ciencias Pecuarias, Universidad de Nariño, Pasto, 2007.127p. [ Links ]
66. Toldrá F, Reig M. Methods for rapid detection of chemical and veterinary drug residues in animal foods. Trends Food Sci Technol 2006; 17:482-489. [ Links ]
67. Vaca AC. Aspectos regulatorios de los medicamentos veterinarios registrados en Colombia e incluidos en el Codex Alimentarius". Tesis Médico Veterinario, Facultad de Medicina Veterinaria y de Zootecnia, Universidad Nacional de Colombia, Bogotá, 2003. 49p. [ Links ]
68. Vela KL, Suárez MC, Tafur M. Detección, identificación y cuantificación de residuos de algunos antimicrobianos en carne bovina. ENICIP: Farmacología, toxicología e inocuidad de productos pecuarios. Rev Col Cienc Pec 2007; 20:569-570. [ Links ]
69. Woodward KN. Veterinary pharmacovigilance. Part 4. Adverse reactions in humans to veterinary medicinal products, J Vet Pharmacol Therap 2005; 28:185-201. [ Links ]
¶ Para citar este artículo: López LP, Romero J, Velásquez LE. Residuos de fármacos en alimentos de origen animal: panorama actual en Colombia. Rev Colomb Cienc Pecu 2008; 21:121-135.
Autor para el envío de correspondencia y la solicitud de separatas: Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia. Bogotá, Colombia. E-mail: mclozanoa@unal.edu.co